牛DAZL基因序列分析、克隆及表達載體構建
鄭鵬 鄭曉萌 于磊 等
摘要:利用生物信息學方法對牛DAZL基因的一級結構和同源性進行分析,并根據牛DAZL基因序列設計引物來克隆該基因,通過酶切、連接、轉化構建該基因的表達載體,成功克隆到了DAZL基因。生物信息學分析結果顯示,哺乳動物的DAZL基因同源性很高。此外,構建了牛DAZL基因的帶綠色熒光蛋白的真核表達質粒pEGFP-N3-DAZL。
關鍵詞:DAZL基因;序列;克隆;表達載體
中圖分類號: S823.3文獻標志碼: A文章編號:1002-1302(2015)01-0034-03
收稿日期:2014-03-21
基金項目:黑龍江省普通高等學校動物遺傳育種與繁殖重點實驗室開放課題(編號:GXZDSYS-2012-07);東北農業大學博士啟動基金(編號:2012RCB27)。
作者簡介:鄭鵬(1979—),男,黑龍江蘭西人,博士,講師,主要從事動物繁殖生理與繁殖技術研究。E-mail:zh-96128@163.com。
通信作者:張貴學,博士,教授,博士生導師,主要從事動物繁殖生理與繁殖技術研究。E-mail: gxzhang@neau.edu.cn。Deleted in azoospermia like (DAZL)基因是DAZ基因家族中的一員,最早克隆于蠅類的睪丸組織,是一個在進化上高度保守的基因,在脊椎動物的生殖細胞中特異表達,是生殖細胞形成所必須的調控因子。DAZL通過RNA識別基序與mRNA結合,并以多聚體的方式在翻譯水平發揮作用[1]。DAZL基因是BOULE基因通過基因修飾、倍增而來,廣泛分布于人類、鼠、爪蟾、蠑螈、斑馬魚、青魚等物種中[2]。許多物種的DAZL同系物對生殖細胞的分化都是非常重要的。DAZL基因的突變、微缺失以及表達下調均可引起生精障礙,導致雄性不育[3]。Ruggiu等發現,與正常鼠相比,雜合DAZL基因缺陷鼠的畸形精子率增高,但仍有正常生育力,而純合鼠表現為嚴重的生殖細胞減少,成熟阻滯,睪丸體積減小,不能生育[4]。此外,Schrans-Stassen等研究證實,DAZL基因敲除鼠表現出雙睪丸干細胞數目減少、以及減數分裂早期精原細胞分化失敗,從而導致不育[5]。因此,研究DAZL基因及其編碼蛋白對探索配子發生和成體生殖缺陷及修復具有重要意義。本試驗主要對DAZL基因進行克隆和開展生物信息學分析,并構建牛DAZL基因真核表達載體pEGFP-N3-DAZL,以期為探索DAZL基因的功能和在精子發生過程中的作用提供前期基礎和試驗依據。
1材料與方法
1.1試驗材料
成年牛(約40月齡)睪丸組織,取自哈爾濱成高子屠宰場;Trizol Reagent和lipofectamine2000購自Invitrogen公司,反轉錄試劑盒購自ABI公司,pEASY-T1 Simple Cloning Kit購自北京全式金生物技術有限公司,T4 DNA連接酶購自NEB公司 DMEM/F12、胎牛血清購自Gibco公司,PrimeSTAR HS DNA聚合酶、限制性內切酶EcoRⅠ、BamHⅠ及其他常規試劑均購自大連寶生物公司。
1.2試驗方法
1.2.1牛DAZL基因的生物信息學分析利用DNAStra軟件分析DAZL的一級結構;采用Clustal X進行DAZL基因同源性多重比對;采用MEGA4程序構建分子進化樹。
1.2.2牛DAZL基因真核表達載體的構建參照GenBank牛DAZL基因序列(NM_001081725)設計其編碼區特異性克隆引物F:CGGAATTCTATGTCTGCTGCAAATCCTGAGACTC和R:CGGATCCAACAGACTTAAGCACTGCCCGACTT(上、下游分別引入EcoRⅠ和BamHⅠ酶切位點),引物由華大基因公司合成。利用Trizol法提取成牛睪丸組織總RNA,并反轉錄成cDNA,以其為模板,利用高保真Prime-STAR HS DNA聚合酶對牛DAZL基因全長編碼區進行RT-PCR擴增,目的片段經凝膠回收加A后連接到pEASY-T1 simple載體上,進一步亞克隆到pEGFP-N3載體上。構建好的質粒經EcoRⅠ和BamHⅠ雙酶切鑒定后,送往北京華大公司測序。
2結果
2.1DAZL基因的生物信息學分析
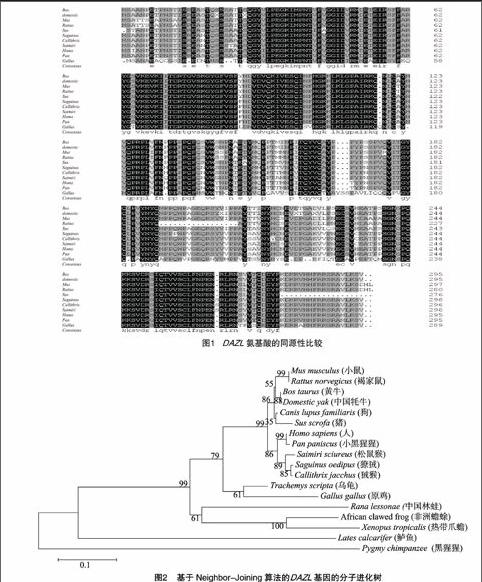
2.1.1DAZL基因一級結構分析牛DAZL基因的CDS全長為888 bp,由264個腺嘌呤(A)、194個胞嘧啶(C)、187個鳥嘌呤(G)和243個胸腺嘧啶(T)組成,4種堿基的含量依次為29.73%、21.85%、21.06%、27.36%。該基因ORF位于 1 888 bp,編碼295個氨基酸,含29個強堿性氨基酸殘基(K,R),24個強酸性氨基酸(D,E),82個疏水性氨基酸殘基(A、I、L、F、W、V),103個極性氨基酸殘基(N、C、Q、S、T、Y),分子量為33.02 Ku,等電點為8.78,脯氨酸、絲氨酸、纈氨酸所占比例較高。
2.1.2DAZL基因同源性分析從NCBI的GenBank數據庫中選取人(Homo sapiens)、大鼠(Rattus norvegicus)、小鼠(Mus musculus)、牛(Bos taurus)、中國牦牛(domestic yak)、豬(Sus scrofa)、狨猴(Callithrix jacchus)、松鼠猴(Saimiri sciureus)、小黑猩猩(Pan paniscus)、獠狨(Saguinus oedipus)、原雞(Gallus gallus)共11個物種的DAZL基因,采用Clustal X進行多重比對,結果顯示牛與中國牦牛的同源性最高,為99%,與小鼠、人、狨猴、小黑猩猩、豬、獠狨、松鼠猴、大鼠、原雞的同源性分別為98%、97%、97%、97%、97%、96%、96%、92%、80%(圖1)。
2.1.3分子進化樹構建使用MEGA4程序,采用 Neighbor-Joining 算法,Bootstrap設為1 000,構建分子進化樹,從樹的拓撲結構上來看,牛的DAZL基因與中國牦牛的關系最近,與大鼠和小鼠一同構成了一個小群,同人、獠狨、豬共同構成一個亞類群(圖2)。
2.2DAZL基因編碼區的克隆
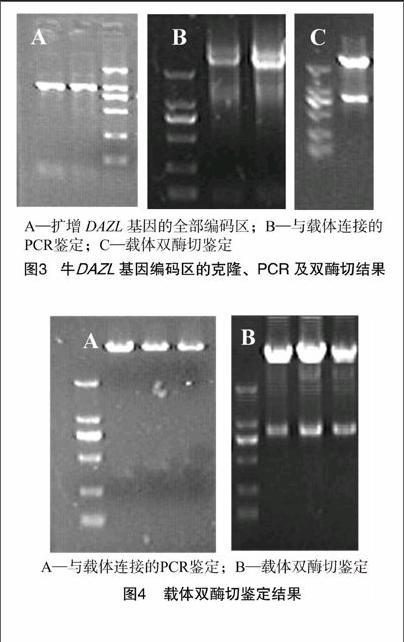
提取的RNA進行反轉錄合成cDNA,檢測內參基因和DAZL基因的表達情況,結果發現成年牛睪丸中有DAZL基因的表達。
以成年牛睪丸組織cDNA為模板進行PCR擴增,擴增出1條與預期長度相符的片段,得到了DAZL基因的全部編碼區(圖3-A)。將擴增出與預期長度相符的片段進行膠回收,與PMD18-T載體連接、轉化,對構建的載體進行PCR鑒定和EcoRⅠ、BamHⅠ雙酶切鑒定,結果顯示在902 bp處出現特異條帶(圖3-B、圖3-C),與預期的插入片段大小相符。
2.3表達載體的制備與鑒定
將DAZL-PMD18-T和PEGFP-N3進行EcoRⅠ和BamHⅠ雙酶切、膠回收,然后按摩爾比1 ∶1的量,用T4 DNA連接酶進行連接,得到構建的載體,然后將構建好的DAZL表達載體進行EcoRⅠ和BamHⅠ雙酶切及PCR鑒定,瓊脂糖凝膠檢測為所要片段大小(圖4)。轉化,挑菌陽性克隆進行序列測定,測序正確的質粒用于下一步的試驗。
3討論
不同物種DAZL基因具有高度的同源相似性,參與調控生殖細胞的發育和分化。有研究表明,DAZL基因的缺失或突變會引起精子發生過程中減數分裂阻滯,導致精子缺乏和男性不育[3]。小鼠DAZL基因突變可影響兩性生殖細胞的功能,DAZL基因敲除鼠表現出不育[5]。DAZL和BOULE都是DAZ家族的重要成員,二者都具有典型的RNA識別基序(RNA recognition motifs,RRM)和DAZ重復序列[6],能夠與一系列影響精子發生基因的mRNA結合,如CDC25A、TPX1、DDX4和TSSK3等[7],并以多聚體的方式在翻譯水平發揮作用。
將目的基因超表達是研究基因功能的主要手段之一[8-9],即將目標基因與合適的載體相連接,使其在體外或體內過量表達,觀察該基因超量表達后細胞或組織或機體所發生的表型變化,從而對該基因的功能作出評價。Yu等利用DAZL基因的超表達技術,將胚胎干細胞誘導分化成精子樣細胞[10-11],可見DAZL基因是精子發生的一個主要基因。本試驗擴增牛DAZL基因的編碼區,構建了PEGFP-N3-DAZL表達載體,為進一步探討DAZL基因超表達的體細胞能否向精細胞方向分化、DAZL基因超表達的生殖干細胞能否加速分化形成精子奠定基礎。
4結論
本試驗成功構建了牛DAZL基因的帶綠色熒光蛋白的真核表達質粒pEGFP-N3-DAZL,為闡明DAZL基因調控精子發生的機制奠定基礎。
參考文獻:
[1]Moore F L,Jaruzelska J,Dorfman D M,et al. Identification of a novel gene,DZIP (DAZ-interacting protein),that encodes a protein that interacts with DAZ (deleted in azoospermia) and is expressed in embryonic stem cells and germ cells[J]. Genomics,2004,83(5): 834-843.
[2]Saxena R,Brown L G,Hawkins T,et al. The DAZ gene cluster on the human Y chromosome arose from an autosomal gene that was transposed,repeatedly amplified and pruned[J]. Nature Genetics,1996,14(3):292-299.
[3]Reynolds N,Cooke H J. Role of the DAZ genes in male fertility[J]. Reproductive BioMedicine Online,2005,10(1):72-80.
[4]Ruggiu M,Saunders P T,Cooke H J. Dynamic subcellular distribution of the DAZL protein is confined to primate male germ cells[J]. Journal of Andrology,2000,21(3):470-477.
[5]Schrans-Stassen B H,Saunders P T,Cooke H J,et al. Nature of the spermatogenic arrest in Dazl—/- mice[J]. Biology of Reproduction,2001,65(3):771-776.
[6]Eberhart C G,Maines J Z,Wasserman S A. Meiotic cell cycle requirement for a fly homologue of human deleted in azoospermia[J]. Nature,1996,381(6585):783-785.
[7]Liu Z,Li Q,Pan Z,et al. Comparative analysis on mRNA expression level and methylation status of DAZL gene between cattle-yaks and their parents[J]. Animal Reproduction Science,2011,126(3/4):258-264.
[8]束婧婷,宋衛濤,朱文奇,等. PGC-la基因在兩種類型雞骨骼肌間的表達差異[J]. 江蘇農業學報,2013,29(1):121-125.
[9]蔣香菊,吳陽升,林嘉鵬,等. 綿羊AMH基因的克隆、序列分析與原核表達[J]. 江蘇農業學報,2013,29(6):1386-1392.
[10]Yu Z,Ji P,Cao J,et al. Dazl promotes germ cell differentiation from embryonic stem cells[J]. Journal of Molecular Cell Biology,2009,1(2):93-103.
[11]Kee K,Angeles V T,Flores M,et al. Human DAZL,DAZ and BOULE genes modulate primordial germ-cell and haploid gamete formation[J]. Nature,2009,462(7270):222-225.