長江口刀鱭幼魚耳石碳、氧同位素特征初報
姜 濤, 劉洪波, 楊 健,
(1.南京農業大學 無錫漁業學院, 江蘇 無錫 214081; 2.中國水產科學研究院 淡水漁業研究中心, 中國水產科學研究院長江中下游漁業生態環境和資源養護重點實驗室, 江蘇 無錫 214081)
刀鱭(Coilia nasus)作為著名的“長江三鮮”之一,是長江的一種重要的漁獲種類。每年三、四月份親魚會在長江口區集結并上溯從而形成“魚汛”。然而,近年來由于水利工程、酷漁濫捕、環境污染等原因,其資源量下降嚴重并已岌岌可危[1]。如何利用各種新興技術來客觀獲取保護這種重要漁業資源的基礎信息已經成為目前亟待解決的難題之一。
迄今, 刀鱭的研究主要集中在分子生物學[2-5]、形態學[6-9]等方面, 但近年基于耳石進行刀鱭生活史、群體組成及動態的研究也逐漸增多[10-14]。魚類耳石具有一些特殊性, 如耳石形成后結構非常穩定、不會被代謝, 其上會形成可以直接讀取的年輪; 耳石中積累的元素組成與其生活過的外界水體生境密切相關。這些特殊性被廣泛應用魚類的生境履歷反演和群體動態的重建等研究中[15-19]。針對耳石中元素和穩定同位素的分析研究常被統稱為耳石微化學研究[20]。前者中的一些元素(如鍶、鈣)由于在自然界不同水體中的差異分布, 通過分析它們在耳石軸上的含量變化, 可以推測魚體在生活史過程中所經歷的水體元素情況, 繼而反演出該魚的生境履歷。除此之外, 耳石核心部位的元素組成, 也常被用于作為源自不同孵化場群體的判別依據[21]。與元素分析相比較, 耳石中穩定同位素的研究多數集中在耳石中碳、氧同位素方面。這其中δ13C被證實與餌料的關系較為密切(如高營養狀態下的δ13C要顯著高于低營養狀態下的值[22]), 而δ18O則被證實為與水溫關系十分密切, 且在正常鹽度條件下, 1‰的δ18O變化應該對應于約5℃的水溫變化[23]。這些特點使得耳石穩定同位素分析除了能像元素分析一樣, 作為群體識別或者生境履歷的標志外, 還能反映出魚體的生理狀況和環境水溫等的情況。Tomida 等[24]利用細鱗大馬哈魚(Oncorhynchus gorbuscha)幼魚耳石中 δ13C 和 δ18O,發現了自然與人工飼養條件下兩者的差異, 并證實了幼魚的餌料水平以及所經歷的環境溫度分別對耳石中δ13C和δ18O的影響, 從而為研究成魚的起源以及評價孵化場對種群資源補充的能力提供了有力的研究手段。Geffen[25]在對自然條件和實驗室條件下的鰈魚(Pleuronectes platessa)幼魚研究發現 δ18O 顯著地受到溫度的影響, 而與餌料無關, 同時通過與相關文獻作比較發現利用魚耳石δ18O水平反演的估測水溫與真實水溫間存在種間差異; 而 δ13C則更多的和生長速度相關。利用耳石中δ13C和δ18O, Gao等[26]發現美國奧澤特湖中的紅大馬哈魚(Oncorhynchus nerka)種群存在起源自不同湖岸產卵場的群體。與國外大量的耳石同位素研究報道相比, 中國相關的研究報道較少, 僅 Shen 等[27]曾利用鰱魚(Hypophthalmichthysmolitrix)耳石中δ18O和δ13C發現贛江、鄱陽湖的鰱魚種群與長江種群并不相同。
鑒于刀鱭相關研究尚未見任何報道, 本研究嘗試對刀鱭幼魚耳石中碳、氧穩定同位素的特征情況進行了探索, 并討論其可能反映出的生態學意義,以期從新角度為刀鱭資源保護和群體判別提供理論依據, 也期為今后更深入地研究積累技術基礎。
1 材料與方法
1.1 實驗材料
本研究選取采自長江口崇明島水域的刀鱭當年幼魚7尾。待測量完全長(109.4 mm±1.7 mm)和體質量(2.8 g± 1.2 g)后, 統一摘取右矢耳石用作分析對象樣品。
耳石先在去離子水中去除外套膜和有機質, 然后在酒精中清洗。隨后, 所有耳石樣品使用超聲清洗機清洗3 min后, 使用MQ水清洗3遍。清洗完成的耳石樣品室溫下自然晾干24 h。
1.2 實驗方法
以酒精清潔過表面的鋁箔紙包裹晾干后的耳石樣品, 使用碾缽輕擊、磨碎耳石, 再將粉末狀耳石樣品混勻后留待分析。
耳石同位素分析使用日本東京大學大氣海洋研究所配備 Gas Bench Ⅱ氣體發生裝置的 Delta V Advantage穩定同位素質譜分析儀(ThemoFisher Scientific, Co., Waltham, USA)進行。分析前, 稱取約200μg耳石粉末, 并置于試管底部。測定結果 δ18O和δ13C用以下公式計算, 即:
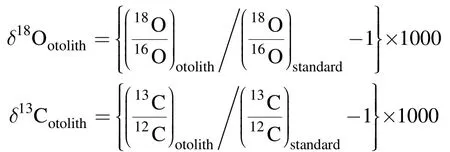
其中“standard”為國際標準物質 VPDB(Vienna Peedee Belemnite),“otolith”為耳石樣品。使用NBS18(National Bureau of Standards)作為分析標樣。測試精度<0.09‰。
1.3 統計方法
本研究統計分析使用美國微軟公司 Excel 2007軟件和 IBM公司SPSS 19.0 軟件來進行。
2 結果與分析
所有耳石樣品δ13C和δ18O結果如表1所示, 其中 δ13C 為 –12.1±1.8(‰VPDB), δ18O 為 –7.9±1.2(‰VPDB)。從表中可以發現, 所有樣品的δ13C波動較大, 從最低–14.4 ‰VPDB(CMJ09)到最高–9.8‰VPDB(CMJ15)。與之相比, δ18O 則波動較小, 從–10.1‰VPDB(CMJ15)到–7.0‰VPDB(CMJ11)。
通過表1不難發現, 相對于δ13C的波動, 部分刀鱭幼魚耳石的 δ18O結果有一定的趨同, 其中CMJ08、–09、–11、–12、–14 的結果均在–7‰VPDB左右波動, 而CMJ13和–15則分別為–9.2‰VPDB和–10.1‰VPDB。有鑒于此, 參考 Gao等[26]將 δ13C和δ18O做散點圖, 以分析這些刀鱭個體可能起源的群體情況(圖1)。結果顯示, 本研究中的 7尾刀鱭幼魚個體應該可以分為兩個組, 其中組一為 CMJ13和–15(全長為 94.5 mm±4.95 mm)組二為 CMJ08、–09、–11、–12、–14(全長為 115.6 mm±16.3mm)。
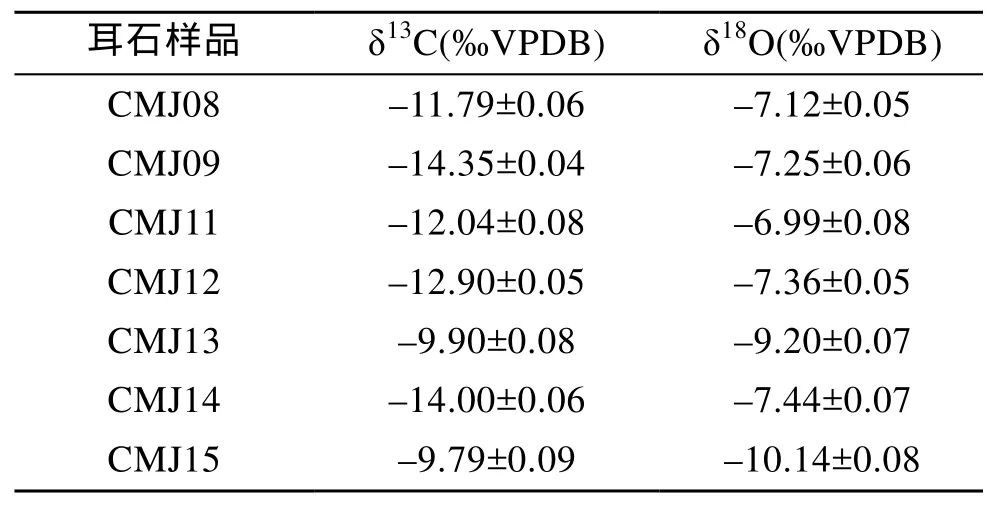
表1 長江口刀鱭幼魚耳石δ13C和δ18O的結果Tab.1 δ13C and δ18O values in the otoliths of the juveniles Coilia nasus from the Changjiang River Estuary
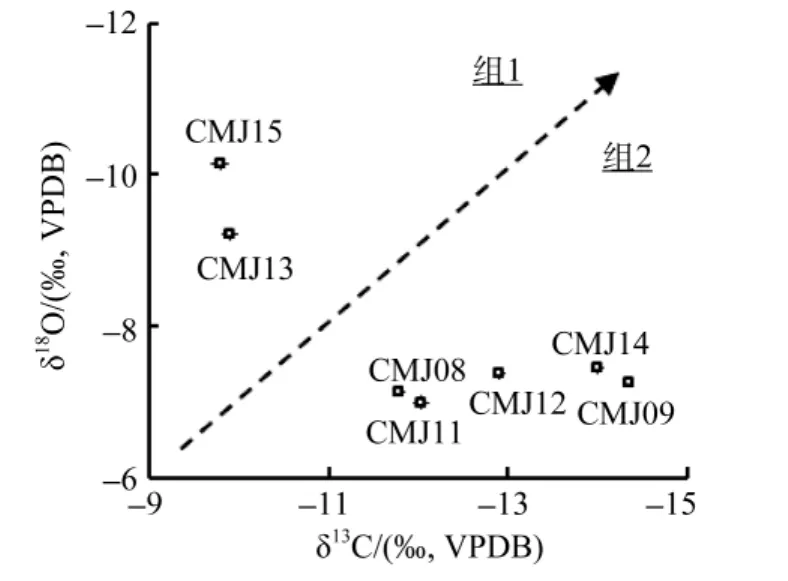
圖1 長江口刀鱭幼魚耳石δ18O和δ13C分布變化Fig.1 Variations of δ13C and δ18O distribution in the otoliths of the juveniles Coilia nasus from the Changjiang River Estuary
3 討論與結論
盡管國際上利用耳石中的碳、氧穩定同位素作為魚類群體起源和判別已經有很多成功的例子[26-28],但在國內相關研究尚很缺乏。除去一些耳石同位素研究的綜述報道外[23,29], 僅Shen等[27]對中國贛江、鄱陽湖、長江中的淡水魚類的鰱魚(Hypophthalmichthys molitrix)群體進行耳石 δ13C和 δ18O分析。因此, 本研究應該是有關刀鱭耳石碳、氧穩定同位素方面的首次探索。
歷史上刀鱭溯河后會在長江不同江段或者湖泊內產卵[30]; 然而近年來, 由于水利工程、水質污染、酷漁濫捕等原因, 其產卵場發生了改變[31]。目前對于長江內刀鱭產卵場的位置以及不同產卵場/孵化地資源群體的組成尚很難研究。考慮到耳石穩定同位素對于魚類群體區分的高精確性, 甚至對于源自相鄰水域的群體亦能有很好地區分[26-27], 因此作者嘗試將相關的方法引入到長江刀鱭群體的起源探索之中。
本研究中所選用的刀鱭均為不到 1齡的幼魚。通過Jiang等[11]的結果可以推知, 本研究中刀鱭個體發育過程中的大部分時間應該在自長江內孵化場到長江口間的淡水環境中度過。考慮到淡水環境不會像海水一樣受到諸如洋流等因素的影響, δ18O在一定程度上反映了生活史過程中平均水溫情況的同時[32-34],也反映了其不同的生境履歷過程。通過分析比較δ18O的含量, 可以很明顯地發現所研究的刀鱭可能存在2個不同來源的組別(圖1), 其中組一為CMJ13和–15; 而組二為 CMJ08、–09、–11、–12、–14。兩組刀鱭耳石樣品在 δ18O上的不同, 可能反映了其在所經歷水體溫度條件的不一樣。由于所有實驗魚為同一時間長江口崇明水域的刀鱭幼魚, 其所經歷的水體溫度的差異可能反映的是不同孵化場水域間的差異。這個現象顯示出該兩組刀鱭幼魚個體極有可能起源自長江中不同的孵化場(亦可對應于親魚產卵場)水域。
通過上述 δ18O的結果, 推測所研究的刀鱭可能存在起源自不同孵化場的兩組。比較所有耳石樣品δ13C的情況, 雖然組內不同個體之間存在波動, 但組間的差異更為明顯, 即總體上組一個體的 δ13C要高于組二(圖1)。考慮到其與營養代謝之間的關系[35-36],以及所有個體均為發育階段較一致的幼魚個體, 不難發現兩組個體間δ13C的差異很有可能與相應的餌料水平有關。Gao等[37]在研究美國太平洋沿岸黃眼石斑魚耳石δ18O和δ13C的時候發現: 相對于較為穩定的δ18O, δ13C卻在遞增, 說明其在生活史過程中棲息地沒有變化, 而食物發生了從低級向相對高級營養水平的改變。相似的結果在大西洋鱈魚中也被發現[38]。由此推測, 本研究中兩組樣品 δ13C的差異可能是源自兩個組別個體之間生活史過程中不同營養水平餌料組成的差異。這也支持基于上述δ18O結果將所有個體歸為不同2組的推論。
由于本研究中所有刀鱭的耳石都被均一化成粉末樣品來進行分析, 故所有數據反映的是所分析標本的整個生活史過程中的情況。造成本研究中刀鱭幼魚耳石樣品δ13C兩組差異進一步的原因可以分為兩種情況: 首先是不同孵化場餌料組成和豐度的差異。歷史上在長江不同江段、通江湖泊均分布有刀鱭的產卵場[30]。雖然對其產卵場目前具體的分布現狀不甚清晰, 但是根據本研究中關于耳石中 δ18O的結果依舊可以發現長江內尚存在有刀鱭的多個產卵場。而這些水域餌料豐度水平的差異勢必也會影響到仔稚魚的攝食從而導致耳石中δ13C的富集情況。如鄱陽湖年平均浮游動物密度 0.449 mg/L[39], 而長江鎮江江段江豚保護區水域內最高浮游動物密度也僅 0.115 mg/L[40]。其次是不同孵化場所在長江江段地理位置上的不同, 從而導致兩組個體到達長江口水域時間上的差異。隨著刀鱭魚苗的發育, 其需要離開孵化場沿長江進入河口水域, 這期間所需餌料也逐漸從最小的輪蟲過渡到枝角類直至體積較大的橈足類[41]。由于幼魚到達河口水域時發育階段較其在孵化場要靠后, 也就意味著需要更高營養等級的餌料。這個過程中, 長江口水域營養鹽和餌料生物最為豐富, 同時也是多種水生動物的仔稚魚的棲息場所[42];特別是該水域的沿岸碎波帶被證實為刀鱭仔稚魚聚集的一個重要水域[43]。比較長江中下游的鄱陽湖、巢湖、太湖, 其浮游動物年平均密度最高的屬太湖約2.14mg/L, 而最低為鄱陽湖約0.449mg/L[39]。與之相比, 長江口區浮游動物密度要高的多; 尤其在5月和8月, 浮游動物總生物量可分別達到 482.64mg/L和1002.65mg/L[42], 仔稚魚在該水域能更加容易地獲得所需要的更高營養水平的餌料。由此可見與孵化場餌料組成和豐度水平的不同對本研究中耳石樣品δ13C的影響相比, 個體由于產卵場/孵化場距河口之間的距離差異而導致的進入長江口水域生活的時間差異對 δ13C的影響可能更為重要, 即距離河口較近的個體從孵化場出來后能夠更早地到達河口附近的餌料生物豐富的水域。這一點也能說明為何δ13C較高的個體, 其全長卻相對較短的原因。這些個體(組一)可能要比 δ13C 較低的個體(組二)孵化時間要晚,但是由于其孵化場較后者離開河口較近, 所以這些個體能夠更早的到達河口水域。同時, 這種情況的存在也說明了不同產卵場刀鱭親魚在上溯時, 可能會由于產卵場的不同而存在分批上溯的現象。
綜上所述, 本研究中長江口刀鱭幼魚耳石 δ13C和 δ18O 個體間存在差異, 可以分為兩個組, 可能起源自兩個不同孵化場水域的群體。其中δ18O反映了兩組個體之間生活史過程中所經歷的環境積溫的不同, 也即孵化場水溫條件存在差異。而 δ13C則反映了兩組個體在生活史過程中餌料組成條件上有所不同, 這一方面可能由于其孵化場水體餌料組成和豐度的差異, 另一個更重要的原因應該是由于孵化場地理位置的不同, 從而導致的幼魚到達長江口時間上的差異。
本研究對刀鱭幼魚耳石中δ13C和δ18O成分特征的探索, 不僅顯示出了其在刀鱭起源水域和群體判別上的應用潛力, 也可為今后的深入研究打下了技術基礎。在進一步的工作中有必要增加長江刀鱭標本數量, 以便為更詳細地探尋資源群體中個體的起源情況。考慮到本研究的對象均為發育階段較晚的幼魚耳石, 其中除了有孵化場的信息(如水溫和餌料)外, 還包含隨后自孵化場到長江口移動過程的信息;故在今后進一步調查不同起源刀鱭群體孵化場水溫、營養條件時, 需要優先選取發育階段更早的仔稚魚耳石或針對成魚耳石核心區域(對應于孵化場)進行分析, 并采集長江刀鱭可能的產卵場(如鄱陽湖水域)、不同江段水樣標本進行穩定同位素成分的同步測定。這將有可能較為準確地定位不同群體的起源地及了解各起源地個體對長江刀鱭資源群體的補充效應, 以便為更合理地保護長江刀鱭資源提供新依據。
致謝:感謝東京大學大氣海洋研究所國際沿岸海洋研究中心的大竹二雄教授以及天野洋典博士在本研究中所提供的幫助和指導。
[1] 田思泉, 田芝清, 高春霞, 等.長江口刀鱭汛期特征及其資源狀況的年際變化分析[J].上海海洋大學學報, 2014, 23(2): 245-250.
[2] 徐鋼春, 魏廣蓮, 李建林, 等.基于線粒體 DNA D-loop 序列分析養殖刀鱭與湖鱭的遺傳多樣性[J].大連海洋大學學報, 2012, 27(5): 448-452.
[3] 徐鋼春, 董晶晶, 聶志娟, 等.刀鱭不同組織的乳酸脫氫酶同工酶及 DNA 含量研究[J].上海海洋大學學報, 2012, 21(4): 481-488.
[4] Ma C Y, Cheng Q Q, Zhang Q Y.Genetic diversity and demographical history ofCoilia ectenes(Clupeiformes:Engraulidae) inferred from the complete control region sequences of mitochondrial DNA [J].Mitochondrial DNA, 2012, 23(5): 396-404.
[5] 周曉犢, 楊金權, 唐文喬, 等.基于線粒體 COI基因DNA條形碼的中國鱭屬物種有效性分析[J].動物分類學報, 2010, 35(4): 819-826.
[6] 王丹婷, 楊健, 姜濤, 等.不同水域刀鱭形態的分析比較[J].水產學報, 2012, 36(1): 78-90.
[7] 聶志娟, 徐鋼春, 顧若波, 等.刀鱭幼魚消化系統的組織形態學結構[J].動物學雜志, 2012, 47(4): 104-113.
[8] 姜濤, 楊健, 劉洪波, 等.刀鱭、鳳鱭和湖鱭矢耳石的形態學比較研究[J].海洋科學, 2011, 35(3): 23-31.
[9] 程萬秀, 唐文喬.長江刀鱭不同生態型間的某些形態差異[J].動物學雜志, 2011, 46(5): 33-40.
[10] 姜濤, 周昕期, 劉洪波, 等.鄱陽湖刀鱭耳石的兩種微化學特征[J].水產學報, 2013, 37(2): 239-244.
[11] Jiang T, Yang J, Liu H B, et al.Life history ofCoilia nasusfrom the Yellow Sea inferred from otolith Sr: Ca ratios[J].Environ Biol Fish, 2012, 95(4): 503-508.
[12] Dou S Z, Amano Y, Yu X, et al.Elemental signature in otolith nuclei for stock discrimination of anadromous tapertail anchovy (Coilia nasus) using laser ablation ICPMS[J].Environ Biol Fish, 2012, 95(4): 431-443.
[13] Dou S Z, Yokouchi K, Yu X, et al.The migratory history of anadromous and non-anadromous tapertail anchovyCoilia nasusin the Yangtze River Estuary revealed by the otolith Sr: Ca ratio[J].Environ Biol Fish, 2012, 95(4): 481-490.
[14] Yang J, Arai T, Liu H B, et al.Reconstructing habitat use ofCoilia mystusandCoilia ectenesof the Yangtze River estuary, and ofCoilia ectenesof Taihu Lake,based on otolith strontium and calcium[J].J Fish Biol,2006, 69(4): 1120-1135.
[15] Brown R J, Severin K P.Otolith chemistry analyses indicate that water Sr: Ca is the primary factor influencing otolith Sr: Ca for freshwater and diadromous fish but not for marine fish[J].Can J Agr Sci, 2009, 66(10): 1790-1808.
[16] Arai T, Goto A, Miyazaki N.Migratory history of the threespine sticklebackGasterosteus aculeatus[J].Ichthyol Res, 2003, 50(1): 9-14.
[17] Arai T, Tsukamoto K.Application of otolith Sr : Ca ratios to estimate the migratory history of masu salmon,Oncorhynchus masou[J].Ichthyol Res, 1998, 45(3):309-313.
[18] Lamson H M , Shiao J C , Iizuka Y, et al.Movement patterns of American eels (Anguilla rostrata) between salt- and freshwater in a coastal watershed, based on otolith microchemistry[J].Mar Biol, 2006, 149(6):1567-1576.
[19] 熊瑛, 劉洪波, 劉培廷, 等.基于耳石元素微化學的江蘇呂泗近岸小黃魚生境履歷重建[J].應用生態學報, 2014, 25(3): 836-842.
[20] Campana S E.Otolith science entering the 21st century[J].Mar Freshwater Res, 2005, 56: 485-495.
[21] Thorrold S R, Latkoczy C, Swart P K, et al.Natal homing in a marine fish metapopulation[J].Science,2001, 291(5502): 297-299.
[22] Schwarcz H P, Gao Y W, Campana S E, et al.Stable carbon isotope variations in otoliths of Atlantic cod(Gadus morhua) [J].Can J Fish Aquat Sci, 1998, 55(8):1798-1806.
[23] 高永文, 魯安懷, 王清印, 等.魚群識別的氧、碳穩定同位素方法[J].礦物巖石地球化學通報, 2011,30(3): 270-276.
[24] Tomida Y, Suzuki T, Yamada T, et al.Differences in oxygen and carbon stable isotope ratios between hatchery and wild pink salmon fry [J].Fish Sci, 2014,80: 273-280.
[25] Geffen A J.Otolith oxygen and carbon stable isotopes in wild and laboratory reared plaice (Pleuronectes platessa) [J].Environ Biol Fish, 2012, 95: 419-430.
[26] Gao Y W, Sones D B, Svec R A.The hatchery and native origin of lake ozette sockeye salmon from stable isotopic records of otoliths [J].Am Fish Soc Symp,2007, 54: 105-115.
[27] Shen J Z, Gao Y W.Stable isotope analyses in otoliths of silver carp: a pilot study in identification of natal sources and stock differences [J].Environ Biol Fish,2012, 95(4): 445-453.
[28] Schloesser R W, Neilson J D, Secor D H, et al.Natal origin of Atlantic bluefin tuna (Thunnus thynnus) from Canadian waters based on otolith δ13C and δ18O [J].Can J Fish Aquat Sci, 2010, 67(3): 563-569.
[29] 高永文, 魯安懷, 宋玉國.魚耳石的碳、氧穩定同位素成分研究[J].自然科學進展, 2004, 14(3): 268-272.
[30] 袁傳宓, 秦安舲, 劉仁華, 等.關于長江中下游及東南沿海各省的鱭屬魚類種下分類的探討[J].南京大學學報(自然科學版), 1980, 3: 67-77.
[31] 張敏瑩, 徐東坡, 劉凱, 等.長江下游刀鱭生物學及最大持續產量研究[J].長江流域資源與環境, 2005,14(6): 694-698.
[32] Matta M E, Orland I J, Ushikubo T, et al.Otolith oxygen isotopes measured by high-precision secondary ion mass spectrometry reflect life history of a yellowfin sole (Limanda aspera) [J].Rapid Commun Mass Spectrom, 2013, 27(6): 691-699.
[33] Javor B, Dorval E.Geography and ontogeny influence the stable oxygen and carbon isotopes of otoliths of Pacific sardine in the California Current [J].Fish Res,2014, 154: 1-10.
[34] Kitagawa T, Ishimura T, Uozato R, et al.Otolith δ18O of Pacific bluefin tunaThunnus orientalisas an indicator of ambient water temperature [J].Mar Ecol Prog Ser, 2013, 481: 199-209.
[35] Nelson J, Hanson C W, Koenig C, et al.Infulence of diet on stable carbon isotope composition in otoliths of juvenile red drumSciaenops ocellatus[J].Aquat Biol,2011, 13(1): 89-95.
[36] Gronkijaer P, Pedersen J B, Ankjaero T T, et al.Srable N and C isotopes in the organic matrix of fish otoliths:validation of a new approach for studying spatial and temporal changes in the trophic structure of aquatic ecosytems [J].Can J Fish Aquat Sci, 2013, 70(2): 143-146.
[37] Gao Y W, Dettman D L, Piner K R, et al.Isotopic correlation (δ18O versus δ13C) of otoliths in identification of groundfish stocks[J].T Am Fish Soc,2010, 139: 491-501.
[38] Schwarcz H P, Gao Y W, Campana S E, et al.Stable carbon isotope variations in otoliths of cod (Gadusmorhua) [J].Can J Fish Aquat Sci, 1998, 55: 1798-1806.
[39] 楊富億, 劉興土, 趙魁義, 等.鄱陽湖的自然漁業功能[J].濕地科學, 2011, 9(1): 82-89.
[40] 代梨梨, 龔迎春, 馮偉松, 等.江蘇鎮江長江豚類保護區浮游動物群落結構特征及江豚生存狀況評估[J].水生態學雜志, 2011, 32(5): 30-36.
[41] Xu G C, Tang X, Zhang C X, et al.First studies of embryonbic and larval development ofCoilia nasus(Engraulidae) under controlled conditions[J].Aquac Res, 2010, 42(4): 593-601.
[42] 徐兆禮, 沈新強.長江口水域浮游動物生物量及其年間變化[J].長江流域資源與環境, 2005, 14(3):282-286.
[43] 蔣日進, 鐘俊生, 張冬良, 等.長江口沿岸隨波帶仔稚魚的種類組成及其多樣性特征[J].動物學研究,2009, 29(3): 297-304.

