2型糖尿病合并頸動脈斑塊的危險因素分析
商書霞 宋光耀 馬慧娟 趙軍魁
隨著居民生活水平的不斷提高及生活方式的改變,2型糖尿病的發病率迅猛增加,已成為威脅人類健康的第三大慢性非傳染性疾病[1]。國際糖尿病聯盟(IDF)2013年發布,世界糖尿病人口總數為3.82億,患病率達8.3%(20~79歲),其中中國糖尿病患病人數排在第一位,約有9 840萬糖尿病患者,推測2035年該數字將攀升至1.43億[2]。糖尿病大血管病變特別是心腦血管病變是糖尿病致死、致殘的主要原因之一,因此,如何及早發現大血管并發癥,并積極干預,對糖尿病并發癥的預防具有極其重要意義。頸動脈在顱外位置相對表淺,便于進行彩色超聲檢查,可作為臨床上糖尿病大血管疾病的篩查項目,為治療提供依據[3]。頸動脈粥樣硬化及斑塊是糖尿病大血管病變之一,高血糖通過氧化應激反應,產生過多的晚期糖基化終末產物(AGE),損傷內皮祖細胞,導致內皮系統功能紊亂,從而促發炎性反應。而動脈粥樣硬化的形成就是炎性反應的結果。因此,高血糖通過促使內皮功能紊亂最終導致了動脈粥樣硬化的進展。另外,AGE直接或間接通過血管內皮細胞上AGE受體,來激活核因子κB(NF-κB),NF-κB是對氧自由基敏感的一種轉錄因子,可調節多種炎性因子的轉錄,如:可增強白介素-1(IL-1)、組織因子、血栓調節蛋白基因,從而誘導參與動脈粥樣硬化形成相關基因的表達。而且,AGE還可以通過受體途徑,導致氧自由基產生增多,從而使NO滅活增加,反過來又激活NF-κB,形成惡性循環,更加重病情進一步進展。在本研究中,通過對290例2型糖尿病住院患者進行頸動脈超聲檢查,分析2型糖尿病合并頸動脈斑塊形成的相關危險因素。
1 資料與方法
1.1 一般資料 選取冀中能源峰峰集團有限公司總醫院2013年1月至2014年2月2型糖尿病住院患者290例,均符合WHO 2型糖尿病的診斷標準。其中男116例,女174例;平均年齡(62.85±11.43)歲,糖尿病病程(10.57±8.14)年。排除以下疾患:(1)發熱性疾病、各種慢性炎癥及創傷;(2)嚴重心腦血管病變及嚴重肝腎功能不全;(3)惡性腫瘤和自身免疫性疾病。根據IMT值作為決定患者分組標準:頸動脈IMT≤1.3 mm時判定為非斑塊(對照組);頸動脈任意一處IMT>1.3 mm時判定有斑塊者(病變組)。受試的290例患者中,病變組123例,男69例,女54例;平均年齡(56±10)歲;對照組167例,男47例,女120例;平均年齡(57±12)歲。
1.2 觀察指標 記錄患者性別比、年齡、病程、身高、體重;并計算體重指數(kg/m2);患者安靜狀態下或至少休息5 min后監測收縮壓(SBP)及舒張壓(DBP),血壓測量2次,間隔時間1~2 min,取其平均值。
1.2.1 實驗室檢查:所有患者均禁食8~10 h,第2天清晨空腹抽靜脈血,分別測定空腹血糖(FPG)、糖化血紅蛋白(HbA1c)、總膽固醇(TC)、三酰甘油(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)。采用全自動糖化血紅蛋白分析儀檢測受試者的糖化血紅蛋白水平,血糖、血脂采用日本7180全自動生化分析儀。
1.2.2 超聲檢查:采用東芝SSA-660A彩色多普勒超聲儀進行頸動脈檢查,其軸分辨率為0.1 mm,檢查及讀數均由我院超聲科同一名醫師完成,檢查方法:受檢者取平臥頭仰位,頭偏向對側,充分暴露頸動脈,分別測量雙側頸總動脈、頸動脈分叉、頸內動脈起始端、頸外動脈。觀察內膜-中膜厚度(IMT):即探頭置于胸鎖乳突肌的前緣,從鎖骨上窩頸動脈起始處開始,經頸動脈分叉至頸內動脈入顱處顯影模糊為止,測量頸動脈內膜表面到中層與外膜相移行的距離,此距離即IMT。將所測量的IMT值作為決定患者分組標準:頸動脈IMT≤1.3 mm時判定為非斑塊(對照組);頸動脈任意一處IMT>1.3 mm時判定有斑塊者[4](病變組)。
1.3 統計學分析 應用SPSS 13.0統計軟件,計量資料以表示,采用t檢驗,計數資料采用χ2檢驗,多因素分析采用Logistic回歸分析中Cox進行分析,P<0.05為差異有統計學意義。
2結果
2.1 一般資料與生化指標比較 病變組與對照組比較,年齡、病程、BMI、SBP、FPG、HbA1c、TC、TG、LDLC、HDL-C差異有統計學意義(P<0.05或<0.01),而DBP差異無統計學意義(P>0.05)。見表1。
表1 一般資料與生化指標比較±s

表1 一般資料與生化指標比較±s
組別 年齡(歲) 病程(年)BMI(kg/m2)SBP(mm Hg)DBP(mm Hg)FBG(mm Hg)HbA1c(%)TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)病變組(n=123) 68.23±10.72 12.09±9.27 26.08±2.98 138.08±18.05 78.85±10.71 9.01±3.26 8.98±2.47 5.04±1.22 1.93±1.53 4.52±1.72 1.04±0.47對照組(n=167) 57.47±12.13 9.05±7.00 25.33±3.07 132.24±15.68 79.79±10.75 7.81±2.68 8.42±2.04 5.82±1.57 1.64±0.90 3.02±0.97 0.89±0.55 P值 <0.01 <0.05 <0.05 <0.01 >0.05 <0.01 <0.05 <0.05 <0.05 <0.01 <0.05
2.2 頸動脈斑塊的多因素回歸分析 以是否有頸動脈斑塊為因變量,各危險因素為自變量進行多因素回歸分析,年齡、SBP、TC是發生糖尿病頸動脈粥樣斑塊的獨立危險因素(P<0.05)。見表2。
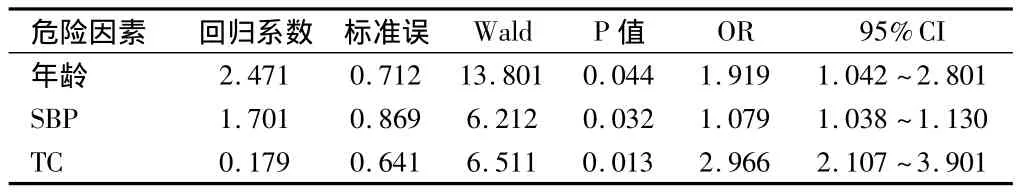
表2 2型糖尿病患者頸動脈斑塊危險因素多因素回歸分析
3 討論
頸動脈粥樣硬化及斑塊的形成常見于大動脈及中等動脈,是2型糖尿病常見并發癥之一,頸動脈斑塊的發生發展是慢性過程,是2型糖尿病大血管并發癥致死、致殘的主要原因。動脈斑塊中的易損斑塊易破裂、出血或引起血管狹窄,血流剪切應力增加,致管腔栓塞或閉塞,造成心腦等臟器不可逆性損傷,可能機制如下:(1)炎癥:動脈斑塊破裂后會出現更多的炎性細胞,其中巨噬細胞及某些炎性因子更能促進易損斑塊的發生發展[5]。而且,單核細胞趨化蛋白-1作為單核細胞中最強的趨化因子之一,它可促使單核細胞進入內皮下形成泡沫細胞,促進斑塊不穩定以及血栓的形成,黏附分子也能吸引單核細胞,使其進入細胞內皮下,形成泡沫細胞,進而促使動脈粥樣硬化的發生發展,故黏附分子作為單核細胞的重要趨化因子,通過檢測血清可溶性黏附分子水平,以此反映組織中的水平[6]。(2)氧化應激:低密度脂蛋白經氧化修飾和血管內皮細胞氧化應激后,均可促使易損斑塊的形成[7]。(3)斑塊的形態與功能:動脈粥樣斑塊破裂重要因素之一是纖維帽的組成和厚度,纖維帽厚度與脂質核比例越小,斑塊越易破裂,而且,偏心斑塊具有較大的擴張性[8]。局部血流剪切力的增加更易使斑塊破裂。(4)斑塊的外力:斑塊所受的外力包括血流剪切力、周向應力、湍流,另外還有動脈局部痙攣對斑塊的擠壓力[9]。這些因素均是斑塊易損的重要原因。本研究顯示,病變組年齡、病程、BMI、SBP、FPG、HbA1c、TC、TG、LDL-C 均高于對照組,而 HDL-C 低于對照組,其中,血糖及糖化血紅蛋白均與頸動脈粥樣硬化的發生發展密切相關,同國外研究結果[10]一致。
本研究中,年齡也是糖尿病頸動脈粥樣硬化的危險因素。年齡作為不可干預的因素,也是頸動脈粥樣硬化斑塊形成過程中的重要危險因素之一,2型糖尿病患者隨著年齡的增加,其動脈血管的退行性變會加劇動脈血管壁內膜的損傷,改變動脈血管的正常生理性,導致動脈粥樣硬化。在對美國東部約4 480名65歲以上老年人調查研究發現,伴隨頸動脈IMT增厚,在平均6.2年內發生心腦血管意外的老年人顯著增加,頸動脈內膜中層厚度在第5百分位數者是第1百分位數者的約4倍左右,頸動脈內膜中層厚度每增加1個標準差,其心腦血管事件發生率就會增高1.37倍。田作軍等[11]在廣州醫學院第一附屬醫院一項研究調查中顯示,頸動脈粥樣硬化斑塊的檢出率在60歲以上的患者明顯高于60歲以下患者,其中28例≥80歲患者的頸動脈粥樣硬化斑塊的檢出率為100%。可見,高齡是促進患者頸動脈粥樣硬化及斑塊形成的危險因素,也提示我們特別注意高齡人群存在頸動脈粥樣硬化的可能性,并能及時行頸動脈超聲篩查,做到早發現、早干預。
本研究多因素回歸分析結果還顯示,SBP這一危險因素進入方程,這說明SBP是頸動脈粥樣硬化斑塊形成過程中的獨立危險因素。血壓升高使血流對血管內皮的剪切力增大,致血管內膜損傷,而損傷的內膜易于脂質的沉積,久之可加速動脈硬化斑塊的發生發展,同時,血壓升高特別是SBP升高,可使去甲腎上腺素、內皮素等血管活性物質增多,致血管內皮及其功能明顯損害。劉溯等[12]對頸動脈斑塊的發生率與其危險因素進行多元逐步回歸分析發現,SBP是唯一進入方程的危險因素。本組研究結果與其一致,提示SBP是頸動脈粥樣硬化斑塊形成過程中的危險因素之一。反之,動脈粥樣硬化會影響血壓水平,兩者互為影響,形成惡性循環,其可能機制如下:(1)炎性因子:IL-17作為一種前炎性因子,也是一種T淋巴細胞亞型,它可促進單核細胞分泌TNF-α和IL-lp因子,并與其發揮協同作用,從而加強炎性反應過程。同時,通過誘導粒細胞集落刺激因子(G-CSF)、IL-lp、人趨化因子2(CXCL2)等介質的分泌,參與中性粒細胞的動員、募集及活化;另外,IL-17作用于腸壁上皮肌纖維母細胞,通過NF-κB和絲裂原活化蛋白酶(MAPK)途徑,刺激單核細胞趨化蛋白-1(MCP-1)、IL-6和MMPs表達。由此提示,IL-17促炎性反應是導致動脈粥樣硬化及其斑塊易損性的重要病理學機制之一。Madhur等[13]在對動脈粥樣硬化斑塊的發病機制研究中發現,IL-17可促使頸動脈粥樣硬化的狹窄加重,并能調節斑塊穩定性,通過研究載脂蛋白E(APOE)及IL17A/ApoE/大鼠,給予脂肪喂養及血管緊張素Ⅱ輸液,或局部頸動脈結扎術形成的頸動脈粥樣硬化模型。結果顯示,IL-17促進了動脈粥樣硬化和全身血管炎癥,調節斑塊穩定性。(2)基質金屬蛋白酶(MMPs):斑塊內膠原降解主要由MMPs介導,MMPs由巨噬細胞分泌,是一組鋅離子(Zn2+)依賴的內肽酶家族,能特異降解細胞外基質(ECM)成分,破壞膠原的結構。炎性細胞所分泌的MMPs,在頸動脈粥樣硬化及斑塊的發生、發展中至關重要。MMPs失調,會上調炎性分子表達,導致氧化應激產生和端粒長度的縮短,使動脈彈性減弱及血管壁壓力增大,彈性纖維易斷裂,造成內膜損傷,進一步加劇了血管的僵硬,最終引起并加重AS,而且,脈壓越大,動脈硬化程度越嚴重。Bouvet等[14]在一項對動物的研究中與證實,早期 MMP-9增加可以激活 TNF-α的信號轉導,增加動脈血管壁硬化強度,從而導致老年純收縮期高血壓病(ISH)的形成,在給予華法林治療5 d后,會導致MMP-9活性增加,7 d后TNF-α活性也會增加,21 d后血管明顯鈣化,而給予金屬蛋白酶抑制劑多西環素后,會阻斷金屬蛋白酶激活TNF-α,TNF-α抑制劑可防止血管硬化的形成。TNF-α升高血壓的可能機制是影響血管內皮功能,減少內皮NO生成,平滑肌增殖,參與高血壓發生發展。同時,血壓升高本身就可導致血流動力學改變,血管內皮細胞和心肌細胞缺血缺氧,釋放出來的TNF-α升高,進一步促進高血壓的發生發展。另外,TNF-α在腦內可通過調節下丘腦室旁核去甲腎上腺素水平參與高血壓病的發生發展,阻斷了中樞 TNF-α的合成,在一定程度上可降低交感神經興奮性。
脂質代謝紊亂在2型糖尿病動脈粥樣硬化斑塊形成過程中有重要作用。(1)LDL-C:高糖狀態下,LDLC被其氧化修飾后,可直接損傷血管內皮細胞,同時可增強T淋巴細胞和單核細胞對內皮細胞的黏附性,致多種黏附分子表達。另外,LDL-C特點是小而密,受體不易被識別,致其清除障礙,過多的LDL-C被巨噬細胞吞噬,會沉積在動脈壁內,形成泡沫細胞,從而促進動脈粥樣硬化性斑塊的形成。同時,LDL在血管壁聚集并氧化,形成氧化低密度脂蛋白(OX-LDL),OX-LDL可通過干擾NO合成底物、儲備及釋放程序,致NO合成不足,從而使內皮依賴性舒張障礙;另外,OX-LDL上調MCP-1、免疫球蛋白超家族黏附分子(ICAM-1、VCAM-1)、選擇素家族成員(P-選擇素、E-選擇素)等多種粘附分子的基因表達,使單核細胞和T細胞易粘附于血管內皮細胞,增強管壁炎性反應。(2)HDL-C:HDL-C對動脈粥樣硬化的保護作用可能機制為:動脈粥樣硬化的發生發展與固有免疫效應有關,固有免疫效應細胞主要是巨噬細胞和內皮細胞,T淋巴細胞中的CD3+細胞和CD4+細胞主要參與動脈粥樣硬化的形成,它們通過識別巨噬細胞樹突狀細胞呈遞的特異性抗原從而激活體內細胞免疫應答,T細胞活化需要巨噬細胞、樹突狀細胞等細胞的參與,同時,這些細胞表面刺激分子與細胞結合,提供活化的第二信號。HDLC通過抑制MCP-1、細胞粘附分子表達,并抑制單核細胞遷移,從而參與動脈粥樣硬化的免疫反應。Suzuki等[15]在對缺乏單核細胞趨化因子大鼠的研究中發現,其動脈粥樣硬化程度減輕。HDL-C還可抑制內皮細胞鞘氨酸氨醇激酶的活性,阻斷鞘氨醇/核因子通路,從而抑制細胞粘附分子表達。(3)脂多糖(LPS):LPS是固有免疫細胞清道夫受體,借脂質介導產生致炎和細胞毒性作用,LPS是自細胞膜釋放入循環中,并在循環中發生相互作用。脂多糖與單核細胞、中性粒細胞CD14、可溶性CD14的結合是由脂多糖內毒素復合體介導,兩種CD14作為脂多糖的主要受體,能夠刺激機體分泌大量細胞因子,從而參與體內固有免疫[16]。HDL-C通過抑制脂多糖的細胞毒性作用,抑制脂多糖誘導的內皮細胞粘附,從而影響動脈粥樣硬化的發生發展。本研究顯示,病變組 LDL-C高于對照組,而HDL-C低于對照組。另外,本研究在多因素回歸分析之后還得出結論,TC這一危險因素進入回歸方程。總膽固醇增高會導致頸動脈內膜細胞的功能受到損傷,并使內皮細胞和白細胞的表面特征發生改變,進而使血漿脂蛋白進到內膜細胞中,巨噬細胞隨后會進行清除反應,合并血管壁上的平滑肌細胞增生,會形成最早的粥樣硬化病變,即脂質條紋,隨著病情進展,吞噬細胞或泡沫樣細胞增多,以及脂質的不斷沉積和結締組織的大量增生,促進了粥樣斑塊的形成。
綜上,2型糖尿病患者隨著年齡及病程逐漸增加,其動脈粥樣硬化或斑塊形成增多,而血糖、血壓及血脂是斑塊形成的危險因素,我們應該積極控制上述因素,并定期篩查IMT,以盡早發現動脈粥樣硬化,做到早期干預,早期預防并發癥的發生。
1 Lin T,Liu JC,Chang LY,et al.Association of metabolic syndrome and diabetes with subclinical coronary stenosis and plaque subtypes in middleaged individuals.J Diabet Med,2011,28:493-499.
2 底雪屏,田海燕,王民,等.頸動脈內中膜厚度與糖尿病視網膜病變程度相關性研究.河北醫藥,2014,36:1825-1826.
3 Steinvil A,Sadeh B,Arbel Y,et al.Prevalence predictors of concomitant carotid and coronary artery atherosclerotic disease.J Am Coll Cardiol,2011,57:779-783.
4 Araki T,Nakamura M,Utsunomiya M,et al.Visualization of coronary plaque in type 2 diabetes mellitus patients using a new 40 MHz intravascular ultrasound imaging system.J Cardiol,2012,59:42-49.
5 Tahara N,Tahara A,Honda A,et al.Molecular imaging of vascular inflammation.Curr Pharm Des,2014,20:2439-2447.
6 Mohammadpour AH,Falsoleiman H,Shansara J,et al.Pentoxifylline decreases serum level of adhesion molecules in atherosclerosis patients.Iran Biomed J,2014,18:23-27.
7 Maziere C,Salle V,Gomila C,et al.Oxidized low density lipoprote in increases RANKL level in human vasvular cells.Involvement of oxidative stress.Biochem Biophys Res Commun,2013,440:295-299.
8 Cassar A,Matsuo Y,Herrmann J,et al.Coronary atherosclerosis with vulnerable plaque and complicated lesions in transplant recipients new insight into cardiac allograft vasculopathy by optical coherence tomography.Eur Heart J,2013,34:2610-2617.
9 Anssari-Bennm A,Korakianitis T.Atherosclerotic plaques:is endothelial shear stress the only factor?Med Hypotheses,2013,81:235-239.
10 Davidson M,Meyer PM,Haffner S,et al.increased high density lipoprotein cholesterol predicts the pioglitazone-media thickness progression in patients with type 2 diabetes mullituts.Circulation,2008,117:2123-2130.
11 田作軍,劉磊,董亞賢,等.影響頸動脈斑塊形成因素的臨床分析.中國神經醫學雜志,2008,7:1168-1173.
12 劉溯,楊宇紅.老年高血壓頸動脈斑塊的發生率及危險因素分析.實用臨床醫藥雜志,2010,14:76-77.
13 Madhur MS,Funt SA,Li L,et al.Role of interleukin 17 in inflaramation,atherosclerosis,and vascular function in apolipoprotein e-deficient mice.Arterioscler Thromb Vase Biol,2011,31:1565-1572.
14 Bouvet C,Moreau S,Blanchette J,et al.Sequential activation of matrix metalloproteinase 9 and transforming growth factor etainarterial elastocalcinosis.Arterioscler Thromb VascBiol,2008,28:856-862.
15 Suzuki M,Pritchard DK,Becker L,et al.High-density lipoprotein suppresses the typeI interferon response a family of potent antiviral immunoregulatorsin macrophages challengedwith lipopolysaccharide.Circulation,2010,122:1919-1927.
16 Drew BG,Rye KA,Duffy SJ,et al.The emerging role of HDL in glucose metabolism.Nat Rev Endocrinol,2012,8:237-245.

