銅綠假單胞菌和鮑曼不動桿菌的臨床分布和耐藥性分析
王亞華 祝永明 吳曉燕 宋秀蘭 李旭梅 陳松勁 馮雪君 邵平揚
1.浙江省嘉興市第一醫院藥劑科,浙江嘉興 314001;2.浙江省嘉興市第二醫院藥劑科,浙江嘉興 314000;3.浙江省嘉興市第二醫院檢驗科,浙江嘉興 314000;4.浙江省嘉興市第一醫院檢驗科,浙江嘉興 314001
銅綠假單胞菌和鮑曼不動桿菌屬于非發酵革蘭陰性菌,是目前醫院感染的主要條件致病菌,也是非發酵菌屬中分離率最高的兩種細菌。近年來隨著臨床抗菌藥物的廣泛使用以及各種侵入性操作的增多,使銅綠假單胞菌和鮑曼不動桿菌的多藥耐藥和泛耐藥菌株不斷增加,給醫院感染控制和臨床抗感染治療帶來極大困難。 為更好地指導臨床合理使用抗菌藥物,筆者對2012~2013 年嘉興地區兩所綜合性三甲醫院銅綠假單胞菌和鮑曼不動桿菌的臨床分布及耐藥性進行回顧性調查與分析,現報道如下:
1 資料與方法
1.1 菌株來源
來自2012 年1 月1 日~2013 年12 月31 日嘉興地區兩所綜合性三甲醫院各類臨床送檢標本, 包括痰液、分泌物、尿液、膽汁、胸腹水、血液、導管、腦脊液等。
1.2 病原菌鑒定與藥敏試驗
病原菌鑒定與藥敏采用法國梅里埃公司VETIK-2 Compact 全自動細菌鑒定儀,及其配套GP、GN、GP-67、GN-16、GN-13 鑒定和藥敏卡。 分離與鑒定參照《全國臨床檢驗操作規程》進行。藥物敏感試驗結果判讀參照美國臨床實驗室標準化委員會(CLSI)每年更新內容進行判讀。
1.3 質控菌株
大腸埃希菌ATCC25922、 銅綠假單胞菌ATCC-27853、金黃色葡萄球菌ATCC29213、糞腸球菌ATCC 29212 和肺炎克雷伯菌ATCC70063,購自原衛生部臨床檢驗中心。
1.4 數據分析
采用WHO 細菌耐藥性監測推薦的Whonet 5.6軟件進行耐藥性分析,剔除重復菌株。
2 結果
2.1 病原菌的標本分布
2012 年1 月~2013 年12 月兩家醫院各類標本共檢出1858 株銅綠假單胞菌、1829 株鮑曼不動桿菌,銅綠假單胞菌和鮑曼不動桿菌均以痰液分離率最高,分別占68.35%和81.79%;其次為分泌物,占16.95%和8.26%;尿液,占5.17%和3.66%。 見表1。
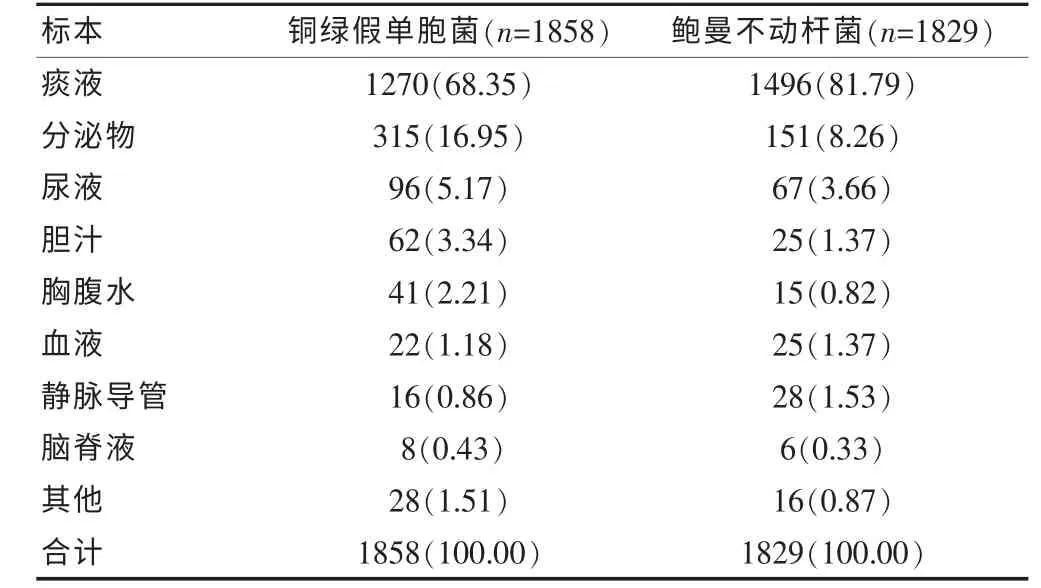
表1 銅綠假單胞菌和鮑曼不動桿菌標本來源分布及構成比[n(%)]
2.2 病原菌的科室分布
銅綠假單胞菌的科室分布以呼吸內科為主,占17.65%,其次為ICU、普外科、腫瘤科、神經外科,分別占15.98%、12.43%、6.40%和6.19%;鮑曼不動桿菌的科室分布以ICU 為主,占19.03%,其次為兒科、呼吸內科、神經外科、普外科,分別占15.42%、12.47%、7.11%和6.83%。 見表2。
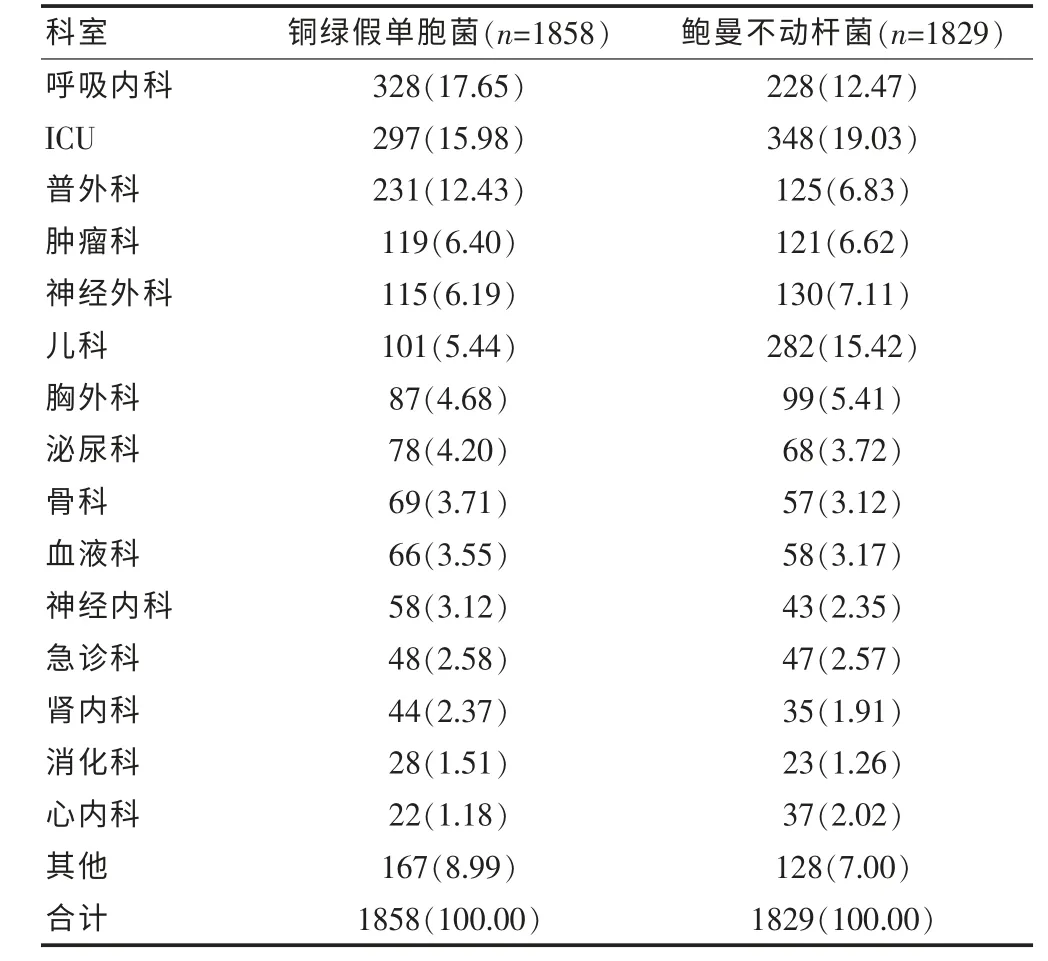
表2 銅綠假單胞菌和鮑曼不動桿菌科室分布及構成比[n(%)]
2.3 銅綠假單胞菌的耐藥率
銅綠假單胞菌對阿米卡星和妥布霉素耐藥率最低,僅為1.15%~3.02%,對頭孢吡肟、哌拉西林/他唑巴坦、慶大霉素、亞胺培南、美洛培南、阿米卡星、妥布霉素耐藥率小于10%,對亞胺培南和美洛培南的耐藥率呈上升趨勢, 分別從2012 年的8.45%、8.09%上升到2013 年的13.10%、11.16%;而對阿莫西林/克拉維酸和氨芐西林/舒巴坦的耐藥率高(>90%)。 見表3。
2.4 鮑曼不動桿菌的耐藥率
鮑曼不動桿菌對妥布霉素、阿米卡星耐藥率較低,為6.18%~14.6%, 對替加環素的耐藥性增長迅速,從2012 年的2.20%上升到2013 年的24.00%;對頭孢吡肟、亞胺培南、美洛培南、頭孢哌酮/舒巴坦、哌拉西林/他唑巴坦、環丙沙星、左氧氟沙星、復方新諾明、四環素和慶大霉素具有一定的耐藥性,耐藥率為19.36%~32.80%,而對氨曲南、頭孢曲松的耐藥率高(>90%)。見表4。
3 討論
3.1 銅綠假單胞菌感染的臨床分布及耐藥性
銅綠假單胞菌是一種需氧革蘭陰性桿菌,對周圍生存繁殖環境和營養要求不高,在醫院內潮濕環境和人體腸道可定植,引起抵抗力受損患者發生院內感染,可導致人體局部器官及全身性、多發性醫院感染[1]。近年來由于廣譜抗菌藥物、激素及免疫抑制劑的廣泛應用,各種侵入性診斷與治療操作的不斷普及,銅綠假單胞菌已成為醫院感染的重要病原菌之一,給臨床抗感染治療帶來了極大困難[2],在免疫力低下的醫院獲得性肺炎患者中尤其多見[3]。 患者感染了銅綠假單胞菌,尤其是多重耐藥或者廣泛耐藥菌株后,由于對抗菌藥物的敏感性差,治療困難,病情常常遷延不愈,嚴重時可導致銅綠假單胞菌膿毒癥,具有重癥性、難治性、持續反復性等特點,已經引起國內外專業人士的關注。

表3 2012~2013 年銅綠假單胞菌對常用抗菌藥物的耐藥率
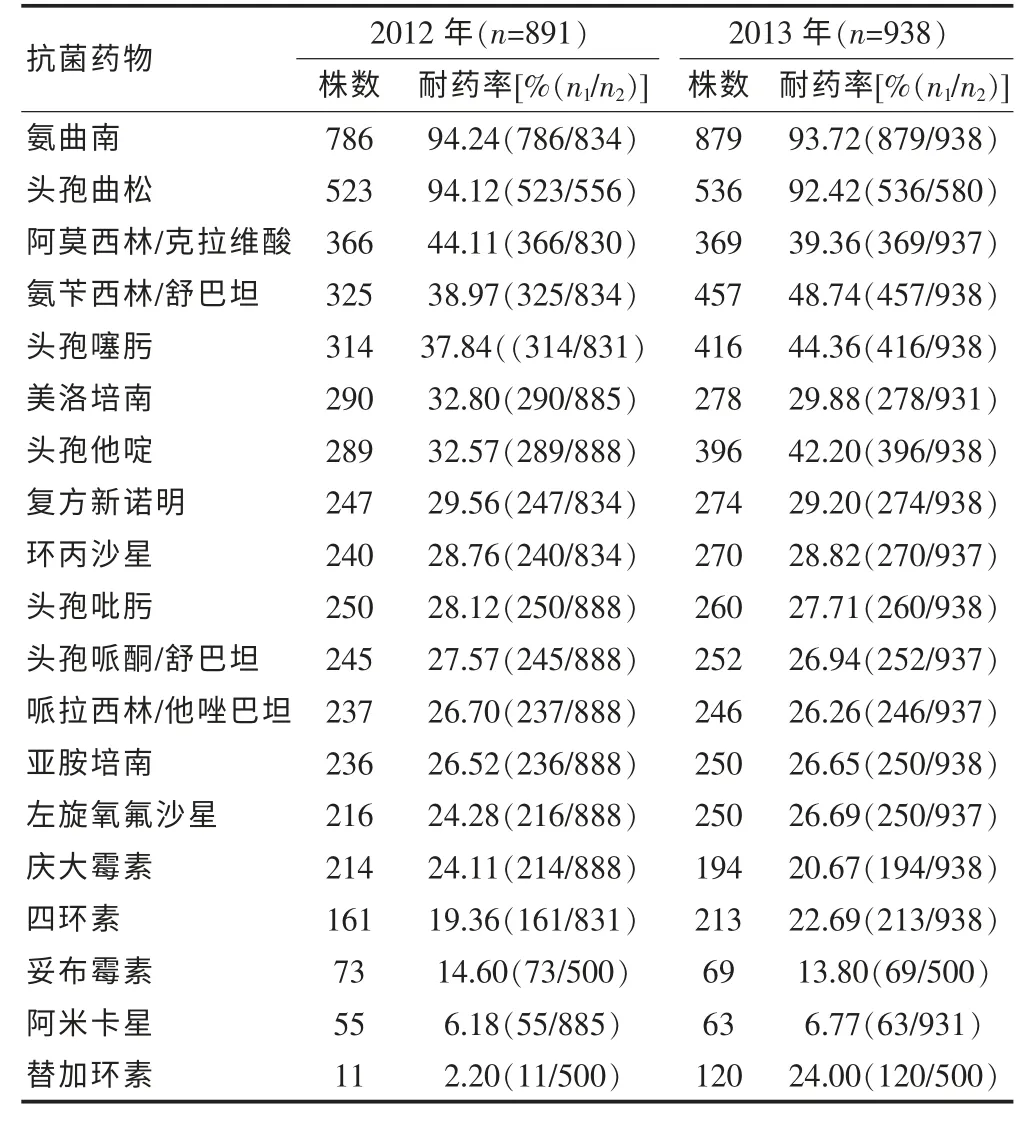
表4 2012~2013 年鮑曼不動桿菌對常用抗菌藥物的耐藥率
本研究結果顯示,銅綠假單胞菌最常見分離自呼吸道標本(68.35%),其次為分泌物(16.95%),與國內的報道一致[4-5]。 科室分布內科以呼吸內科和ICU 為主,分別占17.65%和15.98%,這些科室的患者多為老年患者或患病嚴重、住院時間長、免疫力低下,同時大量使用廣譜抗菌藥物造成菌群失調,致使銅綠假單胞菌繼發感染,藥物敏感的銅綠假單胞菌被殺滅,耐藥性菌株得以存活并成優勢菌群。 外科則以普外科、腫瘤科、神經外科為主,分別占12.43%、6.40%和6.19%,因此加強消毒滅菌制度的落實,減少侵入性操作及合理使用抗菌藥物是預防銅綠假單胞菌的有效措施。
銅綠假單胞菌具有固有耐藥和獲得性耐藥,經常表現對β-內酰胺類、喹諾酮類、氯霉素類和磺胺類等抗菌藥物的多重耐藥,耐藥率呈逐年上升趨勢,且與抗菌藥物使用量存在相關性。銅綠假單胞菌是全球共識的多藥耐藥非發酵菌, 共具有復雜的耐藥形成機制: ①該菌能產生破壞抗菌藥物活性的多種滅活酶、鈍化酶和修飾酶;②基因發生突變使得抗菌藥物的作用靶位變化;③細胞外膜固有的微孔蛋白缺失及膜通透性降低;④細胞主動泵出機制使進入菌細胞的抗菌藥物排出菌體;⑤銅綠假單胞菌感染宿主后形成生物膜,可阻擋白細胞、各種抗體、抗菌藥物進入菌細胞內吞噬和殺滅細菌。攜帶不同耐藥質粒不同類型的銅綠假單胞在醫院內環境中大量繁殖、廣泛傳播,致使多藥耐藥銅綠假單胞菌的數量日益增多,耐藥率也逐年攀升[6]。 本研究結果顯示,銅綠假單胞菌對阿莫西林/克拉維酸和氨芐西林/舒巴坦的耐藥率>90%,表明這類抗菌藥物已經不適于銅綠假單胞菌感染的治療。近年來以亞胺培南為主的碳青霉烯類抗菌藥物被視為控制革蘭陰性菌感染的強效藥物,在臨床經驗用藥中廣泛應用,使銅綠假單胞菌對亞胺培南和美洛培南的耐藥率呈上升趨勢。 本研究結果顯示,銅綠假單菌對亞胺培南和美洛培南的耐藥率分別從2012 年的8.45%、8.09%上升到2013 年的13.10%、11.16%。由于抗菌藥物的不合理使用會增加銅綠假單胞菌適應性耐藥, 因而臨床上應加強抗菌藥物最優劑量的管理,慎重、合理地使用碳青霉烯類抗菌藥物,密切關注銅綠假單胞菌耐藥性的發展, 采用有效的感染控制措施。 銅綠假單胞菌對頭孢吡肟、哌拉西林/他唑巴坦等抗菌藥物較敏感,耐藥率為6.22%~9.85%,臨床常選擇其作為治療呼吸道感染的經驗性用藥。銅綠假單胞菌對阿米卡星和妥布霉素敏感, 耐藥率僅為1.15%~3.02%,盡管這類藥物對銅綠假單胞菌抗菌作用良好,但由于其耳、腎毒性等不良反應,限制了其在臨床的應用,尤其是老年患者應慎用,一般不單用,常與β-內酰胺類抗生素聯合使用。
3.2 鮑曼不動桿菌感染的臨床分布及耐藥性
鮑曼不動桿菌屬于非發酵革蘭陰性菌,廣泛存在于自然界、醫院環境及人體皮膚,常引起慢性病患者、老年人、有侵入性治療、長期使用廣譜抗菌藥物治療的患者以及免疫力低下的患者發生感染[7],是常見的院內感染主要致病菌之一。鮑曼不動桿菌耐藥現象普遍,多重耐藥菌和泛耐藥菌呈逐年上升趨勢,常可在插管、機械通氣、長期住院患者的呼吸道、泌尿道、傷口等部位分離到,嚴重者可出現菌血癥及心內膜炎[8]。一旦感染治療效果差,病死率高[9]。
本研究結果顯示,鮑曼不動桿菌最常見分離自痰液標本(占81.79%),與國內的報道一致[10]。 有研究顯示,鮑曼不動桿菌院內感染最常見部位是肺部,其次是血流感染,是醫院獲得性肺炎(HAP),尤其是呼吸機相關肺炎(VAP)重要的致病菌[11]。 本研究表明,鮑曼不動桿菌的科室分布以ICU 為主,占19.03%,這與全國的CHINET 監測報道一致[12],但所占科室比例明顯低于張勇等[11]報道的45.96%和葉春幸等[13]報道的63.39%,這可能與醫院ICU 床位分布有關。 這一結果與入住ICU 患者存在以下相關危險因素有關,如長時間住院、入住ICU、接受機械通氣、侵入性操作、抗菌藥物暴露以及嚴重基礎疾病等,同時與ICU 的院內感染控制措施有關。
多項研究表明, 鮑曼不動桿菌可以產生質粒介導的TEM-1、TEM-2, 染色體AmpC 型頭孢菌素酶,通過接合、轉導、轉化等方式在菌種間傳遞,導致耐藥性傳播;碳青霉烯酶的產生、高產AmpC 酶伴外膜孔蛋白缺失、靶位點轉移、主動泵出系統過量表達等均是多藥耐藥產生的原因; 對喹諾酮類抗菌藥物的耐藥性則主要與gyrA 和parC 基因突變導致的DNA旋轉酶或拓撲異構酶的改變、膜通透性降低等有關[10]。鮑曼不動桿菌耐藥機制復雜,其中產β-內酰胺酶、碳青霉烯酶是其主要耐藥機制, 且極易經質粒結合方式獲得耐藥性,常有多種耐藥質粒共存,故鮑曼不動桿菌對頭孢菌素類、 青霉素類和氨基糖苷類呈交叉耐藥。 由于廣譜頭孢菌素和碳青霉烯類抗菌藥物廣泛應用,鮑曼不動桿菌的多耐藥、泛耐藥株感病例逐漸增多[14]。
本研究結果顯示,鮑曼不動桿菌對氨曲南、頭孢曲松的耐藥率>90%, 表明這類抗菌藥物已經不適于鮑曼不動桿菌感染的治療。對頭孢吡肟、亞胺培南、美洛培南、頭孢哌酮/舒巴坦、哌拉西林/他唑巴坦、環丙沙星、左氧氟沙星、復方新諾明、四環素和慶大霉素耐藥率在19.36%~32.80%,表明鮑曼不動桿菌對大多數抗菌藥物均存在一定的耐藥性。尤其值得關注的是鮑曼不動桿菌對亞胺培南和美洛培南的耐藥率分別達26.52%~26.65%和29.88%~32.80%,其耐藥機制主要是產生了碳青霉烯酶, 多數為OXA 型β-內酰胺酶。造成耐藥株增多的原因除與亞胺培南和美洛培南使用廣泛有關外,還與耐藥克隆株在醫院環境中定植及在病房內播散有關。 鮑曼不動桿菌對妥布霉素、阿米卡星耐藥率較低,為6.18%~14.60%,但由于本類藥物的耳腎毒性,限制了其在臨床的應用,尤其是老年患者,一般不單用,常與β-內酰胺類等抗菌藥物聯合使用。 本研究結果顯示,鮑曼不動桿菌對替加環素的耐藥性增長迅速,從2012 年的2.20%上升到2013 年的24.00%,這可能與該藥物作為新型抗菌藥物在臨床的廣泛使用有關,導致其耐藥性快速上升。 β-內酰胺類與酶抑制劑的復方制劑如氨芐西林/舒巴坦、 頭孢哌酮/舒巴坦常被用來治療鮑曼不動桿菌的感染, 由于舒巴坦不僅對β-內酰胺酶有抑制作用, 對鮑曼不動桿菌也有直接抗菌活性,是治療鮑曼不動桿菌的較為有效的藥物,本研究數據顯示,對頭孢哌酮/舒巴坦的耐藥率在30%以下,值得臨床經驗用藥。除此之外,國內外報道米諾環素、多黏菌素、替加環素等也是治療泛耐鮑曼不動桿菌的常用藥物[13]。
銅綠假單胞菌和鮑曼不動桿菌是引起醫院感染常見的條件致病菌,針對近年來多重耐藥菌和泛耐藥菌的出現, 臨床應注重感染性疾病的病原學檢查,控制抗菌藥物用藥頻度,合理使用抗菌藥物,加強消毒措施,遏制耐藥菌株的產生、播散與流行。
[1] 高媛,徐雅萍,李曉霞,等.老年患者銅綠假單胞菌感染調查及耐藥性分析[J].中華醫院感染學雜志,2010,20(11):1607-1609.
[2] 夏靜鴻,朱光發,王愛萍,等.銅綠假單胞菌的臨床及耐藥性分析[J].臨床肺科雜志,2014,19(6):993-996.
[3] D'Arezzo S,Lanini S,Puro V,et al. High-level tolerance to triclosan may play a role in Pseudomonas aeruginosa antibiotic resistance in immunocompromised hosts:evidence from outbreak investigation[J].BMC Res Notes,2012,19(5):43.
[4] 陳詠君,陳詠玫,張立群,等.219 株銅綠假單胞菌感染分布與耐藥性分析[J].中國醫學創新,2014,11(12):80-82.
[5] 王秋菊,秦進,袁飛.2162 株銅綠假單胞菌醫院感染的臨床分布及耐藥性分析[J].疾病監測,2014,29(6):454-457.
[6] 程海濤,危艷順,申建維.銅綠假單胞菌對抗菌藥物的耐藥性分析[J].中華醫院感染學雜志,2014,24(80):1840-1842.
[7] 楊虹,王麗,溫見翔,等.肺炎克雷伯菌和鮑曼不動桿菌的耐藥性分布差異研究[J].中國實驗診斷學,2013,17(6):1025-1029.
[8] 鄂建飛,魯靜,蔣香梅,等.銅綠假單胞菌和鮑曼不動桿菌臨床感染和耐藥性分析[J].醫學檢驗與臨床,2012,23(4):37-39.
[9] Lenie D,Alexandr N,Harald S.An increasing threat in hospitals:muhidmg-resistant Acinetobacter baumannii [J]. Nat Rev Microbiol,2007,5(12):939-951.
[10] 丁毅偉,郝秀紅,趙強元,等.銅綠假單胞菌與鮑氏不動桿菌耐藥性分析[J].中華醫院感染學雜志,2014,24(9):2088-2090.
[11] 張勇,周華,楊青,等.鮑曼不動桿菌臨床分布、耐藥性分析和肺部感染病例的預后研究[J].中國微生態學雜志,2014,26(5):530-533.
[12] 習慧明,徐英春,朱德妹,等.2010 年中國CHINET 鮑曼不動桿菌耐藥性監測[J].中國感染與化療雜志,2012,12(2):98.
[13] 葉春幸,馬真,卓宋明.鮑曼不動桿菌的院內感染及耐藥性分析[J].中國醫藥導報,2013,10(14):116-120.
[14] 李桂梅.978 株鮑曼不動桿菌的分布及耐藥性分析[J].中國醫藥導報,2013,10(18):122-124.

