豬RIG-I真核表達載體的構建及其抗口蹄疫病毒作用研究
王國慶,朱紫祥,曹偉軍,楊 帆,毛箬青, 李 丹,劉 磊*,鄭海學*
(1.甘肅農業大學 動物醫學院,蘭州 730070;2.中國農業科學院 蘭州獸醫研究所 家畜疫病病原生物學國家重點實驗室 國家口蹄疫參考實驗室,蘭州 730046)
豬RIG-I真核表達載體的構建及其抗口蹄疫病毒作用研究
王國慶1,朱紫祥2,曹偉軍2,楊 帆2,毛箬青2, 李 丹2,劉 磊1*,鄭海學2*
(1.甘肅農業大學 動物醫學院,蘭州 730070;2.中國農業科學院 蘭州獸醫研究所 家畜疫病病原生物學國家重點實驗室 國家口蹄疫參考實驗室,蘭州 730046)
為研究模式識別受體分子RIG-I是否具有抑制口蹄疫病毒(FMDV)復制的作用,本研究從豬的PK15細胞中提取RNA,通過分段擴增與融合PCR的方法,擴增豬的RIG-I的完整CDS序列,進一步構建豬RIG-I的真核表達質粒。通過Western blotting和間接免疫熒光試驗對構建的真核表達質粒進行表達驗證,證明其成功表達,同時證明豬RIG-I蛋白定位于細胞的細胞質中。感染試驗發現FMDV能夠誘導細胞內RIG-I的轉錄上調,這表明兩者間存在著重要聯系。過表達試驗證實RIG-I具有抑制FMDV復制的作用,而下調表達RIG-I可以促進FMDV的復制,這表明RIG-I在機體抗口蹄疫病毒感染過程中發揮著重要作用。本研究的開展,為進一步探索RIG-I抗口蹄疫病毒的分子機制提供了理論支持;為口蹄疫病毒感染過程中,天然免疫系統抗病毒機制研究奠定了基礎。
口蹄疫病毒;RIG-I;天然免疫;抗病毒作用
口蹄疫(foot and mouth disease,FMD)是由口蹄疫病毒(foot and mouth disease virus, FMDV)引起的一種高度傳染性疫病[1]。FMDV屬于小RNA病毒科,口蹄疫病毒屬,為單鏈正股RNA病毒,包含七個血清型。FMDV主要感染豬、牛和羊等偶蹄類動物[2-3]。FMD曾被世界動物衛生組織(OIE)規定為A類烈性動物傳染病,在我國被列為一類動物傳染病[4-6]。撲殺是FMD防控的主要手段,因此一旦發生疫情,會導致巨大的經濟損失。這嚴重威脅著我國養殖業的發展。作為一個養殖業大國,如何有效地控制、預防和治療FMD是當前科研工作者的一個重要使命和責任。由于FMDV血清型較多,型間無交叉保護反應,這給以疫苗免疫為主的控制措施帶來了巨大的挑戰[4]。為了更好地控制口蹄疫的流行和傳播,除了深入探索FMDV遺傳變異與血清型分布的規律外,同時還需要研究宿主細胞先天性免疫抗口蹄疫機制,因為宿主細胞的先天性免疫反應不僅是抗擊病毒感染的第一道防線,而且在啟動機體后來的獲得性免疫反應中起著非常重要的作用。
模式識別受體(pattern recognition receptors,PRRs)是機體抵抗病原微生物感染,啟動機體先天性免疫應答的重要組成部分,在先天性免疫反應中發揮著極其重要的作用[7]。病原微生物感染細胞后,PRRs通過識別病原的病原相關分子模式(pathogen-associated molecular patterns,PAMPs),促進下游干擾素與細胞因子的分泌,然后激活一些抗菌或抗病毒蛋白的表達,最終促進細胞對病原微生物的清除[8]。 RIG-I樣模式識別受體(retinoic acid-inducible gene I-like helicases receptors,RLRs)為模式識別受體中極為重要的一類分子,其通過RLR級聯信號誘導Ⅰ型干擾素和炎癥因子的產生,在抗病毒天然免疫中起著非常重要的作用[9]。RLRs家族至今已發現有RIG-I、MDA5和LGP2三個成員[10]。RIG-I已經被報道在多種RNA病毒的復制過程中發揮著重要的作用[11-12]。但至今關于RIG-I是否在FMDV感染過程中發揮作用沒有報道。因此,本研究通過構建FMDV感染的本體動物豬的RIG-I真核表達質粒,對其表達情況進行了驗證,對其在細胞內的定位進行了研究,進一步通過過表達試驗以及siRNA干擾試驗,對RIG-I是否抗FMDV感染進行了研究,探討RIG-I在FMDV感染過程中是否發揮抗病毒作用。本研究為深入研究RIG-I的抗病毒功能奠定了基礎,為控制FMDV的蔓延和擴散提供了新的視角。
1 材料與方法
1.1 毒株、細胞、菌株和載體
口蹄疫A型毒株A/WH/CHA/09由國家口蹄疫參考實驗室保存。PK15細胞和BHK-21細胞購自中國科學院上海生命科學研究院細胞資源中心,克隆菌株大腸桿菌DH5α 與克隆載體pMD20-T 均購自寶生物(大連)有限公司。真核表達載體pcDNATM3.1/myc-His(-) A購自Invitrogen公司。
1.2 主要試劑
LATaqPolymerase、PrimeSTAR?HS DNA Polymerase、DNA A-Tailing Kit、DNA Marker、Random Primer(6mer)、Oligo dT寡聚核苷酸、SYBR Green試劑、T4 DNA連接酶及相關限制性內切酶均購自寶生物(大連)有限公司;低分子量蛋白Marker購自賽默飛世爾科技公司(中國);c-Myc單克隆抗體及羊抗鼠IgG二抗均購自Santa Cruz Biotechnology公司;β-actin單克隆抗體購自Cell signaling technology公司;RNA Trizol、LipofectamineTM2000和Alexa FluorH 546 conjugated anti-mouse IgG secondary antibodies購自Invitrogen公司;DAPI購自羅氏公司。
1.3 RNA提取及基因克隆
用Trizol裂解法提取總RNA:將35 mm培養皿中生長狀態好的PK15細胞用PBS洗滌兩次后,加入1 mL Trizol反復吹打裂解,移入1.5 mL無RNase eppendorf離心管內,室溫裂解5 min,加入250 μL氯仿振蕩混勻后4 ℃放置15 min,4 ℃12 000 r·min-1離心15 min,小心吸取上清到新的無RNase的1.5 mL eppendorf離心管中,并加入等體積的異丙醇沉淀RNA,-20 ℃放置30 min后,4 ℃ 12 000 r·min-1離心15 min,棄去上清,用75% DEPC處理水配制的乙醇洗滌離心管,4 ℃10 000 r·min-1離心5 min,小心棄去上清,晾干,加入20 μL無RNase 水溶解RNA,測定RNA濃度。
反轉錄反應(20 μL體系):首先取1 μg RNA,1 μL 100 μmol·L-16 bp random primer,1 μL 10 mmol·L-1dNTPs,補無RNase水至12 μL,65 ℃反應5 min,冰上2 min。離心至管底后,加入4 μL 5×First buffer,2 μL 0.1 mol·L-1DTT,1 μL RNA酶抑制劑RRI,1 μL M-MLV反轉錄酶。反應程序:25 ℃ 10 min,37 ℃ 60 min,75 ℃ 15 min,4 ℃保存備用。
PCR擴增反應(20 μL體系):取10×LA buffer 1 μL,cDNA 2 μL,20 μmol·L-1上下游引物各0.5 μL,2.5 mmol·L-1dNTPs 4 μL,LATaq酶0.5 μL,加水補足至20 μL。反應程序:預變性 95 ℃ 5 min;變性95 ℃ 1 min,退火58 ℃ 30 s,延伸72 ℃ 2 min,共34個循環;72 ℃延伸10 min,4 ℃保存。1%瓊脂糖凝膠電泳鑒定。退火溫度及延伸時間根據引物片段和擴增長度確定。使用PrimeSTAR?HS DNA Polymerase擴增時,取其相應的Buffer,方法與上述步驟相同。擴增引物見表1。
表1 本試驗中應用到的引物序列
Table 1 The primers used in this study
1.4 質粒構建
利用提取好的PK15細胞RNA作為模板進行反轉錄,獲得cDNA。利用LATaq酶、兩對引物(表1)通過RT-PCR分別擴增出豬RIG-I基因的前半部分(RIG-I-1)和后半部分(RIG-I-2),中間重疊約150 bp。將擴增獲得的兩個片段分別與pMD20-T載體連接,構建至T載體中,轉化DH5α大腸桿菌,提取質粒送樣測序。
測序驗證正確后,利用PrimeSTAR?HS DNA Polymerase分別從T載體中擴增兩個片段,然后進行融合PCR,獲得含有豬RIG-I完整編碼區(CDS)的基因序列。然后對擴增的序列進行DNA加A反應,在擴增序列兩端引入A尾以用于TA連接。將加A完成的全長序列連接至T載體,轉化DH5α大腸桿菌,提取質粒。以得到的T載體質粒為模板,用含有限制性內切酶位點(XhoⅠ與BamHⅠ)的一對引物(RIG-I-complete)(表1)擴增完整的RIG-I CDS序列。電泳純化回收擴增產物,再用XhoⅠ與BamHⅠ雙酶切,電泳純化回收。將純化回收片段與利用限制性內切酶XhoⅠ與BamHⅠ酶切得到的pcDNATM3.1/myc-His(-) A線性載體進行連接。轉化DH5α大腸桿菌,提取質粒送樣測序。經測序分析證實,成功構建表達豬RIG-I基因的真核表達質粒,命名為p-RIG-I-myc。
1.5 實時熒光定量PCR(qPCR)(SYBR?Green 法)
收取細胞樣品,按照方法1.3提取RNA,反轉錄,按照SYBR?Premix Ex TaqTM(TaKaRa) 試劑盒說明書操作配制反應體系,利用stratagene_Mx3005 (Agilent) 進行實時定量PCR反應,利用甘油醛-3-磷酸脫氫酶基因GAPDH作為內參基因進行不同基因mRNA的相對定量。利用MxPro-Mx3005P 軟件進行數據分析。擴增引物見表1。
1.6 蛋白免疫印跡(Western blotting)
細胞蛋白樣品的制備:預冷PBS洗滌細胞2次后,收取細胞沉淀。根據收集細胞沉淀的多少加入適量的細胞裂解液,冰上反復吹打重懸細胞樣品,裂解10 min,超聲波瞬時破碎(冰上操作,超聲2~3次),4 ℃ 14 000 r·min-1離心10 min,收取上清于另一預冷離心管中保存。另取2 μL收取的上清用BCA法測定蛋白質濃度。剩余樣品上清加入5×SDS PAGE buffer,沸水煮沸變性5 min,4 ℃ 14 000 r·min-1離心10 min,取適量上清進行蛋白質電泳。
SDS-PAGE蛋白質凝膠電泳及轉印:配制10%聚丙烯酰胺蛋白膠。80 V電壓跑膠,待蛋白質樣品進入分離膠后,調取電壓至120 V,直至電泳結束。通過濕轉方法進行蛋白質轉印,將蛋白質轉印至硝酸纖維素膜(NC膜)。待轉印結束后,利用5%的TBST脫脂乳室溫封閉2~3 h。隨后進行一抗孵育,4 ℃過夜。TBST輕輕漂洗3 次后,HRP標記的二抗孵育,室溫作用2 h,作用完畢用TBST輕輕漂洗3次。利用ECL顯色試劑盒進行顯色反應,曝光X片,掃描膠片保存結果。
1.7 間接免疫熒光(indirect fluorescence assay,IFA)
共聚焦專用培養皿中培養細胞,待細胞快長滿單層后,進行轉染,選取合適時間點進行細胞固定。棄去細胞培養液,用PBS漂洗2次,加入配制好的等體積甲醇丙酮混合液,-20 ℃固定20 min。吸去固定液,PBS洗滌3次,每次約10 min。用1% BSA 37 ℃封閉30 min。PBS漂洗3次,每次約5 min。然后進行一抗孵育,37 ℃作用1 h。PBS漂洗5次,每次5 min。避光滴加稀釋的熒光二抗,37 ℃作用30 min。TBS潤洗5次,每次5 min。然后進行細胞核染色。配制DAPI細胞核染色液,避光染色,室溫作用10 min,TBS漂洗3次,激光共聚焦顯微鏡下觀察拍照。
1.8 病毒感染及病毒滴度測定
病毒感染:35 mm細胞培養皿培養PK15細胞,待細胞長至80%~90%時,轉染p-RIG-I-myc質粒。轉染24 h后,棄去細胞上清,用PBS洗滌3次,接種1 MOI病毒,37 ℃孵育1 h后,去除未吸附的病毒,PBS洗滌一次,加入細胞維持液(1%FBS培養液)。感染12 h后,收集上清及細胞,測定細胞內病毒RNA含量及上清中病毒滴度。
病毒滴度的測定(TCID50):提前18~24 h將BHK-21細胞接種96孔細胞培養板。用DMEM 10倍稀釋病毒液;用PBS洗3遍細胞后,接種病毒,另設兩列陰性對照孔。加入病毒液后,37 ℃吸附1 h,每15 min輕輕搖晃一次,保證病毒吸附均勻。吸附1 h后,棄去上清,用PBS 輕輕洗板 1 次。加入病毒維持液,感染36~48 h觀察,記錄每個稀釋度產生CPE的細胞孔的數目,根據Reed-Muench法計算TCID50。重復三次測定,取平均值為最終病毒滴度。
1.9 siRNA干擾試驗
待35 mm細胞培養皿中PK15細胞快長滿單層后,分別轉染對照組(negative control,NC)和針對RIG-I的siRNA,轉染36 h后,利用qPCR方法檢測干擾效率。在證實了合成的siRNA可以下調RIG-I的表達后,將NC siRNA和RIG-I siRNA分別轉染PK15細胞,轉染36 h后,以等量FMDV(0.5 MOI)分別感染兩組細胞,感染18 h后,收集細胞,提取RNA,利用實時熒光定量PCR進行檢測,比較分析RIG-I和FMDV mRNA差異。
2 結 果
2.1 豬RIG-I CDS序列擴增
利用兩對引物對豬RIG-I基因進行分段擴增后,1%瓊脂糖凝膠跑電泳,分別檢測到約1 564和1 417 bp大小的片段(圖1),與預期大小相符。兩片段分別與pMD20-T連接,提取質粒后,測序結果表明測序完全正確。利用PrimeSTAR?HS DNA Polymerase分別從T載體中擴增兩個片段,然后進行融合PCR擴增,結果獲得了約2 832 bp大小的片段,與預期大小相符(圖2)。該片段為豬RIG-I基因完整CDS序列。
2.2 豬RIG-I真核表達載體的構建
將2.1中獲得的完整CDS序列片段進行加A,連接T載體后,利用含有酶切位點的引物和PrimeSTAR?HS DNA Polymerase進行PCR擴增,獲得了約2 850 bp的片段(圖3A)。XhoⅠ與BamHⅠ雙酶切后、連入pcDNATM3.1/myc-His(-)A載體,轉化提取質粒。對獲得的質粒進行XhoⅠ與BamHⅠ雙酶切鑒定,證實質粒構建成功(圖3B)。送樣測序,結果表明成功構建表達豬RIG-I基因的真核表達質粒p-RIG-I-myc。
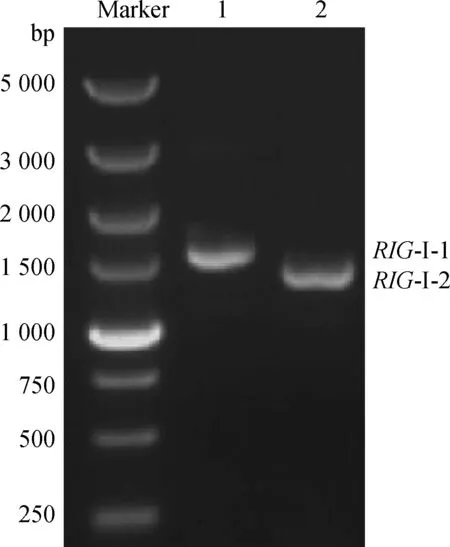
圖1 RIG-I-1與RIG-I-2 片段RT-PCR擴增結果Fig.1 Amplification of RIG-I-1 and RIG-I-2 fragments by RT-PCR
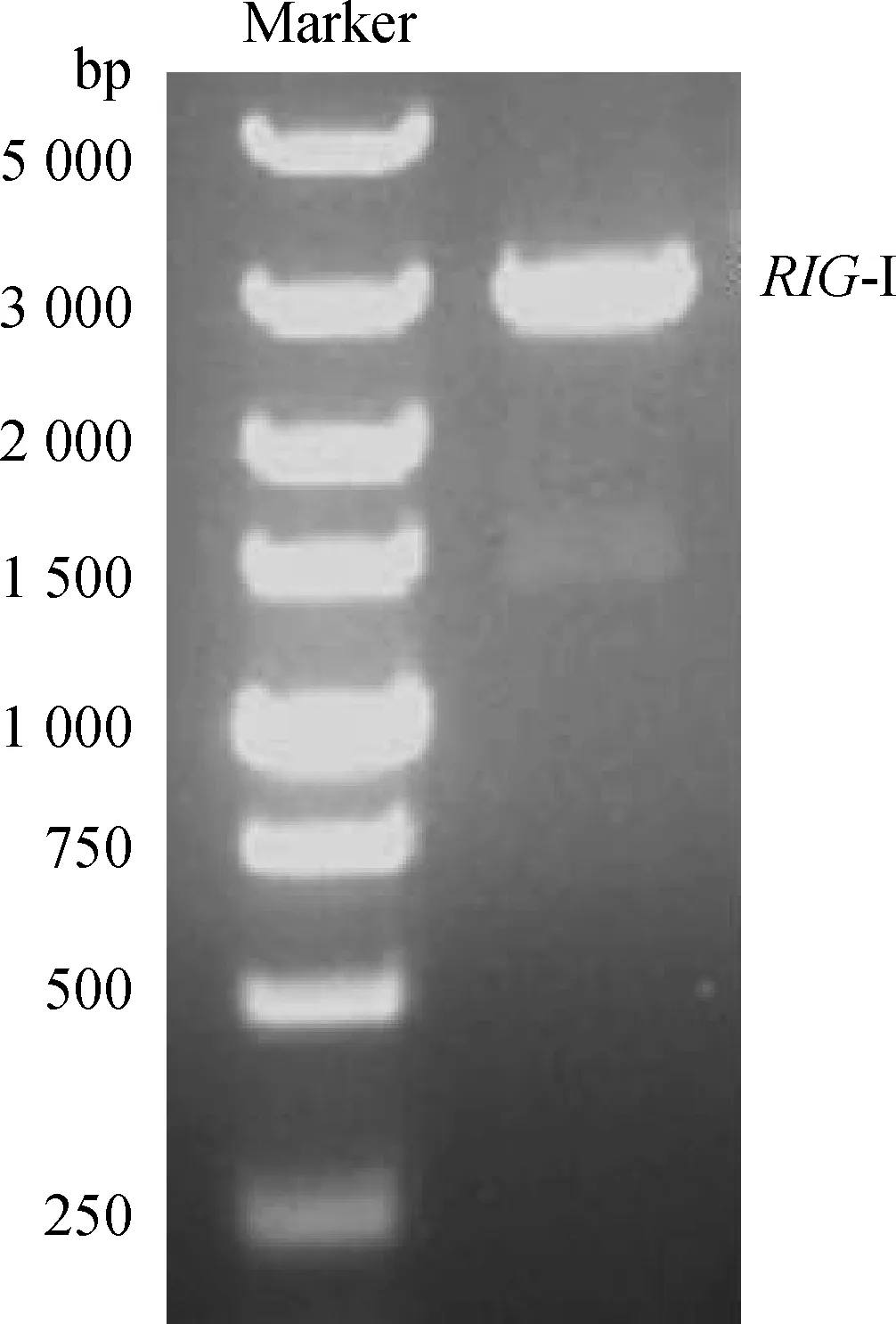
圖2 RIG-I-1與RIG-I-2 片段融合PCR擴增RIG-I-CDS全長Fig.2 Amplification of RIG-I-CDS complete sequence by overlap PCR

A.RIG-I CDS PCR擴增結果;B.RIG-I 真核表達質粒p-RIG-I-myc XhoⅠ與BamHⅠ雙酶切鑒定A.Amplification of RIG-I-CDS sequence by PCR;B.XhoⅠ and BamHⅠ enzymatic digestion of p-RIG-I-myc plasmid圖3 RIG-I 真核表達質粒p-RIG-I-myc的構建與鑒定Fig.3 Construction and identification of RIG-I eukaryotic expression plasmid (p-RIG-I-myc)
2.3 豬RIG-I真核表達質粒的表達驗證
分別將pcDNATM3.1/myc-His(-)A空載體和p-RIG-I-myc質粒轉染PK15細胞48 h后,收取樣品利用c-myc單抗進行Western blotting檢測,結果檢測到相對分子質量約為110 ku大小的帶(圖4),與預期大小相符合。這表明p-RIG-I-myc在PK15細胞內成功表達。同樣,利用間接免疫熒光試驗進行表達檢測,結果表明RIG-I成功表達,并確定RIG-I定位于細胞質內(圖5)。
2.4 FMDV感染上調RIG-I轉錄
利用35 mm培養皿培養PK15細胞,待長至80%~90%后,按照1MOI接種FMDV,分別在0、6、12、24 h收取細胞樣品,進行實時定量PCR檢測。選取GAPDH為內參基因。結果表明,隨著感染時

圖4 蛋白質印跡法驗證p-RIG-I-myc質粒的表達Fig.4 The confirmation of expression of p-RIG-I-myc plasmid by Western blotting
間的推移,FMDV RNA復制量顯著上升,而RIG-I的mRNA水平也明顯上升(圖6)。這表明FMDV感染可以上調RIG-I的轉錄。
2.5 過表達RIG-I可以抑制FMDV的復制
在PK15細胞中,分別轉染0、1、2和3 μg p-RIG-I-myc質粒,轉染24 h后接種1MOI FMDV,感染12 h后,通過實時定量PCR方法和TCID50試驗比較4個組間病毒復制的差異。結果表明,過表達RIG-I能夠顯著抑制FMDV的復制(圖7)。
2.6 下調表達RIG-I能夠促進FMDV的復制
在PK15細胞中,分別轉染對照組(negative control,NC)和針對RIG-I的siRNA,轉染36 h后,利用qPCR方法檢測干擾效率。結果表明,合成的針對豬RIG-I的干擾RNA可以顯著下調PK細胞中RIG-I mRNA的轉錄水平,干擾效率可以達到60%~65%(圖8A)。在證實了合成的siRNA可以下調RIG-I的轉錄后,將NC siRNA和RIG-I siRNA分別轉染PK15細胞,轉染36 h后,以等量FMDV(0.5MOI)分別感染兩組細胞,感染18 h后,收集細胞比較分析RIG-I和FMDV mRNA轉錄差異。結果顯示,RIG-I下調表達后,FMDV的復制水平顯著上升(圖8B)。這表明下調表達RIG-I可以顯著促進FMDV的復制。
3 討 論
豬是FMDV感染的主要宿主,在我國分布的FMDV血清型主要為O、A和亞洲Ⅰ型[13-14]。由于FMDV各型間無交叉保護反應,而且FMDV變異突變較快,這是以疫苗免疫作為主要防控策略的我國面臨的一個難題。宿主細胞的先天性免疫反應是
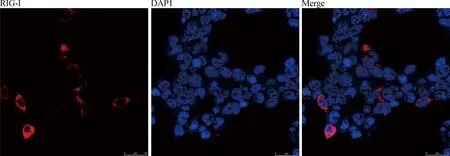
圖5 間接免疫熒光試驗驗證RIG-I質粒的表達及其細胞定位Fig.5 The identification of expression and subcellular localization of the RIG-I plasmid by indirect fluorescence assay
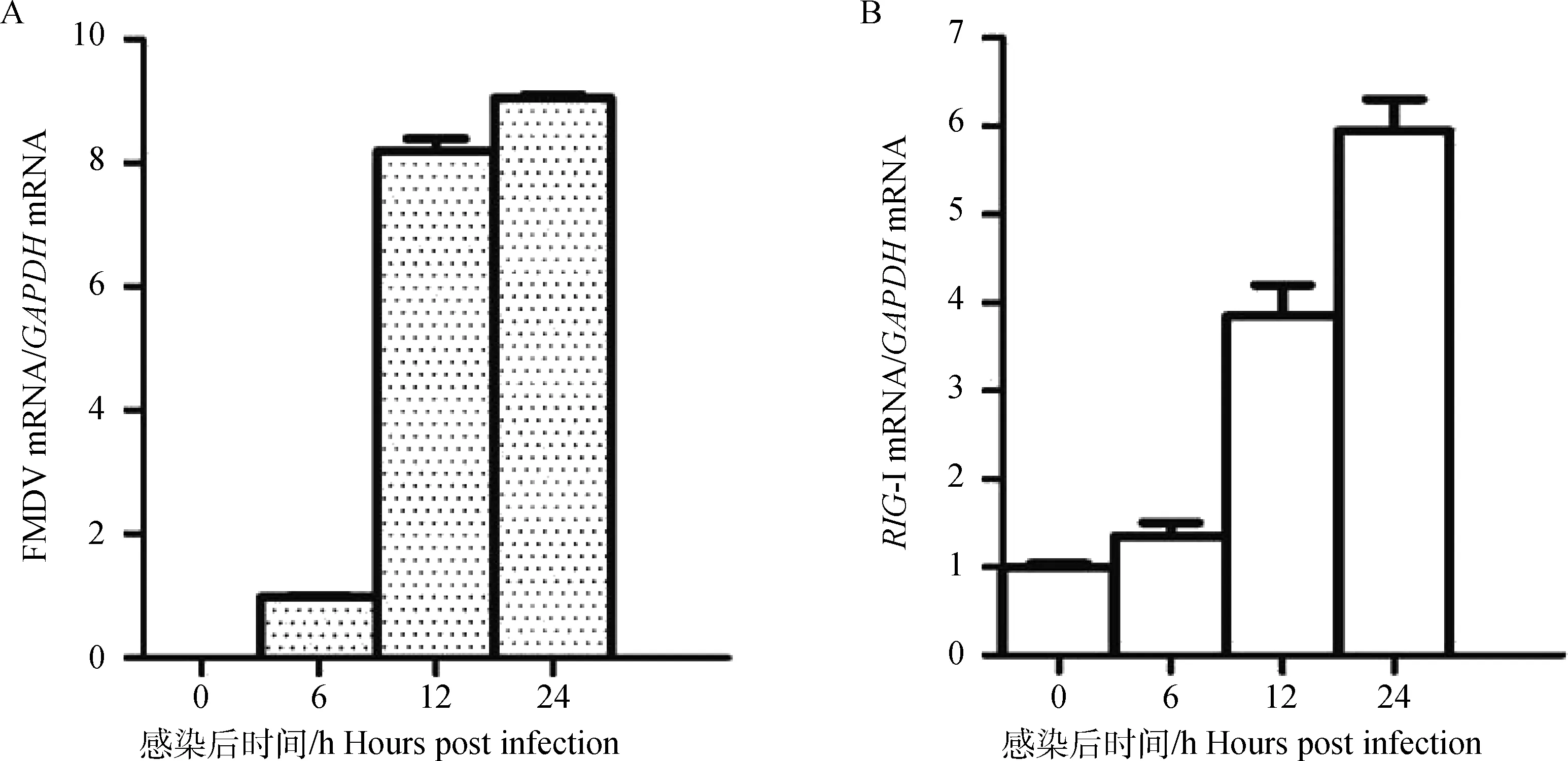
A.口蹄疫病毒 mRNA轉錄水平變化;B.RIG-I mRNA轉錄水平變化A.FMDV mRNA expression levels are detected by qPCR;B.RIG-I mRNA expression levels are detected by qPCR圖6 口蹄疫病毒感染誘導RIG-I mRNA轉錄上調Fig.6 FMDV infection induces RIG-I mRNA transcription
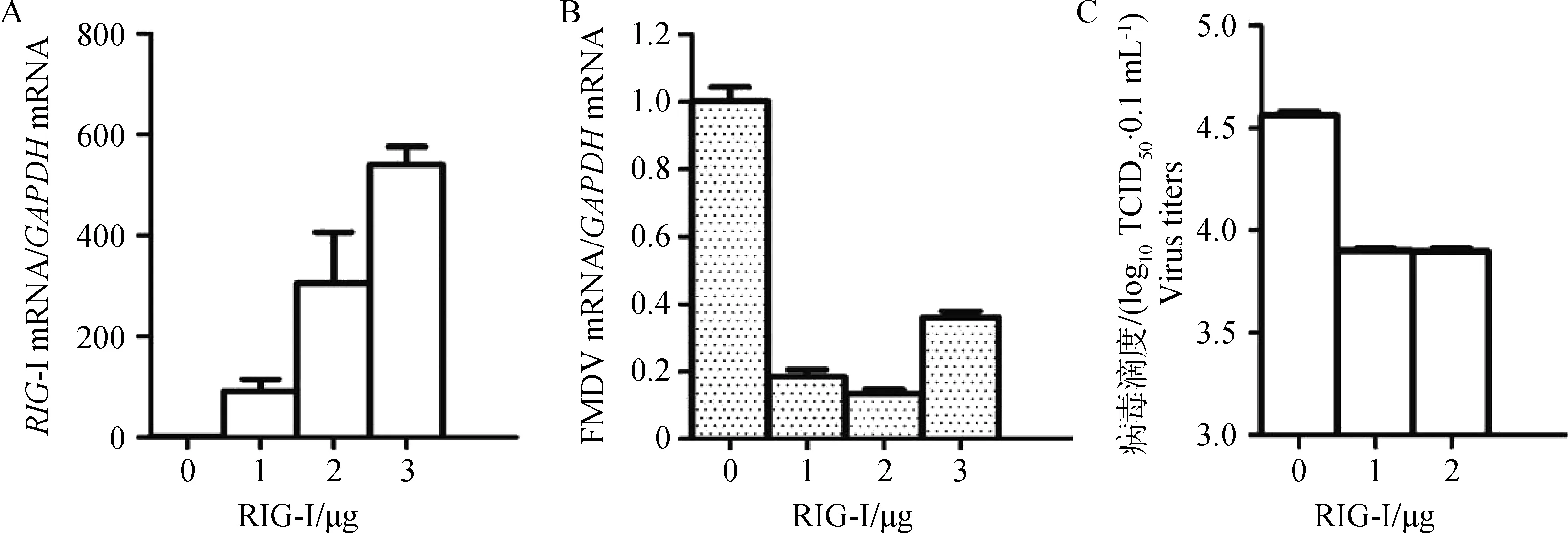
A.RIG-I過表達檢測;B.FMDV mRNA檢測;C.口蹄疫病毒感染TCID50測定A.Detection of RIG-I mRNA expression;B.Detection of FMDV mRNA expression;C.Detection of viral titers by TCID50 assay 圖7 RIG-I過表達抑制FMDV復制Fig.7 Overexpression of RIG-I suppresses FMDV replication
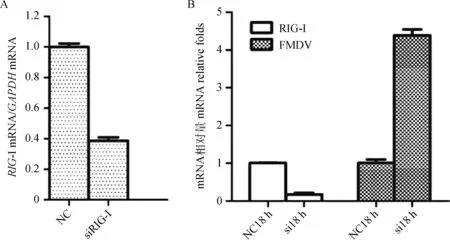
A.RIG-I siRNA干擾效率檢測;B.下調表達RIG-I對FMDV復制的影響檢測A.Detection of silence ratio of RIG-I siRNA;B.Detection of FMDV replication level after downregulation of RIG-I expression圖8 下調表達RIG-I可以促進FMDV復制Fig.8 Downregulation of RIG-I expression promotes FMDV replication
機體抵抗病毒感染的第一道防線,在機體誘導抗病毒反應過程中發揮著非常重要的作用。RIG-I作為RLRs家族中一個重要的分子,其在機體發揮抗病毒作用過程中起著不可或缺的作用。
關于RIG-I與FMDV之間關系的研究至今仍然未有報道,本研究通過擴增豬的RIG-I基因,對FMDV與RIG-I之間的關系進行了研究。由于豬RIG-I基因的CDS序列起始密碼子附近GC含量過高,而且豬RIG-I CDS序列全長較長,因此擴增具有一定的難度。本試驗通過分段擴增,將豬的RIG-I基因分為前后兩部分分別進行擴增,然后進行融合PCR擴增,最終獲得了豬RIG-I基因全長CDS序列,并構建了豬RIG-I基因的真核表達質粒,這為研究FMDV與豬RLRs信號通路間的相互作用機制奠定了基礎。
本研究發現,FMDV感染PK15細胞后,可以顯著誘導細胞內RIG-I的轉錄,這表明FMDV與RIG-I之間存在著必然的聯系。而進一步進行過表達試驗以及siRNA干擾試驗研究發現,RIG-I的上調表達可以抑制FMDV的復制,而下調表達RIG-I可以促進FMDV的復制,這證明了RIG-I在FMDV感染后發揮著重要的抗病毒作用。以往研究報道RIG-I可以通過其C端RD區識別病原RNA,然后通過其CARD區與IPS1結合而激活RLR信號通路,誘導下游炎癥因子和抗病毒蛋白的表達發揮抗病毒作用[15-16]。但是關于FMDV感染后,其病毒RNA是否能夠被RIG-I識別至今仍然不清楚。而本研究發現豬RIG-I蛋白定位于PK15細胞的細胞質中,這為進一步研究FMDV病原RNA與RIG-I之間的關系提供了一定的理論支持。雖然關于RIG-I抑制FMDV復制的機制仍然不清楚,但本試驗初步證實RIG-I具有抑制FMDV復制的作用。這為深入開展RIG-I抗FMDV機制研究奠定了理論基礎,為FMDV的防控提供了新的視角。
4 結 論
成功構建豬RIG-I的真核表達質粒,并驗證了質粒的表達,證實豬RIG-I蛋白定位于細胞的細胞質中。感染試驗發現口蹄疫病毒能夠誘導細胞內RIG-I的轉錄上調,過表達試驗證實RIG-I的上調表達具有抑制FMDV復制的作用,siRNA干擾試驗表明下調表達RIG-I可以促進FMDV的復制。這表明RIG-I在機體抗口蹄疫病毒感染過程中發揮著重要的抗病毒作用。
[1] HIGHFIELD L D,WARD M P,LAFFAN S W,et al.Critical parameters for modelling the spread of foot-and-mouth disease in wildlife[J].EpidemiolInfect,2010,138(1):125-138.
[2] ARZT J,BAXT B,GRUBMAN M J,et al.The pathogenesis of foot-and-mouth disease II:viral pathways in swine,small ruminants,and wildlife;myotropism,chronic syndromes,and molecular virus-host interactions[J].TransboundEmergDis,2011,58(4):305-326.
[3] PINTO A A.Foot-and-mouth disease in tropical wildlife[J].AnnNYAcadSci,2004,1026:65-72.
[4] ALEXANDROV T,STEFANOV D,KAMENOV P,et al.Surveillance of foot-and-mouth disease (FMD) in susceptible wildlife and domestic ungulates in Southeast of Bulgaria following a FMD case in wild boar[J].VetMicrobiol,2013,166(1-2):84-90.
[5] RAMIREZ-CARVAJAL L,DAZ-SAN S F,HICKMAN D,et al.Expression of porcine fusion protein IRF7/3(5D) efficiently controls foot-and-mouth disease virus replication[J].JVirol,2014,88(19):11140-11153.
[6] PEREZ-MARTIN E,DIAZ-SAN S F,WEISS M,et al.Type III interferon protects swine against foot-and-mouth disease[J].JInterferonCytokineRes,2014,34(10):810-821.
[7] NüRNBERGER T,BRUNNER F.Innate immunity in plants and animals:emerging parallels between the recognition of general elicitors and pathogen-associated molecular patterns[J].CurrOpinPlantBiol,2002,5(4):318-324.
[8] ROHMANN K,TSCHERNIG T,PABST R,et al.Innate immunity in the human lung:pathogen recognition and lung disease[J].CellTissueRes,2011,343(1):167-174.
[9] 謝廣成,段招軍.抗病毒感染固有免疫應答的信號轉導[J].病毒學報,2012,28(3):303-310. XIE G C,DUAN Z J.Signal transduction of innate immunity to virus infection[J].ChineseJournalofVirology,2012,28(3):303-310.(in Chinese)
[10] TAKAHASI K,KUMETA H,TSUDUKI N,et al.Solution structures of cytosolic RNA sensor MDA5 and LGP2 C-terminal domains:identification of the RNA recognition loop in RIG-I-like receptors[J].JBiolChem,2009,284(26):17465-17474.
[11] YONEYAMA M,FUJITA T.Function of RIG-I-like receptors in antiviral innate immunity[J].JBiolChem,2007,282(21):15315-15318.
[12] GACK M U.Mechanisms of RIG-I-like receptor activation and manipulation by viral pathogens[J].JVirol,2014,88(10):5213-5216.
[13] LEE B Y,LEE K N,LEE T,et al.Bovine genome-wide association study for genetic elements to resist the infection of foot-and-mouth disease in the field[J].Asian-AustralasJAnimSci,2015,28(2):166-170.
[14] RINGA N,BAUCH C T.Impacts of constrained culling and vaccination on control of foot and mouth disease in near-endemic settings:a pair approximation model[J].Epidemics,2014,9:18-30.
[15] LIU H M,LOO Y M,HORNER S M,et al.The mitochondrial targeting chaperone 14-3-3ε regulates a RIG-I translocon that mediates membrane association and innate antiviral immunity[J].CellHostMicrobe,2012,11(5):528-537.
[16] OSHIUMI H,MIYASHITA M,MATSUMOTO M,et al.A distinct role of Riplet-mediated K63-Linked polyubiquitination of the RIG-I repressor domain in human antiviral innate immune responses[J].PLoSPathog,2013,9(8):e1003533.
(編輯 白永平)
Construction of Porcine RIG-I Eukaryotic Expressing Plasmid and Its Antiviral Effects Research against Foot and mouth Disease Virus
WANG Guo-qing1,ZHU Zi-xiang2,CAO Wei-jun2,YANG Fan2,MAO Ruo-qing2,LI Dan2,LIU Lei1*,ZHENG Hai-xue2*
(1.CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China;2.NationalFootandMouthDiseaseReferenceLaboratory,StateKeyLaboratoryofVeterinaryEtiologicalBiology,LanzhouVeterinaryResearchInstitute,ChineseAcademyofAgriculturalSciences,Lanzhou730046,China)
To investigate whether pattern recognition receptor RIG-I has antiviral role against foot-and-mouth disease virus (FMDV),we extracted porcine cellular RNA from PK15 cells,and the complete CDS region ofRIG-I was obtained by using two-segmental amplification and fusion PCR methods.Subsequently,the eukaryotic expressing plasmid was constructed.The expression of the plasmid was confirmed by Western blotting and indirect fluorescence assay (IFA),which showed RIG-I was successfully expressed.The IFA result indicated porcine RIG-I protein was located in the cellular cytoplasm.The results of infection assay suggested that FMDV infection induced the upregulation of RIG-I expression,which implied the potential connection between RIG-I and FMDV.Over-expression assay confirmed that RIG-I inhibited FMDV replication,and downregulation of RIG-I significantly promoted FMDV replication.These results indicated that RIG-I had antiviral effect against FMDV.In conclusion,this study provided references for further research on antiviral mechanism of RIG-I against FMDV.It also paves ways for the research of antiviral mechanism of innate immune system after FMDV infection.
foot and mouth disease virus;RIG-I;innate immunity;antiviral effect
10.11843/j.issn.0366-6964.2015.04.013
2014-07-28
國家自然科學基金項目(31302118;31402179);甘肅省杰出青年基金項目(145RJDA328);甘肅省科技重大專項項目(1302NKDA027);國際原子能項目(16025/R0)
王國慶(1986-),男,河南商丘人,碩士生,主要從事分子病毒學研究,E-mail:1986guoqing@163.com
*通信作者:劉 磊(1960-),男,教授,E-mail:liuleigs@163.com;鄭海學(1979-),男,研究員,Tel:0931-8342086,E-mail:zhenghaixue@caas.cn
S582.659.6
A
0366-6964(2015)04-0600-08

