基因芯片技術檢測貴州省結核分枝桿菌耐藥基因KatG和inhA
歐維正,陳崢宏,陳 靜,駱科文,王 燕,秦 萬,蒙 俊
基因芯片技術檢測貴州省結核分枝桿菌耐藥基因KatG和inhA
歐維正1,陳崢宏2,陳 靜1,駱科文1,王 燕1,秦 萬1,蒙 俊1
目的 了解本地區結核分枝桿菌(MTB)異煙肼(INH)相關耐藥基因katG和inhA的突變特征,評價基因芯片法對MTB INH耐藥性檢測的臨床應用價值。方法 應用基因芯片法對經PCR-熒光探針法鑒定為MTB陽性的2 738例病人標本進行INH耐藥性檢測,分析其相關耐藥基因katG和inhA的突變特征,同時應用比例法檢測上述同期送檢的相同病人的同類型標本經羅氏培養MTB陽性菌株的INH耐藥性,比較兩種方法的檢測結果。結果 2 738例MTB核酸陽性標本經基因芯片法檢測,INH耐藥465例,耐藥率16.98%,其中以katG315(AGC→ACC)突變為主,基因突變率為78.06%,其次為inhA-15(C→T),katG315(AGC→AAC),突變率分別為16.13%和5.59%。上述病人同期送檢的同類型標本有1 493例經羅氏培養MTB陽性,比例法檢測,INH耐藥255例,耐藥率17.08%,對應的基因芯片法檢測結果為INH耐藥249例,耐藥率16.68%。以比例法結果為判斷標準,基因芯片法測定INH耐藥性的敏感性、特異性、陽性預測值(PPV)、陰性預測值(NPV)及準確性分別為85.49%、97.50%、87.55%、97.03%和95.45%。結論 本地區INH耐藥以katG315(AGC→ACC)和inhA-15(C→T)突變類型為主;基因芯片對MTB INH耐藥性檢測具有高敏感性、特異性、準確性和快速性,可用于本地區MTB INH耐藥性的快速檢測。
基因芯片;異煙肼;基因突變;比例法藥物敏感性試驗;結核分枝桿菌
異煙肼(isoniazid,INH)是治療結核病的首選化學藥物,對結核病的有效控制起著重要作用。但目前結核分枝桿菌(Mycobacteriumtuberculosis,MTB)對INH的耐藥率已達17.6%[1],是結核病治療失敗的一大原因。目前,對于INH耐藥性檢測的方法有多種,但大部分檢測方法所需時間較長,傳統方法是以培養為基礎的絕對濃度法和比例法,需要2~3個月時間才能得到藥物敏感性結果。放射性快速診斷技術(BACTEC)可將耐藥性檢測時間縮短到2~4周,但仍不能滿足臨床的需要。近年來,基因芯片等分子藥敏檢測技術進展迅速,其最大優點是快速,通常1 d即可獲得藥敏結果,但也存在只能檢測主要耐藥基因常見突變位點的問題,并且,耐藥基因突變位點因國家和地區而有所差異[2-4],其檢測的敏感性、特異性、準確性和地區適用性有待臨床驗證。為此,本研究從我院近兩年的17 452例臨床送檢標本中,經PCR-熒光探針法檢測MTB核酸后,篩選出2 738例不同病人的MTB核酸陽性標本,應用基因芯片法檢測MTB對INH的耐藥性,分析本地區INH相關耐藥基因katG和inhA的突變特征,同時與傳統比例法結果比較,為本地區基因芯片法快速檢測INH藥物敏感性的推廣應用提供參考依據。
1 材料與方法
1.1 材料
1.1.1 標本來源 2012年4月至2014年5月來自我院門診、住院病人送檢標本共17 452例。病人來源分布于貴州省各地,年齡20 d至96歲,男:11 143人次,女:6 309人次。送檢標本包括8 814例痰(含咽拭子)、4 064例支氣管灌洗液、2 602例胸水、195例腹水、784例腦脊液、438例穿刺液、409例分泌物、123例尿液和23例其他標本。
1.1.2 MTB核酸提取和PCR-熒光探針法檢測試劑 為博奧生物有限公司生產的“晶芯?分枝桿菌核酸檢測(PCR-熒光探針法)試劑盒” [注冊號為國食藥監械(準)字2010第3400530號]。
1.1.3 MTB耐藥基因芯片法檢測試劑 為博奧生物有限公司生產的“晶芯?結核分枝桿菌耐藥基因檢測試劑盒(DNA微陣列芯片法)” [注冊號為國食藥監械(準)字2010第3400383號],檢測指標含INH耐藥相關基因katG基因和inhA基因啟動子各1個位點,分別為katG基因315位野生型及AGC→ACC和AGC→AAC兩個突變型,inhA基因啟動子-15位野生型及C→T突變型。
1.1.4 培養基 改良羅氏培養基、INH含藥改良羅氏培養基為珠海市銀科醫學工程有限公司產品[注冊號為粵食藥監械(準)字2012第2400717號]。用于比例法檢測的INH含藥培養基藥物終濃度為0.2 μg/mL。
1.1.5 主要儀器 ABI 7300熒光定量PCR儀(美國ABI公司)、K30干式恒溫器(上海之信儀器有限公司)、TG16臺式高速離心機(長沙邁佳森儀器設備有限公司)、XW-80A型旋渦混合器(海門市其林貝爾儀器制造有限公司)、TC06/G/H(b)基因擴增儀(杭州博日科技有限公司)、生化培養箱(上海新苗醫療器械制造有限公司)以及ExtractorTM36核酸快速提取儀、BioMixerTMII芯片雜交儀、SlideWasherTM8芯片洗干儀、LuxScanTM10K-B微陣列芯片掃描儀(以上均為博奧生物有限公司)等。
1.2 方法
1.2.1 DNA提取和PCR-熒光定量法檢測MTB核酸 將17 452例標本嚴格按試劑說明書及標準操作規程(SOP)進行PCR熒光定量分析,以擴增呈S型曲線且CT值<36判斷為陽性,以試劑盒自帶的陰陽性對照作為質控。MTB核酸陽性標本提取的DNA置-20 ℃保存備用。
1.2.2 MTB INH耐藥基因芯片法檢測 篩選MTB核酸陽性標本(MTB核酸濃度較低,CT值>32者除外)按試劑說明書及SOP進行PCR擴增、芯片雜交、洗滌、甩干和結果掃描判讀。以試劑盒自帶的陰陽性對照作為質控。
1.2.3 MTB培養和比例法藥物敏感性試驗 上述標本中6 142例同期送檢做MTB羅氏培養,對分離到的MTB菌株參照《結核病診斷實驗室檢驗規程》[5]進行比例法藥物敏感性試驗,以MTB標準株H37Rv(ATCC27294)為質控菌株。
2 結 果
2.1 PCR-熒光定量檢測結果 17 452例MTB核酸檢測中,3 966例MTB核酸陽性,陽性率為22.73%(3 966/17 452)。
2.2 基因芯片法檢測結果 3 966例MTB核酸陽性標本中,剔除825例MTB核酸濃度較低、CT值>32者,有3 141例為合格標本,占全部陽性數的79.20%(3 141/3 966),除去同一病人重復檢測次數后實為2 738例用于基因芯片檢測。其中,INH耐藥465例,耐藥率16.98%。突變類型包括:katG315(AGC→ACC)單一突變358例,katG315(AGC→AAC)26例,inhA-15(C→T)單一突變69例,katG315(AGC→ACC)聯合inhA-15(C→T)5例,katG基因缺失6例,katG基因缺失聯合inhA-15(C→T)1例。465例耐INH MTBkatG和inhA基因突變譜及突變率,見表1。
表1 465例耐INH MTBkatG和inhA基因突變譜及突變率
Tab.1 Gene mutation spectrum and mutation rate ofkatGandinhAresistance to INH from 465 examples
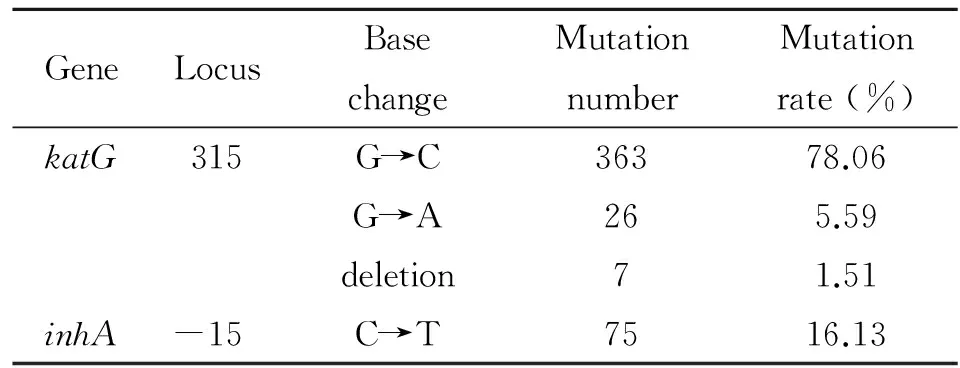
GeneLocusBasechangeMutationnumberMutationrate(%)katG315G→C36378.06G→A265.59deletion71.51inhA-15C→T7516.13
2.3 比例法檢測結果 與基因芯片檢測者為同一病人的同類型送檢標本經羅氏培養后有1 493例MTB陽性,經比例法檢測,INH耐藥255例,敏感1 238例,耐藥率為17.08%。
2.4 基因芯片和比例法檢測INH耐藥性結果的比較 以比例法結果為判斷標準,255株耐藥菌株中有218株經基因芯片法測定為INH耐藥,37株檢測為敏感;1 238株敏感菌株中1 207株經基因芯片法檢測為敏感,31株檢測為耐藥菌株(見表2)。基因芯片法的敏感性、特異性、陽性預測值(PPV)、陰性預測值(NPV)及準確性分別為85.49%(218/255)、97.50%[1 207/(31+1 207)]、87.55%[218/(218+31)]、97.03%[1 207/(37+1 207)]和95.45%[(218+1 207)/1 493]。
3 討 論
結核病是由MTB感染所引發的一種慢性傳染性疾病,目前全世界有1/3的人口存在潛在MTB感染,僅2007年就有927萬新發病例[6]。耐多藥結核病(MDR-TB)和廣泛耐藥結核病(XDR-TB)的出現,掀起了結核病的第3次世界流行高峰(僅2007年全球MDR病例估計數就有50萬之多)[6],同時也嚴重阻礙了我國結核病防治工作的進程。INH的耐藥性檢測是MDR-TB和XDR-TB篩查的主要依據之一。目前分子藥敏檢測技術日益已成為MDR-TB和XDR-TB篩查的研究熱點。
表2 基因芯片和比例法檢測INH耐藥性結果比較
Tab.2 Comparison of the results of gene chip and ratio to detect the resistance to INH

GenechipRatiodrugsensitivetestResistanceSensitivityResistance21831Sensitivity371207
基因芯片技術是20世紀90年代發展起來的分子生物學技術。基因芯片技術是針對不同的基因突變,設計出不同的寡核苷酸探針,并固定在固相載體上,即基因芯片,同時采用PCR技術對含突變的基因片段進行擴增,將擴增片段與基因芯片進行雜交。只需少量樣品一次雜交,即可獲得該菌株對多種抗結核藥物的耐藥性結果。
研究表明,導致MTB對INH耐藥的主要分子機制與katG、inhA、kasA、ndh、ahpC5種基因突變[7]或缺失有關,其中過氧化氫酶-過氧化物酶的編碼基因katG和參與分枝菌酸生物合成的烯酰基還原酶編碼基因inhA發生突變可以解釋約80%以上的耐INH分離株[8],kasA、ndh和ahpC3種基因突變僅占耐藥機制中的不足20%。在本研究中,katG315(AGC→ACC)是最主要的突變類型,inhA-15(C→T)次之,突變率分別為78.06%(363/465)和16.13%(75/465)。本研究與樂軍等的測序報道[9]基本相近。Bang等[10]對l 825例結核病患者的研究,katG315(AGC→ACC)和inhA基因啟動子-15位(C→T)突變型分別占到INH高水平耐藥和低水平耐藥的84%。可以認為katG315(AGC→ACC)和inhA-15(C→T)是本地區INH耐藥最主要的突變類型。但也有不同的報道,西班牙katG315密碼子突變頻率為34.6%[11],而俄羅斯的這種突變頻率高達93.6%[12];對于inhA基因突變,吳雪瓊[13]等人的實驗結果為20%,朱中元[14]等人的研究結果則為65%。由此可見耐藥基因突變具有明顯的地區差異,因此,每個國家和地區的突變類型和頻率資料通常不能應用于其他地區。
在本研究中,還發現katG315(AGC→ACC)聯合inhA-15(C→T)的突變類型,以及katG基因缺失和katG基因缺失聯合inhA-15(C→T)的突變類型。聯合突變報道較為常見,但katG基因缺失以及與inhA-15(C→T)聯合突變報道則并不多見,國內吳雪瓊[13]、陳楊[15]等也曾有katG基因缺失的發現,認為此基因缺失也是導致MTB對INH產生耐藥的分子機制之一。
為了進一步驗證基因芯片檢測INH對MTB耐藥性結果的敏感性和特異性,我們用與基因芯片檢測相同病人的同期送檢同類型標本的培養陽性菌株做比例法藥物敏感性試驗,比較兩種方法的符合性,結果如表2所示,二者具有較高的符合率,這與我們前期的研究結果[16]基本一致。
INH耐藥機制復雜多樣,涉及多個基因的多個突變位點,并不時發現有新的耐藥基因與突變位點,基因芯片因受其載量的限制,不能包羅INH耐藥的所有基因突變類型,這是基因芯片技術的不足,但通過大樣本檢測了解本地區INH相關耐藥基因的主要突變特征,選用適合本地區的基因芯片,對INH耐藥性的快速檢測仍具有重要意義。
綜上所述,本地區INH耐藥以katG315(AGC→ACC)和inhA-15(C→T)突變類型為主,基因芯片對MTB INH耐藥性檢測與比例法比較,具有較高的敏感性、特異性和準確性,可用于本地區MTB INH耐藥性的快速檢測。
[1]Aziz MA, Wright A, Laszlo A, et al. WHO/international union against tuberculosis and lung disease global project on anti-tuberculosis drug resistance surveillance. Epidemiology of antituberculosis drug resistance(the Global Project on Anti-tuberculosis Drug Resistance Surveillance): an updated analysis[J]. Lancet, 2006, 368(9553): 2142-2154.
[2]Afanas’ev MV, Ikryannikova LN, Il’ina EN, et al. Molecular characteristics of rifampicin- and isoniazid-resistantMycobacteriumtuberculosisisolates from the Russian Federation[J]. J Antimicrob Chemother, 2007, 59(6): 1057-1064.
[3]Minime-lingoupou F, Pierre-audigier C, Kassa-Kelembho E, et al. Rapid identification of multidrug-resistant tuberculosis isolates in treatment failure or relapse patients in Bangui, Central African Republic[J]. Int J Tuberc Lung Dis, 2010, 14(6): 782-785.
[4]Ano H, Matsumoto T, Suetake T, et al. Relationship between the isoniazid-resistant mutationkatGS315T and the prevalence of MDR-/XDR-TB in Osaka, Japan[J]. Int J Tuberc Lung Dis, 2008, 12(11): 1300-1305.
[5]Wang SM, Zhu JH, Zhang LX. Clinical laboratory Procedures for tuberculosis Diagnosis[M]. Beijing: Chinese Education and Culture Publishing House, 2006: 30-51. (in Chinese) 王甦民, 朱建華, 張立興. 結核病診斷實驗室檢驗規程[M]. 北京: 中國教育文化出版社, 2006: 30-51.
[6]World Health Organization (2009): Global tuberculosis control-epidemiology, strategy, financing, WHO Report 2009[R]. WHO/HTM/TB/2009.411.
[7]Doustdar F, Khosravi AD, Farnia P, et al. Molecular analysis of isoniazid resistance in different genotypes ofMycobacteriumtuberculosisisolates from Iran[J]. Microb Drug Resist, 2008, 14(4): 273-279. DOI: 10.1089/mdr.2008.0842
[8]Jiao WW, Mokrousov I, Sun GZ, et al. Molecular characteristics of rifampin and isoniazid resistantMycobacteriumtuberculosisstrains from Beijing, China[J]. Chin Med J, 2007, 120(9): 814-819.
[9]Yue J, Zhang M, Zhang HM, et a1. Molecular characterization of mutations associated with isoniazid resistance inMycobacteriumtuberculosisisolates[J]. Chin J Microbiol Immunol, 2006, 26(10): 950-955. (in Chinese) 樂軍, 張旻, 張紅梅, 等. 結核分枝桿菌臨床分離株異煙肼耐藥相關基因突變的分子特征[J]. 中華微生物學和免疫學雜志, 2006, 26(10): 950-955.
[10]Bang D, Andersen PH, Andersen AB, et al. Isoniazid-resistant tuberculosis in Denmark: mutations, transmission and treatment outcome[J]. J Infect, 2010, 60(6): 452-457. DOI: 10.1016/j.jinf.2010.03.017
[11]Kim SY, Park YJ, Kim WI, et al. Molecular analysis of isoniazid resistance inMycobacteriumtuberculosisisolates recovered from south Korea[J]. Diagn Microbiol Infect Dis, 2003, 47(3): 497-502.
[12]Mokrousov I, Narvskaya O, Otten T, et al. High prevalence ofkatGSer315Thr substitution among isoniazid-resistantMycobacteriumtuberculosisclinical isolates from northwestern Russia, 1996 to 2001[J]. Antimicrob Agents Chemother, 2002, 46(5): 1417-1424.
[13]Wu XQ, Zhong M, Zhang JX, et al. Analysis ofKatGgene mutations inM.tuberculosisisolates by direct sequencing[J]. J Clin Lab Sci, 2000, 18(1): 9-11. (in Chinese) 吳雪瓊, 鐘敏, 張俊仙, 等. PCR直接測序法分析結核分枝桿菌katG基因突變[J]. 臨床檢驗雜志, 2000, 18(1): 9-11.
[14]Zhu ZY, Shao HS, Chen YF, et al. Sequencing ofinhAin drug-resistantMycobacteriumtuberculosisisolates[J]. Chin J Tuberc Respir Cis, 2001, 24(1): 48-51. (in Chinese) 朱中元, 邵寒霜, 陳允鳳, 等. 結核分枝桿菌inhA基因突變的測序研究[J]. 中華結核和呼吸雜志, 2001, 24(1): 48-51.
[15]Chen Y, Chen L, Zhang H, et al. Study of the relationship between resistant to isoniazid and mutation ofKatGandinhAinMycobacteriumtuberculosisisolates[J]. Chin J Antibiot, 2010, 35(10): 788-792. (in Chinese) 陳楊, 陳玲, 張泓, 等. 耐異煙肼結核分枝桿菌及其katG與inhA基因突變的研究[J]. 中國抗生素雜志, 2010, 35(10): 788-792.
[16]Ou WZ, Luo KW, Wang Y, et al. The comparative study of gene chip and ratio drug sensitive test in detectingMycobacteriumtuberculosisresistance to rifampin and isoniazid[J]. Lab Med, 2013, 28(5): 404-407. (in Chinese) 歐維正, 駱科文, 王燕, 等. 基因芯片和比例法藥物敏感性試驗檢測結核分枝桿菌對利福平和異煙肼耐藥性的比較研究[J]. 檢驗醫學, 2013, 28(5): 404-407.
Determination of resistance genesKatGandinhAinMycobacteriumtuberculosisisolates from Guizhou Province by gene chip
OU Wei-zheng1,CHEN Zheng-hong2,CHEN Jing1,LUO Ke-wen1,WANG Yan1,QIN Wan1,MENG Jun1
(1.GuiyangPublicHealthTreatmentCenter,Guiyang550003,China;2.DepartmentofPathogenicBiology,GuiyangMedicalUniversity,Guiyang550025,China)
We aimed to investigate the characteristics ofKatGandinhAgene mutations ofMycobacteriumtuberculosis(MTB) associated with INH in Guizhou Province, and to evaluate the clinical application value of gene chip in MTB resistance detection. Resistance to INH of 2 738 clinical samples were detected by gene chip method. These samples were determined as MTB positive by PCR-fluorescent probe method. Characteristics of mutations of INH resistance geneKatGandinhAwere then analysed. Meanwhile, MTB were isolated from these samples by Lowenstein-Jensen method and INH resistance were detected by ratio method. Susceptibility results determined by these two methods were compared. Of 465 samples in 2 738 MTB nucleic acid positive samples were resistant to INH determined by gene chip method, and the rate was 16.98%. Gene mutations were mainly found inkatG315(AGC→ACC)and the mutation frequency was 78.06%. TheinhA-15 (C→T) mutation was in the second place and thekatG315 (AGC→AAC) was in the third place, and the mutation frequency was 16.13% and 5.59%, respectively. A total of 1 493 MTB strains were isolated from the same samples of the above patients. Being determined by conventional ratio method, 255 MTB strains were detected as resistant to INH, with the rate of 17.08%. INH resistance was judged according to the conventional method, and the sensitivity, specificity, positive predictive value (PPV), negative predictive value (NPV), and accuracy of the gene chip method was 85.49%, 97.50%, 87.55%, 97.03% and 95.45%, respectively. In conclusion, gene mutations related with MTB resistance to INH were mainly happened at theKatG315 (AGC→ACC) and theinhA-15 (C→T) in Guizhou Province. Gene chip is a rapid test method with high sensitivity, specificity and accuracy, which could be used in the fast detection of the MTB drug resistance to INH.
gene chip; isoniazid; gene mutation; ratio drug sensitive test;Mycobacteriumtuberculosis
Chen Jing, Email:chenjingfk@sina.cn
陳靜,Email:chenjingfk@sina.cn
1.貴陽市公共衛生救治中心,貴陽 550003; 2.貴陽醫學院微生物學教研室,貴陽 550025
10.3969/cjz.j.issn.1002-2694.2015.07.013
R378.91
A
1002-2694(2015)07-0655-04
2014-12-08;
2015-05-19
貴州省社會發展攻關項目(黔科合SY字[2013]3060號);貴陽市社會發展與民生科技項目(筑科合同[2013103]14號)

Supported by the Brainstorm Project on Social Development in Guizhou Province (Guizhou Science Contract No.[2013]3060) & the Project on Social Development and Science and Technology for People’s Livelihood in Guiyang City (Guiyang Science Contract No.[2013103]14).

