人帶3蛋白對(duì)紅細(xì)胞攜氧過(guò)程調(diào)控的研究進(jìn)展
人帶3蛋白對(duì)紅細(xì)胞攜氧過(guò)程調(diào)控的研究進(jìn)展
作者單位:400038 重慶,第三軍醫(yī)大學(xué)高原軍事醫(yī)學(xué)系高原生理學(xué)與高原生物學(xué)教研室
官立彬,楊誠(chéng)忠,李曉栩,黃瑊
[關(guān)鍵詞]帶3蛋白;血紅蛋白;氣體運(yùn)輸
帶3蛋白(band 3 protein,Band3)是一種紅細(xì)胞膜蛋白,因其在聚丙烯酰胺凝膠電泳時(shí)分布于第3條帶而得名。Band3在紅細(xì)胞膜中含量約為膜蛋白的25%,其屬于糖蛋白的一種,在質(zhì)膜中穿越12~14次,是多次跨膜蛋白。它是由兩個(gè)相同的亞基組成的二聚體,每條亞基含有929個(gè)氨基酸,分子量約 95~100 kDa,由53 kDa的疏水性跨膜段及43 kDa的親水性胞質(zhì)段組成[1]。疏水性跨膜域的生理功能是介導(dǎo)Cl-/HCO3-交換,因此Band3又稱(chēng)為“陰離子交換蛋白(anion exchanger protein, AEP)”。Band3胞漿段有膜骨架蛋白、糖酵解3個(gè)關(guān)鍵酶酶(醛縮酶、磷酸果糖激酶、磷酸甘油醛脫氫酶)、血紅蛋白(hemoglobin,Hb)及其降解物的結(jié)合位點(diǎn)以及磷酸化位點(diǎn),因而 Band3不僅是膜骨架的主要附著點(diǎn),而且參與多種物質(zhì)和信息的跨膜傳遞和功能調(diào)節(jié)[2]。
Hb是紅細(xì)胞運(yùn)氧的載體,占紅細(xì)胞干重的97%、總重的35%。平均每克Hb可結(jié)合1.34 ml的氧,是血漿溶氧量的70倍左右。健康成人Hb主要是血紅蛋白A(HbA),約占總量的98%。其分子量約67 kDa,由4個(gè)亞基(α2β2)組成,且α和β亞基彼此相向形成一個(gè)空腔。在脫氧后(如靜脈血)Hb亞基處于鉗制狀態(tài)(T-狀態(tài)),使氧不能與血紅素結(jié)合,這時(shí)稱(chēng)為脫氧血紅蛋白(deoxy-Hb);在氧合后(如肺部),亞基結(jié)合氧氣后呈松弛狀態(tài)(R-狀態(tài)),稱(chēng)為氧合血紅蛋白(oxy-Hb)。Hb在R-狀態(tài)和T-狀態(tài)互變過(guò)程中,4個(gè)亞基間出現(xiàn)協(xié)同作用,產(chǎn)生了S形的氧平衡曲線(xiàn)(oxygen equilibrium curve,OEC),其形狀由血紅蛋白的氧親和力(P50表示)和亞基間的協(xié)同效應(yīng)(希爾系數(shù),n表示)共同決定。而協(xié)同效應(yīng)存在于氧離氧合互換之間,在S曲線(xiàn)的陡部最高,范圍從1(不協(xié)同)到3(最大),不存在于R-狀態(tài)和T-狀態(tài)(曲線(xiàn)的兩端)[3]。OEC形狀從直線(xiàn)變?yōu)槎盖偷腟形曲線(xiàn),這也是紅細(xì)胞能快速釋放結(jié)合氧氣的基礎(chǔ)。
Band3與Hb如何連接,如何相互作用影響紅細(xì)胞氧氣的運(yùn)輸,一直是很多學(xué)者關(guān)注的問(wèn)題。本文將圍繞這個(gè)方面討論。
1Band3通過(guò)Cl-/HCO3-交換調(diào)控紅細(xì)胞O2的結(jié)合和釋放與CO2的運(yùn)輸

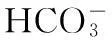

圖1 帶3蛋白反向轉(zhuǎn)運(yùn)Cl-/HCO3-示意圖
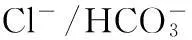
2Band3與deoxy-Hb連接調(diào)控紅細(xì)胞O2的結(jié)合和釋放
Walder[6]研究發(fā)現(xiàn),Band3胞質(zhì)段N端11個(gè)氨基酸主要和deoxy-Hb結(jié)合,結(jié)合點(diǎn)位于脫氧Hb兩條β鏈構(gòu)成的“小穴”中,按1∶1結(jié)合。這種結(jié)合僅發(fā)生于deoxy-Hb與Band3之間,將Hb氧合,不與Band3結(jié)合[7]。Band3與2,3-二磷酸甘油酸(diphosphoglyceric acid,2,3-DPG)結(jié)合Hb的方式相似,具有競(jìng)爭(zhēng)性,且受到pH的影響。酸性環(huán)境時(shí)血紅蛋白與Band3緊密結(jié)合, pH值在6~7時(shí),二者開(kāi)始分開(kāi)[8]。有研究發(fā)現(xiàn)[3],Band3胞質(zhì)段N端11個(gè)氨基酸、2,3-DPG、Cl-與deoxy-Hb結(jié)合后P50、Hill系數(shù)出現(xiàn)一致的變化規(guī)律,即低比例與結(jié)合deoxy-Hb時(shí),T-狀態(tài)Hb出現(xiàn)兩種群體(一部分結(jié)合效應(yīng)因子,一部分未結(jié)合),相互作用后,可降低Hb亞基間的協(xié)同效應(yīng),且在0.5∶1結(jié)合時(shí)降低最明顯,Hb協(xié)同效應(yīng)n值降為1.5;當(dāng)1∶1與deoxy-Hb結(jié)合時(shí),T-狀態(tài)血紅蛋白只有一種狀態(tài)(全部結(jié)合效應(yīng)因子),協(xié)同效應(yīng)n值恢復(fù)到正常(2.7左右);且Hb的氧親和力隨著上述因子濃度的增加而降低,降低幅度2,3-DPG大于Band3胞質(zhì)段N端11個(gè)氨基酸。
Band3與deoxy-Hb這種結(jié)合特性在紅細(xì)胞釋放結(jié)合O2的過(guò)程中發(fā)揮著重要作用。當(dāng)紅細(xì)胞由肺毛細(xì)血管到達(dá)氧分壓低的外周組織毛細(xì)血管后,由于氧分壓壓力差的驅(qū)動(dòng)和CO2彌散進(jìn)入紅細(xì)胞經(jīng)Band3離子交換的作用,將使一部分oxy-Hb釋放O2變?yōu)閐eoxy-Hb。Band3胞質(zhì)段N端11個(gè)氨基酸可與deoxy-Hb結(jié)合,由于是低比例結(jié)合,這時(shí)近膜側(cè)的Hb協(xié)同效應(yīng)降低。而紅胞質(zhì)內(nèi)的Hb可自由結(jié)合2,3-DPG、Cl-,協(xié)同效應(yīng)不受影響,且胞質(zhì)內(nèi)Hb的氧親和力(P50)較近膜側(cè)的Hb低。因此,可促使紅細(xì)胞胞內(nèi)氧合血紅蛋白率先解離釋放氧氣,形成胞內(nèi)向胞膜側(cè)氧分壓逐降趨勢(shì),產(chǎn)生O2向胞外定向彌散的驅(qū)動(dòng)力,也形成了逆血氧飽和度的供氧機(jī)制。
當(dāng)紅細(xì)胞由外周到達(dá)肺時(shí),由于deoxy-Hb與Band3胞質(zhì)段N端11個(gè)氨基酸結(jié)合后Hb氧親和力高于與2,3-DPG或Cl-結(jié)合,因此與Band3胞質(zhì)段N端11個(gè)氨基酸結(jié)合的deoxy-Hb在到達(dá)肺泡時(shí)優(yōu)先與氧氣結(jié)合,這有利于低氧時(shí)紅細(xì)胞的氧合[8]。
3Band3通過(guò)調(diào)控胞內(nèi)能量代謝保護(hù)紅細(xì)胞運(yùn)氧特性
磷酸戊糖途徑(pentose phosphate pathway,PPP)可產(chǎn)生NADPH,而NADPH可促使紅細(xì)胞內(nèi)氧化形成的高鐵血紅蛋白還原回具有運(yùn)氧功能的亞鐵血紅蛋白。糖酵解途徑(glycolytic pathway,GP)是紅細(xì)胞內(nèi)ATP的生成途徑,其途徑中3個(gè)關(guān)鍵酶能與Band3胞質(zhì)段可逆結(jié)合。紅細(xì)胞處于高氧合狀態(tài)時(shí),3個(gè)關(guān)鍵酶與Band3胞質(zhì)段結(jié)合失去活性,而PPP的酶游離于胞質(zhì)中生成NADPH,還原氧化的Hb[2,9]。紅細(xì)胞處于脫氧狀態(tài)時(shí),由于deoxy-Hb與3個(gè)關(guān)鍵酶結(jié)合位置重疊,deoxy-Hb可與3個(gè)關(guān)鍵酶競(jìng)爭(zhēng)性結(jié)合Band3。因而導(dǎo)致3個(gè)關(guān)鍵酶脫下到胞漿[10-11]。因GP與PPP競(jìng)爭(zhēng)共同底物葡萄糖,反應(yīng)向GP進(jìn)行,增加生成ATP。有研究發(fā)現(xiàn)[12-13],紅細(xì)胞在外周毛細(xì)血管由于升高的溫度、降低pH值、高碳酸血癥、高剪切應(yīng)力和增強(qiáng)的機(jī)械變形等增加,可經(jīng)pannexin-1向血漿“拋出”ATP,促進(jìn)內(nèi)皮細(xì)胞產(chǎn)生NO,促使毛細(xì)血管擴(kuò)張,便于其快速通過(guò)外周毛細(xì)血管[14]。氧分壓與pH值的改變可促使deoxy-Hb與Band3的解離,同時(shí)可使3個(gè)關(guān)鍵酶與Band3重新結(jié)合失去活性,胞內(nèi)糖代謝途轉(zhuǎn)化為磷酸戊糖途徑,發(fā)揮抗氧化作用。Band3間接地控制紅細(xì)胞內(nèi)的能量代謝,在一定程度上維護(hù)了糖酵解酶的活性,維持了Hb的攜氧特性。
4Band3通過(guò)調(diào)控紅細(xì)胞的變形性增強(qiáng)紅細(xì)胞在毛細(xì)血管的穿梭
紅細(xì)胞平均直徑為7.5 μm,毛細(xì)血管管徑平均為6~9 μm,紅細(xì)胞通過(guò)毛細(xì)血管除擴(kuò)張毛細(xì)血管外,還有另外一條途徑,增強(qiáng)自身的變形性。
紅細(xì)胞膜骨架蛋白(血影蛋白、肌動(dòng)蛋白)之間的橋梁錨蛋白與Band3的胞質(zhì)域相結(jié)合,保持了紅細(xì)胞雙凹圓盤(pán)狀。由于Band3與錨蛋白接觸的殘基同Band3與deoxy-Hb結(jié)合位點(diǎn)相毗鄰,當(dāng)Band3與deoxy-Hb結(jié)合后,直接影響B(tài)and3與錨蛋白之間的連接,使錨蛋白與Band3解離呈游離狀態(tài),增加紅細(xì)胞膜的變形性[15],這種改變有利于紅細(xì)胞在脫氧狀態(tài)時(shí)快速通過(guò)外周毛細(xì)血管。
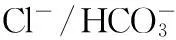
【參考文獻(xiàn)】
[1]Reithmeier AF.The erythrocyte anion transporter (band 3)[J].Curr Opin Struct Biol, 1993, 3: 515-523.
[2]Lewis IA, Campanella ME,Markley JL,et al.Role of band 3 in regulating metabolic flux of red blood cells[J]. Proc Natl Acad Sci USA, 2009, 106(44): 18515-18520.
[3]Zhang Y, Manning LR, Falcone J,et al.Human erythrocyte membrane band 3 protein influences hemoglobin cooperativity. Possible effect on oxygen transport[J]. J Biol Chem, 2003, 278(41): 39565-39571.
[4]Dash RK.Erratum to: blood HbO2and HbCO2dissociation curves at varied O2, CO2, pH, 2,3-DPG and temperature levels[J]. Ann Biomed Eng, 2010,38(4): 1683-1701.
[5]陳靜, 趙守城.帶3蛋白反向轉(zhuǎn)運(yùn)Cl-/HCO3-的意義[J]. 生物學(xué)通報(bào), 2001, 36(10): 14-15.
[6]Walder JA. The interaction of hemoglobin with the cytoplasmic domain of band 3 of the human erythrocyte membrane[J]. J Biol Chem, 1984, 259(16): 10238-10246.
[7]Salhany JM.Cassoly R.Kinetics of P-mereufibefizoate binding to sulfhydrylgroups on the isolated cytoplasmic fragment of band 3 protein,Effect of hemoglobin binding on the conformation[J]. J Biol Chem, 1989, 264: 1399-1404.
[8]Salhany JM,Cordes KA,Sloan RL.Characterization of the pH dependence of hemoglobin binding to band 3. Evidence for a pH-dependent conformational change within the hemoglobin-band 3 complex[J]. Biochim Biophys Acta, 1998, 1371(1): 107-113.
[9]Messana I,Orlando M, Cassiano L,et al. Human erythrocyte metabolism is modulated by the O2-linked transition of hemoglobin[J]. FEBS Lett, 1996, 390(1): 25-28.
[10]De Rosa MC ,Carelli Alinovi C,Galtieri A, et al.Allosteric properties of hemoglobin and the plasma membrane of the erythrocyte: new insights in gas transport and metabolic modulation[J]. IUBMB Life, 2008, 60(2): 87-93.
[11]Campanella ME,Chu H,Wandersee NJ, et al .Characterization of glycolytic enzyme interactions with murine erythrocyte membranes in wild-type and membrane protein knockout mice[J]. Blood, 2008, 112(9):3900-3906.
[12]Gonzalez-Alonso J.ATP as a mediator of erythrocyte-dependent regulation of skeletal muscle blood flow and oxygen delivery in humans[J]. J Physiol, 2012, 590(20): 5001-5013.
[13]Wan J, Forsyth AM, Stone HA.Red blood cell dynamics: from cell deformation to ATP release[J]. Integr Biol (Camb), 2011, 3(10): 972-981.
[14] Sprague RS, Ellsworth ML. Erythrocyte-derived ATP and perfusion distribution: role of intracellular and intercellular communication[J]. Microcirculation, 2012, 19(5): 430-439.
[15]Stefanovic M, Puchulu-Campanella E, Kodippili G, et al.Oxygen regulates the band 3-ankyrin bridge in the human erythrocyte membrane[J]. Biochem J, 2013, 449(1): 143-150.
(收稿日期:2015-01-22)
文章編號(hào)1004-0188(2015)04-0449-03
doi:10.3969/j.issn.1004-0188.2015.04.044
中圖分類(lèi)號(hào)R 331.141
文獻(xiàn)標(biāo)識(shí)碼A
通訊作者:黃瑊,電話(huà):023-68772383;E-mail: hj3red@gmail.com
基金項(xiàng)目:國(guó)家973計(jì)劃項(xiàng)目(2012CB518201);國(guó)家自然科學(xué)基金(81370150,30973446)
- 西南國(guó)防醫(yī)藥的其它文章
- 索拉非尼聯(lián)合經(jīng)動(dòng)脈化療栓塞治療原發(fā)性大肝癌的療效
- 高b值擴(kuò)散加權(quán)成像在顱內(nèi)腦膜瘤診斷中的價(jià)值
- 拜阿司匹林聯(lián)合氯吡格雷及地爾硫卓治療CAE療效觀(guān)察
- 降纖酶聯(lián)合抗凝治療51例頻發(fā)短暫性腦缺血發(fā)作的療效分析
- 圣手鎮(zhèn)痛活絡(luò)酊治療膝關(guān)節(jié)骨性關(guān)節(jié)炎療效觀(guān)察
- 腹腔鏡結(jié)腸系膜切除術(shù)后機(jī)體應(yīng)激反應(yīng)及能量代謝觀(guān)察

