血清Ghrelin水平與糖尿病腎病腹部肥胖患者的相關性
杜雪霞,吳明清,李曉春,李承歡,溫秀芳,陳韶艷
?
血清Ghrelin水平與糖尿病腎病腹部肥胖患者的相關性
杜雪霞,吳明清,李曉春,李承歡,溫秀芳,陳韶艷
目的 探討血清Ghrelin在糖尿病腎病(DN)腹部肥胖患者發生發展中的作用。方法 選擇收治的57例腹部肥胖DN患者為A組,60例非肥胖的DN患者為B組,及同期健康肥胖者60例為C組。對所有入選者測量計算體質量指數(BMI),檢測血糖、血脂、腎功能,應用酶聯免疫法檢測Ghrelin。結果A組BMI、腰圍、空腹血糖(FPG)、糖化血紅蛋白(HbA1c)、尿白蛋白排滿泄率(UAER)、Ghrelin高于B、C組,且A組尿素氮(BUN)、血肌酐(SCr)高于C組(P<0.05,P<0.01),3組總膽固醇(TC)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)比較差異無統計學意義(P>0.05)。相關性分析表明,A組Ghrelin與BMI、腰圍、FPG、HbA1c呈負相關(r=-0.412、r=-0.401、r=-0.331、r=-0.391,P<0.05),與TC、BUN、UAER呈正相關(r=0.411、r=0.374、r=0.561,P<0.05),與HDL-C、LDL-C、SCr未表現相關性(P>0.05)。B組Ghrelin與BMI、FPG、HbA1c呈負相關(r=-0.312、r=-0.401、r=-0.410,P<0.05),與TC、BUN、UAER呈正相關(r=0.384、r=0.402、r=0.556,P<0.05),與腰圍、HDL-C、LDL-C、SCr未表現相關性(r=0.264,r=0.187,r=0.201,r=0.116,P>0.05)。結論 血清Ghrelin在腹部肥胖的DN患者發生、發展中起著重要作用,或可成為預后的重要指標。
血清Ghrelin;糖尿病,2型;腹部肥胖
【DOI】 10.3969 /j.issn.1671-6450.2015.03.012
內源性生長激素促泌受體(growth hormone secreta-gogue receptor, GHS-R)的天然配體——Ghrelin,是20世紀90年代日本科學家Kojima等在人的胃組織中發現的一種由28個氨基酸組成的小分子腦腸肽,它能夠激活G蛋白偶聯受體GHS-R并刺激GH的分泌,是具有生物活性的內源性配體。Ghrelin第三位的絲氨酸辛酰化是主要的活性形式,它與受體結合可表現出與胃動素類似的促進胃排空作用,因此Ghrelin又稱胃動素相關肽[1]。Ghrelin廣泛分布于胰腺、胃腸道、下丘腦等組織中,由胃泌酸腺腺體中的X/A樣內分泌細胞分泌[2]。Ghrelin與能量代謝、調節密切相關,有報道指出血漿Ghrelin濃度在餐前是餐后的近2倍,是能量代謝紊亂的分子生物學靶點之一[3]。
糖尿病腎病(DN)是糖尿病(DM)重要的慢性微血管并發癥之一,是一種由于糖代謝異常引發的腎臟高灌注、高濾過、腎小球基底膜增厚和系膜細胞增生形成彌漫性或結節性硬化,主要表現為血尿、蛋白尿、水腫等腎功能不全。在美歐地區DN是引起終末期腎病的最常見病因,占末期透析患者的40%[4]。因此,積極防治DN是糖尿病領域研究的熱點之一。有研究顯示,Ghrelin受體基因在嚙齒類動物的腎小球內有表達,且Ghrelin在腎臟內會進行旁(內)分泌,或可認為腎臟是Ghrelin的直接作用靶點[5]。Yoshimoto等[6]的實驗表明,Ghrelin會從腎小管產生、分泌并經腎小球濾過,說明慢性腎臟疾病的發生、發展與Ghrelin關系密切。現觀察DN腹部肥胖者與Ghrelin的關系,旨在為DN的防治提供參考。
1 資料與方法
1.1 臨床資料 2011年3月—2014年7月我院內分泌科住院DN伴腹部肥胖患者57例為A組,男30例,女27例,年齡38~72(56.21±3.10)歲,DN病程1~10(7.14±0.26)年,高血壓者14例,視網膜病變者5例,糖尿病足3例;隨機抽取同期DN患者非肥胖者60例為B組,男32例,女28例,年齡36~69(55.17±2.17)歲,DN病程1~12(7.84±0.13)年,高血壓者16例,視網膜病變者4例,糖尿病足2例,余無并發癥;同期選擇本院健康體檢中糖耐量正常且肥胖者60例為C組,男29例,女31例,年齡37~70(57.03±2.47)歲。3組性別、年齡等一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.2 納入與排除標準
1.2.1 診斷標準: 根據2010年美國糖尿病學會的診斷標準[7]診斷2型DM,具有糖尿病典型癥狀(多飲、多食、多尿)伴以下1種指標者,即空腹血糖(fastingplasmaglucose,FPG)≥7.0mmol/L、糖化血紅蛋白(glycosylatedlatedhemoglobinA1c,HbAlc)≥6.5%、餐后2h血糖(twohourspostprandialglucose,2hPG)≥11.1mmol/L。根據24h尿蛋白排泄率(urinaryalbuminexcretionrates,UAER)>200μg/min診斷為DN。
1.2.2 排除標準: 急性腎炎、1個月內發生糖尿病酮癥酸中毒及其他糖尿病急性并發癥、泌尿系統感染者;心力衰竭、惡性腫瘤、風濕免疫、胰腺炎等疾病患者;肝、甲狀腺、腦功能異常者;近期有手術、創傷者;近期應用腎毒性藥物、血管緊張素轉換酶抑制劑、他汀類調脂藥者。
1.3 檢測指標及方法
1.3.1 常規檢查: 3組在檢查前1天清淡飲食,晚餐后禁食8~10h,避免應激及劇烈活動。測量身高、體質量,計算體質量指數(BMI),BMI=體質量(kg)/身高(m)2;于清晨取肘靜脈血5ml,不抗凝,將標本置于37℃恒溫箱中30min,3 000r/min離心5min分離血清、分裝儲存于-70℃冰箱中待測,應用全自動生化分析儀(7600型,羅氏公司)測定FPG、HbAlc、總膽固醇(TC)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、血肌酐(serumcreatinine,SCr)、尿素氮(bloodureanitrogen,BUN);連續留取24h尿3次,檢測尿微量白蛋白濃度,根據平均值計算UAER;
1.3.2Ghrelin檢測: 按照Ghrelin酶聯免疫試劑盒(MARKETNIC,美國) 說明書進行操作。首先取出酶標板按序加入100μl標準品或待測品,充分混勻置于37℃,放置120min;洗板;將100μl第一抗體工作液加入反應板每個孔中,混勻37℃放置6min,洗板;將100μl酶標抗體工作液加入反應板每孔中,混勻37℃放置30min,洗板;將100μl底物工作液加入反應板,置于37℃暗處反應15min;每孔加入100μl終止液停止反應。應用全自動酶標儀(Model680型,日本伯樂公司)于450nm處在30min內讀取各孔OD值。
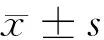
2 結 果
2.1 一般檢查BMI比較:A組高于C組(q=2.19,P<0.01),B組低于C組(q=6.30,P<0.01),A組高于B組(q=7.30,P<0.01);腰圍比較:A組高于C組(q=9.38,P<0.01),B組低于C組(q=5.92,P<0.01),A組高于B組(q=4.18,P<0.01);FPG比較:A組高于C組(q=8.35,P<0.01),B組高于C組(q=9.97,P<0.01),A組高于B組(q=9.69,P<0.01);HbAlc比較:A組高于C組(q=7.39,P<0.01),B組高于C組(q=7.64,P<0.01),A組高于B組(q=8.61,P<0.01);TC、HDL-C、LDL-C組間比較未見統計學差異(q=10.23,均P>0.05)。見表1。
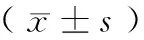
表1 3組體質指標及血糖、血脂水平比較
注:與A組比較,aP<0.01;與B組比較,bP<0.01
2.2 腎功能及Ghrelin情況BUN比較:A組高于C組(q=6.20,P<0.01),B組高于C組(q=8.07,P<0.01),A組低于B組(q=6.05,P>0.05);SCr比較:A組高于C組(q=16.62,P<0.01),B組高于C組(t=13.51,P<0.01),A組低于B組(q=7.63,P>0.05);UAER比較:A組高于C組(q=75.84,P<0.01),B組高于C組(q=36.93,P<0.01),A組高于B組(q=17.32,P<0.01);Ghrelin比較:A組高于C組(q=6.44,P<0.01),B組高于C組(q=8.05,P<0.01),A組低于B組(q=8.93,P<0.05)。見表2。
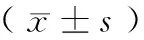
表2 3組腎功能、UAER及Ghrelin水平比較
注:與A組比較,aP<0.05,bP<0.05;與B組比較,cP<0.01
2.3 相關性分析A組進行相關性分析,Ghrelin與BMI、腰圍、FPG、HbAlc呈負相關(r=-0.412、r=-0.401、r=-0.331、r=-0.391,P<0.05);與TC、BUN、UAER呈正相關(r=0.411、r=0.374、r=0.561,P<0.05);與HDL-C、LDL-C、SCr未表現相關性(P>0.05)。B組進行相關性分析,Ghrelin與BMI、FPG、HbAlc呈負相關(r=-0.312、r=-0.401、r=-0.410,P<0.05);與TC、BUN、UAER呈正相關(r=0.384、r=0.402、r=0.556,P<0.05);與腰圍、HDL-C、LDL-C、SCr未表現相關性(r=0.264,r=0.187,r=0.201,r=0.116,P>0.05)。
3 討 論
近年來Ghrelin頻頻被引入到2型DM的相關性研究中。有研究發現胚胎期小鼠Ghrelin的主要來源是胰腺,成年鼠Ghrelin的主要來源是胃,指出Ghrelin可能與胰島細胞的發育密切相關[8~10]。在一項健康志愿者的觀察報道中發現,胰島素處于對低水平時Ghrelin水平無影響,當胰島素處于較高水平時,其升高會伴隨Ghrelin的濃度下降[11]。在本次觀察的對象中,A、B組Ghrelin水平明顯高于C組,說明Ghrelin與2型DM發病關系緊密。
有研究指出,成年肥胖者血漿Ghrelin水平與2型糖尿病的發病率呈負相關,肥胖者血漿Ghrelin水平偏低[12]。本次研究發現A組較其他2組肥胖相關指標最高,提示Ghrelin水平或可從肥胖程度得到反映。林少達等[13]對26例肥胖2型DM患者與32例非肥胖2型DM患者進行胰升血糖素——C-P釋放試驗觀察時發現,空腹血漿Ghrelin水平與BMI和腰圍呈負相關,且腰圍是Ghrelin水平的預測因子,并指出BMI、腰圍、肥胖狀態的差異性會對肥胖糖尿病患者Ghrelin水平產生影響。張森等[14]在觀察39例肥胖型2型DM時的結果表明,Ghrelin水平與BMI呈負相關性(r=-0.240,P=0.042),但與FPG、HbAlc無明顯相關(均P>0.05)。本次研究結果發現,Ghrelin水平與FPG、HbAlc均具有一定相關性。有學者認為Ghrelin升高血糖的途徑有以下幾條:(1)Ghrelin通過肝細胞內存在的Ghrelin受體升高血糖;(2)Ghrelin通過阻滯胰島素來抑制糖異生繼而刺激肝糖原分解;(3)Ghrelin通過影響胰升糖素、生長激素等的分泌產生抵抗胰島素作用;(4)Ghrelin會影響胰島素釋放和敏感性[15]。國外研究顯示,Ghrelin血漿濃度與胰島素分泌量呈負相關,也就是說血漿中Ghrelin的高水平可能導致胰島素分泌抑制[16]。調查顯示,空腹血漿Ghrelin在2型DM患者后代中也表現為低水平,指出Ghrelin水平可作為耐糖量減低和2型DM的危險因子之一[17]。因此,Ghrelin水平在一定程度上或可反映出體內糖代謝紊亂的程度。
本次觀察中,2組肥胖者的TC、LDL-C均高于B組,但未見統計學意義(均P>0.05);在對2型DM患者進行相關性分析時,A組Ghrelin與TC的r值大于B組,證實了Ghrelin與人體脂代謝的關聯性。馬慧等[18]在研究2型DM大鼠血清Ghrelin與肥胖關系時發現,血清Ghrelin與HDL-C呈正相關(r=0.354),多元回歸分析顯示肥胖指數是影響血清Ghrelin水平的獨立因子。同時,我們還觀察到,A組的平均血糖水平是最高,同為DN患者體型肥胖者其糖、脂代謝紊亂程度可能較體型正常者更為顯著,但這有待進一步大樣本觀察。但是較之B組,血清Ghrelin與FPG、HbAlc的相關性在A組中并未表現出更多的優勢,血清Ghrelin在肥胖或非肥胖患者體內糖代謝的關系程度有待進一步觀察。
2組DN患者的腎功能比較未見統計學差異(均P>0.05),而UAER有統計學差異(P<0.05),且Ghrelin與UAER呈正相關性,提示DN患者的血清Ghrelin在一定程度上可反映腎臟損傷程度。李健等[19]在探討2型DM合并慢性腎病患者血漿Ghrelin水平時發現,UARE是血清Ghrelin水平的獨立影響因素,Ghrelin可能是腎功能受損的標志性物質,或可作為預測DN的指標。賈文芳等[20]在探討血清Ghrelin與DN的關系時指出,隨著DN的發展,血清Ghrelin的表達水平亦會升高,可預測DN的加重情況,且血清Ghrelin與TG、BUN、UAER均呈正相關,提示血脂對Ghrelin的影響不可忽視。周燕等[21]在分析90例2型DM患者并發腎病情況時認為,Ghrelin水平受BMI、UAER及脂聯素的影響較大,且Ghrelin的升高可能先于腎功能受損的出現。
DN患者體內是高糖環境,而肥胖者易出現代謝紊亂,因此肥胖的DN患者在本次研究中表現出了較高程度的病變。從本次結果來看,血清Ghrelin在DN發生、發展過程中起著重要作用,與患者糖代謝、脂代謝、腎臟受損程度均有關。Ghrelin是否能作為DN的預測指標,尚有待多中心大樣本觀察。
1LebedYV,OrlovskyM,NikonenkoAG,etal.Earlyreactionofastroglialcellsinrathippocampustostreptozotocin-induceddiabetes[J].NeurosciLett,2008,444(2):181-185.
2 洪兵,王旭.糖尿病胃輕癱患者血漿Ghrelin水平的變化[J].實用醫學雜志,2010,26(17):3170-3172.
3ChaoCS,LoomisZL,LeeJE,etal.GeneticidentificationofanovelNeuroDIfunctionintheearlydifferentiationofisletalpha,PPandepsiloncells[J].DevBiol,2007,312(2):523-532.
4 謝林森.2型糖尿病腎病患者血清脂聯素、BNP和HCY的測定意義[J].中國誤診學雜志,2010,10(15):3618-3619.
5 賈文芳.血清ghrelin、抵抗素、脂聯素水平與2型糖尿病腎病相關性研究[D].桂林:桂林醫學院,2011.
6YoshimotoA,MoriK,SugawaraA,eta1.Plasmaghrelinanddesacylghrelinconcentrationsinrenalfailure[J].JAmSocNephrol,2002,13:2748-2752.
7AmericanDiabetesAssociation.Diagnosisandclassificationofdiabetesmellitus[J].DiabetesCare,2014,37(Suppl1):S81-S90.
8ChaoCS,LoomisZL,LeeJE,etal.Geneticidentificationofanovelneurod1functionintheearlydifferentiationofisletappandεcells[J].DevBiol,2007,3(12):523-532.
9 袁明杰,孔彬,權力,等.Ghrelin對大鼠心肌梗死后血管重構的影響及機制研究[J].中國醫藥導報,2013,10(25):4-6,9.
10 張建生,薛承銳.Ghrelin對大鼠急性胰腺炎的保護作用[J].中國煤炭工業醫學雜志,2008,11(10):1584-1587.
11 徐珞,郭菲菲,孫向榮,等.Ghrelin對糖尿病大鼠下丘腦弓狀核胃牽張敏感神經元放電活動及胃運動的調控[J].中國病理生理雜志,2013,29(1):28-35.
12 張淑蘭,劉靜,郭茜,等.Ghrelin基因Arg51Gln、Leu72Met多態性與甘肅回族2型糖尿病及血脂的關系[J].蘭州大學學報:醫學版,2011,37(1):21-24, 30.
13 林少達,段紅艷,林楚佳,等.2型糖尿病患者外源性給予胰升血糖素對肥胖與血漿Ghrelin的影響[J].中國糖尿病雜志,2011,19(4):243-245.
14 張森,郭毅飛,時立新,等.二甲雙胍和吡格列酮對初診糖代謝異常伴腹型肥胖患者血清ghrelin水平的影響[J].中華糖尿病雜志,2012,4(5):282-285.
15 劉靜,劉佳,馬小琴,等.我國東鄉族Ghrelin基因Leu72Met多態性與2型糖尿病的關系[J].中國糖尿病雜志,2010,18(3):179-181.
16MaderazoEG.Diabeticgastroparesis[J].NEngIJMed,2007,357(4):418-419.
17 鄧震亭,劉芳,柴士偉,等.羅格列酮對2型糖尿病患者血清內脂素和生長激素釋放肽水平的影響[J].天津醫藥,2012,40(1):28-30.
18 馬慧,王文匯,毛艷華,等.糖尿病大鼠血清胃促生長素、內臟脂肪素水平與胰島素敏感性的關系[J].中國老年學雜志,2012,32(7):1443-1445.
19 李健,劉澤煒,王懷國,等.2型糖尿病合并慢性腎臟疾病患者血漿Ghrelin水平的變化及其臨床意義[J].中國糖尿病雜志,2014,22(4):337-339.
20 賈文芳,周燕.血清生長激素釋放肽及抵抗素與2型糖尿病腎病患者的關系[J].廣東醫學,2010,31(22):2917-2919.
21 周燕,賈文芳,于健.糖尿病腎病患者血清胃促生長素和脂聯素水平變化及臨床意義[J].中國全科醫學,2011,14(21):2392-2395.
Changes in the level of Ghrelin in type 2 diabetic patients with nephropathy and abdominal obesity
DUXuexia,WUMingqing,LIXiaochun,LIChenghuan,WENXiufang,CHENShaoyan.
DepartmentofComprehensive,YuebeiPeople'sHospitalAffiliatedtoMedicalCollegeofShantouUniversity,Shantou512026,China
Objective To investigate the role of serum Ghrelin in the occurrence and development of the abdominal obesity in patients with diabetic nephropathy (DN).Methods Fivety-seven cases of abdominal obesity DN patients were enrolled as group A, 60 cases of non-obese DN patients were enrolled as group B, and 60 cases of healthy obese person were enrolled as group C. The calculation of BMI, the detection of blood glucose, blood lipid, renal function, detection of Ghrelin using enzyme linked immunosorbent assay were performed in all subjects.Results Group A’s BMI, waist circumference, FPG, HbA1c, UAER, Ghrelin were higher than group B, C, group A’s BUN, SCr higher than that of group C (P<0.05,P<0.01),nostatisticalsignificanceof3groups’TC,HDL-C,LDL-Cwerefound(P>0.05).Correlationanalysisshowedthat,groupA’sGhrelinwasnegativelyrelatedtoandBMI,waistcircumference,FPG,HbA1c(r=-0.412,r=-0.401,r=-0.331,r=-0.391,P<0.05),positivecorrelationwithTC,BUN,UAER(r=0.411,r=0.374,r=0.561,P<0.05),andnocorrelationwithHDL-C,LDL-C,SCr(P>0.05).GroupB’sGhrelinwasnegativelyrelatedtoBMI,FPG,HbA1c(r=-0.312,r=-0.401,r=-0.410,P<0.05),positivecorrelatedwithTC,BUN,UAER, (r=0.384,r=0.402,r=0.556,P<0.05),andnocorrelationwithwaistcircumference,HDL-C,LDL-C,SCr(r=0.264,r=0.187,r=0.201,r=0.116,P>0.05).Conclusion Serum Ghrelin plays an important role in development of abdominal obesity of DN patients, it may become an important index of prognosis.
Serum Ghrelin;Diabetes,type 2;Abdominal obesity
512026 汕頭大學醫學院附屬粵北人民醫院綜合科
2014-11-17)

