射干麻黃湯對哮喘患者T細胞功能的影響
楊碩 羅光偉 胡小萍 萬軍 夏倩 陳菁 袁文勝 孫潔民
對以往未經規范治療的初診哮喘患者,推薦按需使用短效β2受體激動劑,并選用低劑量吸入糖皮質激素或白三烯調節劑[1]。但部分患者尤其是輕癥患者,往往因經濟收入和顧慮激素副作用,不愿意選用控制藥物。中西醫結合治療依從性更好,對這些患者病情控制可能是有益的。目前認為支氣管哮喘的發病與輔助性T細胞(T helper cells,Th)亞群功能失衡、Th2活化亢進為特征的免疫學異常相關,如白細胞介素(interleukin,IL)-5、IL-10等 Th1/Th2細胞因子表達的調節異常[2]。射干麻黃湯作為哮證治療的要方,具有較好療效。麻黃湯是治療哮喘寒證的經典方劑,在對難治性哮喘也具有良好的療效,可有效改善患者肺功能[3],本研究探討射干麻黃湯治療對輕癥哮喘患者T細胞亞群及IL-5、IL-10表達的影響。
1 對象與方法
1.1 對象
51例研究對象來自2010年9月至2013年3月武漢市中西醫結合醫院呼吸科門診,根據隨機數字表分為治療組25例和對照組26例。治療組中男12例,女13例;年齡19~60歲,平均年齡(44.0±11.8)歲;對照組中男13例,女13例;年齡20~58歲,平均年齡(44.1±9.8)歲。兩組患者性別、年齡、病情嚴重程度比較差異無統計學意義(P>0.05),具有可比性。
1.2 診斷標準
西醫診斷標準參照支氣管哮喘防治指南(支氣管哮喘的定義、診斷、治療和管理方案)[1]制定:符合哮喘防治指南中哮喘的診斷標準;中醫辨證標準參照文獻[4]制定,癥見氣喘,胸膈滿悶如塞,咳不甚,痰少咯吐不爽,色白而多泡沫,形寒怕冷,天冷或受寒所發,舌苔白滑,辨為冷哮者。
1.3 納入標準
年齡在18歲以上,病情為輕度發作,尚未吸入糖皮質激素治療;中醫辨證屬于寒哮,能接受并完成治療、觀察和各項檢查;所有患者入試前獲得知情同意書。
1.4 排除標準
合并支氣管擴張、肺結核等基礎肺病者;有嚴重心、腦、肝、腎等疾病者;誘發加重或使哮喘難以控制的因素;有重度哮喘發作史;對本試驗藥物過敏者;妊娠和哺乳期婦女;不能依從研究方案者。
1.5 治療方法
對照組:應用沙丁胺醇氣霧劑(英國葛蘭素史克制藥有限公司,生產批號KR0354)100 μg,每天4次。
治療組:在對照組的基礎上加用射干麻黃湯,予中藥配方顆粒(湖北天濟中藥飲片有限公司生產)口服,組成:射干12 g(2袋),麻黃12 g(2袋),細辛3 g(1袋),生姜9 g(3袋),大棗10 g(1袋),紫菀12 g(2袋),款冬花10 g(1袋),五味子6 g(1袋),法夏12 g(2袋),每天1劑,早晚2次溫服。兩組均治療12周。
1.6 觀察指標和方法
對每位患者于治療前后抽取外周靜脈血8 mL,5 mL采用全血直標法流式細胞術檢測T細胞亞群,分析 CD3+、CD4+、CD8+細胞百分率,并計算CD4/CD8比值。另3 mL肝素抗凝,用淋巴細胞分離液分離外周血單個核細胞。將外周血單個核細胞(1×107個)用經焦碳酸二乙酯處理過的PBS液洗滌3次后移至1.5 mL的Eppendorf管中,4℃離心棄上清,用Tripure 1 mL提取總RNA,紫外線分光光度計測定其純度和含量。引物由中國科學院上海細胞生物研究所合成。應用OneStep RTPCR試劑盒(美國QIAGEN公司),擴增目的基因,反應參數為:50℃ 30分鐘;95℃ 15分鐘,1個循環;94℃ 1 分鐘;57℃(IL-5)、62℃(IL-10)或 65℃(β-actin)1分鐘;72℃ 1分鐘,32個循環;72℃延伸10分鐘。
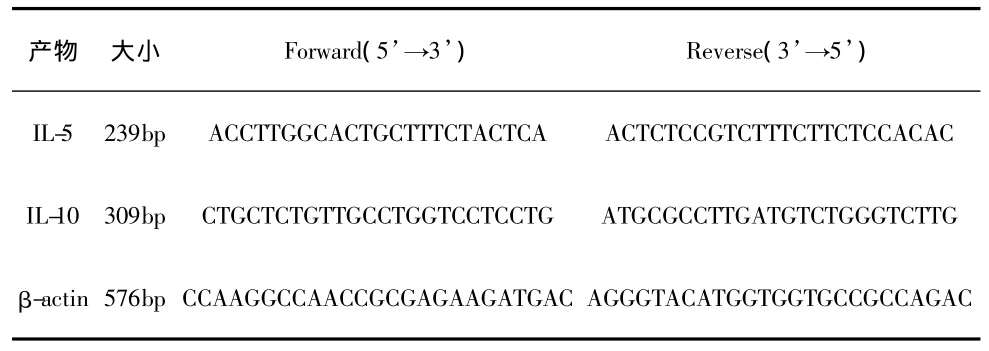
表1 RT-PCR檢測用引物
凝膠掃描擴增合成的RT-PCR產物,在1.0%瓊脂糖凝膠電泳,凝膠成像分析系統中掃描打印,并分析測定電泳帶灰度,以特異的擴增條帶灰度與擴增的β-actin條帶灰度之比表示目的基因相對表達水平。
1.7 療效判定
參照文獻[1]制定,分為完全控制、部分控制及未控制。(1)白天癥狀>2次/周;(2)有活動受限;(3)有夜間癥狀/憋醒;(4)需要使用緩解藥的增加次數>2次/周;(5)1秒用力呼氣容積(Forced expiratory volume in one second,FEV1)<預計值的80%。若5項均無為完全控制,1~2項為部分控制,3項及以上為未控制。未控制者退出試驗升級哮喘治療。
1.8 統計學處理
采用SPSS 18.0軟件處理數據。兩組患者臨床療效比較采用秩和檢驗。計量資料用均數±標準差(x±s)表示,數據符合正態分布,兩組間比較采用獨立樣本t檢驗,組內治療前后的比較用配對樣本t檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1 兩組患者療效比較
共5例患者試驗期間癥狀加重并調整治療方案,其中治療組1例,對照組4例,其余患者均完成試驗,兩組患者臨床療效比較采用秩和檢驗,治療組療效優于對照組(P=0.028),詳見表2。
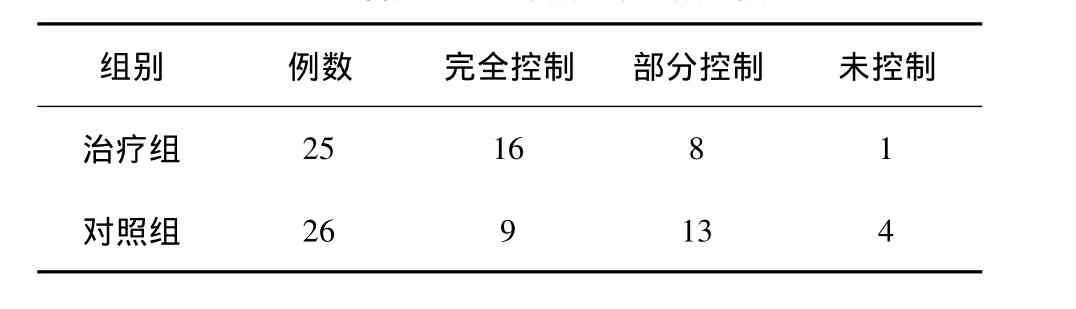
表2 治療組與對照組療效比較
2.2 兩組患者治療前后外周血T細胞亞群比較
兩組間比較采用獨立樣本t檢驗,治療前兩組CD3+、CD4+、CD8+及 CD4/CD8 比值比較差異無統計學意義,治療后兩組比較:CD3+(t=0.747,P=0.459)、CD4+(t=1.806,P=0.077)、CD8+(t=1.584,P=0.120)差異無統計學意義,CD4/CD8比值明顯下降(t=2.593,P=0.012)。本組治療前后的比較用配對樣本t檢驗,與治療前比較,對照組 CD3+、CD4+、CD8+及 CD4/CD8比值均差異無統計學意義,治療組 CD3+、CD4+無明顯變化,CD8+增加(t=2.752,P=0.008)、CD4/CD8 比值下降(t=3.539,P=0.001)有統計意義,詳見表3。
表3 各組治療前后CD3+、CD4+、CD8+及CD4+/CD8+比值的比較(±s)
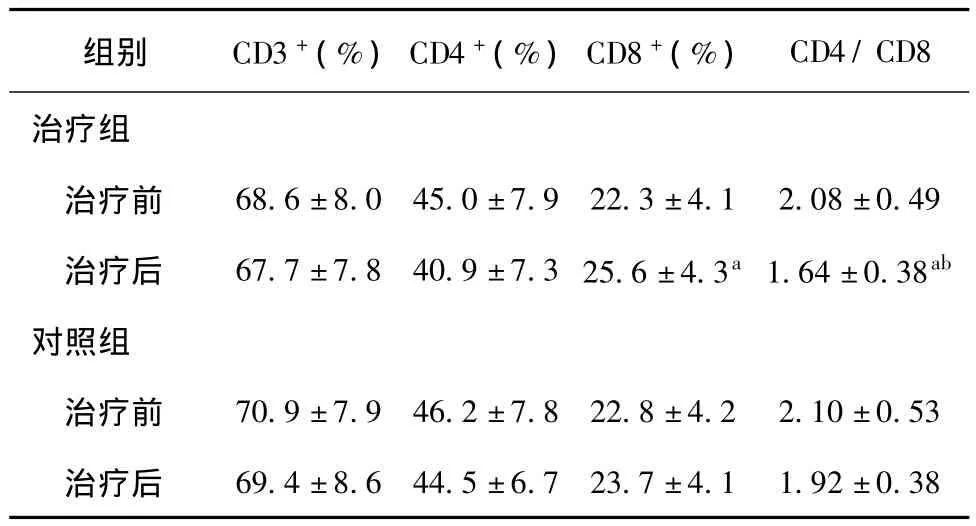
表3 各組治療前后CD3+、CD4+、CD8+及CD4+/CD8+比值的比較(±s)
注:與本組治療前比較,aP<0.05;與對照組同時間點比較,bP<0.05。
組別 CD3+(%)CD4+(%)CD8+(%)CD4/CD8治療組治療前 68.6±8.0 45.0±7.9 22.3±4.1 2.08±0.49治療后 67.7±7.8 40.9±7.3 25.6±4.3a1.64±0.38ab對照組治療前 70.9±7.9 46.2±7.8 22.8±4.2 2.10±0.53治療后69.4±8.6 44.5±6.7 23.7±4.1 1.92±0.38
2.3 兩組患者治療前后IL-5、IL-10表達水平比較
兩組間比較采用獨立樣本t檢驗,治療前兩組IL-5、IL-10 mRNA相對表達水平無明顯差異,治療后治療組較對照組IL-5(t=2.492,P=0.016)表 達 下 降,IL-10(t=2.659,P=0.011)表達增加。本組治療后與治療前比較用配對樣本t檢驗,對照組 IL-5(t=4.874,P<0.01)明顯下降,IL-10無明顯改變,治療組IL-5(t=6.946,P<0.01)明顯下降,IL-10(t=5.052,P<0.01)明顯升高,詳見表4。
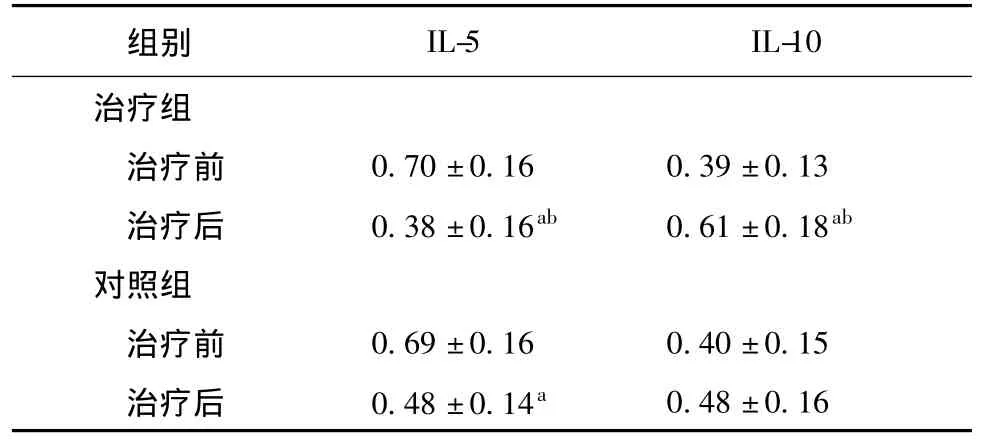
表4 各組治療前后IL-5、IL-10表達水平比較
3 討論
哮喘的治療應以患者的病情嚴重程度為基礎,根據其控制水平級別選擇適當的治療方案,也要考慮患者的實際狀況,如經濟收入和當地的醫療資源等。對以往未經規范治療的初診哮喘患者可選擇第2級治療方案,按需使用短效β2受體激動劑,并選用低劑量吸入糖皮質激素或白三烯調節劑。部分患者尤其是輕癥患者,往往因經濟收入和顧慮激素不良反應,不愿意選用指定的控制藥物,而選擇第1級治療方案,該方案按需使用短效β2受體激動劑,未指定使用何種控制性藥物。對這些患者,密切隨訪觀察病情,及時升級治療十分必要。同時,給予其他可接受的治療,如中西醫結合治療,對患者也是有益的[5]。本研究中,與對照組比較,射干麻黃湯治療組患者病情控制水平明顯提高。
T細胞在機體細胞免疫應答中起重要作用,T淋巴細胞亞群紊亂,輔助T細胞(CD4+)水平升高,抑制T細胞(CD8+)水平下降,CD4/CD8比值失調,可導致IgE升高和氣道高反應性而誘導哮喘發作[6]。哮喘患者氣道阻力與CD4+T細胞及CD4/CD8比值呈顯著正相關[7],與CD8+T呈顯著負相關,射干麻黃湯治療后CD4/CD8比例的改變,有助于改善患者肺通氣。射干麻黃湯治療后患者與治療前及對照組比較CD4+T細胞數量均有所下降,但差異無統計學意義。治療組CD8+T細胞數量較治療前顯著增加,但與對照組比較差異無統計學意義。盡管射干麻黃湯治療后CD4+及CD8+T細胞數量變化不顯著,但CD4/CD8比例變化有統計學意義,提示對機體細胞免疫功能情況產生顯著的影響。
CD4+T細胞可分泌細胞因子對體液免疫產生影響,與支氣管哮喘發病密切相關。IL-5、IL-10均為Th2細胞因子,可抑制原始T細胞分化為Th1細胞及Th1細胞功能。IL-5在接觸抗原后,能促進活化B淋巴細胞向產生抗體細胞分化,并誘導骨髓干細胞向嗜酸性細胞(eosinophil,EOS)增殖分化。IL-5不僅可作用于EOS前體促進其增殖分化,維持并延長成熟EOS的生存期,引起EOS趨化和黏附,還可提高抗體依賴細胞介導細胞毒作用和抗體誘導的EOS脫顆粒[8]。IL-10是重要的免疫炎癥下行調節因子,它能抑制激活的CD4+T細胞的增值,抑制Th2細胞合成IL-5等多種細胞因子及炎癥的發生和發展,促進Treg細胞增殖,構成免疫反應的負反饋機制[9-10]。IL-10水平的升高,有助于控制哮喘患者氣道炎癥與癥狀[11]。在本研究中射干麻黃湯治療后雖然CD4+細胞數量影響較小,但IL-5水平顯著下降,IL-10水平顯著升高,提示射干麻黃湯能夠調節細胞因子表達,控制哮喘的發生。
[1]中華醫學會呼吸病學分會哮喘學組.支氣管哮喘防治指南(支氣管哮喘的定義、診斷、治療和管理方案)[J].中華哮喘雜志(電子版),2008,(1):3-13.
[2]Elias JA,Lee CG,Zheng T,et al.New insights into the Pathogenesis of asthma[J].J Clin Invest,2003,111(30):291-297.
[3]王晶波,彭先祝,隋博文.射干麻黃湯加味治療難治性哮喘33 例臨床觀察[J].中醫雜志,2013,54(10):846-8.
[4]鄭筱萸.中藥新藥臨床研究指導原則[M].北京:中國醫藥科技出版社,2002:61-65.
[5]吳祖群,沈華浩.T細胞在哮喘免疫調節中的作用[J].國外醫學:呼吸系統分冊,2005,25(9):690-695.
[6]喬靖,林亮.中醫藥治療支氣管哮喘的研究概述[J].環球中醫藥,2013,6(10):769-772.
[7]賴映君,邱晨,酆孟潔.哮喘患者T細胞亞群失衡與氣道阻力變化的相關性[J].現代預防醫學,2006,33(3):284-285.
[8]Yeon-Joon Park,Eun-Jee Oh,Jong-Won Park,et al.Plasma Eosinophil Cationic Protein,Interleukin-5,and ECP/Eo Count Ratio in Patients with Various Eosinophilic Diseases[J].Ann Clin Lab Sci,2006,36(3):262-266.
[9]Ye Z,Huang H,Hao S,et al.IL-10 has a distinct immunoregulatory effect on naive and active T cell subsets[J].J Interferon Cytokine Res,2007,27(12):1031-1038.
[10]Rutz S,Janke M,Kassner N,et al.Notch regulates IL-10 production by T helper 1 cells[J].Proc Natl Acad Sci USA,2008,105(9):3497-3502.
[11]Yüksel B,Aydemir C,Ustündag G,et al.The effect of treatment with montelukast on levels of serum interleukin-10,eosinophil cationic protein,blood eosinophil counts,and clinical parameters in children with asthma[J].Turk J Pediatr,2009,51(5):460-465.
(本文編輯:董歷華)

