聚乙二醇(PEG)脅迫誘導(dǎo)水稻DNA甲基化變異與脯氨酸代謝相關(guān)性研究
張春玉
(1.長春職業(yè)技術(shù)學(xué)院食品與生物技術(shù)分院,吉林 長春130033;2.東北師范大學(xué)生命科學(xué)學(xué)院,吉林 長春130024)
作物產(chǎn)量經(jīng)常受到干旱等非生物脅迫因素的影響,而植物在響應(yīng)滲透脅迫的過程中常會出現(xiàn)脯氨酸的積累;已有的研究表明,脯氨酸在植物應(yīng)對脅迫的過程中發(fā)揮了重要的抗逆作用[1-3].植物體內(nèi)脯氨酸的合成主要有兩條途徑:一條是以谷氨酸為底物合成脯氨酸,催化此途徑的酶是Δ1-吡咯啉-5-羧酸合成酶(P5CS)和Δ1-吡咯啉-5-羧酸還原酶(P5CR);另一條途徑是以鳥氨酸為底物合成脯氨酸,催化此途徑的酶是鳥氨酸轉(zhuǎn)氨酶(δ-OAT)和Δ1-吡咯啉-5-羧酸合成酶(P5CR).脯氨酸的降解則由脯氨酸脫氫酶(Prodh)催化和Δ1-吡咯琳-5-羧酸脫氫酶(P5CDH)調(diào)控[4-5].研究表明,脯氨酸合成過程中相關(guān)基因表達(dá)的上調(diào)有利于葉片中游離脯氨酸的積累,如Roosens等將鳥氨酸轉(zhuǎn)氨酶(δ-OAT)基因用于煙草植株的轉(zhuǎn)化,結(jié)果證明與非轉(zhuǎn)化植株相比,葉片脯氨酸含量明顯升高,即鳥氨酸轉(zhuǎn)氨酶(δ-OAT)基因轉(zhuǎn)化植株的后代對脯氨酸的積累能力顯著增強(qiáng).
雖然脯氨酸的積累是逆境條件下最常見的生理反應(yīng),常被作為衡量抗逆性強(qiáng)弱的指標(biāo).但是其確切機(jī)理仍不清楚[4].最新的研究表明,逆境脅迫(如干旱、冷害和鹽堿)能夠改變植物基因組DNA 甲基化水平,這表明DNA 甲基化與植物的抗逆性有關(guān)[6].為了研究逆境脅迫下DNA 甲基化是否參與了脯氨酸的累積,本文首次從表觀遺傳學(xué)角度探討了聚乙二醇(PEG)脅迫下DNA 甲基化與脯氨酸代謝之間可能存在的相關(guān)性,對于深入研究逆境條件下脯氨酸代謝的表觀遺傳學(xué)機(jī)制具有重要意義.
1 實(shí)驗(yàn)方法
1.1 材料與試劑
1.1.1 植物材料
水稻(Oryza sativa L.)粳稻品種——松前.
1.1.2 材料的處理
隨機(jī)選取松前S0代和S1代(S0的自交后代)種子各30粒進(jìn)行培養(yǎng).待苗長到三葉一心時,將S0代和S1代植株分別分成兩組:一組為對照組,不進(jìn)行PEG 脅迫;另一組為處理組.選取15%的PEG 模擬干旱脅迫處理,在處理期間每天更換新的處理液以保證處理濃度的均一性的,脅迫處理4d后,分別取處理組和對照組的葉片,在液氮中冷凍后置于-70℃冰箱中保存待用.
1.1.2 營養(yǎng)液
1.44 mmol/L (NH4)2SO4,0.32 mmol/L NaH2PO4,0.6 mmol/L K2SO4,1.0 mmol/L CaCl2,1.6mmol/L MgSO4,0.072mmol/L EDTA,0.2mmol/L Na2SiO3,9.1mmol/L MnCl2,0.154μmol/L ZnSO4,0.156μmol/L CuSO4,18.5μmol/L H3BO3,0.526μmol/L H2MoO4.pH=5.2.
1.2 技術(shù)路線
1.2.1 松前基因組總DNA 提取
采用改良的十六烷基三甲基溴化銨(CTAB)法[7].
1.2.2 松前的DNA 甲基化敏感擴(kuò)增多態(tài)性(MSAP)檢測
參照Xiong等報道的方法[8],以上述提取的松前DNA 為模板,對S0代進(jìn)行DNA 甲基化敏感擴(kuò)增多態(tài)性檢測,雙酶切組合為EcoRⅠ/MspⅠ和EcoRⅠ/HpaⅡ,接頭、預(yù)擴(kuò)增及選擴(kuò)增引物序列如表1所示.
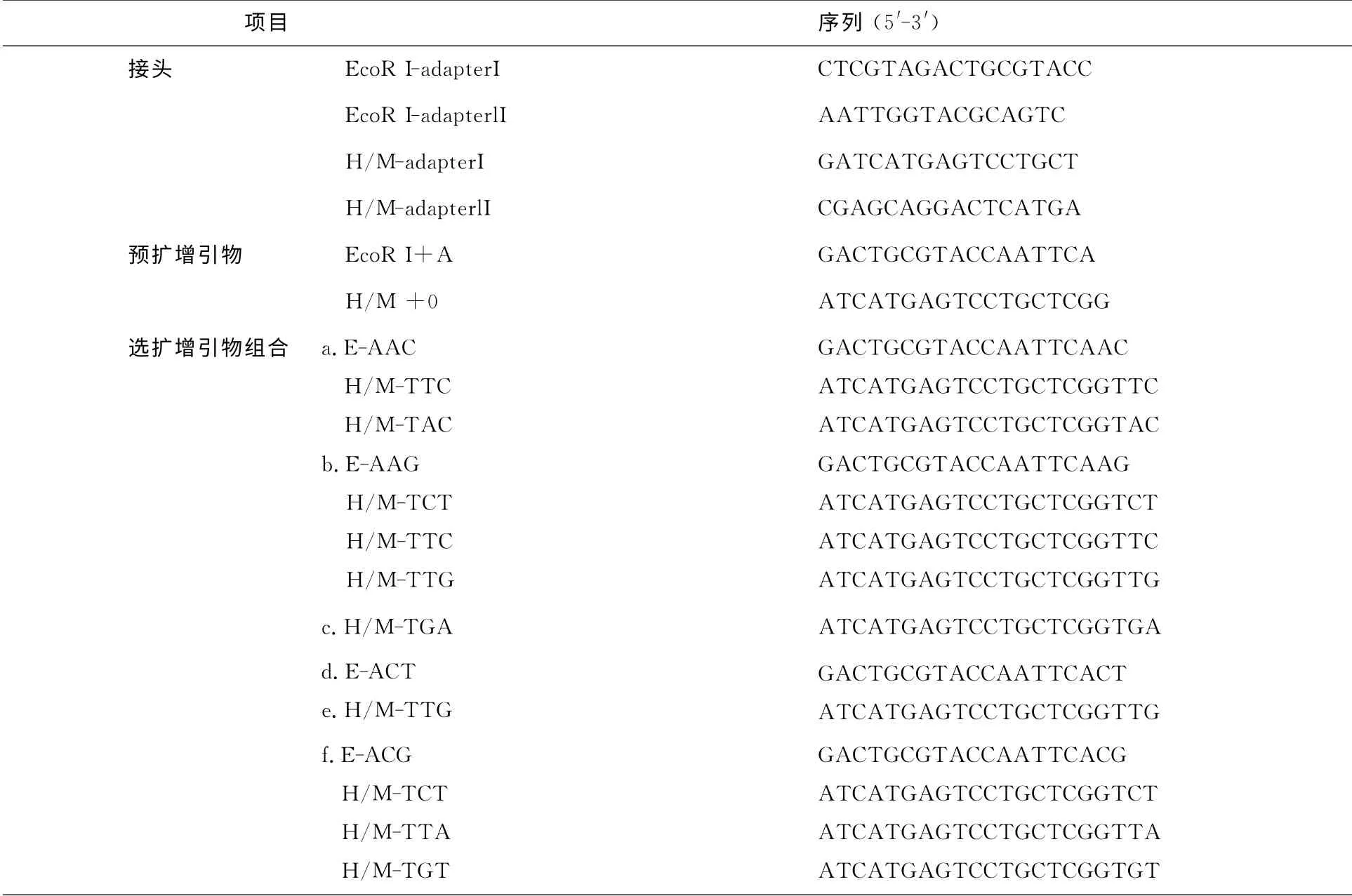
表1 松前擴(kuò)增MSAP中接頭序列、預(yù)擴(kuò)增引物和選擇性擴(kuò)增引物組合

續(xù)表1
1.2.3 松前總RNA 的提取
參照Lepz等方法提取松前總RNA[9].
1.2.2 松前總RNA 反轉(zhuǎn)錄
以上述提取的松前總RNA 為模板進(jìn)行反轉(zhuǎn)錄,反轉(zhuǎn)錄反應(yīng)體系如表2所示.反應(yīng)程序?yàn)椋?0℃,10min;42℃,30min;99℃,5min.

表2 10μL反轉(zhuǎn)錄反應(yīng)體系
1.2.3 脯氨酸代謝相關(guān)基因的Southern印跡雜交檢測
用限制性內(nèi)切酶消化水稻當(dāng)代變異最大的單株S0及其后代S1代單株葉片的基因組DNA,進(jìn)行脯氨酸代謝相關(guān)基因的Southern印跡雜交檢測.
1.2.4 脯氨酸代謝相關(guān)基因的實(shí)時熒光定量聚合酶鏈?zhǔn)椒磻?yīng)(Realtime-PCR)
以上述反轉(zhuǎn)錄獲得的水稻樣品的cDNA 為模板,按照表3提供的引物,采用熒光染料(SYBR Green)三步法進(jìn)行實(shí)時熒光定量聚合酶鏈?zhǔn)椒磻?yīng)(Realtime-PCR)擴(kuò)增.反應(yīng)體系如表4所示.反應(yīng)程序?yàn)椋?5℃,1min;95℃,5s;58℃~60℃,10s;72℃,30s.40個循環(huán).

表3 用于擴(kuò)增松前的轉(zhuǎn)座子和基因的探針的引物
1.2.5 游離脯氨酸含量的測定
按照Bates等方法測定樣品葉片中游離脯氨酸的含量[10].
2 結(jié)果與分析
2.1 松前S0 代甲基化變異最大的單株
對隨機(jī)選取的S0代的14個單株進(jìn)行DNA 甲基化敏感擴(kuò)增多態(tài)性檢測,采用EcoRⅠ+MspⅠ選擇性擴(kuò)增引物組合(19對)擴(kuò)增出了956條清晰可辨的條帶.結(jié)果表明,S0代的14個單株的CHG 甲基化水平和模式均發(fā)生了變異,但是CG 甲基化卻沒有發(fā)生變異.CHG 總甲基化變異范圍為0.2%~8%,結(jié)果如圖1所示.根據(jù)以上的檢測結(jié)果,篩選出甲基化變異最明顯的第4株(變異率為8%)進(jìn)行后續(xù)的研究,記作S0,S0的自交后代記為S1.

表4 松前的Realtime-PCR反應(yīng)體系(10μL)

圖1 PEG 脅迫S0 代DNA甲基化模式變異
2.2 S0 和S1 代脯氨酸代謝相關(guān)基因的Southern印跡雜交的檢測
為了進(jìn)一步明確脯氨酸代謝相關(guān)基因P5CS、δ-OAT、P5CR 以 及P5CDH 在S0和S1代所發(fā)生的DNA 甲基化變異特征,利用Southern印跡雜交技術(shù)檢測S0代和S1代的14個單株的DNA 甲基化水平,結(jié)果見圖2.結(jié)果表明:這些基因在S0代,CHG、CG 甲基化均未發(fā)生變異.S1代Δ1-吡咯啉-5-羧酸合成酶(P5CS)基因甲基化變異率為100%(全部發(fā)生去甲基化變異);鳥氨酸轉(zhuǎn)氨酶(δ-OAT)基因甲基化變異率約為21%(3個單株發(fā)生去甲基化變異,11個單株沒有變化);脯氨酸合成途徑Δ1-吡咯啉-5-羧酸合成酶(P5CR)基因和脯氨酸降解途徑基因Δ1-吡咯啉-5-羧酸脫氫酶(P5CDH)基因的甲基化變異率為0(S1代沒有發(fā)生甲基化變化).
2.3 S0 代和S1 代葉片的脯氨酸代謝基因的
DNA甲基化變異與基因表達(dá)的相關(guān)性
(1)Δ1-吡咯啉-5-羧酸合成酶(P5CS)基因的表達(dá).與對照相比,S0代P5CS基因表達(dá)上調(diào)得不明顯,S1代所有單株P(guān)5CS基因的表達(dá)均上調(diào),尤其是S1-8,S1-9和S1-10這3個單株的表達(dá)明顯上調(diào)(P<0.05),P5CS基因在S1后代中表達(dá)上調(diào)的比率為100%(見圖3A).
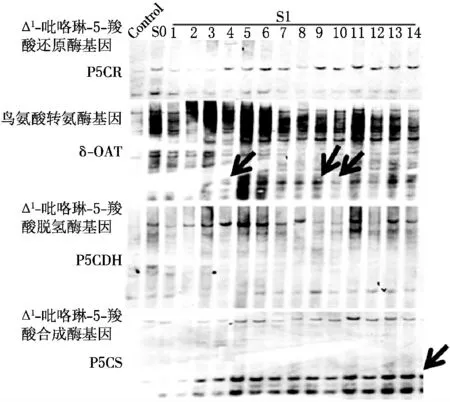
圖2 S0 代和S1 代的Southern雜交結(jié)果
(2)鳥氨酸轉(zhuǎn)氨酶(δ-OAT)基因的表達(dá).與對照相比,除S1-5,S0代和S1代其他13 個單株中δ-OAT 基因的表達(dá)均上調(diào),上調(diào)的比率為71.4%.Southern印跡雜交的結(jié)果顯示S1-4,S1-9和S1-10這3個單株δ-OAT 基因發(fā)生了去甲基化變異;Realtime-PCR 結(jié)果顯示這3個單株對應(yīng)的基因表達(dá)結(jié)果為上調(diào),說明二者基本可以吻合.但是該基因的Southern 印跡雜交結(jié)果表明,S1代其他的11 個單株δ-OAT 基因沒有發(fā)生去甲基化變異,但是對應(yīng)的基因表達(dá)卻有上調(diào),這進(jìn)一步證明了僅是部分單株甲基化變異與基因的表達(dá)可能呈現(xiàn)相關(guān)性(見圖3B).
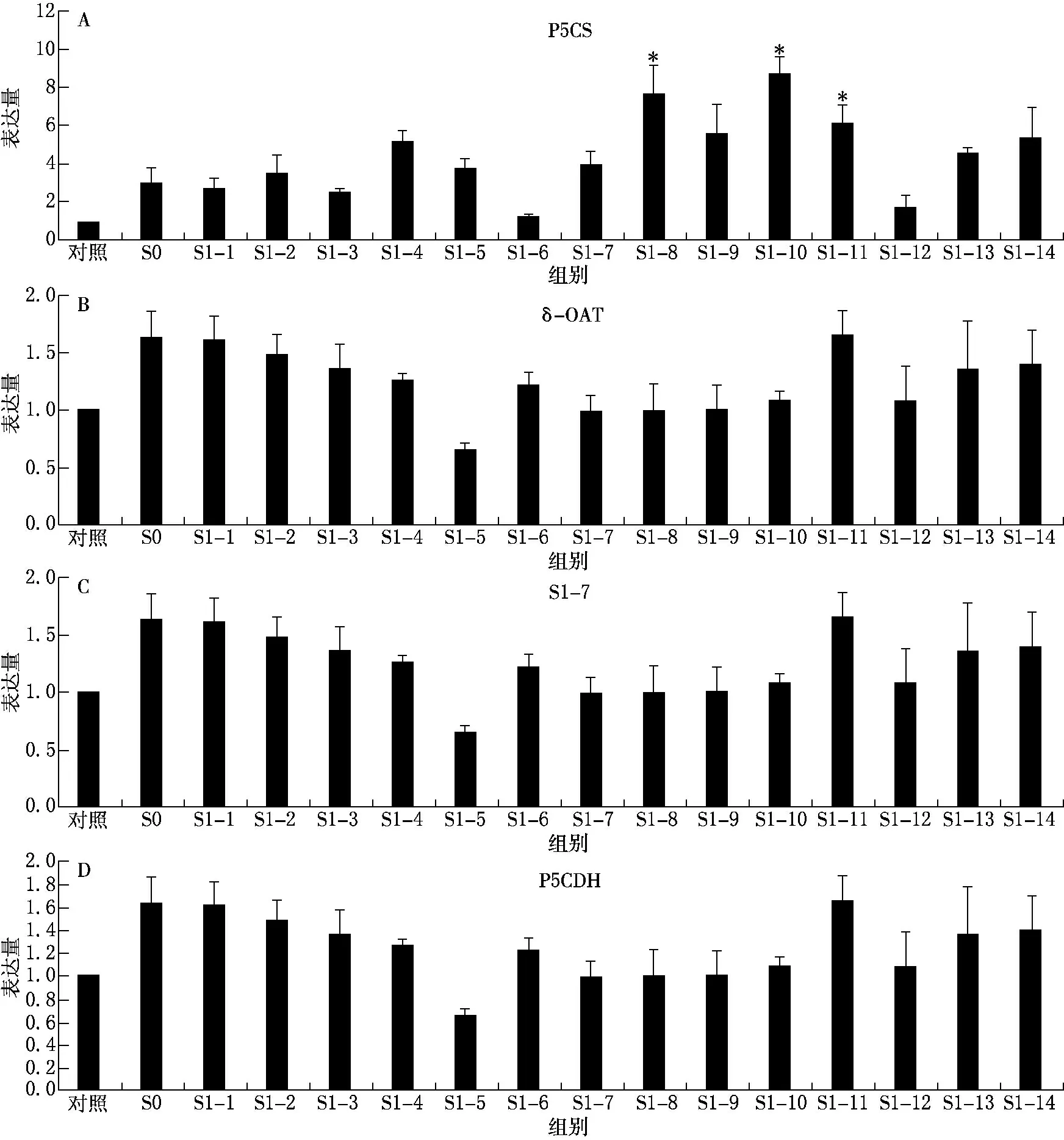
圖3 S0 代和S1 代的Realtime-PCR檢測
(3)Δ1-吡咯啉-5-羧酸還原酶(P5CR)基因的表達(dá).與對照相比,S0代P5CR 基因表達(dá)上調(diào),S1代P5CR基因表達(dá)上調(diào)率為71.4%,這與Southern印跡雜交的去甲基化變異率(0)不相符,表明P5CR 基因在S1代單株中的DNA 去甲基變異與該基因在S1代的表達(dá)不直接相關(guān)(見圖3C).
(4)Δ1-吡咯啉-5-羧酸脫氫酶(P5CDH)基因的表達(dá).與對照相比,S0代P5CDH 基因表達(dá)上調(diào),S1代P5CDH 基因表達(dá)下調(diào)率為7.1%,這與Southern印跡雜交0的去甲基化變異率之間存在一定的差距,表明P5CDH 基因的甲基化變異與基因表達(dá)也不存在直接相關(guān)(見圖3D).
2.4 干旱脅迫對后代(S1 代)葉片游離脯氨酸含量的影響
前述的基因表達(dá)結(jié)果已經(jīng)表明,S1代所有植株的控制脯氨酸合成的關(guān)鍵基因Δ1-吡咯啉-5-羧酸合成酶(P5CS)表達(dá)均上調(diào).為了驗(yàn)證這個基因的DNA 甲基化變異及其基因表達(dá)的變化是否對脯氨酸的累積產(chǎn)生影響,分別對S0代和S1代葉片中游離脯氨酸含量進(jìn)行測定.結(jié)果(見圖4)表明,與對照相比,無論是否經(jīng)過再次脅迫處理,在脅迫6h和4d時S1代葉片中的脯氨酸含量均高于對照;并且S1代在經(jīng)過再次脅迫處理時,葉片中脯氨酸含量明顯高于未脅迫狀態(tài),而對照在經(jīng)過處理后脯氨酸含量沒有明顯的增強(qiáng).很多研究表明脯氨酸可以作為植物抗逆的指標(biāo)之一[3,13],因此,這也表明經(jīng)過脅迫處理的后代植株S1代的抗旱性有所增強(qiáng).

圖4 S0 代和S1 代的脯氨酸含量
3 討論與結(jié)論
植物的生長發(fā)育是在遺傳和環(huán)境因素以及二者的相互作用下,通過極其復(fù)雜的生理和生化過程完成的.逆境尤其是干旱可以引起植物體內(nèi)游離脯氨酸含量的增加,而脯氨酸含量是否可以作為植物抗旱適應(yīng)性和育種的指標(biāo)一直存在爭議.但是很多研究表明,水稻受到干旱脅迫后脯氨酸的累積有利于水稻抗逆性的提高.引起脯氨酸累積的可能原因主要是脯氨酸合成途徑被激活、氧化降解途徑受到抑制或合成途徑的原料供應(yīng)受阻[11-13].
本研究發(fā)現(xiàn):(1)S1代脯氨酸合成途徑部分基因的DNA 甲基化變異與基因表達(dá)可能存在一定的相關(guān)性,但是否就是由于Δ1-吡咯啉-5-羧酸合成酶(P5CS)和鳥氨酸轉(zhuǎn)氨酶(δ-OAT)基因的去甲基化變異激活了基因的表達(dá)而導(dǎo)致表達(dá)量上調(diào)還不能明確定論,因?yàn)槊傅幕钚允艿睫D(zhuǎn)錄和翻譯的共同調(diào)控,因此還有待于在蛋白質(zhì)水平上進(jìn)行進(jìn)一步的驗(yàn)證.但是我們獲得的信息表明,S1代中14個單株的Δ1-吡咯啉-5-羧酸合成酶(P5CS)基因甲基化的變化與基因表達(dá)呈現(xiàn)了一致性,3 個單株的鳥氨酸轉(zhuǎn)氨酶(δ-OAT)基因的甲基化變異與基因的表達(dá)呈現(xiàn)了一致性,因而我們猜測DNA 甲基化極有可能參與了對Δ1-吡咯啉-5-羧酸合成酶(P5CS)和鳥氨酸轉(zhuǎn)氨酶(δ-OAT)基因表達(dá)的調(diào)控,進(jìn)而影響了脯氨酸的累積.(2)Δ1-吡咯啉-5-羧酸還原酶(P5CR)基因和Δ1-吡咯啉-5-羧酸脫氫酶(P5CDH)基因的表達(dá)可能并不受DNA 甲基化的調(diào)控.(3)DNA 甲基化變異可能只對脯氨酸部分特定基因的表達(dá)產(chǎn)生一定的影響.
本文的研究結(jié)果表明:表觀遺傳修飾如DNA 甲基化極有可能在植物響應(yīng)干旱脅迫時參與脯氨酸代謝的調(diào)節(jié),并且這種代謝特性(基因表達(dá)水平和脯氨酸含量的變化)可按照一定的頻率遺傳給后代,因而可能在植物適應(yīng)干旱以及脅迫抗性獲得中發(fā)揮重要作用.本研究為DNA甲基化在脯氨酸代謝中的作用提供了一個可靠的證據(jù),脅迫生物學(xué)的研究應(yīng)該更多地關(guān)注執(zhí)行抗性的生物活性的分子表觀遺傳學(xué)調(diào)節(jié).
[1]RAZIN A,CEDAR H.DNA methylation-biochemistry and biological significance[J].Chromatogr,1992,581(1):31-40.
[2]ADAMS R L P,BURDON R H.Molecular biology of DNA methylation[M].New York,Berlin,Herddberg,Tokyo:SpringerVerlag,1985:1.
[3]SANTI D V,GARRETT C E,Barr P J.On the mechanism of inhibition of DNA-cytosine methyltransferases by cytosine analogs[J].Cell,1983,33:9-10.
[4]PAUL E VERSLUES1,SANDEEP SHARMA.Proline metabolism and its implications for plant-environment interaction[J].The Arabidopsis Book,2010,11(3):1-23.
[5]SAVOURE A,JAOUA S,HUA X J,et al.Isolation,characterization,and chromosomal location ofa gene encoding theΔ1-pyrroline-5-carboxylate synthetase in Arabidopsis thaliana[J].FEBS Lett,1995,372:13.
[6]FINNEGAN E J,GENGER R K,PEACOCK W J,et al.DNA methylation in plants[J].Annu Rev Plant Physiol Plant Mol Biol,1998,49(1):223-247.
[7]KIDWELL K K.Simple plant DNA isolation procedures,in plant genomes:methods for genetic and physical mapping Amsterdam[M].The Netherlands,Kluwer:Academic Publishers,1992:1-13.
[8]XIONG L Z,XU C G,MAROOF S,et al.Patterns of cytosine methylation pattern in an elite rice hybrid and its parental lines detected by a methylation sensitive amplification polymorphism technique[J].Molecular and General Genetics,1999,261:439-446.
[9]LEPZ GMEZ R,LIM M A.A method for extracting RNA with modified Gomez method[J].Hortscience,1992,27:440-442.
[10]BATES L S,WALDREN R P,TEARE I D.Rapid determination of free proline for water-stress studies[J].Plant and Soil 1973,39:205-207.
[11]ZHANG C S,LU Q,VERMA D P S.Removal of feedback inhibition ofΔ1-pyrroline-5-carboxylate synthetase,a bifunctional enzyme catalyzing the first two steps of proline biosynthesis in plants[J].J Biol Chem,1995,270:20491-20496.
[12]VERBRUGGEN N,HUA X J,MAY M,et al.Nvironmental and developmental signals modulate proline homeostasis:evidence for a negative transcriptional regulator[J].Proc Natl Acad Sci USA,1996,93:8787-8791.
[13]IYER S,CAPLAN A.Products of proline catabolism can induce osmotically regulated genes in rice[J].Plant Hysiology,1998,116:203-21.

