姜黃素對大鼠慢性腦缺血誘發腦損傷的保護作用及分子機制研究
楊 柳,張 敏,賀 曦,朱 潔,王進平,孟 濤
(重慶市急救醫療中心神經內科,重慶 400014)
姜黃素對大鼠慢性腦缺血誘發腦損傷的保護作用及分子機制研究
楊 柳,張 敏,賀 曦,朱 潔,王進平,孟 濤
(重慶市急救醫療中心神經內科,重慶 400014)
目的觀察姜黃腦素對缺血后海馬組織中細胞色素C以及caspase-3蛋白的表達情況,探討姜黃素發揮其神經保護作用的機制。方法將50只SD大鼠隨機分為假手術組(Sham)、正常對照組、缺血后二甲基亞砜(DMSO)干預對照組、姜黃素高劑量組(100 mg/kg)和姜黃素低劑量組(50 mg/kg)。所有治療組于術后24 h開始以姜黃素每日腹腔注射,連續28 d。給藥結束后,對各組進行Morris水迷宮試驗測試大鼠空間學習和記憶能力,然后處死大鼠,用HE染色和尼氏染色觀察海馬組織的病理形態變化,Western-Blot法檢測海馬組織中細胞色素C和capase-3蛋白的表達情況。結果與各對照組比較,姜黃素明顯增強了慢性腦缺血大鼠的空間學習和記憶能力,而且明顯減輕了神經細胞的凋亡。Western-Blot法檢測到姜黃素使海馬組織中細胞色素 C和caspase-3蛋白表達水平明顯降低(P<0.05)。結論姜黃素對慢性大腦缺血誘發腦損傷有明顯的神經保護作用,其機制可能是通過細胞色素C途徑抑制caspase-3蛋白的表達而發揮作用。
姜黃素;慢性腦缺血;細胞色素C;細胞凋亡
血管性癡呆(VD)是老年人群常見的癡呆類型之一,是一類與腦血管因素有關的癡呆,通常以各種腦血管疾病導致腦組織損傷引起的認知功能障礙為臨床特征。目前認為,慢性腦血流灌注不足引起的腦缺血缺氧是誘發VD發生的重要原因[1]。而在慢性腦缺血過程中,神經元的凋亡對損傷腦組織發揮著重要的作用,是引起VD認知功能障礙的重要機制[2]。因此,研究和尋找安全有效的抗凋亡藥物具有很強的現實意義。姜黃素(curcumin)是一種黃色粉末狀的天然植物化合物,是由植物姜黃的根莖中提取,已被證實具有抗炎癥[3]、抗氧化[4]、抗腫瘤[5]等多種生物學效應,而對正常組織細胞幾乎無毒性[6]。近年來已有研究證實,姜黃素具有抗大鼠腦缺血損傷的作用,但多數研究集中于其對急性腦缺血-再灌注導致腦損傷的保護作用和機制,對其在慢性腦缺血損傷中的作用及相關機制尚不清楚。因此,本研究中擬通過建立慢性腦缺血的大鼠模型,并觀察姜黃素對慢性腦缺血的神經保護作用,從而探討姜黃素可能的保護機制,并為防治VD提供新的理論依據。
1 材料和方法
1.1 材料
動物:SPF級Sprague-Dawley大鼠,雄性,體重200~300 g,
由重慶醫科大學動物實驗中心提供[許可證號為 SCXK(渝)2007-0001];試驗開始前將大鼠置室溫恒定(20~25℃)的實驗室適應性飼養7~10 d,給予充足的普通飼料和水,飲食自由攝取;造模手術開始前禁食12 h,可自由飲水。
試藥:姜黃素購自美國Sigma公司,稱取10 mg,用二甲基亞砜(DMSO,Sigma公司)溶解,形成母液;PRO-PREPTM蛋白提取液購自北京賽百盛基因技術有限公司;SDS-PAGE凝膠配置試劑盒購自碧云天生物技術研究所;Page RulerTMPrestained Protein ladder來自美國 Fermentas公司;PVDF膜購自美國 Millipore公司。Cyto C和 caspase-3兔抗大鼠一抗來源于 Cell Signaling公司;內參兔抗β-actin抗體和辣根過氧化物酶標記山羊抗兔IgG二抗均來自北京博鰲森生物技術有限公司;ECL發光試劑盒購自美國Bio-rad公司。
1.2 試驗方法
1.2.1 動物分組與藥物處理
選用SPF級Sprague-Dawley大鼠50只,雄性,體重200~300g,將其隨機分為5組,即正常對照組(A組)、假手術組(B組)、缺血后 DMSO干預對照組(C組)、藥物治療組(D組),D組又分為高劑量組(D1組,100 mg/kg)和低劑量組(D2組,50 mg/kg),每組10只。D組于術后24 h開始以100 mg/kg和50 mg/kg的劑量腹腔注射姜黃素。A組、B組、C組用等量的DMSO腹腔注射,每日1次,不間斷給藥28 d。
1.2.2 慢性腦缺血模型制備(2VO式)
采用 Liu等[7]介紹的經典方法復制大鼠慢性腦缺血模型[7]。造模手術開始前大鼠禁食12 h,可自由飲水。用3.5%水合氯醛(350 mg/kg)腹腔注射麻醉大鼠,待麻醉成功后,將大鼠仰臥固定,頸部備皮并消毒,用無菌手術器械沿頸正中切開皮膚及皮下組織,長度約1.5 cm,暴露頸部肌肉,分別沿兩側頸前肌肉和側方肌肉間隙鈍性分離雙側頸總動脈,分別結扎兩側頸總動脈,結扎血管后間斷縫合皮膚,縫合完畢,酒精消毒切口,完成慢性腦缺血模型。B組只分離雙側頸總動脈而不結扎,其余過程相同。
1.2.3 Morris水迷宮試驗
空間定位航行試驗:于各組大鼠給藥28 d后進行。參照水迷宮原理[8],試驗共測試5 d。從第1天到第5天,試驗開始前允許先將大鼠放在平臺上停留20 s,然后每天將大鼠分別從Ⅰ,Ⅱ,Ⅲ,Ⅳ象限的固定入水點入水,入水時使大鼠背對水池壁緩慢放入水中,防止其看到水下平臺位置。入水的同時由攝像機連接電腦,記錄2 min內大鼠找到平臺的時間(即逃避潛伏期)、路程和游泳速度。大鼠找到平臺并爬上平臺停留3 s及3 s以上,電腦系統自動停止計時,此時該象限試驗結束。若大鼠在2 min內仍沒有找到平臺,則將其逃避潛伏期計為2 min,并引導該大鼠找到平臺同時在平臺上停留15 s。
空間探索試驗:第5天做完空間定位航行試驗后撤去水下平臺,將大鼠從第Ⅲ象限的入水點放入水中,記錄其穿越原平臺所在位置的次數和原平臺所在象限的路程(即軌跡)長度。
1.2.4 形態學檢測
HE染色:取經石蠟包埋切片后的腦組織切片,依次作二甲苯透明、酒精脫水、蘇木素染色、鹽酸酒精分化、伊紅染色、酒精脫水、二甲苯透明等操作,用中性樹膠封片。
尼氏染色:腦組織切片按以上過程常規脫蠟,將脫蠟好的切片用蒸餾水沖洗后浸入1%的甲苯胺藍溶液中,室溫下浸染30 min;切片置蒸餾水中沖洗,以酒精梯度脫水、二甲苯透明,最后以中性樹膠封片。
1.2.5 Western-Blot法檢測
將處死后大鼠的海馬組織迅速取出,加入組織裂解液,碾磨、勻漿、離心后取上清,應用BCA蛋白定量試劑盒測定蛋白濃度,以20 μL樣品上樣,行10%SDS-聚丙酰胺凝膠電泳(保證樣品的含量基本一致),然后將電泳蛋白電轉移至PVDF膜上,5%脫脂奶粉溶液室溫下封閉1 h,加入cyto C(1∶2000),caspase-3(1∶2 000)以及β-actin(1∶500)4℃孵育過夜,加二抗(1∶1 000)室溫下孵育2~3 h,顯色,曝光洗片。以 β-actin作為內參,凝膠成像系統分析各條帶吸光度值,計算各條帶與內參條帶的吸光度比值作為蛋白半定量分析結果。
1.3 統計學處理
采用SPSS 11.5軟件對各組數據進行方差齊性檢驗,數據均以表示,兩樣本間均數比較采用SNK-q檢驗,多組數據間比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 Morris水迷宮試驗
結果見表1及圖1。經過連續5 d的訓練,盡管處理方式不同,但各組大鼠逃避潛伏期隨訓練次數的增加均呈縮短趨勢(圖1A),說明大鼠空間學習和記憶能力可伴隨訓練次數增加而增強。第5天試驗結果顯示,缺血后C組大鼠逃避潛伏期時間明顯高于B組和A組(P<0.05),表明慢性缺血后大鼠的空間學習能力顯著下降;姜黃素治療后,與C組比較,大鼠的空間學習能力明顯得到提高,且呈劑量依賴性(P<0.05)。為了進一步觀察姜黃素對慢性腦缺血大鼠記憶能力的影響,記錄了大鼠在原平臺所在象限停留時間占總游泳時間的比例,見圖1B。結果顯示,C組在原平臺所在象限停留時間占總游泳時間的比例明顯少于B組和A組(P<0.05),而D1組和D2組則比C組顯著延長(P<0.05),表明姜黃素可增強慢性腦缺血大鼠的記憶能力。
表1 Morris水迷宮試驗結果(,s,n=10)

表1 Morris水迷宮試驗結果(,s,n=10)
組別A組B組C組D1組D2組給藥DMSO等量DMSO等量DMSO等量姜黃素100 mg/kg姜黃素50 mg/kg逃避潛伏期12.83±8.61 14.73±3.73 76.82±2.31 22.29±3.41 33.90±5.42
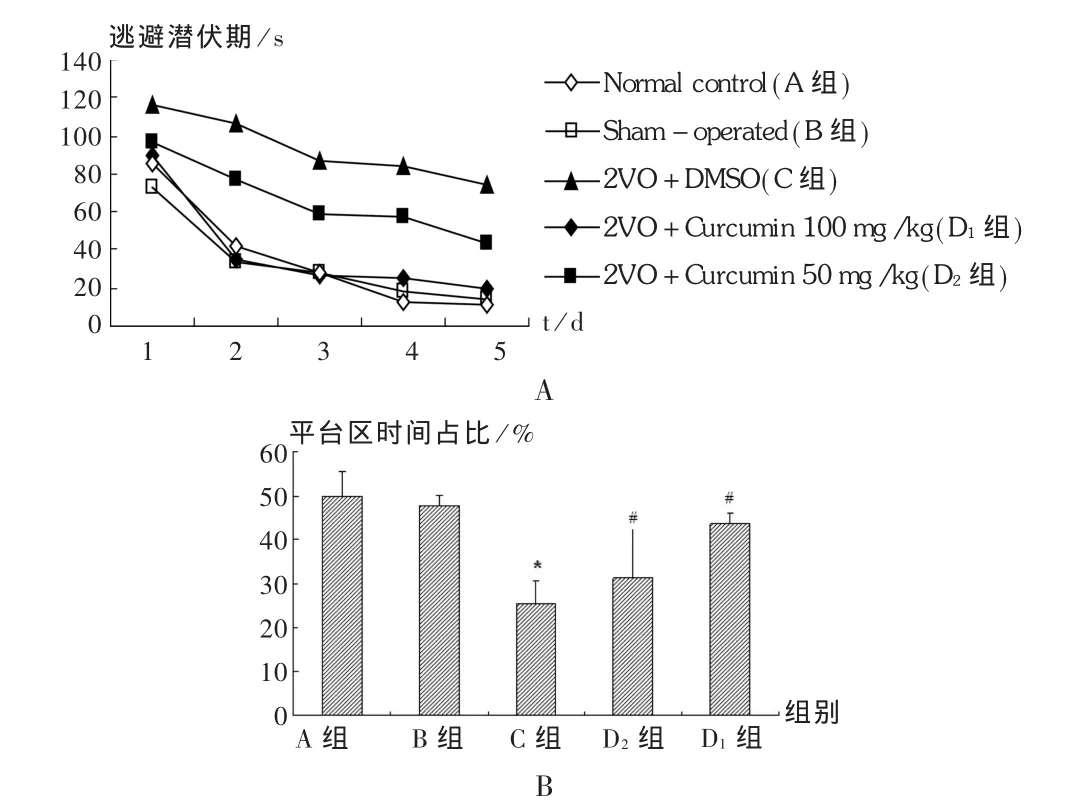
圖1 姜黃素對術后大鼠空間學習和記憶能力的影響
2.2 形態學檢測
慢性腦缺血動物模型建立后,與A組和B組比較,HE染色顯示海馬CA1區大量壞死或凋亡的神經元,錐體細胞也明顯丟失,細胞排列紊亂,極為不規則,可見細胞核大量皺縮,膠質細胞也明顯增生(圖2),尼氏染色顯示尼氏小體明顯丟失(圖3);而姜黃素處理后,海馬CA1區的異常形態學改變得到明顯改善,壞死及凋亡的神經元明顯減少,細胞排列規整,細胞核形態正常,膠質細胞數量明顯減少,健存的神經元和尼氏小體數量也較多,形態完整。
2.3 Western-Blot法檢測
結果見圖4和圖5。與A組和 B組比較,慢性腦缺血大鼠模型建立后,海馬組織內cyto C和caspase-3蛋白的表達水平都顯著升高(P<0.05);經不同劑量的姜黃素處理28 d后,海馬組織中cyto C和caspase-3蛋白的表達水平明顯受到抑制,且抑制作用隨姜黃素的劑量增加而增強,呈濃度依賴性(P<0.05)。
3 討論
細胞凋亡作為基本的生命現象,在維持機體自身穩定中起著重要作用,現階段對其的研究已涉及到生命科學的各個領域,具有十分重要的生物學意義。眾所周知,半胱氨酸蛋白酶家族(caspases)是特異性凋亡信號轉導分子,它的激活被認為是凋亡發生機制中最關鍵的環節之一。caspase酶原本身沒有活性,必須通過活化才能導致細胞凋亡。線粒體依賴途徑則是激活 caspase的主要途徑:當受到細胞凋亡信號刺激時,線粒體釋放細胞色素C(cytochrome c,Cyto C)至細胞漿中;Cyto C與細胞內存在的一種凋亡細胞蛋白酶激活因子(apoptosis protease activating factor-1,apaf-1)結合,在dATP存在的條件下,發揮其促使細胞凋亡的作用。參與凋亡的caspases包括兩類:一類是凋亡啟動組,包括caspase-2,8,9,10等;凋亡執行組,包括 caspase-3,6,7等。其中caspase-3是最重要的凋亡執行者之一,參與凋亡途徑的最后執行階段,完成致命性的DNA斷裂,直接參與凋亡形態學和生化特征的形成。
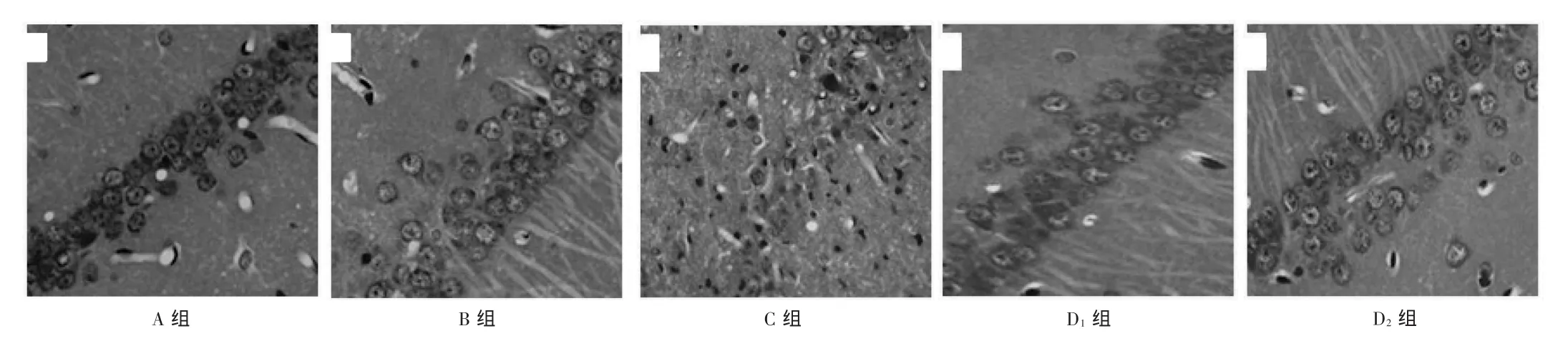
圖2 姜黃素對受損海馬CA1區錐體層細胞形態學變化的影響(HE染色)

圖3 姜黃素對受損海馬CA1區錐體層細胞形態學變化的影響(尼氏染色)
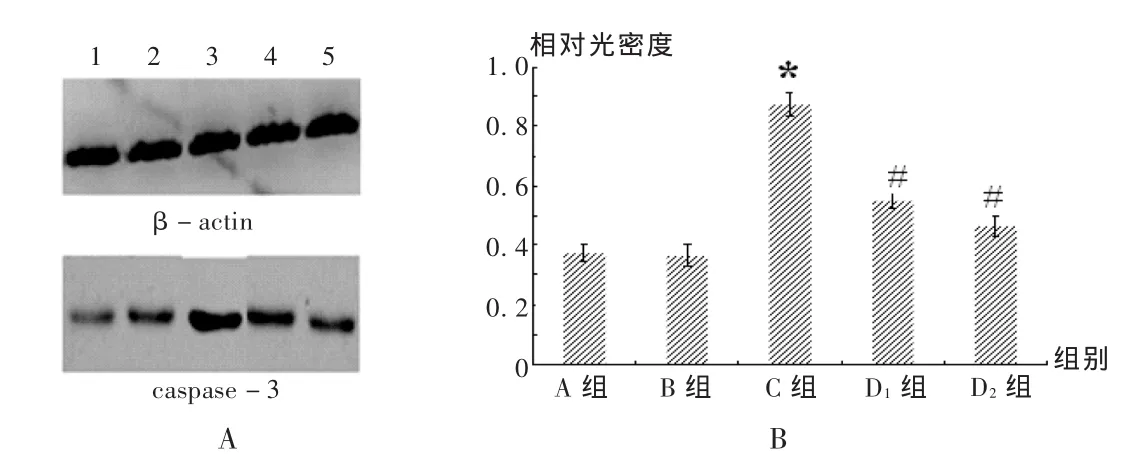
圖4 姜黃素對受損大鼠海馬組織內cyto C蛋白表達水平的影響
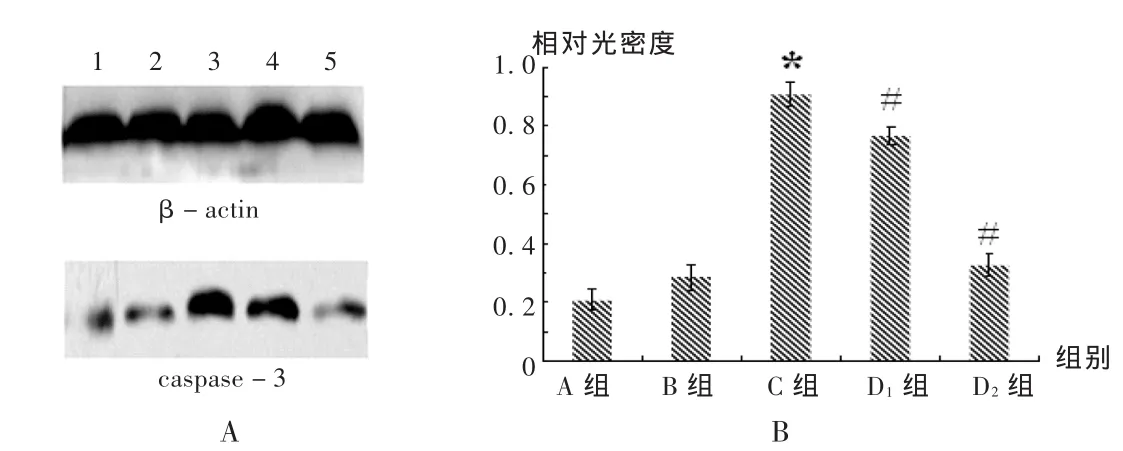
圖5 姜黃素對受損大鼠海馬組織內caspase-3的影響
VD是老年性癡呆的常見類型,且往往合并阿爾茨海默病(AD),VD的存在可加重AD患者的病情。從對VD的治療和預防角度而言,對VD的研究要比AD更有實際價值和意義,故目前許多國內外學者將研究重點轉移到VD上來。各種腦血管疾病誘發的腦血流灌注不足是引起VD發生的主要原因。由于腦灌注不足且不能及時恢復正常,導致腦血流量減少,引起腦組織中葡萄糖、活性氧及其他代謝產物的量出現異常,從而造成缺血區域神經元的死亡。在各種實驗性腦缺血動物模型中已經證實,凋亡是缺血后神經細胞死亡的主要形式。因此,抑制與細胞凋亡相關的caspases活性,可能對于治療VD有很高的現實意義和社會價值。
本研究中,采用永久性結扎大鼠雙側頸總動脈的方法來建立慢性腦缺血動物模型。Tsuchiya等[9]的研究顯示,采用該方法2.5 h后,大鼠腦血流量立即銳減25% ~87%,1周后由于大鼠腦血管交通支的建立以及其代償功能,腦血流量又恢復到術前正常時的60% ~75%,并長期維持在這一水平。因此,采用該方法建立的模型更接近人類患病的情況,可將其用于研究因慢性腦缺血導致VD的發病機制和相關治療藥物的篩選。
姜黃素作為咖喱、食品添加劑及傳統中藥姜黃的主要活性成分,具有多種生物學效應,且毒性低、安全有效,開發前景廣闊,備受國內外醫學界的密切關注。Jing等[10]發現,姜黃素對局部以及全腦的缺血腦組織均有保護作用。Zhao等[11]發現,在急性缺血-再灌注的大鼠模型中,姜黃素可通過抑制細胞凋亡而發揮腦保護作用。然而,關于姜黃素對慢性腦缺血的保護作用及其機制卻尚未見報道。
本研究中通過腹腔注射不同劑量的姜黃素以觀察其對慢性腦缺血-再灌注大鼠模型的作用,結果顯示,與DMSO處理組大鼠比較,姜黃素處理后能明顯縮短大鼠逃避潛伏期,延長大鼠在原平臺所在象限的停留時間,且這種效應隨著姜黃素濃度的增加而逐漸提高,表明姜黃素能明顯改善模型大鼠的空間學習和記憶能力。形態學檢測HE染色及尼氏染色結果也顯示,姜黃素能明顯減輕模型大鼠海馬CA1區組織中異常的形態學變化,提示姜黃素對慢性腦缺血誘發的腦損傷也有神經保護作用。進一步的研究結果顯示,姜黃素能降低海馬組織中凋亡激活通路中重要的因子cyto C和凋亡執行的重要因子capsase-3蛋白表達的水平,且呈劑量依賴效應。
綜上所述,姜黃素對慢性腦缺血導致的VD也具有腦保護作用,而抑制 cyto C和caspase-3的表達,抗缺血后神經元的凋亡可能是其保護作用機制之一。由于姜黃素還具有多方面的藥理學作用,其抗凋亡機制仍需進一步的研究。
[1]Liu H,Zhang J.Cerebral hypoperfusion and cognitive impairment:the pathogenic role of vascular oxidative stress[J].Int J Neurosci,2012,122(9):494-499.
[2]Zhang LM,Jiang CX,Liu DW.Hydrogen sulfide attenuates neuronal injury induced by vascular dementia via inhibiting apoptosis in rats[J].Neurochem Res,2009,34(11):1 984-1 992.
[3]Ueki M,Ueno M,Morishita J,et al.Curcumin ameliorates cisplatin-induced nephrotoxicity by inhibiting renal inflammation in mice[J].J Biosci Bioeng,2013,11(5):547-551.
[4]Yang Y,Duan W,Liang Z,et al.Curcumin attenuates endothelial cell oxidative stress injury through Notch signaling inhibition[J].Cell Signal, 2013,25(3):615-629.
[5]于長秀姜黃素對人食管癌細胞株Eca-109增殖抑制和凋亡誘導的實驗研究.[J].中國藥業,2007,16(15):3-4.
[6]Araújo CC,Leon LL.Biological activities of Curcuma longa L[J].Mem Inst Oswaldo Cruz,2001,96(5):723-728.
[7]Liu HX,Zhang JJ,Zheng P,et al.Altered expression of MAP-2,GAP-43,and synaptophysin in the hippocampus of rats with chronic cerebral hypoperfusion correlates with cognitive impairment[J].Brain Res Mol Brain Res,2005,139(1):169-177.
[8]Deven BD,Goad EH,Petri HL.Dissociation of hippocampal and striatal contributions to spatial navigation in the water maze[J].Neurobiol Learn Mem,1996,66(3):305-323.
[9]Tsuchiya M,Sako K,Yura S,et al.Local cerebral glucose utilisation following acute and chronic bilateral carotid artery ligation in Wistar rats:relation to changes in local cerebral blood flow[J].Exp Brain Res,1993,95(1):1-7.
[10]Jing J,Wang W,Sun YJ,et al.Neuroprotective effect of curcumin on focal cerebral ischemia rats by preventing blood-brain barrier damage[J].Eur J Pharmacol,2007,561(1-3):54-62.
[11]Zhao J,Yu S,Zheng W,et al.Curcumin improves outcomes and attenuates focal cerebral ischemia injury via antiapoptotic mechanisms in rats[J].Neurochem Res,2010,35(3):374-379.
Protective Effects of Curcumin on Brain Injury Induced by Chronic Cerebral Ischemia in Rats and Its M olecular M echanism
Yang Liu,Zhang Min,He Xi,Zhu Jie,Wang Jinping,Meng Tao
(Department of Neurology,Chongqing Emergency Medical Center,Chongqing,China 400014)
Objective To observe the effects of curcumin on the expression of cytochrome C and caspase-3 protein in the hippocampus tissue after ischemia,and to explore the potential mechanism for curcumin playing its neuroprotection role.M ethods 50 Sprague-Dawley rats were randomly divided into the sham-operation group(Sham),normal control group,bilateral common carotid occlusion(2VO)+ dimethyl sulfoxide(DMSO)intervention control group,curcumin high dose group(100 mg/kg)and curcumin low dose group(50 mg/kg).All treatment groups were intraperitoneally injected by curcumin with in 24 h after operation for consecutive 28 d.Each group was performed the Morris water maze test for detecting the spatial learning and memory ability after medication.Then the rats were killed and the pathological morphological changes of hippocampus were observed by the hematoxylin and eosin(HE) staining and Nissl staining.Western-Blot was used to detect the expression of cytochrome C and caspase-3 in the hippocampus tissue.Results Compared to the various control groups,curcumin significantly enhanced the spatial learning and memory ability in the chronic ischemic rats and obviously alleviated the apoptosis of nerve cells.The Western-Blot detection showed that curcumin significantly decreased the expression levels of cytochrome C and caspase-3 protein in the hippocampus tissue(P<0.05).Conclusion Curcumin has obviously neuroprotective effect on the brain injury induced by chronic cerebral ischemia,its mechanism could be that curcumin might inhibit caspase-3 protein expression through cytochrome C pathway.
curcumin;chronic cerebral ischemia;cytochrome C;cell apoptosis
R285.5;R282.71
A
1006-4931(2015)04-0031-04
楊柳(1979-),碩士研究生,主治醫師,主要從事神經內科工作,(電話)023-63692355;張敏,大學本科,主任醫師,主要從事神經內科工作,(電話)023-63692353。
2014-03-20;
2014-09-26)

