激活Sonic hedgehog通路改善1型糖尿病小鼠內皮祖細胞功能
覃 媛,何艷華,張根水,張貴平,羅健東
(廣州醫科大學藥學院1.蛇毒研究所、2.藥理學教研室,廣東廣州 510182)
激活Sonic hedgehog通路改善1型糖尿病小鼠內皮祖細胞功能
覃 媛1,何艷華1,張根水2,張貴平2,羅健東2
(廣州醫科大學藥學院1.蛇毒研究所、2.藥理學教研室,廣東廣州 510182)
中國圖書分類號:R-332;R329.24;R329.25;R364.3;R587.1
摘要:目的 研究激活Sonic hedgehog通路對1型糖尿病小鼠內皮祖細胞(EPCs)生物學功能的影響。方法 用鏈脲佐菌素(STZ)誘導建立1型糖尿病小鼠模型;采用密度梯度離心法分離并培養糖尿病小鼠骨髓EPCs;體外給予Sonic hedgehog(Shh)信號通路配體蛋白Shh和受體激動劑SAG,通過MTT法、改良Boyden小室、Matrigel和β-半乳糖苷酶分別檢測各組EPCs的增殖、遷移、小管形成和衰老的功能性指標。結果 1型糖尿病小鼠EPCs與正常對照組相比功能明顯下降,體外給予Shh蛋白和受體激動劑SAG,可促進糖尿病EPCs增殖,減少衰老,改善遷移和小管形成能力。結論體外激活Sonic hedgehog通路可以改善1型糖尿病小鼠內皮祖細胞受損的功能。
關鍵詞:內皮祖細胞;1型糖尿病;Sonic hedgehog信號通路;增殖;遷移;小管形成;衰老
網絡出版時間:2015-7-22 10:42 網絡出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150727.0901.011.html
內皮祖細胞(endothelial progenitor cells,EPCs)是能定向分化為血管內皮細胞的前體細胞。大量研究表明,EPCs不僅參與胚胎時期的血管生成,在出生后的血管內皮損傷后的修復和血管新生中都起著重要作用。近來的一些臨床前和臨床研究報道在四肢和心肌的缺血疾病中,給予EPCs治療可以促進組織的血管再生[1-2]。然而研究發現,無論1型還是2型糖尿病患者均存在EPCs數量減少,增殖能力、黏附能力和血管形成能力的下降,EPCs功能及數量的改變在糖尿病并發癥的發生發展過程中起著重要作用[3-4]。因此,增加糖尿病患者EPCs數量和改善其功能對于糖尿病血管并發癥的預防和治療具有重要意義。
Hedgehog信號通路在胚胎發育期調節細胞的分化、組織的形成和器官的發生,在出生后及成年期可維護組織的穩態及受損后的修復及再生[5-6]。許多的研究表明[7-8],Sonic hedgehog(Shh)信號通路可以促進多種組織中血管的生長,缺血損傷時激活Shh通路可促進血管新生的生成過程。我們之前的研究證實,在1型糖尿病小鼠心肌梗死模型中,給予Shh信號通路受體激動劑SAG,能增加梗死周邊區心肌組織毛細血管密度,明顯改善心肌梗死后的心臟功能[9]。那么Shh通路促進糖尿病血管新生的機制是否與EPCs有關,尚未見相關報道。
因此,本實驗觀察了激活Shh信號通路對糖尿病EPCs增殖、遷移和小管形成等多種功能的影響,旨在探討Shh信號通路對糖尿病EPCs的影響,闡明其促進糖尿病血管新生的機制。
1 材料
1.1動物 C57/B6♂小鼠為SPF級,體質量20~23 g,購于廣東省醫學實驗動物中心。
1.2藥品與試劑 DiI-acLDL購自美國Molecular Probe公司;鏈脲佐菌素(STZ)、FITC-UEA-1、淋巴細胞分離液購自美國Sigma公司;EGM-2培養基購自Lonza公司;Sonic hedgehog信號通路Smo受體激動劑SAG購自于美國Merck公司;Shh重組蛋白購自R&D公司。
2 方法
2.1建立1型糖尿病小鼠模型 取7~8周的C57/B6♂小鼠,腹腔注射溶于無菌枸櫞酸緩沖液(pH 4.5,0.05 mmol·L-1枸櫞酸鈉)的STZ,劑量為45 mg·kg-1。正常對照組給予等量的檸檬酸緩沖液,連續給藥5 d。1周后取尾部靜脈血,用強生穩豪型血糖分析儀,血糖高于280 g·L-1者,確認為糖尿病小鼠模型。
2.2骨髓EPCs的分離培養和鑒定 成年小鼠經脫頸致死后,無菌解剖分離四肢長骨,生理鹽水沖洗骨髓腔,收集細胞。取15 mL離心管,加入淋巴細胞分離液5 mL,將細胞懸液小心加至分離液面上層,2 000 r·min-1離心30 min。吸取中間白色云霧狀層細胞,PBS洗滌2次。用含5%FBS的EGM-2培養基調整細胞密度,以1×109·L-1的密度接種于包有纖連蛋白的培養皿中,置37℃、5%CO2培養箱內培養,取培養7 d的貼壁細胞進行后續實驗。
取培養d 7原代EPCs,在培養液中加入DiI-acLDL(2.4 mg·L-1),37℃孵育4 h,用冰冷的75%乙醇固定10 min。加入FITC-UEA-1(10 mg· L-1),室溫暗處孵育1 h。PBS洗滌后,在熒光顯微鏡下觀察。
2.3EPCs增殖實驗 糖尿病和對照小鼠的EPCs加入96孔板,5%CO2、37℃孵育,至細胞單層鋪滿孔底,加入2 mg·L-1Shh重組蛋白和500 nmol· L-1激動劑SAG,每組設6個復孔。5%CO2、37℃孵育48 h。每孔加入20 μL MTT溶液(5 g·L-1),繼續培養4 h。終止培養,小心吸去孔內培養液。每孔加入150 μL二甲基亞砜,置搖床上低速振蕩10 min,使結晶物充分溶解。在酶聯免疫檢測儀OD 570 nm處測量各孔的吸光值。
2.4EPCs遷移實驗 采用改良的Boyden小室法觀察細胞遷移情況,用胰蛋白酶消化收集培養的小鼠骨髓EPCs。用EBM培養液制成單個細胞懸液,100 μL (2×108·L-1)的細胞懸液加入孔徑為5 μm的Tran-swell小室的上室,下室加入10%FBS的1640培養基,加入2 mg·L-1Shh重組蛋白和500 nmol·L-1的SAG。置于37℃、5%CO2培養箱中培養,16 h后用棉簽擦拭Transwell小室內膜上面未遷移的細胞,100%甲醇固定,0.1%結晶紫染色,在200倍光學顯微鏡下隨機選取5個視野計數遷移的細胞數。
2.5EPCs小管形成實驗 在冰上用Matrigel包被24孔培養板,置于培養箱內使Matrigel聚合30 min。用EGM培養液制成單個細胞懸液,每孔加入500 μL細胞懸液,輕拍使細胞分布均勻,加入2 mg· L-1的Shh重組蛋白和500 nmol·L-1的SAG,37℃、5%CO2培養16 h。顯微鏡下觀察并拍照,選取5個視野計數小管長度。
2.6EPCs衰老實驗 采用β-半乳糖苷酶染色試劑盒檢測細胞衰老。取培養的正常和糖尿病小鼠EPCs,用EBM培養液制成單個細胞懸液,等量接種24孔板,EGM培養鋪滿后,換無血清EBM培養48 h。加入β-半乳糖苷酶染色固定液,室溫固定15 min。每孔加入1 mL染色工作液,37℃孵育過夜,顯微鏡下拍照,選取5個視野計數。
3 結果
3.1EPCs分離與培養 新鮮分離的單個核細胞呈圓形。d 4起,細胞逐漸拉長,呈梭形生長。d 7時貼壁細胞生長旺盛,多處可見呈“集落”樣放射狀生長,集落中央細胞圓形,由中央向外周伸展出梭形細胞,細胞呈紡錘形,近似單層生長。培養14 d左右,細胞呈鵝卵石樣改變,融合成鋪路石樣內皮細胞單層(Fig 1A)。EPCs的DiI-acLDL和FITC-UEA-1雙染法鑒定,顯示紅色熒光的為ac-LDL陽性,顯示綠色熒光為UEA-1陽性,顯示雙熒光陽性(橙黃色)的細胞則認為是EPCs,其比例占貼壁細胞總數的80%以上,證實絕大多數貼壁細胞為EPCs(Fig 1B)。
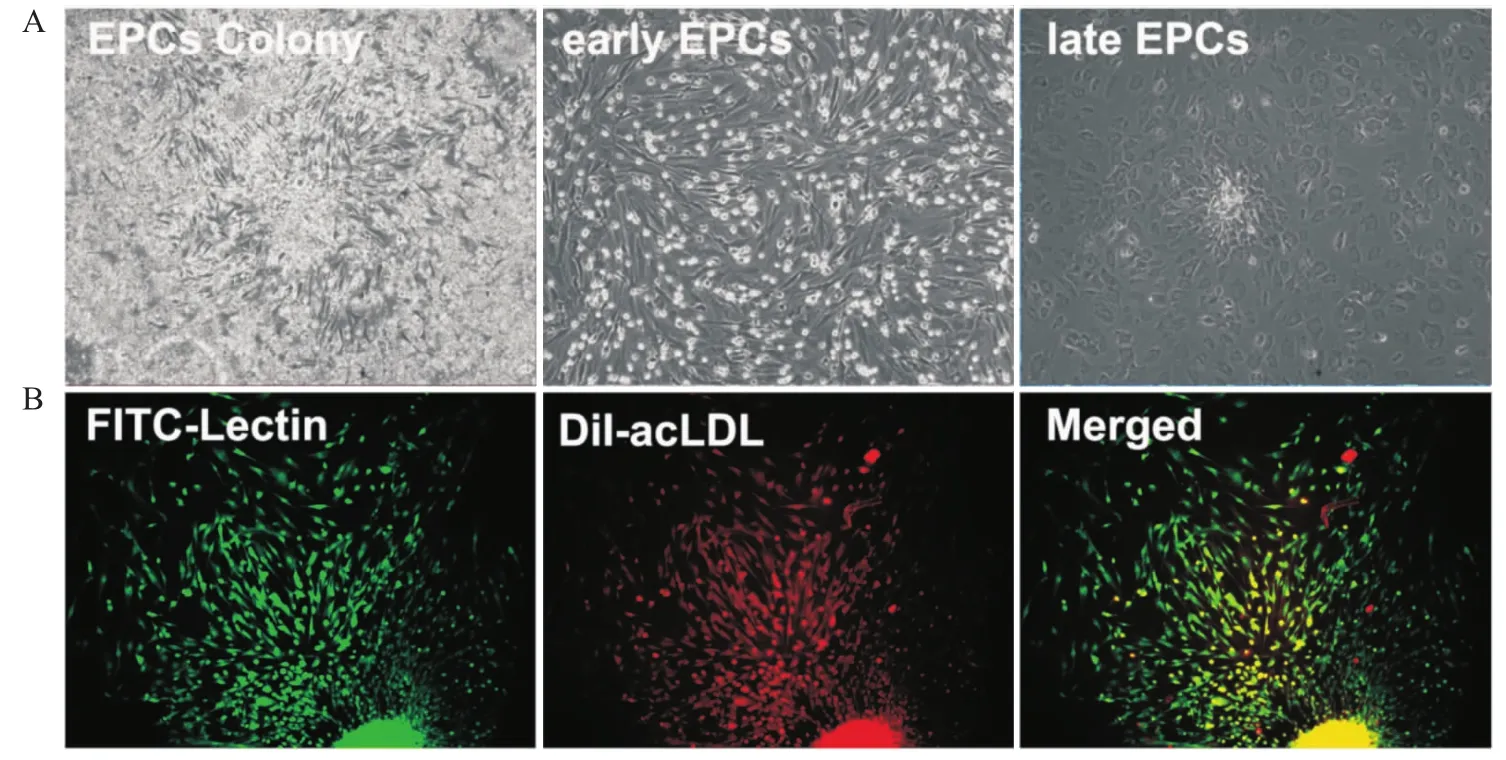
Fig 1 Characteristics of EPCs derived from bone marrow
3.2激活Sonic hedgehog通路增強1型糖尿病小鼠EPCs增殖能力 用MTT法檢測細胞增殖能力,結果如Fig 2所示,糖尿病小鼠EPCs比正常對照組EPCs增殖能力明顯減弱(P<0.05)。當給予Shh通路Shh重組蛋白和激動劑SAG,糖尿病小鼠EPCs增殖能力明顯增強加(P<0.05)。
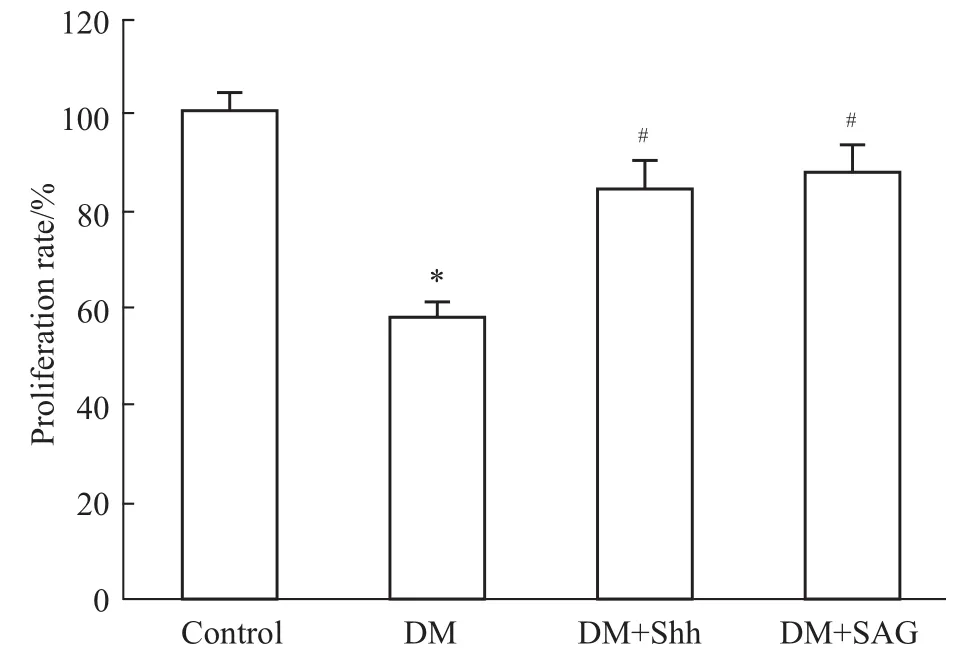
Fig 2 Activating Sonic hedgehog pathway can increase EPCs proliferation in type 1 diabetes(n=4)
3.3激活Sonic hedgehog通路改善1型糖尿病小鼠EPCs遷移能力 用Transwell小室檢測EPCs的遷移能力,計數遷移至膜下表面的細胞數。如Fig 3所示,糖尿病小鼠骨髓培養的EPCs比正常對照組小鼠EPCs遷移能力明顯下降(P<0.05)。當給予Shh通路Shh重組蛋白和Sonic hedgehog激動劑SAG,糖尿病小鼠EPCs細胞遷移數量明顯增加(P
<0.05)。
3.4激活Sonic hedgehog通路促進1型糖尿病小鼠EPCs小管形成 體外成血管實驗顯示,EPCs具有體外成血管能力,種植于Matrigel上的細胞首尾相連成條索狀,形成血管網樣結構。糖尿病小鼠骨髓培養的EPCs比正常對照組小管形成明顯減少(P <0.05)。當給予Shh重組蛋白和激動劑SAG,糖尿病小鼠EPCs形成的血管樣結構管腔明顯增長(P <0.05)(Fig 4)。
3.5激活Sonic hedgehog通路減少1型糖尿病小鼠EPCs衰老 采用β-半乳糖苷酶法檢測EPCs衰老,染為藍色的即為衰老細胞。結果如Fig 5所示,糖尿病小鼠骨髓培養的EPCs比正常對照組小鼠EPCs衰老明顯增多(P<0.05)。給予Shh通路Shh重組蛋白和Shh激動劑SAG,糖尿病小鼠EPCs衰老細胞數量明顯減少(P<0.05)。
4 討論
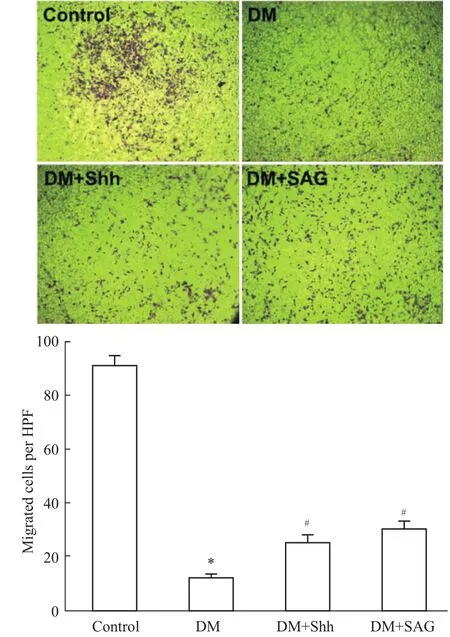
Fig 3 Activating Sonic hedgehog pathway can impove migratory ability of EPCs in type 1 diabetes(n=4)
隨著經濟高速發展和生活方式的快速轉變,糖尿病在中國不僅發病率高,而且處于快速增長階段。最近的調查表明,目前我國糖尿病患者已有9千多萬,準糖尿病患者達1億4千多萬[10]。代謝紊亂導致的糖尿病血管并發癥是糖尿病患者致死、致殘的主要原因。如何有效預防和治療糖尿病血管并發癥的發生與發展,成為亟待解決的問題。
1997年,Asahara等[11]首次發現成人外周血中CD34+細胞能在體外增殖分化為內皮細胞,并命名為內皮祖細胞。1998年,Shi等[12]報道骨髓來源的CD34+細胞亞群可動員入血,并分化為內皮樣細胞。由于EPCs的數量極其稀少,純化困難,體外培養周期短,成功分離培養EPCs成為科研人員研究EPCs的一個難點。我們通過腹腔小劑量注射STZ誘導了1型糖尿病小鼠模型,并經過不同的實驗方法,終于通過密度梯度離心法分離骨髓單個核細胞,在體外經EGM培養基培養,成功分離培養出糖尿病小鼠骨髓EPCs。
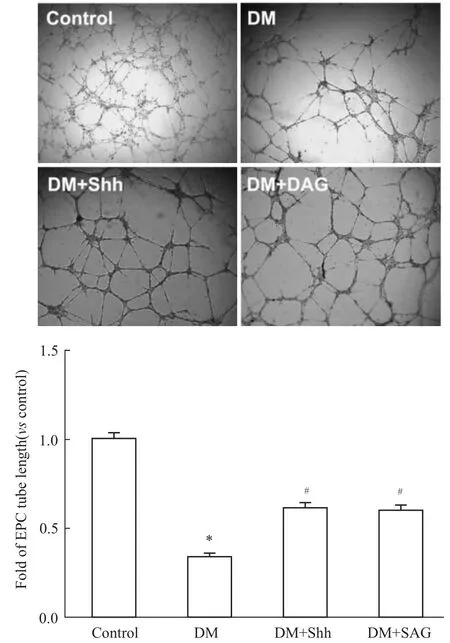
Fig 4 Activating Sonic hedgehog pathway can increase EPCs tube formation in type 1 diabetes(n=4)
EPCs具有增殖、遷移能力,并能摻入受損的血管,參與血管的修復和新生。我們首先檢測了培養的1型糖尿病小鼠EPCs的這些功能。結果顯示,糖尿病小鼠EPCs與正常對照相比,增殖能力減弱,遷移明顯下降,小管形成能力明顯下降,細胞衰老明顯增多,這與之前的研究結果相一致。而當我們將1型糖尿病小鼠EPCs給予Sonic hedgehog蛋白和Smo受體激動劑SAG時,發現糖尿病小鼠EPCs增殖能力增強,遷移數量增多,小管形成能力明顯增強,而且細胞衰老減少。這些結果表明激活Sonic hedgehog通路可以明顯改善糖尿病小鼠EPCs的功能。
糖尿病患者的外周循環EPCs數量比非糖尿病者的明顯減少,這種減少在1型和2型糖尿病患者都被報道[13-14]。Loomans等[15]報道1型糖尿病患者外周血中EPCs數目比正常對照平均降低44%,而且EPCs數目減少的程度與HbA1C的水平呈正相關。我們的研究結果證實1型糖尿病小鼠EPCs增殖能力減弱,且衰老增多,這些都會導致EPCs數量減少。而激活Sonic hedgehog既可促進糖尿病EPCs的增殖,也減少EPCs的衰老,這都可以增加循環EPCs的數量。Fu等[16]報道Sonic hedgehog蛋白通過PI3K/Akt信號通路促進正常EPCs增殖和遷移。而Sonic hedgehog是否通過PI3K/Akt通路促進糖尿病EPCs的增殖,有待進一步研究。
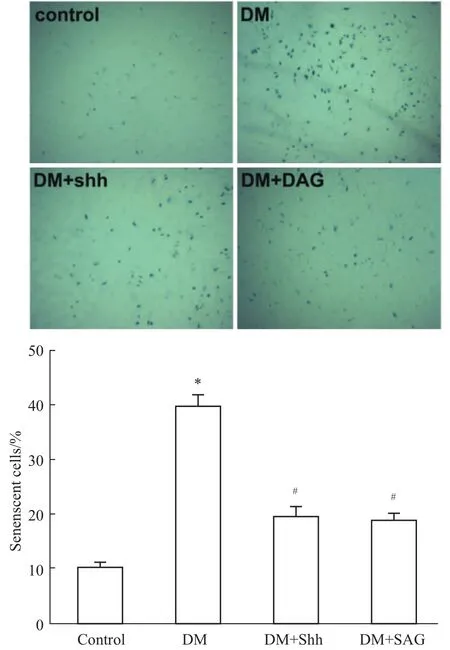
Fig 5 Activating Sonic hedgehog pathway can decrease EPCs senescence in type 1 diabetes(×40,n=4)
EPCs的遷移能力對其參與血管新生具有重要意義。在血管損傷或組織缺血的情況下,存在于骨髓中的EPCs可以動員并特異性地歸巢于損傷或缺血部位,參與血管的修復和新生。我們的實驗發現,Sonic hedgehog可以促進糖尿病EPCs的遷移。研究表明CXCR4在EPCs表面高度表達,SDF-1通過與CXCR4結合,促進EPCs的遷移和歸巢[17]。而CX-CR4是Sonic hedgehog經典通路的靶基因,Sonic hedgehog可能通過調節CXCR4的表達而促進EPCs的趨化遷移。
EPCs成血管能力的強弱直接關系著血管的自身修復和新生血管的形成。EPCs的成血管能力主要受細胞增殖、黏附及遷移等多種因素的影響。本研究證實激活Sonic hedgehog通路可使糖尿病小鼠EPCs的增殖及遷移能力增強,這都有助于EPCs的體外成血管能力。
本實驗通過給予Sonic hedgehog通路配體蛋白和激動劑,首次證實了激活Shh通路可以促進1型糖尿病小鼠EPCs的增殖,改善其受損的遷移和小管形成能力。激活Sonic hedgehog通路可通過改善1型糖尿病EPCs功能,促進組織的血管修復和新生,恢復缺血組織的功能,為糖尿病血管并發癥的治療提供了新的作用靶點和理論基礎。有關Sonic hedgehog作用于糖尿病EPCs的具體分子生物學機制,尚需進一步的研究和探討。
參考文獻:
[1] Balaji S,King A,Crombleholme T M,et al.The role of endothelial progenitor cells in postnatal vasculogenesis:implications for thera-peutic neovascularization and wound healing[J].Adv Wound Care (New Rochelle),2013,2(6):283-95.
[2] Chen S Y,Wang F,Yan X Y,et al.Autologous transplantation of EPCs encoding FGF1 gene promotes neovascularization in a por-cine model of chronic myocardial ischemia[J].Int J Cardiol,2009,135(2):223-32.
[3] Oikonomou D,Kopf S,von Bauer R,et al.Influence of insulin and glargine on outgrowth and number of circulating endothelial pro-genitor cells in type 2 diabetes patients:a partially double-blind,randomized,three-arm unicenter study[J].Cardiovasc Diabetol,2014,13:137.
[4] 鄧亞萍,趙 婷,倪 敏,等.eNOS:糖尿病內皮祖細胞功能失調的一個關鍵因素[J].中國藥理學通報,2012,28(7):901-3.
[4] Deng Y P,Zhao T,Ni M,et al.eNOS:a key factor behind the dysfunction of endothelial progenitor cells in diabetes mellitus[J].Chin Pharmacol Bull,2012,28(7):901-3.
[5] Hui C C,Angers S.Gli proteins in development and disease[J].Annu Rev Cell Dev Biol,2011,27:513-37.
[6] Petrova R,Joyner A L.Roles for Hedgehog signaling in adult organ homeostasis and repair[J].Development,2014,141(18):3445 -57.
[7] Renault M A,Roncalli J,Tongers J,et al.The Hedgehog tran-scription factor Gli3 modulates angiogenesis[J].Circ Res,2009,105(8):818-26.
[8] Yao Q,Renault M A,Chapouly C,et al.Sonic hedgehog mediates a novel pathway of PDGF-BB-dependent vessel maturation[J].Blood,2014,123(15):2429-37.
[9] Xiao Q,Hou N,Wang Y P,et al.Impaired sonic hedgehog path-way contributes to cardiac dysfunction in type 1 diabetic mice with myocardial infarction[J].Cardiovasc Res,2012,95(4):507-16.
[10]Yang W,Zhu D,Ge J,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1090 -101.
[11]Asahara T,Murohara T,Sullivan A,et al.Isolation of putative pro-genitor endothelial cells for angiogenesis[J].Science,1997,275 (5302):964-7.
[12]Shi Q,Rafii S,Wu M H,et al.Evidence for circulating bone mar-row-derived endothelial cells[J].Blood,1998,92(2):362-7.
[13]Reinhard H,Jacobsen P K,Lajer M,et al.Multifactorial treatment increases endothelial progenitor cells in patients with type 2 diabe-tes[J].Diabetologia,2010,53(10):2129-33.
[14]Westerweel P E,Teraa M,Rafii S,et al.Impaired endothelial pro-genitor cell mobilization and dysfunctional bone marrow stroma in diabetes mellitus[J].PLoS One,2013,8(3):e60357.
[15]Loomans C J,de Koning E J,Staal F J,et al.Endothelial progeni-tor cell dysfunction:a novel concept in the pathogenesis of vascu-lar complications of type 1 diabetes[J].Diabetes,2004,53(1):195-9.
[16]Fu J R,Liu W L,Zhou J F,et al.Sonic hedgehog protein promotes bone marrow-derived endothelial progenitor cell proliferation,mi-gration and VEGF production via PI 3-kinase/Akt signaling path-ways[J].Acta Pharmacol Sin,2006,27(6):685-93.
[17]Rolland-Turner M,Goretti E,Bousquenaud M,et al.Adenosine stimulates the migration of human endothelial progenitor cells.Role of CXCR4 and microRNA-150[J].PLoS One,2013,8(1):e54135.
Activating Sonic hedgehog pathway can improve the impaired function of endothelial progenitor cells in type 1 diabetic mice
QIN Yuan1,HE Yan-hua1,ZHANG Gen-shui2,ZHANG Gui-ping2,LUO Jian-dong2
(1.Guangzhou Snake Venom Research Institute,2.Dept of Pharmacology,School of Pharmaceutical Sciences,Guangzhou Medical University,Guangzhou 510182,China)
Abstract:Aim To study the effect of activating Sonic hedgehog(Shh)pathway on the function of endothelial progenitor cells(EPCs)in type 1 diabetic mice.Methods EPCs were isolated and cultured by density gradient method from diabetic mice.The effects of Shh N-terminal peptide and agonist SAG on EPCs prolifera-tion were evaluated by using the MTT colorimetric as-say.EPCs migration was measured by Transwell meth-od.EPCs tube formation ability was estimated by Matrigel.EPCs senescence activity was determined bybook=1071,ebook=40β-galactosidase staining.Results Compared with control mice,the function of EPCs in type 1 diabetic mice was impaired.The proliferation,migration and tube formation of diabetic EPCs could be promoted by Shh peptide and agonist SAG.The senescence of dia-betic EPCs could be decreased by Shh peptide and ag- onist SAG.Conclusion Activating Shh signaling pathway can improve the impared function of diabetic EPCs in type 1 diabetic mice.
Key words:endothelial progenitor cells;type 1 diabe-tes mellitus;Sonic hedgehog pathway;proliferation;migration;tube formation;senescence
作者簡介:覃 媛(1978-),女,博士,實驗師,研究方向:心血管藥理學,Tel:020-37103277,E-mail:307842880@qq.com;何艷華(1977-),女,博士,助理研究員,研究方向:心血管藥理學,并列第一作者,E-mail:790641003@qq.com;羅健東(1961-),男,博士,教授,博士生導師,研究方向:心血管藥理學,通訊作者,E-mail:jiandongluo@hotmail.com
基金項目:國家自然科學基金資助項目(No 81173062);廣州市屬高校科研計劃項目(No 2012C205);廣州醫科大學科研項目(No 2013C2205)
收稿日期:2015-04-01,修回日期:2015-05-06
文獻標志碼:A
文章編號:1001-1978(2015)08-1066-06
doi:10.3969/j.issn.1001-1978.2015.08.008