長白山牛皮杜鵑凋落物分解及土壤動物的作用
包劍利, 殷秀琴, 李曉強
1 東北師范大學地理科學學院, 長春 130024 2 吉林省動物資源保護與利用重點實驗室, 長春 130024
長白山牛皮杜鵑凋落物分解及土壤動物的作用
包劍利1, 殷秀琴1,2,*, 李曉強1
1 東北師范大學地理科學學院, 長春 130024 2 吉林省動物資源保護與利用重點實驗室, 長春 130024
凋落物分解是生態系統養分循環的重要環節。土壤動物對凋落物分解具有重要作用。有關高山常綠小灌木凋落物分解及土壤動物作用的研究鮮有報道。采用凋落物網袋法對長白山北坡岳樺林帶(42°03′41.23″ N,128°03′12.75″ E,1900 m)牛皮杜鵑(Rhododendronchrysanthum)凋落物的分解過程進行了為期1a的野外觀測與室內試驗研究,采用4、2 mm和0.01 mm三種網孔凋落物袋來控制不同體型的土壤動物的參與,以研究凋落物的分解率、養分動態及土壤動物在凋落物分解中的作用。結果表明,4、2 mm和0.01 mm網孔凋落物分解率分別為34.19%、31.22%和25.45%。分解率表現出顯著的季節差異性。從總體上來看,網袋內凋落物的總氮含量先增后減;C/N呈下降趨勢。對分解起主要作用的優勢類群是甲螨亞目和等節跳科。土壤動物總個體數與養分元素的釋放關系顯著,中小型土壤動物對有機碳的釋放起到重要作用。截至2012年10月末試驗結束,全部土壤動物對牛皮杜鵑凋落物分解質量損失的貢獻率為25.57%,中小型土壤動物貢獻率(16.88%)> 大型土壤動物貢獻率(8.69%)。大型土壤動物和中小型土壤動物在牛皮杜鵑凋落物分解過程中所起的作用,具有不同步性。
土壤動物; 牛皮杜鵑凋落物; 養分動態; 分解作用; 岳樺林; 長白山
凋落物分解是生態系統物質循環和能量流動的主要途徑。其分解過程主要受到氣候、土壤性質、凋落物質量和土壤生物的控制[1]。土壤動物是陸地生態系統的的組分之一,對生態系統功能和穩定性具有重要的意義[2]。土壤動物通過物理粉碎、化學消化以及刺激微生物的活性和活動方式等途徑來調控分解過程[3- 10]。土壤動物在營養元素循環,尤其是N、P元素循環中具有重要作用[11]。近年來,森林凋落物分解的研究引起了國內外學者們的廣泛關注,但是對于長白山垂直植被帶凋落物的研究報道不多,尤其是對于岳樺林帶灌木優勢種牛皮杜鵑凋落物分解的研究還未見報道。本文通過野外調查及室內實驗探究長白山牛皮杜鵑(Rhododendronchrysanthum) 凋落物分解及土壤動物在凋落物分解中的作用,旨在為長白山岳樺林帶生態系統穩定及可持續發展提供土壤動物學依據。
1 研究區概況
本試驗研究區設在長白山北坡岳樺林帶(42°03′41.23″ N,128°03′12.75″ E,1900 m),其氣候主要特點為冷而多強風,具體為冬季寒冷而多風,1月平均溫度為-19—-20 ℃,夏季多雨而濕潤,7月平均溫度為10—14 ℃,年降水量為1000—1100 mm。岳樺林喬木優勢種為岳樺(Betulaermanii),灌木優勢種為牛皮杜鵑(Rhododendronchrysanthum),草本優勢種為星葉蟹甲草(Paraseneciokomarovianus)等。土壤為亞高山森林草甸土[12]。
本試驗選擇長白山北坡岳樺林帶灌木優勢種牛皮杜鵑為研究對象。牛皮杜鵑,又名高山茶,為多年生常綠灌木。在我國主要生長于長白山岳樺林帶和高山凍原帶[13- 14],葉片具有較厚的角質層,柵欄組織厚,且根系十分發達[13, 15]。牛皮杜鵑是珍稀的高山常綠花卉,目前,牛皮杜鵑處于漸危狀態,為國家三級保護植物。牛皮杜鵑對長白山國家自然保護區的水土保持與生態平衡起重要作用[15- 17]。
2 研究方法
2.1 凋落物的采集、處理和樣地布設
2011年10月在長白山岳樺林帶典型樣地采集當年牛皮杜鵑新鮮葉片,置于60 ℃溫度下烘干8 h,以模擬牛皮杜鵑凋落物自然狀態。將干重8 g的凋落物分別放入4、2 mm和0.01 mm 3種網孔(4 mm網孔是大型、中小型土壤動物和微生物共同作用;2 mm網孔是中小型土壤動物和微生物共同作用;0.01 mm網孔僅微生物作用),規格為15 cm × 20 cm的凋落物網袋中。2011年10月末將分裝好的牛皮杜鵑凋落物網袋分別擺放在事先選取的6個面積為10 m × 10 m的樣地中,上覆少許凋落物。這6個樣地條件均一,作為本試驗的6個重復樣地。
2.2 網袋凋落物樣品、土壤動物樣品的采集與處理
各網孔凋落物袋于2012年4月末、6月末、8月末和10月末分別取回,首先手撿凋落物中的大型土壤動物,然后采用Tullgren法收集中小型土壤動物。3個網孔和4個月份取樣均設6個重復。收集的土壤動物,一般鑒定到科。
分離土壤動物后的凋落物樣品在60 ℃溫度下烘至恒重,并記錄其干重,用于計算凋落物分解率。將凋落物樣品粉碎機粉碎,采用重鉻酸鉀容量法測定有機碳含量,采用Smartchem140全自動化學分析儀測定全氮和全磷含量。
2.3數據統計處理與分析
(2)凈分解率計算公式為Ln(%)=Lct-Lct(t-1),式中Ln(%)為凋落物在該段時間內的凈分解率,Lct是t時間的分解率,Lc (t-1)為截止到時間t的上一次取樣時間的分解率。

(4)對土壤動物群落特征進行分析時,主要采用Shannon-Wiener多樣性指數(H′)、Margalef豐富度指數(D)、Pielou均勻度指數(E)和Simpson優勢度指數(C)。
(6)統計分析方法:本文選用單因素方差分析(ANOVA)來研究不同網孔內的凋落物分解率之間的差異。本文選用F檢驗來研究凋落物分解率的衰減模型。為了解土壤動物與養分元素分解率之間的關系,本文采用Pearson相關系數進行相關分析。
3 研究結果
3.1 牛皮杜鵑凋落物分解率及其衰減模型
3.1.1 牛皮杜鵑凋落物分解率時間動態
經過一年的分解,4、2 mm和0.01 mm網袋內牛皮杜鵑凋落物的分解率分別為34.19%、31.22%和25.45%(圖1)。由圖可知,分解率的大小關系為:大型、中小型土壤動物和微生物共同作用 > 中小型土壤動物和微生物共同作用 > 僅微生物作用。
總體來看,各取樣月份間的凈分解率呈現明顯的季節性,即水熱條件配置良好的盛夏至初秋時節的凈分解率較高,而水熱條件配置比較差的初冬至春末夏初時節的凈分解率較低。其中 6—8月最高(圖2)。由于2012年4月是第1次取樣,數據表示的是自2011年10月—2012年4月,6個月的凈分解率,其凈分解率大致與2012年6—8月的凈分解率持平,均在10%左右,但不同網孔間存在一定差異。2012年4—6月的3種網孔中,2 mm網孔網袋內的凋落物凈分解率最高。2012年8—10月的網孔間差異最為顯著。
通過對不同網孔內的分解凈分解率、分解率進行單因素方差分析(ANOVA),結果顯示8—10月4 mm網袋與 0.01 mm網袋之間分解凈分解率差異達到了顯著水平(P<0.05),分解差異也達到了顯著水平(P<0.05)。
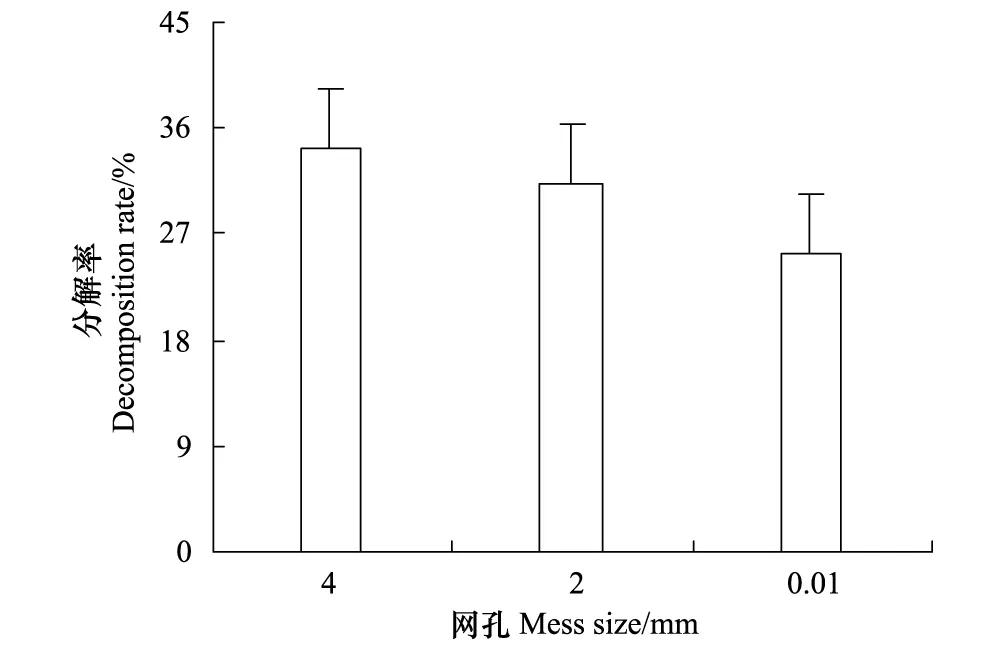
圖1 分解一年時間不同網孔牛皮杜鵑凋落物分解率
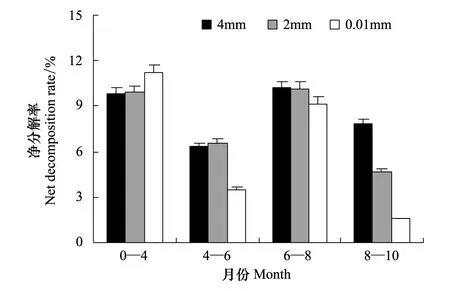
圖2 不同網孔牛皮杜鵑凋落物凈分解率時間動態
3.1.2 凋落物分解率的衰減模型
由模型可知,4 mm網孔凋落物袋內的凋落物分解最快,2 mm網孔次之,0.01 mm網孔最慢。其中4 mm網孔與2 mm網孔的分解率較為接近,而0.01 mm網孔分解率遠落后于前兩者。4 mm網孔分解常數k值為0.034是3個模型中的最大值,通過Olsen指數衰減模型可預測其凋落物分解至95%所需時間t0.95約為7a,2 mm網孔次之約為8a,而0.01 mm則約為10a。
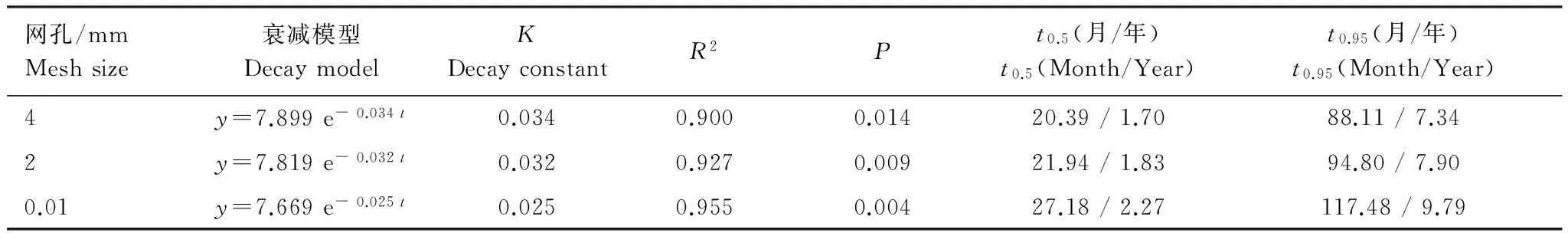
表1 凋落物殘留率(y)與分解月數(t)的指數模型及相關參數Table 1 Parameters of decay model:an exponential function of litter remaining rate and time
3.2 凋落物分解過程中養分動態
分析凋落物的分解過程中的養分動態,全氮、全磷及C/N 是關鍵性的指標。表2為長白山岳樺林帶牛皮杜鵑凋落物的初始化學性質的各參數。

表2 長白山岳樺林帶牛皮杜鵑凋落物的初始化學性質Table 2 Concentrations of different chemicals in the initial litters
不同網孔凋落物,總體上全氮含量呈現先增后減的趨勢(圖3)。8月以前各網孔凋落物的全氮含量均呈上升趨勢,8—10月,0.01 mm網孔凋落物的全氮含量持續增加,而4 mm網孔和2 mm網孔略有下降。
不同網孔凋落物的全磷含量動態變化趨勢各不相同(圖3)。4 mm網孔凋落物的全磷含量持續下降,2 mm網孔凋落物的全磷含量變化不大,比較穩定,0.01 mm網孔凋落物的全磷含量在4—6月基本保持不變,之后逐漸增加。
不同網孔凋落物的有機碳含量動態變化趨勢有較大差異(圖3)。總體而言,4 mm和2 mm網孔凋落物的有機碳含量在各月份間波動較大;0.01 mm網孔凋落物的有機碳含量相對前兩者變化不大,在8月之前持續下降,8月之后有小幅上升。

圖3 同網孔凋落物的全氮、全磷、有機碳含量及C/N、C/P時間動態
從C/N動態來看,除4 mm網孔凋落物的C/N 6月以后有小幅回升外,總體上呈現出下降趨勢,各網孔在各月間的降幅略有差異(圖3)。從C/P動態來看,除4 mm網孔呈上升趨勢外,其余網孔均近乎直線下降。具體為:4 mm網孔凋落物的C/P呈上升趨勢,各月間升幅較為接近,近乎直線上升;2 mm和0.01 mm網孔凋落物的C/P均呈現出下降趨勢,其中2 mm網袋各月間的降幅較為接近,近乎直線下降(圖3)。
3.3 凋落物分解過程中土壤動物群落特征及時間動態變化
由表3可知,試驗期間牛皮杜鵑4 mm網孔凋落物袋中共收集到土壤動物908只,24個類群,其中優勢類群為甲螨亞目和等節跳科,共占總個體數的73.02%;常見類群為革螨亞目、線蚓科、圓跳科、鱗跳科、雙翅目幼蟲、輻螨亞目、馬陸目和山跳科,共占總個體數的22.58%;稀有類群為球角跳科、石蜈蚣科、隱翅蟲科、隱翅蟲科幼蟲、疣跳亞科、纓甲科、鞘翅目幼蟲、長角跳科、蜘蛛目、盲蛛目、地蜈蚣科、葉甲科、蟻科和短角跳科,共占總個體數的4.41%。
由表3亦可知,試驗期間牛皮杜鵑2 mm網孔凋落物袋中共收集到土壤動物879只,22個類群,其中優勢類群為甲螨亞目和等節跳科,共占總個體數的60.75%;常見類群為線蚓科、革螨亞目、雙翅目幼蟲、輻螨亞目、鱗跳科、圓跳科、馬陸目、山跳科、球角跳科和纓甲科,共占總個體數的35.72%;稀有類群為隱翅蟲科、鞘翅目幼蟲、蜘蛛目、疣跳亞科、石蜈蚣科、隱翅蟲科幼蟲、鱗翅目幼蟲、瓦婁蝸牛、長角跳科和步甲科,共占總個體數的3.53%。
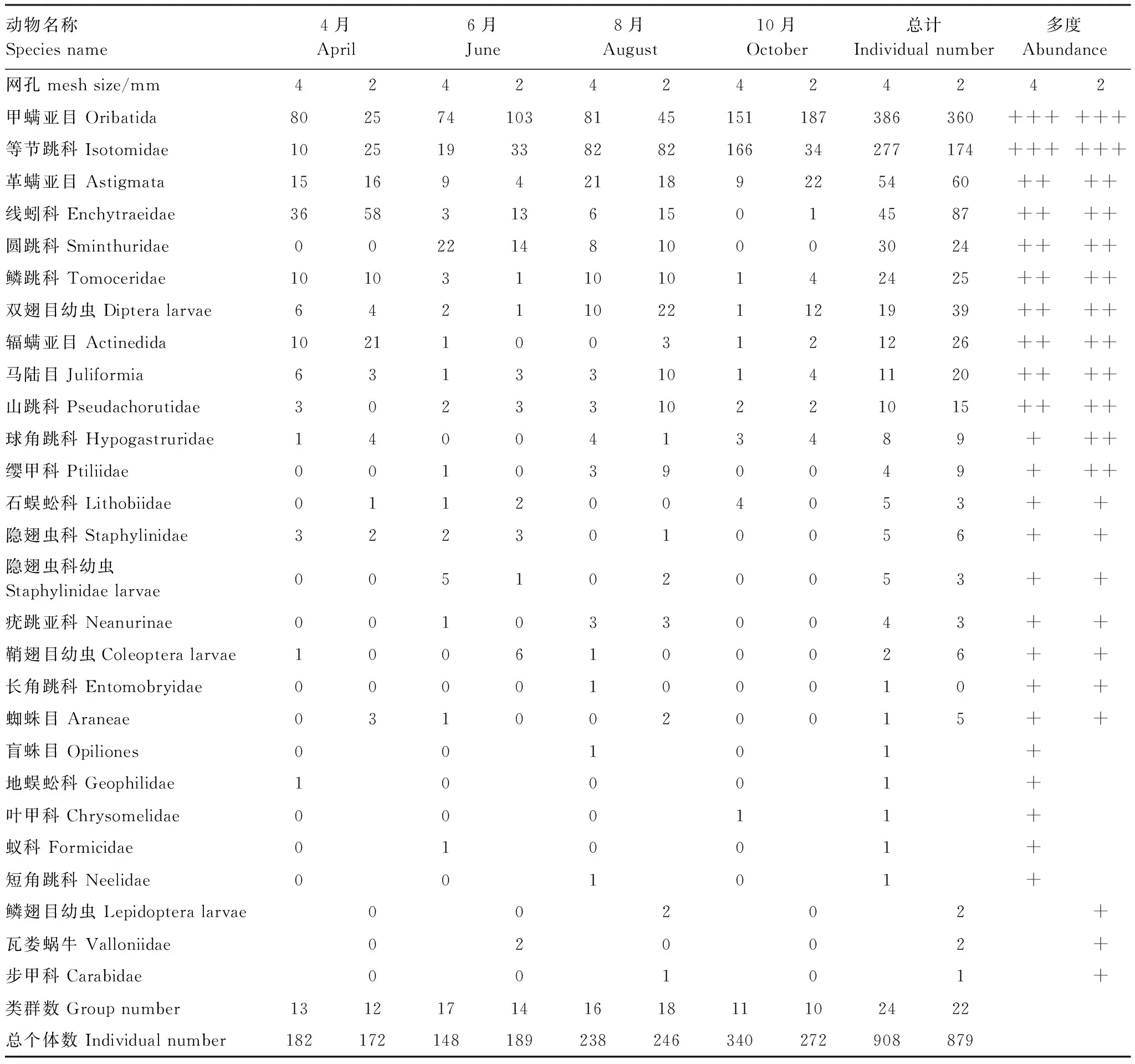
表3 4、2 mm 網孔凋落物袋主要土壤動物統計表Table 3 Dynamics of soil fauna in 4 mm litterbags and 2 mm litterbags
總體來看,4 mm和2 mm網袋土壤動物類群數比較接近,分別為24,22個類群。
從多樣性指數來看,4 mm和2 mm網孔土壤動物Shannon-Wiener多樣性指數與Pielou均勻度指數變化趨勢均相同,即先降再升,最后又下降;而前兩者與Simpson優勢度指數的變化趨勢恰好相反,即先升再降,最后又上升(圖4)。

圖4 不同網孔凋落物袋土壤動物多樣性季節動態
3.4 土壤動物在凋落物分解過程中的作用
3.4.1 對凋落物分解起主要作用的土壤動物類群
基于網孔對不同體型土壤動物的篩選和控制,對凋落物分解起主要作用的優勢類群(>10%)是甲螨亞目和等節跳科。常見類群主要有革螨亞目、線蚓科、圓跳科、鱗跳科、雙翅目幼蟲、輻螨亞目、馬陸目、山跳科、球角跳科和纓甲科(1%—10%)。
3.4.2 土壤動物對凋落物分解過程中養分元素釋放的影響
為了解土壤動物個體數和多樣性指數與養分元素分解率之間的關系,本文采用Pearson相關系數進行相關關系分析,分析結果見表4。4 mm網孔凋落物袋的土壤動物的個體數與凋落物分解過程中全氮含量的相關系數達到了顯著相關水平(P<0.05),2 mm網孔凋落物袋內的土壤動物的個體數與凋落物分解過程中全磷、有機碳含量均達到了顯著相關水平,其中與有機碳含量達到了極顯著相關水平(P<0.01)。兩種網袋的土壤動物的多樣性指數與全氮、全磷、有機碳的分解率之間的相關關系均未達到顯著水平。
表4 不同網孔凋落物袋內的土壤動物個體數、多樣性指數與分解過程中各養分元素分解率的Pearson相關分析
Table 4 Correlations between total number and diversity soil fauna & cumulative mass loss rate of nutrient elements in different-mesh-size litterbags

**: P<0.01(雙側檢驗),*: P<0.05(雙側檢驗)
3.4.3 土壤動物對凋落物分解的貢獻
如表5所示,無論是全部土壤動物,還是大型、中小型土壤動物,總體上對長白山岳樺林帶牛皮杜鵑凋落物分解的貢獻率均隨分解時間的延長呈現上升趨勢。需要特殊說明的是,分解初期,均出現了負值。具體而言,全部土壤動物的貢獻率在分解8個月之前大幅上升,分解8—10個月基本保持穩定,10—12個月再次大幅上升。大型土壤動物的貢獻率,在分解前10個月均為負值,分解10個月以后其貢獻率大幅上升。中小型土壤動物的貢獻率,分解8個月以前保持大幅上升趨勢,8—10個月之間基本保持穩定,10—12個月之間有所上升。由此可知,大型土壤動物對分解的貢獻在10個月后剛剛發揮出來,且貢獻率除初期外基本始終小于中小型土壤動物。土壤動物對凋落物分解的貢獻率基本體現在中小型土壤動物上。在8—10個月之間土壤動物的貢獻率基本保持穩定。總而言之,對于一年中牛皮杜鵑凋落物的分解的總的貢獻率,全部土壤動物為25.57%,其中,中小型土壤動物(16.88%)> 大型土壤動物為(8.69%)。
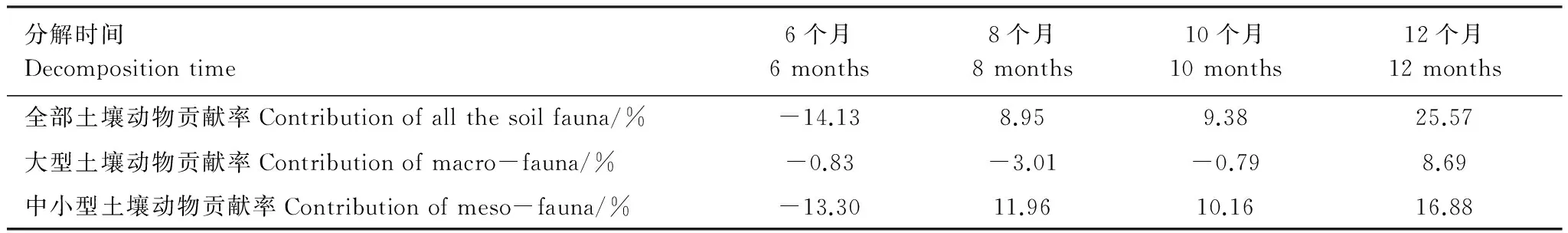
表5 土壤動物對長白山岳樺林帶牛皮杜鵑凋落物分解的貢獻率動態比較表Table 5 Dynamic contrast of contribution of soil fauna to litter decomposition
4 結論與討論
4.1 結論
(1)經過1a的分解,4、2 mm和0.01 mm網孔凋落物分解率分別為34.19%、31.22%和25.45%。凈分解率表現出顯著的季節差異性。
(2)總體上總氮含量動態,先增后減;總磷含量與有機碳含量動態,各網孔凋落物袋間差異較大;C/N時間動態,總體呈下降趨勢,各網孔在各月間的降幅略有差異;C/P時間動態,除4 mm網孔呈上升趨勢外,其余網孔均近乎直線下降。
(3)對分解起主要作用的是優勢類群甲螨亞目和等節跳科。土壤動物總個體數與養分元素的釋放關系顯著,中小型土壤動物對有機碳的釋放起到重要作用。第1年的分解過程中土壤動物對牛皮杜鵑凋落物分解的貢獻率隨分解時間的延長而增大,全部土壤動物貢獻率為25.57%,其中,中小型土壤動物貢獻率為16.88%> 大型土壤動物貢獻率為8.69%。
(4) 在干冷的冬春季節,土壤動物對凋落物分解起到了一定的抑制作用;暖濕的夏秋季節,土壤動物對分解起到了積極的促進作用。
4.2 討論
凋落物的分解率受凋落物質量、環境條件和分解者群落3個因素控制[20]。分解前6個月時期,由于一直是積雪覆蓋,溫度較低,土壤動物的個體數量和類群數較低,其牛皮杜鵑的分解率較慢,而到了8個月和10個月時,整個夏季土壤動物個體數量和類群數最多,活性較強,分解作用明顯,其牛皮杜鵑的分解率也較高,進一步證明了土壤動物與凋落葉分解率密切相關。牛皮杜鵑凋落物總氮含量動態總體上,先增后減的趨勢與劉穎等對于長白山岳樺林帶凋落物分解中養分動態變化研究中的總氮含量動態趨勢大體一致[21]。原因是兩者研究樣地均位于長白山岳樺林帶,所處環境一致;研究的物種均為岳樺林帶具有代表性的物種。因此二者的總氮含量動態趨勢大體一致。分解初期的總氮含量呈現上升趨勢,這與Berg等人的研究結論及Tripathi等對于日本東北部次生林中岳樺林矮竹灌木——菲黃竹的地上地下不同部位凋落物分解的研究結果一致,這可能與易分解組分如,水溶性物質等物質的迅速損失有關[22- 24]。
經過一年的分解,分解率的變化趨勢為:大型、中小型土壤動物和微生物共同作用 > 中小型土壤動物和微生物共同作用 > 僅微生物作用,這與小興安嶺研究結果一致[25]。經過一年的分解,土壤動物對長白山岳樺林帶牛皮杜鵑凋落物分解質量損失的貢獻率為25.57%,明顯低于楊效東等關于西雙版納熱帶季節雨林凋落葉分解過程中土壤動物群落對凋落葉物分解率的貢獻率46%[26]。這種明顯的差異可以解釋為,兩地的緯度差異導致水熱條件差異較大,進而影響了土壤動物及微生物的群落組成及其活動強度,結果貢獻率不同。本研究中中小型土壤動物貢獻率(16.88%)> 大型土壤動物貢獻率(8.69%)。而夏磊等的研究結果土壤動物的貢獻率為大型土壤動物 >中型土壤動物>微型土壤動物[27- 28],這與本研究的結果不一致,本研究中4 mm和2 mm網袋中的優勢類群均為甲螨亞目和等節跳科中小型土壤動物,進而中小型土壤動物的分解作用較大,貢獻率高。殷秀琴等研究表明土壤動物可以通過其新陳代謝活動加速凋落物—土壤動物—土壤系統中營養元素的循環速率[11]。本研究中4 mm網孔凋落物袋的土壤動物的個體數與凋落物分解過程中全氮的含量的達到了顯著相關水平(P< 0.05),2 mm網孔凋落物袋內的土壤動物的個體數與凋落物分解過程中全磷、有機碳的含量達到了顯著相關水平,其中與有機碳的含量達到了極顯著相關水平(P< 0.01),表明土壤動物在營養元素循環中具有重要意義。
[1] Dias T, Oakley S, Alarcón-Gutiérrez E, Ziarelli F, Trindade H, Martins-Lou??o M A, Sheppard l, Ostle N, Cruz C. N-driven changes in a plant community affect leaf-litter traits and may delay organic matter decomposition in a Mediterranean maquis. Soil Biology and Biochemistry, 2013, 58: 163- 171.
[2] Yin X Q, Song B, Dong W H, Xin W D, Wang Y Q. A review on the eco-geography of soil fauna in China. Journal of Geographical Sciences, 2010, 20(3): 333- 346.
[3] 林波, 劉慶, 吳彥, 何海. 森林凋落物研究進展. 生態學雜志, 2004, 23(1): 60- 64.
[4] Anderson J M, Ineson P, Huish S A. Nitrogen and cation mobilization by soil fauna feeding on leaf litter and soil organic matter from deciduous woodlands. Soil Biology and Biochemistry, 1983, 15(4): 463- 467.
[5] Byzov B A, Chernjakovskaya T F, Zenova G M, Dobrovolskaya T G. Bacterial communities associated with soil diplopods. Pedobiologia, 1996, 40(1): 67- 79.
[6] Maraun M, Scheu S. Changes in microbial biomass, respiration and nutrient status of beech (Fagussylvatica) leaf litter processed by Millipedes (Glomerismarginata). Oecologia, 1996, 107(1): 131- 140.
[7] Petersen H, Luxton M. A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos, 1982, 39(3): 288- 388.
[8] Bray J R, Gorham E. Litter Production in Forests of the World. New York: Academic Press, Inc., 1964: 101- 157.
[9] Robin L E. Production and Mineral Cycling in Terrestrial Vegetation, Transl, Scripat Technica. London: Oliver and Boyd, 1967.
[10] Edwards P J. Studies of mineral cycling in a montane rain forest in New Guinea: V. rates of cycling in throughfall and litter fall. Journal of Ecology, 1982, 70(3): 807- 827.
[11] 殷秀琴, 宋博, 邱麗麗. 紅松闊葉混交林凋落物-土壤動物-土壤系統中 N、P、K 的動態特征. 生態學報, 2007, 27(1): 128- 134.
[12] 許林書. 曹齡月. 長白山火山活動與現代土壤垂直帶譜的構成 // 長白山地理系統研究(第三輯). 長春: 東北師范大學出版社, 2010: 111- 122.
[13] 宮宇, 劉憲虎, 張春影, 李美善, 項美玲. 不同地區牛皮杜鵑葉片解剖結構比較分析. 延邊大學農學學報, 2010, 32(1): 22- 25.
[14] 涂英芳. 長白山野生觀賞植物. 北京: 中國林業出版社, 1993.
[15] 蘇家樂, 李暢, 陳璐, 劉曉青, 陳尚平, 何麗斯. 不同預處理方法對牛皮杜鵑和小葉杜鵑種子萌發的影響. 植物資源與環境學報 2011, 20(4): 64- 69.
[16] 張淑梅, 王興國, 鄭成淑, 曹麗. 長白山杜鵑花科植物資源的園林應用. 中國野生植物資源, 2001, 20(2): 34- 34.
[17] 祝廷成, 嚴仲鎧, 周守標. 中國長白山植物. 北京: 北京科學技術出版社, 2003: 495- 496.
[18] Xin W D, Yin X Q, Song B. Contribution of soil fauna to litter decomposition in Songnen sandy lands in northeastern China. Journal of Arid Environments, 2012, 77: 90- 95.
[19] Olsen J S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44(2): 322- 331.
[20] Cadish G, Giller K E. Driven by Nature: Plant Litter Quality and Decomposition. Wallingford: CAB International, 1997.
[21] 劉穎, 韓士杰, 林鹿. 長白山4種森林凋落物分解過程中養分動態變化. 東北林業大學學報, 2009, 37(8): 28- 30.
[22] Berg B. Litter decomposition and organic matter turnover in northern forest soils. Forest Ecology and Management, 2000, 133(1/2): 13- 22.
[23] Berg B, McClaugherty C, Johanasson M B. Chemical changes in decomposing plant litter can be systemized with respect to the litter’s initial chemical composition. Reports from the Departments of Forest Ecol and For Soils. Swed Univ Agric Sci, 1997, report 74.
[24] Tripathi S K, Sumida A, Shibata H, Ono K, Uemura S, Kodama Y, Hara T. Leaf litter fall and decomposition of different above- and belowground parts of birch (Betulaermanii) trees and dwarf bamboo (Sasakurilensis) shrubs in a young secondary forest in Northern Japan. Biology and Fertility of Soils, 2006, 43(2): 237- 246.
[25] 殷秀琴, 仲偉彥, 王海霞, 陳鵬. 小興安嶺森林落葉分解與土壤動物的作用. 地理研究, 2002, 21(6): 689- 699.
[26] 楊效東, 鄒曉明. 西雙版納熱帶季節雨林凋落葉分解與土壤動物群落: 兩種網孔分解袋的分解實驗比較. 植物生態學報, 2006, 30(5): 791- 801.
[27] 夏磊, 吳福忠, 楊萬勤. 季節性凍融期間土壤動物對岷江冷杉凋落葉質量損失的貢獻. 植物生態學報, 2011, 35(11): 1127- 1135.
[28] 夏磊, 吳福忠, 楊萬勤, 譚波. 川西亞高山森林凋落物分解初期土壤動物對紅樺凋落葉質量損失的貢獻. 應用生態學報, 2012, 23(2): 301- 306.
The contribution of soil fauna to litter decomposition ofRhododendronchrysanthumin the Changbai Mountains
BAO Jianli1, YIN Xiuqin1,2,*,LI Xiaoqiang1
1SchoolofGeographicalScience,NortheastNormalUniversity,Changchun130024,China2JilinProvincialKeyLaboratoryofAnimalResourceConservationandUtilization,Changchun130024,China
Decomposition of forest litter is one of the fundamental pathways for the flow of nutrients and energy in forest ecosystems and is an important component of the global carbon budget. Soil fauna plays a significant role in litter decomposition. However, the effect of soil fauna on alpine plant litter decomposition is poorly understood. In the present study, we have studied the dynamics of litter decomposition, nutrient-release, characteristics of the soil fauna community in litterbags, and the contribution of soil fauna in the process of litter decomposition ofRhododendronchrysanthumin theBetulaermaniiforest in the Changbai Mountains. Nylon litterbags (15 cm × 20 cm) with three mesh sizes (4 mm, 2 mm and 0.01 mm) were used in the experiment. Air-dried leaf litter ((8.00 ± 0.01) g) was kept in the nylon bags and these were placed on the forest floor. The remaining litterbags of each type were taken on the 6th, 8th, 10th and 12th month after field placement. Soil macrofauna were picked by hand from the litterbags (4 mm and 2 mm mesh). Subsequently, mesofauna and microfauna were collected and separated by Tullgren methods. The litter was rinsed with deionized water to remove soil particles, oven-dried at 60oC for 48 hours and weighed. Total nitrogen (TN), total carbon (TC) and total phosphorous (TP) contents were then tested. The results showed that the seasonal fluctuation and difference in decomposition rate ofRhododendronchrysanthumlitter in the three different mesh size litterbags was very obvious during the first year. At the end of the first year, the accumulated rate of loss of litter in 4 mm, 2 mm and 0.01 mm size litterbags reached 34.19%, 31.22% and 25.45%, respectively. The decomposition rate showed significant seasonal differences. In general, the concentration of N increased and then declined during litter decomposition. A downward trend was generally found in the ratio of C/N in the remaining litter. Oribatida and Isotomidae played a dominant role in the decomposition process. In the first half of the year the involvement of soil fauna slowed down the decomposition process, when the environment was much colder and drier, however, with the rise in temperature and moisture in the following six months, the contribution rates of macrofauna and mesofauna to litter decomposition increased greatly. The contribution rates of soil fauna to the litter mass loss increased with time in the first year. During the 12 month decomposition, the contribution rate of both macrofauna and mesofauna to litter decomposition was 25.57%, of which the contribution rate of mesofauna to litter decomposition was 16.88%, much higher than the contribution rate of macrofauna to litter decomposition (8.69%). Mesofauna play an important role in the release of organic carbon. These results suggest that during the seasons of winter and spring there is an antagonistic effect of soil fauna on litter decomposition, whilst in summer and autumn, there is a synergistic effect from soil fauna on litter decomposition.
soil fauna;Rhododendronchrysanthum; litter decomposition; nutrient dynamics;Betulaermaniiforest; Changbai Mountains
國家自然科學基金項目(41171207, 40871120)
2013- 06- 27;
2014- 05- 30
10.5846/stxb201306271788
*通訊作者Corresponding author.E-mail: yinxq773@nenu.edu.cn
包劍利, 殷秀琴, 李曉強.長白山牛皮杜鵑凋落物分解及土壤動物的作用.生態學報,2015,35(10):3320- 3328.
Bao J L, Yin X Q,Li X Q.The contribution of soil fauna to litter decomposition ofRhododendronchrysanthumin the Changbai Mountains.Acta Ecologica Sinica,2015,35(10):3320- 3328.

