天麻最細粉對帕金森病大鼠腦內神經遞質及環磷酸腺苷/環磷酸鳥苷的調節作用
劉 瑋 曹燕滔 艾 國
1.空軍總醫院神經內科,北京 100036;2.武警總醫院干三科,北京 100039;3.空軍航空醫學研究所,北京 100142;4.軍事醫學科學院放射與輻射醫學研究所,北京 100850
帕金森病(Parkinson's disease,PD)是一種老年神經系統退變性疾病,主要的病理特征不僅包括引起核心的運動障礙癥狀的黑質-紋狀體多巴胺能系統變性,而且包括中樞、外周和自主神經系統的多靶點侵犯,并伴有廣泛的路易小體和路易軸突的形成,從而引起基底神經節的功能失調[1]。臨床上以靜止性震顫、運動遲緩、肌強直和姿勢步態障礙四大核心癥狀為主要表現,病程呈慢性進展性[2]。 據統計全球65 歲以上老年人中,有1%的人患有PD,而到了80 歲,患病率將增加5 倍。在我國,PD 的發病率更高。目前,我國有200 萬PD 患者,且年增10 萬新患者。 該病的治療目前無論藥物或手術,只能改善其癥狀,不能阻止病情的發展,更無法治愈,給患者以及全社會都造成十分嚴重的負擔。 對PD 的治療和研究工作刻不容緩。
在PD 發生發展過程中,由于中腦多巴胺(dopamine,DA)產生的減少引起全身多部位的神經遞質發生紊亂,如去甲腎上腺素(noradrenaline,NE)和5-羥色胺(5-hydroxytryptamine,5-HT)。 這些神經遞質的合成、分泌發生紊亂,引發了基底神經節網絡調控功能失調,導致運動不能癥狀的出現。在之前的實驗中,筆者采用6-羥基多巴胺(6-hydroxydopamine,6-OHDA)建立了PD 大鼠模型,發現經過天麻普通粉和最細粉的治療后,無論是在改善PD 大鼠的神經行為學方面,還是在減輕PD 大鼠氧化應激損傷和神經炎性反應方面,天麻最細粉的治療效果均要優于普通粉[3]。為了進一步確證天麻最細粉對于PD 大鼠的治療作用,本文探討了天麻最細粉和普通粉對PD 大鼠學習記憶能力的改善作用,以及對PD 大鼠腦內3 種神經遞質——DA、NE 和5-HT 的影響。 此外,環磷酸腺苷(cyclic adenosine monophosphate,cAMP)和環磷酸鳥苷(cyclic guanosine monoph-osphate,cGMP)是細胞功能的重要調節物質,在細胞代謝及多種生理效應的體現中具有關鍵的作用[4]。 筆者繼而測定了PD 大鼠經過天麻最細粉和普通粉治療后血清中cAMP、cGMP 的含量,為天麻最細粉的臨床應用提供科學依據。
1 材料與方法
1.1 藥物
天麻(Gastrodia elata)原產地貴州,普通粉(D50=157.10 μm)和最細粉(D50=27.44 μm)均由四川金歲方藥業有限公司提供。 兩種粉體的電鏡照片見圖1。
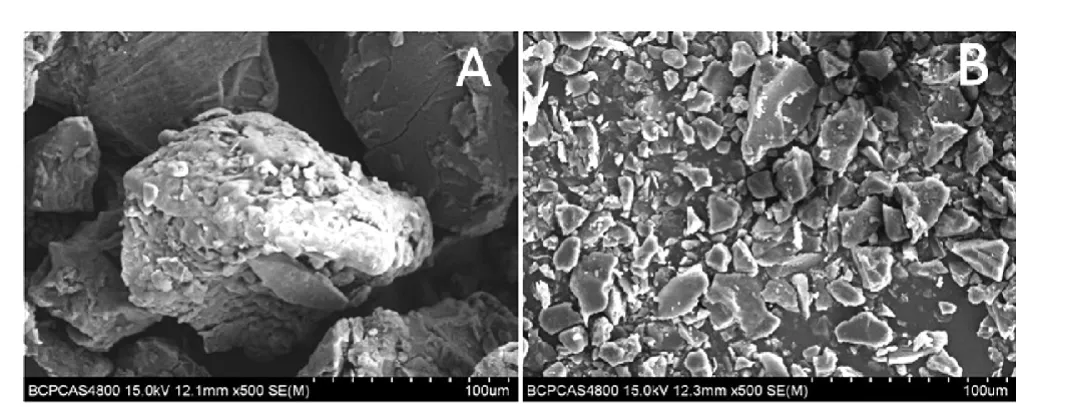
圖1 天麻普通粉(A)和最細粉(B)的掃描電鏡照片(500×)
1.2 動物
健康Wistar 雄性大鼠,體重195~210 g,由軍事醫學科學院實驗動物中心提供,許可證號為醫動字SCXK-(軍)2002-2001。
1.3 試劑與儀器
鹽酸氯胺酮注射液(北京雙鶴藥業股份有限公司,0.1 g/2 mL);6-OHDA、鹽酸去水嗎啡、DA 鹽酸鹽、NE 鹽酸鹽和5-HT 鹽均購自美國Sigma 公司;大鼠cAMP 酶免試劑盒、大鼠cGMP 酶免試劑盒均由成都光海科技有限公司提供;Waters 高效液相色譜儀(Millennium 32 色譜工作站,Waters460 電化學檢測器,美國Waters 公司);色譜柱為AlltimaTMC18(250 mm×4.6 mm,5 μm,美國Alltech 公司);AE163天平(瑞士Mettler 公司);大鼠腦立體定位儀(軒泰儀北京科技有限公司);微量進樣器(上海安亭微量進樣器廠)。
1.4 分組及給藥
PD 模型的制備如前所述[3]。 挑選造模成功的PD大鼠隨機分為模型組、天麻普通粉組(1.8 g/kg)、天麻最細粉組(1.8 g/kg),每組10 只,另納入10 只正常大鼠為正常組。將天麻普通粉和最細粉分別加入適量蒸餾水配制成2 g/mL 的混懸液,臨用現配,搖勻取用灌胃給藥。天麻普通粉和最細粉在造模成功后分別以相應的粉體混懸液灌胃給藥,每天1 次,連續3 周。正常組和模型組以蒸餾水代替藥材,其他均相同。
連續給藥3 周后,用Morris 水迷宮測試大鼠的學習記憶能力。之后,各組大鼠禁食不禁水12 h,腹腔注射20%烏拉坦溶液(10 mL/kg)麻醉,于枕骨大孔處斷頭處死,腹主動脈取血,制血漿,待測cAMP 和cGMP含量。 在冰皿上迅速分離雙側腦組織,取腦組織塊0.3~0.4 g,在4℃的生理鹽水中漂洗,除去血液,濾紙拭干,電子天平稱重,再加入4℃生理鹽水后勻漿。將勻漿液以4000 r/min 離心15 min。 將上清液置-80℃冰箱中備用,測定腦組織中神經遞質的含量。
1.5 學習記憶能力檢測
采用Morris 水迷宮測試其學習記憶能力。 前4 d為訓練時間,第5 天為測試時間。訓練每天上午進行,訓練5 次,每次間隔15 min,每次將大鼠面向池壁分別從4 個象限的4 個入水點入水,記錄其在60 s 內尋找平臺的時間,即逃避潛伏期。 如果達60 s 仍未找到平臺,則引導其到達平臺,停留30 s,本次成績計為60 s,然后進行下次訓練。 測試時取消平臺,同法觀察各組大鼠逃避潛伏期[6]。
1.6 腦組織中神經遞質含量的測定
神經遞質含量的測定采用高效液相色譜-電化學檢測法[7]。取腦組織勻漿,加正丁醇5 mL,混勻,于4℃下離心(5000 r/min)15 min。 取上清液,加HClO4(0.1 mol/L)0.15 mL,正庚烷0.2 mL,旋渦振蕩3 min 后離心(3000 r/min)。除去有機相,在下層的水相中加入1 mL CHCl3,經旋渦振蕩3 min、低速離心3 min 后,取水相直接進樣,進樣量20 μL。 流動相為緩沖液(0.1 mol/L檸檬酸三鈉和0.1 mol/L 磷酸氫二鈉) ∶甲醇=90∶10 的溶液,經0.45 μm 濾膜過濾并超聲脫氣后使用,流速為1 mL/min。 電化學監測器設定電壓為+650 mV。 洗脫順序依次為NE、DA、5-HT。
1.7 血清中cAMP 和cGMP 含量的測定
取血漿2 mL,靜置30 min 后,3000 r/min 離心10 min,取上層血清,4℃保存待測。 按酶聯免疫檢測試劑盒使用說明書操作,即在96 孔板中加入準備好的樣品和對照品,生物素標記二抗和酶標試劑,37℃反應60 min,洗板5 次,加入顯色液A、B,37℃顯色10 min,加入終止液。 在酶標儀450 nm 波長下讀測量各孔的吸光度并計算。
1.8 統計學方法
采用SPSS 10.0 統計學軟件進行數據分析,計量資料數據用均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t 檢驗,以P <0.05 為差異有統計學意義。
2 結果
2.1 各組大鼠學習記憶能力比較
正常組、模型組、天麻普通粉組和天麻最細粉組大鼠的逃避潛伏期分別為(14.5±1.1)、(37.4±3.3)、(29.8±3.3)和(23.6±2.2)s。 與正常組比較,模型組大鼠的逃避潛伏期明顯延長(P <0.01)。與模型組比較,天麻普通粉組和天麻最細粉組大鼠的逃避潛伏期明顯縮短(P <0.05),且天麻最細粉組對大鼠學習記憶能力的改善作用優于天麻普通粉組(P <0.05)。 見圖2。
2.2 各組大鼠腦組織神經遞質含量比較
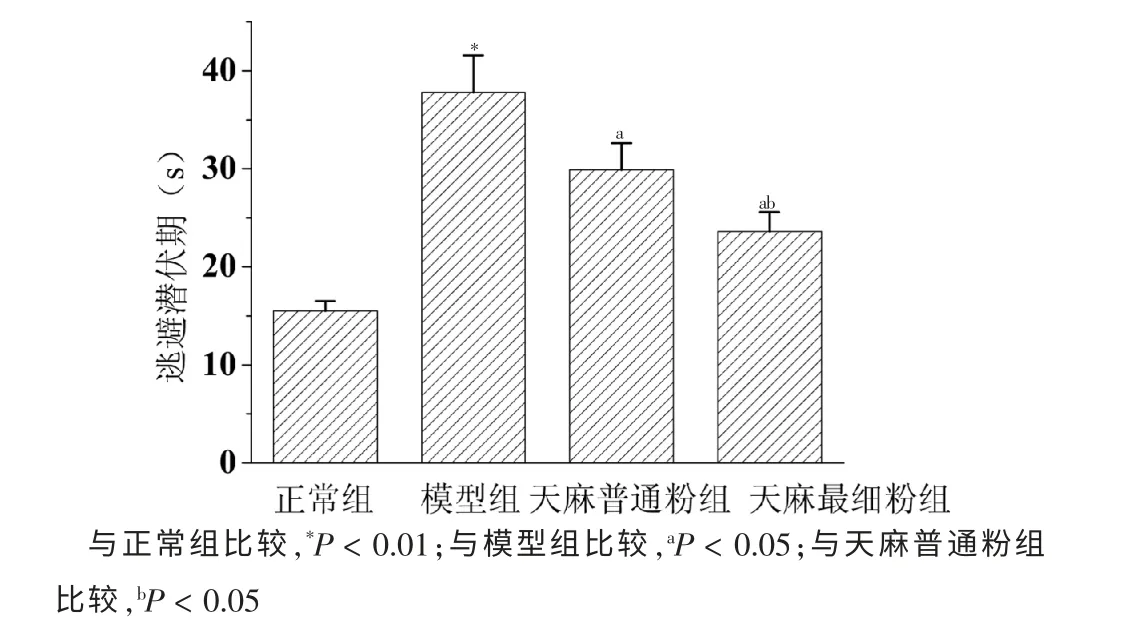
圖2 各組大鼠逃避潛伏期比較
模型組大鼠腦組織DA、NE、5-HT 含量均顯著低于正常組大鼠(P <0.01);經治療后,天麻普通粉組和天麻最細粉組的DA、NE、5-HT 含量均有所增加,且天麻最細粉組的改善作用優于天麻普通粉組(P <0.05)。 見表1。
表1 各組PD 大鼠腦組織內多巴胺、去甲腎上腺素和5-羥色胺含量比較(ng/g,±s)
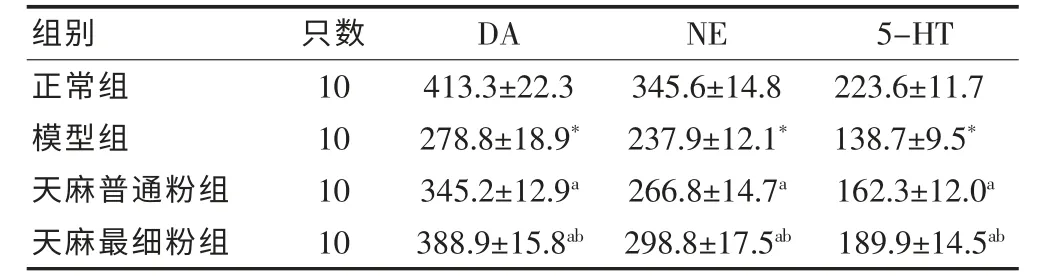
表1 各組PD 大鼠腦組織內多巴胺、去甲腎上腺素和5-羥色胺含量比較(ng/g,±s)
注:與正常組比較,*P <0.01;與模型組比較,aP <0.05;與天麻普通粉組比較,bP <0.05;DA:多巴胺;NE:去甲腎上腺素;5-HT:5-羥色胺
組別 只數 DA NE 5-HT正常組模型組天麻普通粉組天麻最細粉組10 10 10 10 413.3±22.3 278.8±18.9*345.2±12.9a 388.9±15.8ab 345.6±14.8 237.9±12.1*266.8±14.7a 298.8±17.5ab 223.6±11.7 138.7±9.5*162.3±12.0a 189.9±14.5ab
2.3 各組大鼠血清中cAMP 和cGMP 含量比較
較之正常組,模型組cAMP 顯著下降,cGMP 顯著升高,cAMP/cGMP 值顯著降低(P <0.01)。 經過天麻普通粉和最細粉的3 周治療后, 較之PD 模型大鼠,大鼠血清中的cAMP 顯著上升(P <0.05),cGMP 顯著降低(P <0.05),進而二者的比值顯著升高(P <0.05),趨于正常,而且天麻最細粉的療效明顯優于天麻普通粉(P <0.05)。 見表2。
表2 各組PD 大鼠腦血清中的環磷酸腺苷、環磷酸鳥苷含量及環磷酸腺苷/環磷酸鳥苷比較(±s)

表2 各組PD 大鼠腦血清中的環磷酸腺苷、環磷酸鳥苷含量及環磷酸腺苷/環磷酸鳥苷比較(±s)
注:與正常組比較,*P <0.01;與模型組比較,aP <0.05;與天麻普通粉組比較,bP <0.05;cAMP:環磷酸腺苷;cGMP:環磷酸鳥苷
?
3 討論
PD 多發于中老年人,男性略多于女性,是中老年人致殘的主要原因之一。 其發病機制迄今尚不十分清楚,可能與環境因素、免疫學異常、線粒體功能障礙和氧化應激過度、年齡老化、細胞凋亡等諸多因素有關,是多種機制協同作用的結果。 隨著人口老齡化的加劇和人們生活節奏的增快,以PD 為代表的中樞神經退行性疾病已經成為僅次于心血管疾病、惡性腫瘤以及中風之后的主要致死性疾病,該病的治療是神經內科面臨的世界性難題。
目前尚無治療PD 的特效藥物,常用西藥只能控制癥狀,以左旋多巴為代表的藥物替代療法仍是西醫治療帕金森病的金標準,但是隨著用藥時間的延長和用量的加大,毒副作用也越來越大,嚴重影響患者的生活質量。 中醫中藥以其毒副作用小、協同作用強和整體調節等優勢,為PD 的中藥防治提供了良好前景。現代藥理學研究亦表明,在保護神經細胞、抑制氧化應激、抗興奮性毒性、抑制細胞凋亡等方面,中醫藥的作用明顯。 進一步深入挖掘中醫中藥的潛力,對于提高PD 患者的生存質量意義重大[8]。 有多種中藥復方、單味藥、有效部位及單體均可在動物模型上對PD有防治作用,其主要機制涉及保護黑質細胞、改善神經遞質含量、抗氧化和調節免疫、提高化療療效、減輕毒副作用等,并可能延緩疾病進程。 尤其是中藥復方通過多種有效成分對人體有多環節、多層次、多靶點的整合調節作用,可能對PD 神經保護治療有一定的優勢[9]。
天麻為蘭科天麻屬植物天麻(Gastrodia elata)的干燥塊莖,又名赤箭、定風草、獨搖蘭,為我國傳統名貴中藥,主治頭昏、眩暈、肢體麻木、抽搐、中風等中樞神經系統疾病,被《神農本草經》列為上品。 從天麻干燥塊莖中提取出的化學成份主要有酚類、有機酸類及植物中常見的甾醇等,其中活性成分含量最高的有效單體成分是天麻素,又稱天麻苷,常作為衡量天麻藥材和制劑質量的指標成分。 現代醫學已經證實,天麻具有抗驚厥、鎮靜、鎮痛及抗感染等作用,并對大腦的學習和保護功能也有不同程度的作用[10]。 實驗證實,天麻對PD 模型大鼠具有DA 神經元保護作用,能夠改善PD 大鼠的運動功能,恢復紋狀體的DA 含量,減緩PD 病程的進展[11-13]。 作為常用中藥,天麻經常出現在中醫治療PD 的方藥之中[14]。
采用超微粉碎的方式可以將中藥粉碎成最細粉。由于超微粉碎減少了細胞壁的屏障作用,因而比表面積大幅提高,改善了口感,減少了藥材用量,可以大幅提高細胞內有效成分的釋放速度及釋放量,顯著提高中藥的生物利用度[15]。 在前期的研究中,筆者發現天麻經過超微粉碎后,隨著粒徑的減小(D50由157.10 μm減小到27.44 μm),中藥粉體的比表面積顯著增加(由0.403 m2/g 增加到0.626 m2/g),中藥粉體的醇溶性浸出物和有效成分的提取效率也顯著改善,天麻醇溶性浸出物的量由普通粉的10.83%提高到最細粉的12.23%,天麻有效成分(天麻素)的量由普通粉的0.31%提高到最細粉的0.43%[16]。 在隨后的常溫留樣實驗考察中,比較了不同時間的天麻最細粉的形貌結構、粒徑、比表面積、堆密度、休止角等粉體學特征以及有效成分(天麻素)的量和體外溶出曲線的變化,發現經過12 個月的常溫留樣實驗,天麻最細粉的粉體學特征沒有發生顯著性改變,有效成分(天麻素)的量基本保持不變,體外溶出曲線的差異性很小,具有等價性,表明天麻制成最細粉后,質量穩定性良好,可以保證臨床用藥的安全[17]。 動物實驗研究亦肯定了天麻在制成最細粉后,藥理效應顯著增強[3]。
PD 動物模型的制作是PD 研究的基礎和關鍵。在眾多的模型中,6-OHDA 大鼠模型和1-甲基-4-苯基-1,2,3,6-四氫吡啶(MPTP)靈長類模型的病理改變以及行為學表現與人類PD 表現相類似,成為目前最常用最經典的PD 動物模型,對研究PD 主要病理機制和治療藥物起著重要作用[18]。 在之前研究[3]的基礎上,筆者繼續采用經典的6-OHDA 損毀注射法制作PD 大鼠模型,天麻普通粉和最細粉分別給藥3 周后,用Morris 水迷宮測試天麻對PD 模型大鼠學習記憶能力的影響;采用高效液相色譜-電化學檢測法檢測腦內DA、NE 和5-HT 神經遞質的含量;采用酶聯免疫法測定經過天麻普通粉和最細粉治療后,PD 模型大鼠血清中cAMP、cGMP 及cAMP/cGMP 比值的變化。 實驗結果表明,在改善PD 大鼠的學習記憶能力、提高PD 大鼠腦組織神經遞質的水平、調節血清中cAMP/cGMP 的平衡方面,天麻具有確實的功效,而且天麻最細粉的效果要優于普通粉,再次為天麻最細粉的臨床使用提供了科學依據。
[1] 孫作厘,賈軍,虞芬,等.帕金森病基底神經節神經遞質失衡的研究進展[J].生理科學進展,2011,42(6):427-430.
[2] 盧曉喆,黃延焱.帕金森病的治療[J].中華老年心腦血管病雜志,2014,16(9):1007-1008.
[3] 陳慧,艾國,黃正明.天麻最細粉和普通粉對帕金森病大鼠神經行為學、氧化應激反應和神經炎癥反應的對比研究[J].中國實驗方劑學雜志,2014,20(3):144-148.
[4] 陳敏,余江平,黃敏.環核苷酸的生理作用及臨床應用[J].中國藥房,2007,18(11):872-874.
[5] 包新民,舒思云.大鼠腦立體定位圖譜[M].北京:人民衛生出版社,1991:53.
[6] Morris R. Developments of a water-maze procedure for studying spatial learning in the rat [J]. NeurosciMethods,1984,11(1):47-64.
[7] 陸征宇,趙虹,汪濤,等.補腎養肝熄風湯對帕金森病小鼠紋狀體神經遞質和多巴胺受體的影響[J].中醫雜志,2011,52(14):1217-1220.
[8] 李強,霍青.中醫中藥治療帕金森病前景展望[J].中醫臨床研究,2013,5(24):117-119.
[9] 吳斌,趙書志,王修敏,等.中醫藥對帕金森病動物模型的治療機制[J].中國中藥雜志,2011,36(18):2588-2591.
[10] 陶云海.天麻藥理研究新進展[J].中國中藥雜志,2008,33(1):108-110.
[11] 袁紅,張振文,梁立武,等.天麻對帕金森病模型鼠腫瘤壞死因子α 及膠質源性神經營養因子表達的影響[J].中華老年心腦血管病雜志,2010,12(1):69-72.
[12] 劉平,黃麗紅,袁紅,等.天麻對帕金森病大鼠黑質凋亡細胞表達及酪氨酸羥化酶陽性神經元的影響[J].國際免疫學雜志,2011,34(2):147-151.
[13] 馮為菊,李玉梅,張小莉,等.天麻素對帕金森病合并輕度認知功能損害患者的療效[J].實用醫學雜志,2011,27(10):1866-1868.
[14] 魏維,蔡晶.帕金森病的中醫證型分布及中醫藥治療方藥文獻分析[J].中醫雜志,2013,54(20):1778-1782.
[15] 孫建國,易延逵,蔡光先,等.中藥超微粉碎技術研究及應用的現狀和思考[J].湖南中醫雜志,2010,26(6):115-118.
[16] 化瑋,劉洋,艾國,等.3 種中藥最細粉的制備及理化性質考察[J].中草藥,2013,44(23):3296-3302.
[17] 陳菲,艾國,盛柳青,等.浙貝母、天麻和紅景天最細粉的穩定性研究[J].中草藥,2014,45(23):3397-3401.
[18] 張健,徐阿晶.帕金森病動物模型研究進展[J].藥學服務與研究,2012,12(5):382-386.

