鹽脅迫對黃花蒿生長及其揮發(fā)性成分的影響
郁 霄,潘魏松,田 浩,2,王劍文*
1蘇州大學(xué)醫(yī)學(xué)部藥學(xué)院,蘇州 215123;2 云南省農(nóng)業(yè)科學(xué)院藥用植物研究所,昆明 620205
黃花蒿(Artemisia annua L.)是抗瘧藥物——青蒿素的資源植物。除青蒿素外,黃花蒿還含有重要的揮發(fā)性成分,其中以單萜和倍半萜為主,主要包括樟腦、l,8-桉樹腦、石竹烯、莰烯、蒎烯和大根香葉烯等化合物[1]。這些成分具有顯著的抗植物病原菌[2]、驅(qū)蟲、止咳平喘、消炎抗菌等藥理活性[3]。黃花蒿揮發(fā)性物質(zhì)的誘導(dǎo)已見報道,如UV-B 輻照處理黃花蒿幼苗3 h,誘導(dǎo)黃花蒿揮發(fā)油產(chǎn)量提高1.2倍[4]。施加1.2 mmol/L 納米銀處理黃花蒿,可誘導(dǎo)單萜物質(zhì)的合成,且在100 μmol/L 茉莉酸甲酯共同作用下,青蒿酮相對含量提高了2.05 倍[5]。關(guān)于黃花蒿不同生長階段(生長期、開花前期、開花期及開花后期)地上部分的揮發(fā)油產(chǎn)量及組成變化已有報道[6]。
黃花蒿生態(tài)適應(yīng)性極廣,是荒地先鋒植物,在鹽堿地也多見生長[3]。鹽脅迫可以改變藥用植物揮發(fā)油成分組分和產(chǎn)量,50 mmol/L NaCl 可誘導(dǎo)鼠尾草(Salvia officinali L.)果實揮發(fā)油產(chǎn)量提高1.59倍,同時揮發(fā)油的成分組成發(fā)生變化[7]。唇萼薄荷(Mentha pulegium)用50 mmol/L NaCl 處理5 周后,揮發(fā)油產(chǎn)量提高2.75 倍,其主要組分胡薄荷酮的相對含量則從23.91%增加至37.98%[8]。但鹽脅迫對黃花蒿的生長、生理及揮發(fā)性次生代謝物合成的影響尚少見報道,本實驗通過對盆栽黃花蒿幼苗澆灌NaCl 溶液處理,考察鹽脅迫對黃花蒿植株生長、生理活性及青蒿素、揮發(fā)性成分合成的影響,探討黃花蒿對鹽脅迫的生理響應(yīng),研究鹽脅迫對黃花蒿次生代謝生物合成的影響,為黃花蒿鹽堿地栽培條件的優(yōu)化、探討黃花蒿活性成分的調(diào)控方法提供參考。
1 材料與方法
1.1 主要材料、儀器和試劑
實驗材料為黃花蒿(Artemisia annua L.)幼苗,黃花蒿種子(cv.CQF39)由云南省昆明市云南省農(nóng)業(yè)科學(xué)院提供。
電子天平、紫外分光光度計、離心機、超聲波清洗器、LI-COR 公司LI-6400 便攜式光合儀、Agilent-1260 型高效液相色譜系統(tǒng)、Agilent 5975C-6890 氣相色譜-質(zhì)譜聯(lián)用儀。
NaCl(分析純)、蒸餾水、甲醇(色譜純)、正己烷(分析純)。
1.2 幼苗培養(yǎng)
用20%的次氯酸鈉對黃花蒿種子進(jìn)行表面滅菌,之后用無菌的蒸餾水沖洗種子三遍。將種子撒于裝土(泥炭和珍珠巖1∶1,v/v)的托盤萌發(fā),并置于溫度(25±2)℃,濕度70%,每天光照時間16 h的溫室中培養(yǎng)。待培養(yǎng)一個月后,將長勢相同的黃花蒿幼苗轉(zhuǎn)入小盆中培養(yǎng),每盆一株。待盆中的黃花蒿幼苗長出4 片真葉后,開始對幼苗進(jìn)行鹽脅迫處理。
1.3 試驗設(shè)計
本試驗采用單因素完全隨機區(qū)組試驗設(shè)計,每個分組處理的鹽濃度分別為2、4、6、8 g/L,每兩天澆一次鹽溶液,對照組澆灌等體積的蒸餾水。每個處理設(shè)置3 個重復(fù),開始處理后1 個月采集樣品測定各指標(biāo)。
1.4 株高和干重的測定
測量每組黃花蒿植株地上部分的高度。收集每個處理組的黃花蒿植株,置于50 ℃烘箱,干燥至恒重后用電子天平稱重。
1.5 過氧化氫(H2O2)和丙二醛(MDA)的測定
H2O2含量通過KI 法測定[9]。脂質(zhì)過氧化物MDA 的含量用硫代巴比妥酸(TBA)法進(jìn)行測定[10]。
1.6 抗氧化酶活性的測定
采用氮藍(lán)四唑(NBT)光化學(xué)還原法測定SOD活力;過氧化氫酶(CAT)活性的測定采用紫外吸收法;愈創(chuàng)木酚法測定POD 活性[11,12]。
1.7 凈光合速率和蒸騰速率的測定
使用LI-6400(美國,LI-COR 公司)便攜式光合測定系統(tǒng)測定生長完好、葉面積相近且完全展開的黃花蒿葉片凈光合速率和呼吸速率。測定過程中,分析儀每30 分鐘校準(zhǔn)調(diào)零一次。每片葉子置于封閉的氣體交換室測定1 min。測定條件為:晴朗天氣,上午9∶30~10∶00,溫度25~27 ℃。
1.8 青蒿素含量測定
青蒿素的測定參照文獻(xiàn)[13],稱取黃花蒿粉末0.1 g,加入30 mL 30~60 ℃沸程的石油醚,超聲提取1 h。之后于40 ℃水浴揮干溶劑,加入色譜甲醇充分溶解,加入NaOH 溶液衍生后,經(jīng)0.45 μm 濾膜過濾用于高效液相進(jìn)樣檢測。色譜條件:Agilent HC-C18(4.6 ×250 mm,5 μm);流動相:甲醇-磷酸鹽緩沖液(50∶50);流速:1 mL/min;柱溫:30 ℃;檢測波長:260 nm。
1.9 揮發(fā)油的提取和測定
稱取黃花蒿粉末2 g,加入10 mL 正己烷,輕輕搖勻使黃花蒿粉末浸沒,在超聲槽內(nèi)超聲2 h,之后將黃花蒿粉末浸液放置5 ℃保存過夜。提取液用0.45 μm 尼龍膜過濾后立即進(jìn)行測定。氣相色譜條件:載氣為高純度氦氣,體積流量為1 mL/min,分流比20∶1 進(jìn)樣量為1 μL;進(jìn)樣口溫度為280 ℃,接口溫度為240 ℃;程序升溫:60 ℃(0 min),3 ℃/min到240 ℃,保持5 min。質(zhì)譜條件:電子轟擊(EI)離子源,電離電壓70 eV;離子源溫度230 ℃;掃描范圍35~780 amu。各分離組分采用美國國家標(biāo)準(zhǔn)局NIST2008 譜庫檢索定性,采用色譜峰面積歸一法進(jìn)行相對定量。
1.10 數(shù)據(jù)分析
實驗每個處理重復(fù)三次,所得結(jié)果以平均值±SD 表示,利用Excel 軟件采用t 檢驗進(jìn)行顯著性分析。
2 結(jié)果與分析
2.1 鹽脅迫對黃花蒿植株生長的影響
隨著鹽濃度(2~8 g/L)的增加,黃花蒿幼苗生長被抑制,處理一個月后,對照組植株的高度為10.6 cm,而鹽濃度最高(8 g/L)的處理組植株的高度僅為5.1 cm(圖1),植株干重減少到對照的36%左右。在試驗中我們發(fā)現(xiàn)隨著處理的鹽濃度的增加,植株葉片皺縮枯萎的情況加劇,6~8 g/L NaCl處理下的黃花蒿幼苗出現(xiàn)了比較高的死亡率。
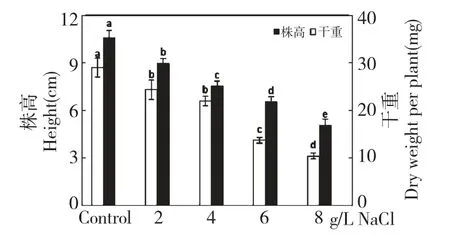
圖1 鹽脅迫對黃花蒿株高和植株干重的影響Fig.1 Effect of salt stress on height and dry weight of A.annua seedlings
2.2 鹽脅迫對黃花蒿的氧化損傷及抗氧化酶活性的影響
4 g/L NaCl 溶液脅迫處理黃花蒿植株一個月后,處理組植株中H2O2的含量比對照增加了72.7%,且MDA 量高于對照組25.25%(圖2)。黃花蒿植株持續(xù)性的氧化損傷也引起了植株葉片中抗氧化酶活性的提高。在4 g/L NaCl 處理1 個月后,植株葉片中抗氧化物酶SOD、CAT 和POD 的活性分別比對照提高了43.9%、70.9%和42.4%(圖3)。

圖2 鹽脅迫對黃花蒿植株H2O2和MDA 含量的影響Fig.2 Effect of salt stress on H2O2and MDA contents of A.annua seedlings

圖3 鹽脅迫對黃花蒿植株抗氧化酶SOD、CAT 和POD 活性的影響Fig.3 Effect of salt stress on SOD,CAT and POD activity in A.annua seedlings
2.3 鹽脅迫對黃花蒿凈光合速率和蒸騰速率的影響
鹽脅迫處理的黃花蒿植株表現(xiàn)出光合活力的抑制。4 g/L NaCl 溶液處理的植株葉片凈光合速率降低27.9%,表現(xiàn)出葉片生長上一定程度的損傷。同時,鹽脅迫處理組葉片的蒸騰速率也比對照組降低39.5%(圖4)。

圖4 鹽脅迫對黃花蒿植株凈光合速率和蒸騰速率的影響Fig.4 Effect of salt stress on net photosynthetic and transpiration rate of A.annua seedlings
2.4 鹽脅迫對黃花蒿次生代謝的影響

圖5 鹽脅迫對黃花蒿植株青蒿素含量的影響Fig.5 Effect of salt stress on artemisinin content of A.annua seedlings
在對試驗中黃花蒿葉片中青蒿素含量進(jìn)行測定后,我們發(fā)現(xiàn)施加4 g/L NaCl 溶液處理一個月后,處理組的青蒿素含量相比對照增加了44.3%(圖5)。青蒿素作為黃花蒿植株重要的次級代謝產(chǎn)物,在鹽脅迫刺激下其含量表現(xiàn)出明顯的增多。
我們采用GC-MS 對黃花蒿植株揮發(fā)性組分進(jìn)行鑒定,得到總離子流圖,并通過面積歸一化法定量揮發(fā)油組分的相對含量,結(jié)果見表1。GC-MS 共分離出58 個峰,鑒定出揮發(fā)油中40 個主要化學(xué)成分。對照組和處理組已鑒定出的組分占揮發(fā)油總量的77.74%和78.73%。GC-MS 的分析結(jié)果表明,黃花蒿植株的代謝產(chǎn)物較多,包括有醇、醛、酮、烯、內(nèi)酯、烷烴、羧酸、多環(huán)化合物、雜環(huán)化合物等。主要成分包括:葉醇18.14%、大根香葉烯9.35%、鄰苯二甲酸二異丁酯6.60%、新丁香萜烯5.93%、α-萜品醇4.75%、二十二烷醇3.61%、乙酸3.19%、青蒿素2.97%、脫氧青蒿素2.78%和沒食子酸2.58%。鹽脅迫處理后黃花蒿植株揮發(fā)油成分的組成沒有發(fā)生變化。但是揮發(fā)油各組成成分的相對含量出現(xiàn)了比較明顯的變化。例如葉醇相對含量減小至15.85%,大根香葉烯相對含量減小至9.04%。同樣的鹽脅迫處理也伴隨著一些主要成分相對含量的增加,例如:鄰苯二甲酸二異丁酯增加了1.3 倍、白菖油萜增加了1.3 倍、脫氧青蒿素增加了1.2 倍、α-萜品醇增加了1.1 倍。另外,GC-MS 測定的鹽脅迫處理后青蒿素的相對含量相比對照增加了39.73%,這與之前通過高效液相色譜測定出的青蒿素含量變化的結(jié)果一致。

表1 黃花蒿揮發(fā)油成分鑒定Table 1 Analysis of chemical constituents in volatile oil of A.annua

3 討論
本研究中,鹽脅迫對黃花蒿植株的影響主要表現(xiàn)為對其生長的抑制,葉片光合速率下降。黃花蒿植株葉片蒸騰速率降低,減少了植物細(xì)胞水分的散失,維持滲透壓的水平,幫助抵御逆境。在鹽脅迫下,植株細(xì)胞中活性氧的產(chǎn)生與清除平衡被打破[14],4 g/L NaCl 處理黃花蒿植株一個月后,胞內(nèi)H2O2含量顯著升高。鹽脅迫引起的這種活性氧的產(chǎn)生與積累將導(dǎo)致細(xì)胞膜脂過氧化、膜的選擇通透性喪失。在鹽脅迫作用下,黃花蒿植株抗氧化酶SOD、CAT 和POD 活性均呈現(xiàn)出不同程度地升高,以減輕黃花蒿植株在鹽脅迫下遭受的氧化損傷。
植物的次生代謝是植物體內(nèi)的另一種重要的生理代謝,次級代謝產(chǎn)物的合成與積累與植物的生長環(huán)境密切相關(guān)。在本研究中,4 g/L NaCl 溶液處理黃花蒿植株一個月,植株中青蒿素含量顯著增多,說明青蒿素的生物合成對鹽脅迫有應(yīng)答反應(yīng)。而且,黃花蒿植株揮發(fā)組分相對含量也發(fā)生顯著變化,鄰苯二甲酸二異丁酯、白菖油萜、脫氧青蒿素、α-萜品醇的相對含量在鹽脅迫處理后顯著增加,而葉醇及大根香葉烯在鹽脅迫處理后相對含量明顯降低。這些受鹽脅迫誘導(dǎo)的物質(zhì)如鄰苯二甲酸二異丁酯、α-萜品醇具有顯著的抗蟲和抑菌活性[15,16]。我們的研究表明:鹽脅迫也可作為黃花蒿活性揮發(fā)性成分一種誘導(dǎo)方式,本研究結(jié)果對于黃花蒿鹽漬地栽培具有參考應(yīng)用價值。
1 Li Y (李燕),Hu HB (胡浩斌),Zheng XD (鄭旭東),et al.Research progress on the essential oil of Artemisia Annua L.J Anhui Agric Sci (安徽農(nóng)業(yè)科學(xué)),2011,39:3960-3961.
2 Kordali S,Cakir A,Mavi A,et al.Screening of chemical composition and antifungal and antioxidant activities of the essential oils from three turkish Artemisia species.J Agric Food Chem,2005,53:1408-1416.
3 Li Q (李清).Research and application overview of Artemisia annua L.Chin Med Guides (中國醫(yī)藥導(dǎo)報),2008,5:25-25.
4 Pandey N,Pandey-Rai S.Modulations of physiological responses and possible involvement of defense-related secondary metabolites in acclimation of Artemisia annua L.against short-term UV-B radiation.Planta,2014,240:611-627.
5 Ghanati F,Bakhtiarian S.Changes of natural compounds of Artemisia annua L.by methyl jasmonate and silver nanoparticles.Adv Environ Biol,2013,7:2251-2258.
6 Rana VS,Abirami K,Blázquez MA,et al.Essential oil composition of Artemisia annua L.at different growth stages.J Spices Aromatic Crops,2013,22:181-187.
7 Taarit MB,Msaada K,Hosni K,et al.Plant growth,essential oil yield and composition of sage (Salvia officinali L.)fruits cultivated under salt stress conditions.Ind Crop Prod,2009,30:333-337.
8 Karray-Bouraoui N,Rabhi M,Neffati M,et al.Salt effect on yield and composition of shoot essential oil and trichome morphology and density on leaves of Mentha pulegium.Ind Crop Prod,2009,30:338-343.
9 Sergiev I,Alexieva V,Karanov E.Effect of spermine,atrazine and combination between them on some endogenous protective systems and stress markers in plants.Compt Rend Acad Bulg Sci,1997,51:121-124.
10 Li HS (李合生).Principles and Techniques of Plant Physiological Biochemical Experiment (植物生理生化實驗原理和技術(shù)).Beijing:Higher Education Press,2006.164.
11 Manoranjan K,Dinabandhu M.Catalase,peroxidase,and poly-phenoloxidase activities during rice leaf senescence.Plant Physiol,1976,57:315-319.
12 Garcia-Limones C,Hervas A,Navas-Cortes JA,et al.Induction of an antioxidant enzyme system and other oxidative stress markers associated with compatible and incompatibleinteractions between chickpea (Cicer arietinum L.)and Fusarium oxysporum f.sp.ciceris.Physiol Mol Plant Pathol,2002,61:325-337.
13 Guo XX,Yang XQ,Yang RY,et al.Salicylic acid and methyl jasmonate but not rose Bengal enhance artemisinin production through invoking burst of endogenous singlet oxygen.Plant Sci,2010,178:390-397.
14 Yu BJ (於丙軍),Liu YL (劉友良).Effects of salt stress on the metabolism of active oxygen in seedlings of annual halophyte Glycine Soja Acta Bot Boreal-Occident Sin (西北植物學(xué)報),2003,23:18-22.
15 Li Y (李勇),Liu SL (劉時輪),Huang XF (黃小芳),et al.Allelopathy of ginseng root exudates on pathogens of ginseng.Acta Ecol Sin (生態(tài)學(xué)報),2009,29:161-168.
16 Tian YN (田雨濃),Ma W (馬偉),Wei QS (韋慶慧),et al.Effects of α-terpineol fumigation on the in vivo antioxidant activity in Zophobas morio (Coleoptera:Tenebrionidae).Acta Entomol Sin (昆蟲學(xué)報),2013,56:161-168.

