缺血再灌注對大鼠頜下腺分泌功能的影響
肖孟 劉少華 劉云生 魏奉才 石亮
1.山東大學齊魯醫院口腔頜面外科,山東大學口腔醫學研究所;2.山東大學口腔醫學院,山東省口腔生物醫學重點實驗室,濟南 250012
重癥角結膜干燥癥是由多種原因引起的眼表及淚膜異常的疾病[1],通過自體頜下腺移植以頜下腺分泌的唾液代替淚液是有效的治療方法[2-3]。血管化自體移植頜下腺難免要經歷失神經和缺血再灌注過程,可能影響腺體的分泌功能[4]。缺血預適應能改善移植頜下腺的分泌功能[5],而目前缺血再灌注后頜下腺的損傷-應激反應尚缺乏研究。本實驗建立了大鼠頜下腺原位缺血再灌注模型,探討缺血再灌注對大鼠頜下腺的損傷及損傷-應激反應對頜下腺分泌功能的影響。
1 材料和方法
1.1 實驗動物和材料
健康的雄性Wistar大白鼠購于山東大學實驗動物中心,質量均大于200 g。GMS10016.5 v.A氧化應激活性氧檢測試劑盒(Genmed公司,美國);末端核苷酸轉移酶介導的生物素化的三磷酸脫氧尿苷(2’-deoxyuridine 5’-triphosphate,dUTP)末端標記(terminal deoxyribonucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)凋亡檢測試劑盒(QIA33型;Merk公司,德國); CM1900冰凍切片機、DFC425 C型熒光顯微鏡(Leica公司,德國)。
1.2 方法
1.2.1 大鼠頜下腺原位缺血再灌注模型 健康雄性Wistar大鼠隨機分成4組,每組6只。大鼠經腹腔注射10%水合氯醛麻醉、消毒后,做頸部正中切口,依次剝離肌肉和筋膜,尋找大鼠頜下腺血管、神經及頜下腺導管束。游離并保護大鼠舌神經支配頜下腺的分支,保留副交感神經的支配作用。4組大鼠腺體通過無損傷血管夾夾閉頜外動脈頜下腺供血支(圖1A),待缺血90 min后分別再灌注1、12、24、72 h。對側腺體作為對照組。
1.2.2 頜下腺分泌量測定 腺體經歷1、12、24、72 h再灌注后,各組大鼠再次麻醉,游離兩側頜下腺導管至口底后切斷導管(圖1B、C),并于斷端處插入直徑約0.5 mm的聚乙烯塑料小管(由10 μL移液管槍頭拉制)測量腺體的分泌量(圖1D)。測量腺體分泌量的方法采用Schirmer實驗,以5 min內濾紙條(35 mm×5 mm)濕潤的長度來表示[6]。測量結果重復3次取平均值。
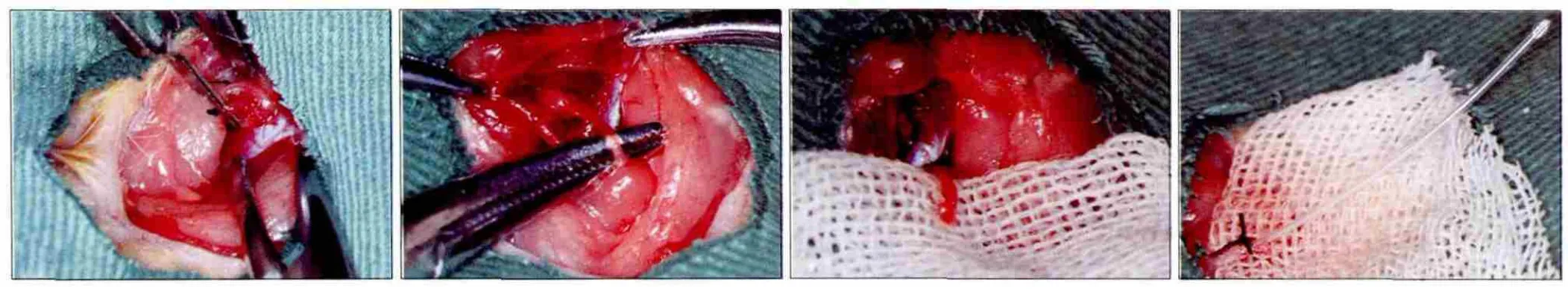
圖1 大鼠頜下腺原位缺血再灌注模型的建立及腺體分泌量測定Fig 1 In situ ischemia reperfusion experimental model and salivary flow measurement of rat submandibular glands
1.2.3 頜下腺組織形態學觀察 大鼠兩側頜下腺游離后摘除,取部分腺體組織于10%中性甲醛固定,經水洗、脫水、透明、包埋,切成5 μm厚的切片。腺體組織切片經蘇木精-伊紅(hematine-eosin,HE)染色,封固后于光學顯微鏡下觀察腺體的組織學形態。
1.2.4 活性氧(reactive oxygen species,ROS)檢測將部分新鮮頜下腺組織制成10 μm厚的冰凍切片,按氧化應激ROS檢測試劑盒的說明檢測腺體組織中ROS水平。熒光顯微鏡下觀察(激發波長490 nm,散發波長520 nm),綠色熒光信號表示組織內ROS的水平。細胞核由4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)復染,顯示出藍色熒光信號。
1.2.5 腺體細胞凋亡檢測 取5 μm厚的石蠟包埋組織切片,按照TUNEL凋亡檢測試劑盒的說明檢測腺體組織內細胞凋亡的水平,然后用甲基綠復染。通過光學顯微鏡觀察,凋亡細胞核呈現深棕色,非凋亡細胞核呈現青綠色至淡綠色。每組標本在400倍的顯微鏡下隨機選取10個視野,觀察并記錄各實驗組TUNEL陽性細胞的數目。
1.2.6 統計學分析 采用SAS 9.1.3統計學軟件對數據進行隨機樣本t檢驗,檢驗水準為雙側α=0.05。數據結果以均值±標準差表示。
2 結果
2.1 缺血再灌注后大鼠頜下腺分泌功能的變化
缺血再灌注后頜下腺分泌量的變化見圖2:實驗側頜下腺分泌量在再灌注1、12 h時與對照側相比明顯降低(P<0.01);再灌注24 h,實驗側腺體分泌量開始增加,到再灌注72 h時,實驗側腺體的分泌量接近正常水平(P>0.05)。
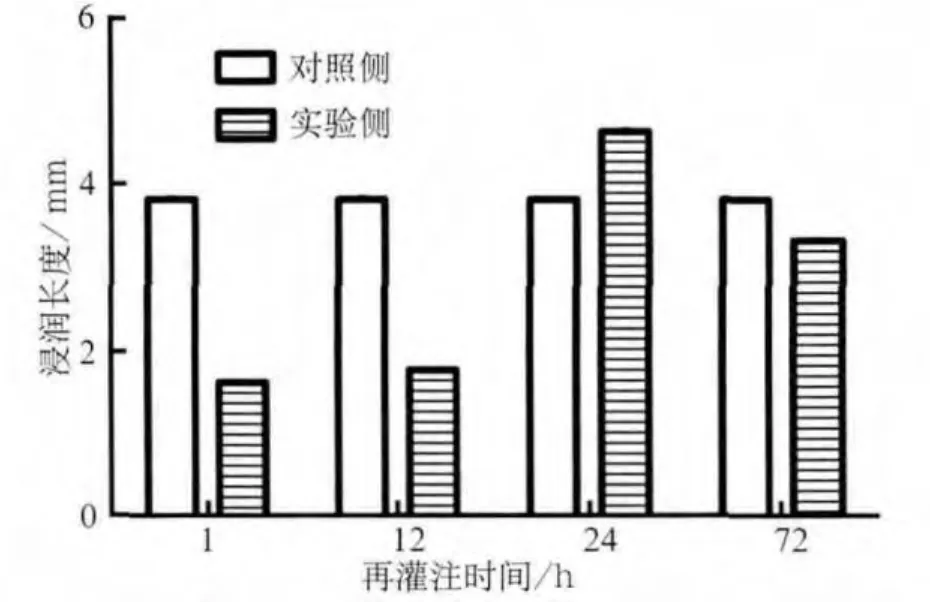
圖2 缺血再灌注后頜下腺的分泌量Fig 2 The secretory function of the submandibular glands after ischemia reperfusion
2.2 缺血再灌注后頜下腺組織形態學的變化
對照側頜下腺經HE染色后在顯微鏡下可觀察到正常腺泡和導管的形態(圖3A)。經過1 h再灌注,大鼠頜下腺的腺實質細胞輕度萎縮,間質較正常組織疏松,并出現充血、水腫現象;間質內可查見以少量單個核細胞為主的炎癥浸潤(圖3B)。再灌注12 h后,頜下腺導管和腺體細胞萎縮,組織水腫加重,部分導管失去正常的形態,管腔閉鎖;在腺小葉之間和導管周圍出現大量的炎癥細胞彌散分布,以早期中性粒細胞為主(圖3C)。腺體經過24 h再灌注后,組織內炎癥浸潤以單核-巨噬細胞為主,組織水腫有所恢復,間質內可見少量梭形的纖維母細胞(圖3D)。至再灌注72 h,組織水腫及炎癥細胞浸潤減輕,接近正常(圖3E)。

圖3 頜下腺缺血再灌注后的組織形態學變化 HE × 200Fig 3 The histological change of the submandibular glands after ischemia reperfusion HE × 200
2.3 缺血再灌注后大鼠頜下腺的氧化應激反應
正常頜下腺組織幾乎檢測不到ROS信號(圖4A);實驗側腺體經歷缺血再灌注后,熒光顯微鏡下可以觀測到綠色ROS信號分布在腺體組織中,再灌注1~12 h,ROS信號逐漸增多(圖4B、C);持續灌注24~72 h,腺體內ROS水平逐漸降低,最終接近正常組織(圖4D、E)。
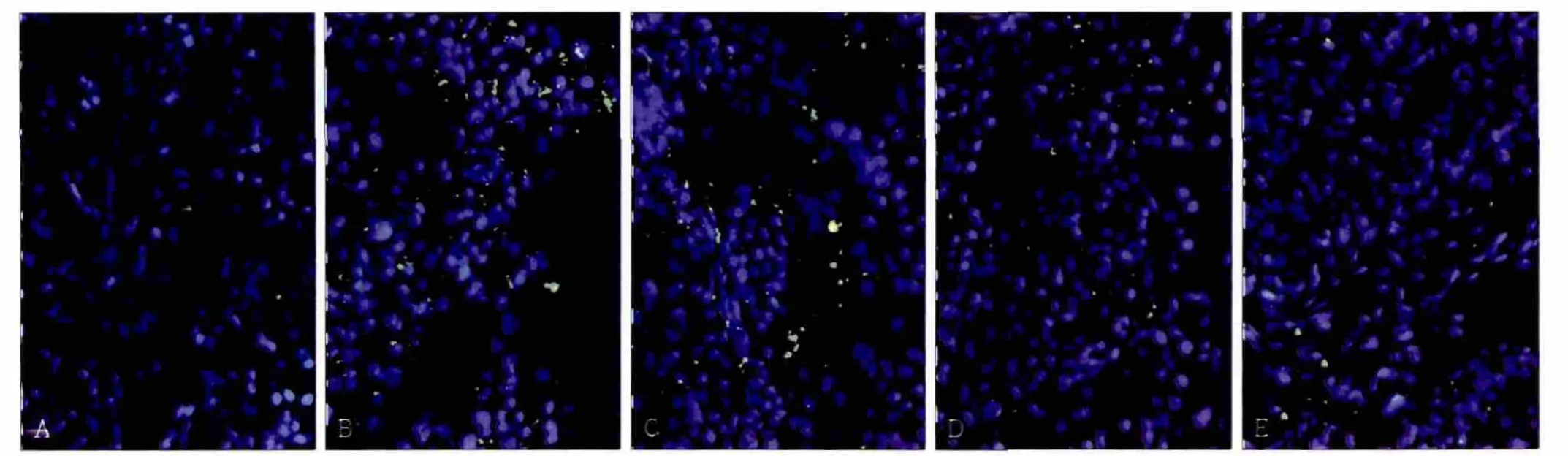
圖4 頜下腺缺血再灌注后ROS的表達 免疫熒光染色 × 200Fig 4 ROS level of the submandibular glands after ischemia reperfusion immunofluorescence × 200
2.4 缺血再灌注后大鼠頜下腺細胞凋亡水平的變化
大鼠頜下腺缺血再灌注1、12、24、72 h后的細胞凋亡狀況見圖5。凋亡細胞呈深棕色,非凋亡細胞核呈青綠色至淡綠色。
在正常的腺體組織內,僅有少量TUNEL陽性細胞(圖5A);而腺體經過缺血再灌注1、12、24 h后,凋亡細胞的數目明顯增多(圖 5B、C、D),隨著再灌注時間延長,凋亡細胞的數目逐漸減少,再灌注72 h后,實驗側腺體細胞的凋亡數目與正常組織相當(圖5E)。 經凋亡細胞計數,對照側凋亡細胞為每視野(1.9±0.41)個,實驗側缺血再灌注1、12、24、72 h的凋亡細胞數分別為(14.7±1.40)、(11.0±0.56)、(9.0±0.89)、(2.8±0.59)個。經統計學分析,缺血再灌注1、12、24 h的凋亡細胞數明顯多于對照側(P<0.01),72 h后,實驗側與對照側的差異無統計學意義(P>0.05)。
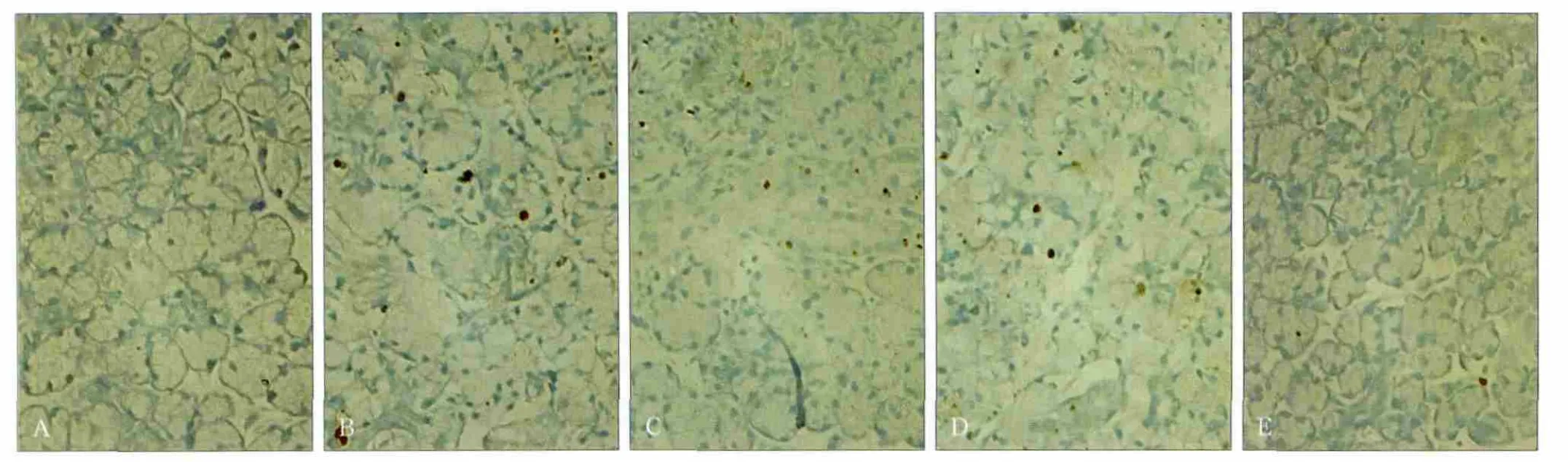
圖5 頜下腺缺血再灌注后的細胞凋亡狀況 TUNEL × 400Fig 5 Apoptotic cells of the submandibular glands after ischemia reperfusion TUNEL × 400
3 討論
大量研究[7-8]證實,缺血再灌注損傷是臨床多種疾病的病理基礎,能夠引起移植器官結構和功能狀態的改變。為進一步探討單純缺血再灌注對移植腺體分泌功能的影響,本實驗保留支配大鼠頜下腺分泌的神經分支,建立大鼠頜下腺原位缺血再灌注模型,通過觀察腺體組織學變化、ROS水平、細胞凋亡及腺體功能狀況,闡明單純缺血再灌注能引起大鼠頜下腺損傷-應激反應及腺體分泌功能的改變。本研究證實,腺體的損傷-應激反應主要發生在再灌注早期,隨著再灌注時間的延長而逐漸減輕。
本研究結果顯示,經歷缺血再灌注后大鼠頜下腺的組織學變化主要表現為早期的急性炎癥反應及腺實質細胞的損傷。研究[9-10]證實,缺血再灌注后血管內皮細胞損傷,組織滲出增多,白細胞和巨噬細胞激活,導致多種趨化因子和細胞黏附分子大量生成、釋放,并進一步介導局部組織細胞的炎癥損傷。此外,缺血再灌注后血管功能紊亂和微循環的變化,可能會加重組織細胞的損傷[11]。本研究提示缺血再灌注后早期結構損傷與頜下腺分泌降低密切相關。
ROS是氧分子的活性代謝產物,主要包括超氧陰離子、過氧化氫和羥自由基等,能與許多生物分子發生活性反應。研究表明,ROS產生于缺血組織再灌注后早期,其引起的氧化應激是細胞損傷的主要因素[12]。缺血組織經歷再灌注后產生大量的活性氧自由基,ROS能通過攻擊細胞內生物大分子物質(如脂質、蛋白質、核酸),引起細胞通透性增加,破壞細胞內環境的穩定,導致細胞結構破壞和誘導細胞凋亡[13];同時,ROS可增加缺血再灌注后白細胞的激活、趨化及白細胞-內皮細胞的黏附,后者又進一步導致炎癥介質的大量產生和釋放,間接加重組織的損傷[14]。在本實驗中,腺體缺血再灌注后ROS的水平與觀察到的組織損傷情況相符,再灌注早期組織內ROS水平顯著增加。
凋亡是細胞在生理或病理情況下發生的一種主動應激反應,大量的動物或人體器官模型研究表明,細胞凋亡是組織缺血再灌注損傷的病理特征之一。本實驗發現,大鼠頜下腺缺血再灌注早期凋亡細胞的數目增加,其機制可能是由于缺血再灌注后的組織能量代謝障礙,氧應激及炎癥反應等引起細胞內環境改變及結構破壞,并進一步通過下游細胞凋亡通路最終導致細胞凋亡的發生[15]。
頜下腺是主要的唾液分泌器官,在兔頜下腺移植實驗中,移植腺體早期唾液分泌功能降低,而12 h后腺體出現暫時性分泌增多現象[5],失神經支配可能是其分泌改變的直接原因,而對于單純缺血再灌注對腺體分泌功能的影響尚不清楚。本研究發現,大鼠頜下腺在保留神經支配的情況下經歷缺血再灌注1~12 h后,腺體的分泌功能與正常組相比明顯降低,與缺血再灌注后腺體的損傷-應激反應情況相符。該結果提示,缺血再灌注的損傷-應激反應是移植腺體早期分泌功能低下的重要原因。涎腺組織的水轉運主要通過跨細胞和旁細胞途徑來實現[16],本課題組前期的研究[5]也證實缺血預適應能夠改善再灌注早期移植腺體的分泌功能;筆者推測,缺血再灌注后損傷-應激反應可能影響腺體水轉運途徑,其機制尚需要進一步的研究。明確缺血再灌注對頜下腺分泌功能的損傷作用,尋找合適的臨床干預手段減少缺血再灌注損傷-應激反應,對改善移植腺體早期的分泌功能,減少腺體移植術后早期并發癥有重要意義。
[1]Yao W, Davidson RS, Durairaj VD, et al. Dry eye syndrome:an update in office management[J]. Am J Med, 2011, 124(11):1016-1018.
[2]Paniello RC. Submandibular gland transfer for severe xerophthalmia[J]. Laryngoscope, 2007, 117(1):40-44.
[3]Yu GY, Zhu ZH, Mao C, et al. Microvascular autologous submandibular gland transfer in severe cases of keratoconjunctivitis sicca[J]. Int J Oral Maxillofac Surg, 2004, 33(3):235-239.
[4]Xiang B, Zhang Y, Li YM, et al. Phenylephrine protects autotransplanted rabbit submandibular gland from apoptosis[J]. Biochem Biophys Res Commun, 2008, 377(1):210-214.
[5]Yang NY, Shi L, Zhang Y, et al. Ischemic preconditioning reduces transplanted submandibular gland injury[J]. J Surg Res, 2013, 179(1):e265-e273.
[6]López-Jornet P, Camacho-Alonso F, Bermejo-Fenoll A. A simple test for salivary gland hypofunction using Oral Schirmer’s test[J]. J Oral Pathol Med, 2006, 35(4):244-248.
[7]Kadkhodaee M, Mikaeili S, Zahmatkesh M, et al. Alteration of renal functional, oxidative stress and inflammatory indices following hepatic ischemia-reperfusion[J]. Gen Physiol Biophys, 2012, 31(2):195-202.
[8]Eltzschig HK, Eckle T. Ischemia and reperfusion—from mechanism to translation[J]. Nat Med, 2011, 17(11):1391-1401.
[9]Lutz J, Thürmel K, Heemann U. Anti-inflammatory treatment strategies for ischemia/reperfusion injury in transplantation[J]. J inflamm: Lond, 2010, 7:27.
[10]Liu H, Drew P, Cheng Y, et al. Pirfenidone inhibits inflammatory responses and ameliorates allograft injury in a rat lung transplant model[J]. J Thorac Cardiovasc Surg, 2005,130(3):852-858.
[11]Schmitz V, Schaser KD, Olschewski P, et al.In vivovisualization of early microcirculatory changes following ischemia/reperfusion injury in human kidney transplantation[J]. Eur Surg Res, 2008, 40(1):19-25.
[12]Zhang W, Wang M, Xie HY, et al. Role of reactive oxygen species in mediating hepatic ischemia-reperfusion injury and its therapeutic applications in liver transplantation[J].Transplant Proc, 2007, 39(5):1332-1337.
[13]Sugawara T, Chan PH. Reactive oxygen radicals and pathogenesis of neuronal death after cerebral ischemia[J]. Antioxid Redox Signal, 2003, 5(5):597-607.
[14]Collard CD, Gelman S. Pathophysiology, clinical manifestations, and prevention ofischemia-reperfusion injury[J].Anesthesiology, 2001, 94(6):1133-1138.
[15]Crow MT, Mani K, Nam YJ, et al. The mitochondrial death pathway and cardiac myocyte apoptosis[J]. Circ Res, 2004,95(10):957-970.
[16]Murakami M, Shachar-Hill B, Steward MC, et al. The paracellular component of water flow in the rat submandibular salivary gland[J]. J Physiol: Lond, 2001, 537(Pt 3):899-906.

