大草蛉Chrysopa pallens(Rambur)觸角cDNA 文庫的構建
王 娟,張禮生,張海平,劉晨曦,王孟卿,陳紅印
(中國農業科學院植物保護研究所農業部作物有害生物綜合治理重點實驗室,中國-美國生物防治實驗室,北京 100081)
大草蛉Chrysopa pallens(Rambur)屬于脈翅目Neuroptera 草蛉科Chrysopidae,是葉螨、蚜蟲、鱗翅目卵及低齡幼蟲等多種農林害蟲的重要天敵,在害蟲生物防治中極具應用價值,廣泛分布在我國大部分省市(林美珍等,2007)。天敵昆蟲的行為受多種因素的影響,比如環境信息化合物、溫度、濕度等。大草蛉成蟲釋放于田間或溫室大棚后由于諸多因素的影響,通常會發生逃逸或者死亡,定殖性較差,嚴重降低了其利用價值(武鴻鵠,2014)。觸角是昆蟲感覺系統的重要組成部分,行使嗅覺和味覺功能,昆蟲感受外界氣味物質主要是通過觸角上的感受器來完成的(Steinbrecht,1997;Steinhbrecht & Stankiewicz,1999),在長期的進化過程中,昆蟲嗅覺系統已經發展成為一個高度專一、極其靈敏的化學監測系統。昆蟲通過這種復雜的嗅覺系統來鑒定和識別環境中的特異性化學氣味分子,并將這些化學信號轉化為電信號,從而啟動了昆蟲的一系列專一行為反應,如尋找食物和配偶、搜尋產卵及生殖場所、避免不利環境的傷害等(Kaissling et al.,1987;Breer et al.,1994;Field et al.,2000),而這些功能主要是通過昆蟲觸角中幾種嗅覺相關蛋白與外界氣味分子的結合來實現的。對昆蟲嗅覺相關基因深入研究,有利于從分子水平明確昆蟲的嗅覺識別機制,并從生理生化水平了解昆蟲觸角與昆蟲覓食、產卵、交配等昆蟲行為的關系(Benton et al.,2009;Zhou et al.,2010)。從利用捕食性天敵昆蟲進行害蟲生物防治角度,掌握了天敵昆蟲嗅覺相關蛋白與外界氣味化合物之間的作用機理,有利于人們對天敵昆蟲行為的控制,通過釋放對天敵昆蟲有較強吸引作用的氣味化合物于田間或溫室大棚,從而提高其在某一特定空間的定殖成功率。隨著分子生物學的發展,全長cDNA 文庫的構建、測序和功能注釋,為深入開展昆蟲觸角嗅覺相關基因的克隆及信息識別機制的研究,提供了成本低廉且信息量豐富的技術平臺。Li 等(2014)運用SMART 技術構建了云斑天牛Batocera horsfieldi(Hope)(Coleoptera:Cerambycidae)觸角全長cDNA 文庫,并成功篩選出了4個氣味結合蛋白基因,2個性信息素結合蛋白基因及3個化學感受蛋白基因,為云斑天牛嗅覺相關基因的功能研究奠定了基礎。張帥等(2009a,2009b)通過對棉鈴蟲Helicoverpa armigera(Hübner)cDNA文庫基因篩選和生物信息學分析,鑒定獲得11個氣味受體基因,并克隆表達了信息素結合蛋白HarmPBP2。Gao & Wang(2014)從松褐天牛Monochamus alternatus Hope 觸角cDNA 文庫中克隆并表達了4種氣味結合蛋白,并研究了其與17種植物揮發性化合物的熒光競爭結合特性,結果表明MaltOBP3 和MaltOBP5 與某幾種特定植物揮發物有較強的結合作用。本研究應用Infusion SMART技術構建了大草蛉雌雄觸角cDNA 文庫,填補了脈翅目昆蟲cDNA 文庫數據信息的稀缺,豐富了大草蛉基因序列信息,為克隆發掘大草蛉嗅覺相關基因及探索其嗅覺識別機制奠定基礎,為合理利用大草蛉進行生物防治提供理論依據。
1 材料與方法
1.1 材料
1.1.1 供試蟲源
大草蛉采自中國農業科學院廊坊科研中試基地棉田和玉米田,成蟲于室內人工氣候箱中飼養,寄主為大豆蚜Aphis glycines,建立穩定種群,飼養條件:溫度(26±2)℃,相對濕度(50±10)%,光周期L∶D=14 h∶10 h。羽化三天之內剪下觸角,用離心管放液氮中收集50 對以后放-70℃冰箱備用。
大豆蚜采自中國農業科學院廊坊科研中試基地大豆田,室內以大豆Glycine max L.,(品種為化誘5 號)為寄主飼養多代,建立穩定種群。飼養條件:溫度(25±2)℃,相對濕度(50±10)%,光周期L∶D=14 h∶10 h。
1.1.2 主要試劑
Trizol 提取試劑購自Invitrogen 公司;氯仿、異丙醇、乙醇、瓊脂糖、LB 培養基制備所用的胰蛋白胨、酵母提取液、AMP、X-gal、IPTG 瓊脂粉、二甲苯藍等試劑購自中保科農生物科技有限公司;In-Fusion SMART cDNA 文庫構建試劑盒購自Clontech 公司(包括In-Fusion SMARTer PCR cDNA Synthesis Kit;In-Fusion HD Cloning Kit;In-Fusion SMARTer Directional Cloning & Screening Component;Advantage?倕2 PCR Kit);大腸桿菌Escherichia coli 感受態細胞DH5α 購自北京全式金生物技術有限公司。其他均為進口或國產分析純試劑。
1.2 引物序列
第一鏈cDNA 合成引物In-Fusion SMART CDs Primer(12μM):
5'-CGGGGTACGATGAGACACCATTTTTTTTT TTTTTTTTTTTVN-3'
(N=A,C,G,or T;V=A,G,or C)
雙鏈cDNA 合成引物:
3'In-Fusion SMARTer PCR Primer(12μM):5'-CGGGGTACGATGAGACACCA-3'
菌液PCR 檢測采用引物:
F:5'-TCACACAGGAAACAGCTATGA-3',R:5'-CCTCTTCGCTATTACGCCAGC-3'
1.3 大草蛉觸角總RNA 提取及cDNA 合成
采用Trizol 法提取大草蛉成蟲觸角總RNA。用準備好的剪刀剪下已被乙醚處理的大草蛉觸角約50-100 mg 放入預冷的干凈研缽中,加入液氮后,迅速研磨成粉末狀,加入1 mL Trizol,充分混勻后,移入1.5 mL 離心管中,氯仿抽提,加入異丙醇沉淀RNA,75% 乙醇洗滌2 次,溶于30μL Rnase-free water。用瓊脂糖凝膠電泳和Nanodrop ND-2000 定量總RNA 的純度和濃度。
cDNA 第一鏈合成按照In-Fusion ? SMARTeTMDirectional cDNA Library Construction Kit 說明書進行。在無菌1.5 mL 離心管中依次加入:提取總RNA 1μg(約2μL),In-Fusion SMART CDs Primer(12μM)1μL,去離子水加至4.5μL,混勻,72℃孵育3 min 后,42℃放置2 min。再向反應管中依次加入以下試劑:5×First-Strand Buffer 2μL,DTT(100 mM)0.25μL,dNTP Mix(10 mM)1μL,SMART V oligonucleotide(12μM)1μL,Rnase Inhibitor 0.25μL,SMARTscribeTMReverse Transcriptase(100 U)1μL。簡單離心后,42℃溫浴90 min,68℃孵育10 min 終止第一鏈cDNA 的合成。將cDNA 放于-20℃保存備用。
1.4 LD-PCR 合成雙鏈cDNA
于100μL PCR 反應體系中加入第一鏈cDNA 2μL,去離子水80μL,10×Advantage 2 PCR Buffer 10μL,50×dNTP Mix(10μM)2μL,5'PCR Primer ⅡA(12μM)2μL,3'In-Fusion SMARTer PCR Primer(12μM)2μL,50×Advantage 2 Polymerase Mix 2μL。簡單離心混勻。反應條件為條件體系:oliacoli 95 ℃預變性1 min;95℃變性15 s,65℃退火30 s,68℃延伸6 min,先設置15個循環,然后暫停程序,轉移70μL 至第二個反應管中,于4℃保存。余下的30μL 繼續擴增,每加3個循環,取出5μL 于4 ℃保存,直至達到27個循環數。將不同循環數的產物進行電泳檢測,確定最適循環數。復蘇保存的產物,加至最適循環數后,加入10μL 1%的二甲苯藍染料,混勻后,于-20℃保存備用。將循環合適的PCR 產物進行CHROMA SPIN+TE-1000 過柱后,選取0.4-2.0 kb 之間的cDNA 片段與載體連接。
1.5 ds cDNA 的純化與分離
按照試劑盒說明書,將CHROMA SPIN+TE-1000 柱子取出,顛倒數次,以便混勻懸浮膠體。將分離柱固定好,移去底蓋,使貯存Buffer 通過重力作用留下,調整流速為1 d/40-60 s,待貯存Buffer 流盡后,沿著柱管壁緩慢加入700μL 柱Buffer,直到流盡,(約15~20 min),緩慢的加入含二甲苯藍的ds cDNA 于分離柱內,靜置2 min,使樣品完全吸附于基質中,加入100μL 的柱Buffer 沖洗含有ds cDNA 的離心管,并緩慢加入到分離柱內。準備16個收集管至于柱子下面,第一個離心管對著柱子下面的出口。加入600μL 柱Buffer 后,立即收集,每管一滴(約35μL),直到收集完全部的離心管。每管取3μL 于1.1%的瓊脂糖凝膠電泳上檢測,染料遷移1-2 cm 時停止電泳(若時間太長,很難看到條帶)。根據觀察結果,收集片段最長的3-4 管ds cDNA 重新混合到一個新的離心管中。向離心管中依次加入1/10 體積的 Sodium Acetate(3 M;pH4.8),Glycogen(20 mg/mL)1.3μL,2.5 倍體積的95% 乙醇。前后晃動,充分混勻。于-20 ℃過夜保存,以便沉淀ds cDNA。次日,室溫,14 000 rpm,離心20 min。用槍小心的移去上清,不要觸及底部沉淀,充分干燥。向試管中加入600μL 80%的乙醇,室溫下14 000 rpm 離心5 min。小心移去上清,不要碰及沉淀,干燥10 min。用10μL 去離子水重新懸浮沉淀,輕微混勻,于-20 ℃保存備用。
1.6 ds cDNA 與pSMART2IFD 載體連接
cDNA 片段和載體的連接比率是決定文庫轉化效率和文庫庫容的關鍵因素。因此,為了得到最佳的連接效率,在此建立了3個連接反應體系(表1)。

表1 In-fusion 克隆連接體系Table 1 In-fusion cloning reactions
加完上述試劑后輕輕混勻,短暫離心,50℃孵育15 min,然后轉移至冰上。向連接體系A,B,C 中分別加入TE 90μL,Quick Clean Resin 10μL,渦旋1 min,將上清液轉移至新的離心管中,向上清液中加入1.2μL glycogen,混勻后,加入280μL 無水乙醇,前后震蕩混勻。將離心管與-70℃放置過夜。次日,15 000 rpm 離心20 min,小心吸走乙醇,不要觸及底部沉淀。空氣中干燥后,用10μL 無菌水重新懸浮。至此得到3種不同連接反應的重組質粒。
1.7 重組質粒電轉入E.coli 感受態細胞
將上述含A,B,C 三管中的重組質粒分別加入解凍后的DH5α 電轉感受態細胞,每管25μL,輕輕混勻。電轉條件:電擊杯內徑0.1 cm,電轉參數為2 000 V,200 Ω。電轉完成后轉移到加有965μL 的LB 培養基上,于37℃225 rpm 條件下孵育1 h。每管分別取出2μL 電轉物涂布在含有氨芐霉素的培養基上,37℃倒置培養過夜。次日,檢查菌落生長狀況,從而確定最佳的連接比例。
1.8 文庫質量鑒定
挑取文庫中單克隆若干個,在液體LB 培養基中培養過夜,次日取1μL 作為菌液PCR 的模板,加入PCR Mix(2×)10μL,正向和反向引物各1μL(10μM),加去離子水至20μL,混勻,離心。PCR 反應程序如下:95℃變性30 s,65℃退火30 s,68℃延伸3 min,3個循環;95℃變性30 s,68℃延伸3 min,25個循環。PCR 完成后在1.5%的瓊脂糖凝膠電泳上檢測插入片段的大小。
1.9 文庫滴度的測定
在將原始cDNA 文庫冷凍保存之前,應當確定檢測其滴度(以1μL 文庫菌液涂板產生的單克隆數表示)。美國Clontech 公司一個良好的基因文庫標準為:原始文庫的重組子數據應達到5×105-5×108。插入的cDNA 片段不小于300 bp。
文庫滴度測定方法如下:
分別取0.5μL,0.25μL,0.05μL,0.025μL,0.005μL 涂布LB 平板,37℃培養12 h 左右,計算長出的單克隆數目。
文庫滴度(pfu/mL)=(單克隆數×稀釋倍數)/受體菌體積
2 結果與分析
2.1 大草蛉觸角RNA 的提取
瓊脂糖甲醛變性凝膠電泳檢測總RNA,結果如圖1(示雄性觸角總RNA,雌同)。由圖可見28s rRNA,18s rRNA 條帶清晰可見,5s rRNA 及其他小核糖體RNA 條帶微弱可見,表明提取的RNA完整性較好,也沒有明顯的DNA 污染。經Nanodrop ND-2000 測得總RNA 濃度為408 ng/μL,A260/A280值為1.91,表明提取RNA 純度較高,完全符合構建文庫的質量要求。

圖1 大草蛉雄蟲觸角總RNA 電泳Fig.1 Total RNA of Chrysopa pallens male antennae
2.2 最佳循環數的確定
PCR 產物經過1.1%的瓊脂糖凝膠電泳檢測(圖2),結果顯示,設置18個循環數條帶較亮,表明在LD-PCR 合成體系中循環數為18 較為合適。
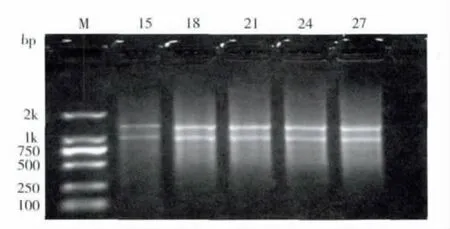
圖2 不同循環數下的LD-PCR 擴增產物瓊脂糖凝膠電泳Fig.2 Agarose gel electrophorests of ds cDNA based on different cycles
2.3 ds cDNA 分析
第一鏈cDNA 經LD-PCR 擴增后,其雙鏈片段成彌散帶,大小主要集中于0.4-2.0 kb 之間(圖2),且均一性良好,并且可見幾條明顯的亮帶,代表觸角中含量比較高的mRNA。
2.4 ds cDNA 的純化與分離
由于小片段比較容易連接到載體上,因此需要經過過柱分級分離,除去小片段的cDNA 片段和引物片段。利用CHROMA SPIN+TE-1000 柱除去小片段的cDNA 片段,分離ds cDNA 片段,共收集16 管洗脫液,電泳結果如圖3,泳道1-16 代表按不同長度分級分離得到的ds cDNA,由圖可以看出,第8-11 管ds cDNA 電泳產物清晰可見,并且長度適中,故收集此4 管的ds cDNA 合并成一管,和pSMART2IFD 載體連接并且電轉化DH5α感受態細胞。

圖3 按片段大小分離ds cDNAFig.3 Separation of ds cDNA by different length fraction
2.5 菌液PCR 鑒定文庫插入片段的大小
隨機挑取單克隆(>1000個)進行菌液PCR和酶切鑒定插入cDNA 片段的大小和文庫重組率,部分結果如圖4 示,由圖可知,插入片段長度基本都在500 bp 以上,重組率在93%以上,說明構建的文庫質量較高。
2.6 cDNA 文庫滴度的測定
參照In-Fusion?SMARTer?Directional cDNA Library Construction Kit 說明書計算構建的大草蛉觸角cDNA 文庫的滴度,最后測得雄性觸角cDNA 文庫滴度為1.8×106pfu/mL,雌性觸角cDNA 文庫的滴度為2.1×106pfu/mL。
3 結論與討論
高質量的RNA 是成功構建全長cDNA 文庫的關鍵,28S 和18S 是真核生物RNA 的兩個主要亞基,電泳時一般28S 的亮度約為18S 的兩倍。本試驗在反復提取總RNA 后,幾次電泳得到的結果均顯示18S 條帶遠比28S 亮,這與Gambacurta 等(1993)在提取昆蟲觸角RNA 的試驗結果吻合。Fujiwara & Ishikawa(1986)認為這種現象的產生是由于28S RNA 較18S RNA 容易斷裂,且斷裂產物大小與18S 相當,導致28S 含量的減少或缺失而18S 相對偏多的情況。本試驗得到的總RNA 具有較好的完整性(A260/A280=1.91),純度及完整性均達到文庫構建要求,完全可以用來合成雙鏈cDNA。

圖4 菌液PCR(A)和酶切鑒定(B)cDNA 文庫插入片段大小和重組率Fig.4 The inserts length and recombinant efficiency of the antennal cDNA library evaluated by PCR or enzyme digestion
過柱分離過程中,分離片段的大小會影響到文庫的質量,是決定cDNA 文庫插入片段平均長度和初始文庫滴度的關鍵因素。如果為保證文庫的插入片段平均長度而篩除過多的cDNA 片段,在構建文庫過程中,勢必會降低文庫的初始滴度,因此可能丟掉一些基因,降低文庫的質量。若不能有效篩除短片段,則其將與載體優先連接,這樣就會使文庫平均插入片段長度縮短,從而大大降低文庫的應用價值(張麗芳等,2012)。本試驗在cDNA 片段與載體連接之前,將合成的cDNA 通過CHROMA SPIN+TE-1000 分離柱進行分級分離,可以有效地將小片段和引物片段去除。此外,由于嗅覺相關基因的長度大多分布在0.4-2.0 kb 之間(張康,2011;Gao & Wang,2014),我們構建該文庫的目的是為后續克隆大草蛉嗅覺相關基因奠定基礎,所以本研究中僅切取長度在500 bp 以上的片段用于后續文庫的構建。
全長cDNA 文庫構建是篩選全長基因的重要方法,也是進行功能基因組研究的一種經濟、快速、有效的途徑。它克服了傳統cDNA 文庫的缺點,極大促進了功能基因組的研究進程(Wiemann et al.,2003)。為此,構建全長cDNA 文庫已經越來越受到研究者的重視,許多種重要生物全長cDNA 文庫相繼建成。然而,對于較小組織而言,因獲得足夠的組織材料非常困難,其文庫構建相應的也十分困難。昆蟲觸角即屬于該種情況。谷少華(2010)運用傳統 SMART 技術以苜蓿盲蝽Adelphocoris lineolatus(Goeze)雌雄觸角各300 根以上為提取總RNA 的原始材料構建了其觸角cDNA 文 庫。Zhang 等(2011)以棉鈴Helicoverpa armigera(Hübner)雌雄觸角各200 根以上為材料構建了其觸角cDNA 文庫,所用組織材料數量較大且較難獲得。本試驗以大草蛉Chrysopa pallens(Rambur)雌雄觸角為材料,繼傳統SMART 技術之后運用優化的Infusion SMART 技術以雌雄觸角各60 根提取總RNA,成功構建了其觸角cDNA 文庫,且雌雄觸角cDNA 初級文庫滴度達到2.1×106pfu/mL 和1.8×106pfu/mL,構建獲得的文庫質量較高。與其他文庫構建結果相比,Infusion SMART 技術是一種比較好的全長文庫構建技術,其優點體現在:一是建庫效率高。與其他較常用的OLIGO-CAPPING(Maruyam et al.,1994)、CAP TRAPPER(Suzuki et al.,1997)方法及傳統SMART 技術相比,Infusion SMART 技術所使用的原始材料mRNA 用量更少,省去了雙鏈cDNA 的酶切步驟,實驗快速、簡單,可以從poly+RNA 開始,也可以從總RNA 開始,大約需要50 ng 就可以構建一個結果較好的文庫(106pfu左右),彌補了因材料不足所帶來的困擾。二是文庫重組率較高。Infusion SMART 試劑盒中載體與cDNA 之間雖然是平端連接,但試驗結果顯示自連可能性很小,本試驗中文庫重組率高達93%以上。
脈翅目昆蟲基因數據信息較少,對其進行全長cDNA 文庫的構建、測序和功能注釋為研究該物種的基因功能提供了極為寶貴的資源,為深入開展昆蟲觸角嗅覺相關基因的克隆及信息識別機制的研究,提供了成本低廉且信息量豐富的技術平臺。從利用捕食性(或寄生性)天敵昆蟲進行害蟲生物防治角度,掌握了天敵昆蟲嗅覺相關蛋白與外界氣味化合物之間的作用機理,有利于人們對天敵昆蟲行為的控制,通過釋放對天敵昆蟲有較強吸引作用的氣味化合物于田間或溫室大棚,從而提高其在某一特定空間的成功定殖性。張康(2011)通過構建中紅側溝繭蜂Microplitis mediato(Haliday)觸角cDNA 文庫共鑒定獲得10個氣味結合蛋白基因和34個氣味受體基因,并結合氣味結合蛋白熒光結合功能與室內行為試驗共驗證7種氣味化合物對中紅側溝繭蜂有較強吸引作用。本試驗應用In-fusion SMART 技術構建了大草蛉雌雄觸角全長cDNA 文庫。希望通過對cDNA 文庫的篩選、克隆,大量獲得大草蛉嗅覺相關蛋白基因,為研究大草蛉嗅覺識別機制奠定基礎,為進一步利用大草蛉防治農林害蟲提供理論依據。
References)
Benton R,Varmiee KS,Gamez C,et al.Variant lonotropic glutamate receptors as chemosensory receptors in Drosophila[J].Cell,2009,136(1):149-162.
Breer H,Raming K,Krieger J.Signal recognition and transduction in olfactory neurons[J].Biochem.Biophys.Acta,1994,1224:277-287.
Field LM,Pickett JA,Wadhams LJ.Molecular studies in insect olfaction[J].Insect Molecular Biology,2000,9:545-551.
Fujiwara H,Ishikawa H.Molecular mechanism of introduction of the hidden break into the 28S rRNA of insects:Implication based on structural studies[J].Nucleic Acids Research,1986,14(16):6393-6401.
Gambacurta A,Piro MC,Asco1i F.Cooperative homodimeric hemoglobin from Scapharca inaequivalvis:cDNA cloning and expression of the fully functional protein in E.coli[J].FEBS Letters,1993,330(1):90-94.
Gao X,Wang MQ.A cDNA library from the antenna of Monochamus alternatus Hope and binding properties of odorant-binding proteins[J].Journal of Applied Entomology,2014,138(3):233-240.
Gu SH.Exploration and functional analysis of olfactory related genes in the lucerne plant bug,Adelphocoris lineolatus(Goeze)[D].Beijing:Chinese Academy of Agricultural Sciences,2014.[谷少華.苜蓿盲蝽嗅覺相關基因的發掘及功能分析[D].北京:中國農業科學院碩士學位論文,2010]
Kaissling KE,Zack SC,Rumbo ER.Adaptation processes in insect olfactory receptors:Mechanisms and behavioral significance[J].Annals of the New York Academy of Sciences,1987,510:104-112.
Kazuo M,Sumio S.Oligo-capping:a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides[J].Gene,1994,138(1-2):171-174.
Li H,Zhang AJ,Chen LZ,et al.Construction and analysis of cDNA libraries from the antennae of Batocera horsfieldi and expression pattern of putative odorant binding proteins[J].Journal of Insect Science,2014,14(57):1-15.
Lin MZ,Chen HY,Wang SY,et al.Development of artificial diet for Chrysopa pallens larva[J].Chinese Journal of Biological Control,2007,23(4):316-321.[林美珍,陳紅印,王樹英,等.大草蛉幼蟲人工飼料的研究[J].中國生物防治,2007,23(4):316-321]
Steinbrecht RA.Pore structures in insect olfactory sensilla:a review of data and concepts[J].International Journal of Insect Morphology and Embryology,1997,26:229-245.
Steinbrecht RA,Stankiewicz BA.Molecular composition of the wall of insect olfactory sensilla-the chitin question[J].Journal of Insect Physiology,1999,45(8):785-790.
Suzuki Y,Yoshitomo NK,Maruyama K,et al.Construction and characterization of a full length-enriched and a 5'-end-enriched cDNA library[J].Gene,1997,200(1-2):149-156.
Wiemann S,Mehrle A,Bechtel S,et al.cDNAs for functional genomics and proteomics[J].Comptes Rendus Biologies,2003,326(10):1003-1009.
Wu HH.Research on the effect of greenhouse environmental factors on Chrysopa pallens(Rambur)and Chrysopa formosa Brauer dispersal behavior[D].Beijing:Chinese Academy of Agricultural Sciences,2014.[武鴻鵠.溫室環境因子對大草蛉和麗草蛉擴散行為的影響研究[D].北京:中國農業科學院碩士學位論文,2014]
Zhang K.Binding characterization of odorant-binding protein MmedOBP8 in the Microplitis mediator and the taxis responseauthentication[D].Wuhan:Huazhong Agricultural University,2011.[張康.中紅側溝繭蜂氣味結合蛋白MmedOBP8 的氣味結合特征及行為反應驗證[D].武漢:華中農業大學碩士畢業論文,2011]
Zhang LF,Zhu JY,Yang FZ,et al.Construction and analysis of full length cDNA library from the antenna of Spodoptera exigua[J].Biotechnology,2012,4:11-14.[張麗芳,朱家穎,楊發忠,等.甜菜夜蛾觸角全長cDNA 文庫的構建與分析[J].生物技術,2012,4:11-14]
Zhang TT,Gu SH,Wu KM,et al.Construction and analysis of cDNA libraries from the antennae of male and female cotton bollworms Helicoverpa armigera(Hübner)and expression analysis of putative odorant-binding protein genes[J].Biochemical and Biophysical Research Communications,2011,407:393-399.
Zhang S,Zhang YJ,Su HH,et al.Cloning and tissue-specific expression of olfactory receptors in Helicoverpa armigera(Hübner)[J].Acta Entomologica Sinica,2009,52(7):728-735.[張帥,張永軍,蘇宏華,等.棉鈴蟲氣味受體的克隆與組織特異性表達[J].昆蟲學報,2009,52(7):728-735]
Zhang S,Zhang YJ,Su HH,et al.Cloning,expression and tissue-specific expression of cDNA encoding pheromone binding protein PBP2 in Helicoverpa armigera(Hübner)[J].Scientia Agricultura Sinica,2009,42(7):2359-2365.[張帥,張永軍,蘇宏華,等.棉鈴蟲信息素結合蛋白PBP2 cDNA 的克隆、表達與組織特異性表達[J].中國農業科學,2009,42(7):2359-2365]
Zhou JJ,Field LM,He XL.Insect odorant—binding protein:Do they offer an alternative pest control strategy?[J].Outlooks on Pest Management,2010,21(1):31-34.

