苯妥英鈉片溶出度試驗方法的改進
李楊,聞京偉,蔣登高,郭毅(.河南省食品藥品檢驗所,鄭州450003;.鄭州大學化工與能源學院,鄭州 45000)
苯妥英鈉(Phenytoin sodium)主要作為癲癇大發作的首選藥物,在空氣中會漸漸吸收二氧化碳分解成苯妥英;其水溶液顯堿性反應,常因發生部分水解而產生渾濁[1];且筆者根據試驗發現,該藥在酸性溶液和在pH 9.6以下的緩沖液中均產生沉淀。該藥臨床使用個體差異大,治療濃度范圍窄(有效血藥濃度10~20 μg/ml)[2],據醫院臨床血藥濃度監測人員反映,不同廠家、不同批次的苯妥英鈉片在同一患者體內的血藥達峰濃度和時間均不一樣,患者在更換藥品廠家和批號時常出現不良反應。可見,該藥在各廠家各批次之間有顯著差異,進行溶出度的考察很有必要。
2010年版《中國藥典》(二部)中以水作為溶出介質考察苯妥英鈉的溶出度[1],但由前所述苯妥英鈉的性質可知,其在水中不穩定;筆者經過試驗發現,對照品水溶液在短時間內吸光度就有明顯下降,因此,這對大批量檢驗十分不便;此外,水對不同廠家片劑的區分作用也比較差。在日本橙皮書中并未收載該藥的溶出行為,其所常用的幾種介質也均偏酸性,均可使該藥產生沉淀,無法測定,即使嘗試加入表面活性劑和模擬人工胃液后也同樣產生沉淀。為了更好地區分藥品的溶出行為,以及使其在溶出介質中性質更穩定,不在短時間內降解,筆者決定采用pH 10.0的緩沖液(硼砂-氫氧化鈉)為溶出介質,對苯妥英鈉片進行溶出度評價。結果表明,建立的方法區分作用強,并且使溶液更加穩定。本試驗中,筆者根據醫院推薦得知某知名企業S藥廠生產的產品效果最佳,決定以該廠產品作為參比制劑進行以下試驗。
1 材料
1.1 儀器
UV-2550紫外分光光度測定儀(日本島津公司);FOPT-601FX光纖藥物溶出儀(上海富科思生物技術發展有限公司);ZKT-18F真空脫氣儀(天津市天大天發科技有限公司)。
1.2 藥品與試劑
苯妥英鈉對照品(中國食品藥品檢定研究院,批號:100210-201002,純度:98.6%);苯妥英鈉片(國內12家藥廠生產產品,廠家編號為A~L,產品共247批,規格分別為:每片50、100 mg);參比制劑苯妥英鈉片(S藥廠,批號:043120302,規格:每片50 mg)。
2 方法與結果
2.1 對照品溶液的制備
分別取苯妥英鈉對照品40 mg兩份,精密稱定,分別置于兩個200 ml量瓶中,用水和pH 10.0緩沖液(0.05 mol/L硼砂50 ml和0.2 mol/L氫氧化鈉溶液43 ml混合,稀釋至200 ml)分別溶解并稀釋至刻度,得兩種溶出介質的對照品溶液。
2.2 測定條件
光纖溶出儀測定;測定間隔:60 s;探頭規格:5 mm;檢測波長:258 nm,參比波長:550 nm[3];溶出時間:60 min。
2.3 溶出條件的選擇
2.3.1 方法、轉速及溶出介質體積。根據2010年版《中國藥典》方法[1],仍采用槳法;為了更好地體現區分作用,轉速擬定為50 r/min;由于采用了5 mm的探頭,為了使吸光度在0.3~0.7內,溶出介質體積采用500 ml。
2.3.2 溶出曲線考察比較。取12個廠家中具有代表性的100批樣品,分別以水和pH 10.0緩沖液為溶出介質進行溶出度考察,繪制溶出曲線,并與參比制劑進行比較,見圖1。
溶出曲線與參比制劑相似的產品,才有可能在體內具有與參比制劑相似的功效。因此,能夠最大限度地區分各個產品之間的差異的溶出介質則為最理想溶出介質。考察相似性的方法一般采用相似因子(f2)法:
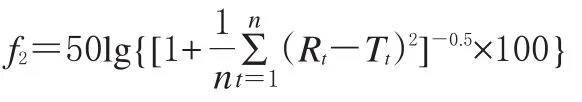
式中,Rt和Tt分別代表參比制劑和受試制劑第t時間點的平均累積釋放度,n為測試點數。
以受試制劑和參比制劑各個時間點的溶出量的差值為統計量進行分析,判斷標準(條件:任一溶出點平均差異限度不大于10%):f2小于50,兩條溶出曲線不相似;f2界于50~100,可認為兩條溶出曲線相似。
結果,除去抽驗中一些生產批數少和批號重復等部分不具有統計學意義的廠家,選取了國內3家產量大的藥廠L、H、F,比較情況見表1。
由表1結果可知,L廠家產品與參比制劑在兩種介質中最為相似,f2分別達到了78、100;而F廠家產品在水中f2為23,在緩沖液中卻全部不相似;H廠家產品在緩沖液中也較在水中的f2更低。可見,pH 10.0的緩沖液區分作用明顯,多數在水中與參比制劑相似的產品,在緩沖液中體現出了差異。據此,可推測用pH 10.0的緩沖液作為溶出介質比水對苯妥英鈉片溶出量的鑒別力更強。
2.3.3 溶出介質的選擇。根據上述溶出曲線的考察和相似性比較的結果,決定采用pH 10.0緩沖液為溶出介質。
2.3.4 限度的確定。根據溶出度檢測要求的規定,如果第1次出現相鄰的2個點溶出量均達到85%以上,且二者的平均值的差值在5%以內,則第1個點即為質量標準的取樣點。參比制劑在30、31 min時溶出量均達到100%,最終選擇30 min作為取樣點。該點的溶出量為100%,減去15%,可得溶出限度Q為85%[4]。取全國抽驗的247批產品進行光纖溶出測定后,驗證得該時間點和限度的要求有效、可行。
2.4 含量測定方法
2.4.1 專屬性試驗。取已知處方的苯妥英鈉片生產廠家的輔料按照處方配制成樣品再按供試品溶液制備方法制備,在本試驗條件下檢測,結果輔料在258 nm波長處的吸光度為0.01~0.04,供試品溶液在258 nm波長處的吸光度為0.5~0.75,可見輔料對本方法測定未見影響,方法專屬性良好。

圖1 不同廠家樣品在兩種溶出介質中的溶出曲線比較Fig 1 Comparison of dissolution curves of samples from different manufacturers in 2 dissolution mediums
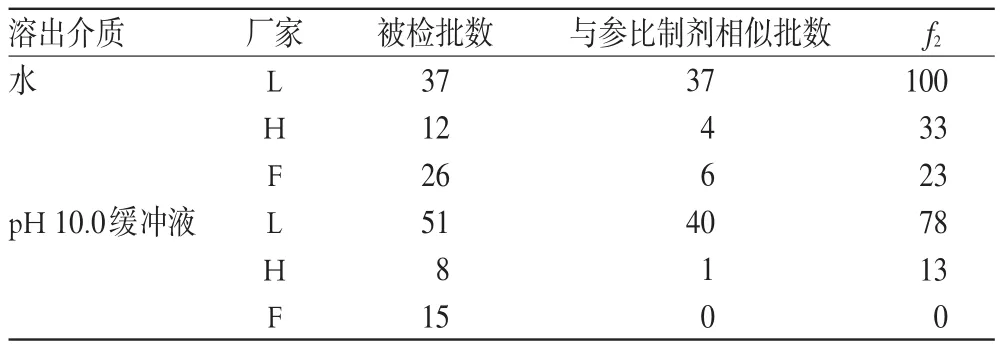
表1 各廠家產品在兩種介質中的相似性考察Tab 1 Similarities assessment of samples from different manufacturers in 2 dissolution mediums
2.4.2 線性關系考察。精密稱取苯妥英鈉對照品約32 mg,置于50 ml量瓶中,加pH 10.0緩沖液溶解并稀釋至刻度,搖勻得貯備液。精密量取貯備液置于量瓶中,加緩沖液稀釋至刻度,搖勻,分別配制質量濃度為0.032、0.064、0.080、0.160、0.192、0.320 mg/ml的系列溶液,于258 nm波長處測定。以質量濃度(x)為橫坐標、吸光度(y)為縱坐標進行線性回歸,得回歸方程為y=3.3706x-0.0045(r=0.9999),結果表明苯妥英鈉檢測質量濃度線性范圍為0.032~0.320 mg/ml。
2.4.3 重復性試驗。取“2.4.2”項下溶液(0.192 mg/ml),重復測定6次,結果吸光度的RSD=0.2%(n=6)。
2.4.4 穩定性試驗。取某批樣品配制成供試品溶液(溶劑為pH 10.0的緩沖液)后分別在0、1、2、4、8、24 h測定吸光度,結果吸光度的RSD=0.3%(n=6),表明苯妥英鈉在pH 10.0的緩沖液中24 h內穩定性很好。
2.4.5 耐用性試驗。更換紫外分光光度計,由3名不同人員測定同一供試品溶液,測得吸光度的RSD=0.3%(n=3),可見方法耐用性好。
2.4.6 回收率試驗。分別精密稱取苯妥英鈉對照品及輔料置于200 ml量瓶中,制備質量濃度為0.10、0.15、0.20 mg/ml的溶液各3份,測定吸光度,計算得回收率,見表2。
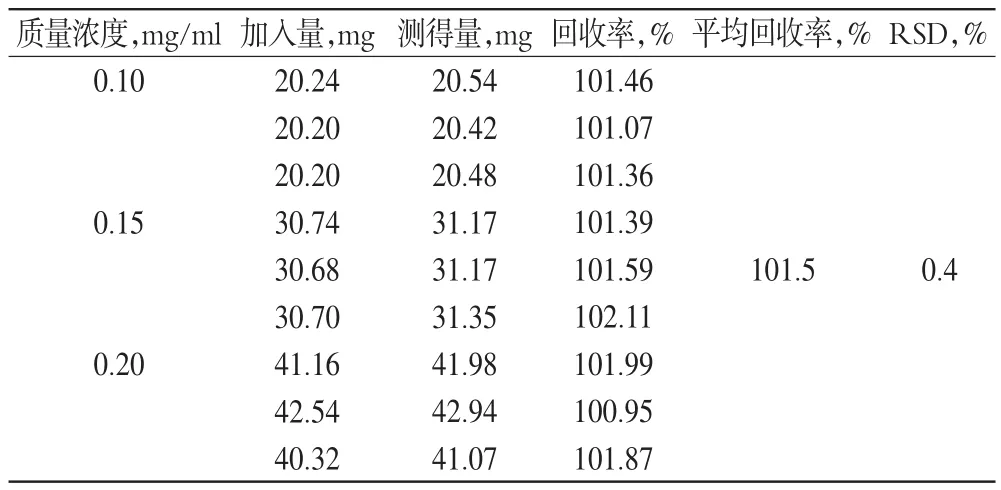
表2 回收率試驗結果(n=3)Tab 2Results of recovery tests(n=3)
2.5 在pH 10.0的緩沖液與水溶液中穩定性比較
在進行pH 10.0的緩沖液的穩定性試驗時,同時配制水溶液,平行做穩定性試驗,分別在0、1、2、4、8、24 h測定吸光度。結果吸光度分別為 0.674、0.667、0.660、0.651、0.648、0.621,RSD=2.9%(n=6)。可見與pH 10.0的緩沖液相比,苯妥英鈉水溶液的穩定性較差,苯妥英鈉分解較快。
2.6 測定結果
取抽樣量較大的3家企業樣品采用《中國藥典》方法和本方法的測定結果見表3。
由表3結果可見,取全國12個廠家247批樣品按照建立的方法測定溶出度,結果不合格率為8.1%;而按《中國藥典》方法檢測的結果卻是樣品全部合格,二者結果有顯著差異。其中L廠家的合格率為100%,H廠家的合格率為94%,F廠家的合格率為91%,這與溶出曲線的相似率比較結果也是一致的。從試驗中筆者還發現,這些產品在緩沖液中的溶出曲線千差萬別,部分樣品3 min就全部溶出了,而部分樣品在整個溶出時間內都沒有平臺期,這可能就是為什么不同廠家不同批號的產品,雖然檢查結果都是合格的,但在同一個患者身上產生的效果不一樣的原因。如果用水溶液為溶出介質,這種差別就無法體現了,并且穩定性也不好。由此可以確證,現行標準的區分作用明顯不夠,采用pH10.0的緩沖液作為溶出介質能夠顯著提高區分作用。
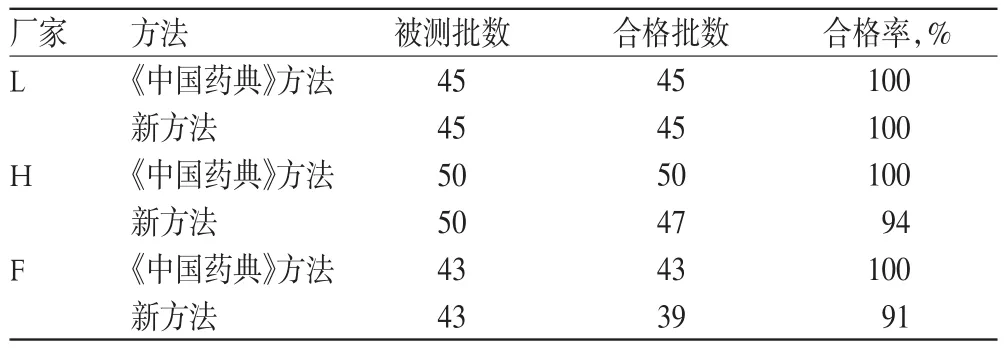
表3 兩種測定方法測得合格率比較Tab 3 Comparison of qualification rate between 2 kinds of methods
3 討論
為了使溶液穩定不降解,并能夠有效地區分產品的優劣,筆者認為現行法定標準中苯妥英鈉片溶出度考察時需要改變溶出介質的pH,并建議以pH 10.0的緩沖液代替水作為溶出介質。
筆者在考察了鄭州市幾家大型醫院苯妥英鈉片的臨床使用情況并進行了血藥濃度監測后發現,服藥后患者的血藥濃度差別較大。經分析后估計,隨著人年齡的增長,胃酸的分泌越來越稀,胃動力也越來越差,藥物的吸收也將越來越難,由此造成血藥達峰時間隨著年齡增長越來越延長。考慮到中老年人的胃動力并且為了更好體現區分作用,建議苯妥英鈉片溶出度考察時轉速設為50 r/min,而不是《中國藥典》中的100 r/min,取樣時間則根據試驗結果定為30 min。
在試驗中發現,F廠家樣品與參比制劑相比溶出曲線差別最大,且廠內批與批之間的重復性也很差,分析可能是由于所有的廠家幾乎都用了淀粉作為填充劑,而F廠沒有使用淀粉作為填充劑,并且制劑工藝不穩定所致。L廠家的產品與參比制劑相似性最高,但在輔料中只用到了淀粉和硬脂酸鎂,比參比制劑相比少用了兩種輔料。可見,淀粉和硬脂酸鎂是達到苯妥英鈉最佳溶出的必需輔料,其余輔料可視情況而定。而H廠家用到的輔料以及制片過程與L廠家都近似,但相似率卻不高,分析可能是因為制片過程中操作不同造成的。
綜上所述,本文建立的苯妥英鈉片溶出度方法區分作用強、溶液穩定,不僅對藥品的質量控制具有現實意義,而且對于改進制劑工藝、進一步提高藥物的生物利用度也具有較好的考察作用。
[1]國家藥典委員會.中華人民共和國藥典:二部[S].2010年版.北京:中國醫藥科技出版社,2010:440.
[2]王蘋,柯永勤,王念祖.苯妥英鈉血藥濃度測定及其臨床意義[J].貴陽醫學院學報,1990,15(2):159.
[3]陳英,貝琦華.光纖藥物溶出原位過程監測儀評價茶苯海明片的體外溶出度[J].中國藥房,2010,21(33):3144.
[4]鄭淑鳳,郭偉斌.氨苯蝶啶片溶出度試驗方法的建立[J].藥物分析雜志,2011,31(12):2338.

