刺參高溫定向選育群體子一代耐溫性狀的分析
趙 歡, 劉石林, 楊紅生, 趙鶴凌, 林承剛
(1. 大連海洋大學 遼寧省海洋生物資源恢復與生境修復重點實驗室, 遼寧 大連 116023; 2. 中國科學院海洋研究所, 海洋生態與環境科學重點實驗室, 山東 青島 266071; 3. 中國科學院 成都生物研究所, 四川 成都610041 )
刺參(Apostichopus japonicus)隸屬于棘皮動物門、海參綱、楯手目、刺參科。其富含蛋白質, 黏多糖和微量元素, 具有很高的營養和藥用價值[1-2]。近年來隨著刺參的藥用和保健價值逐步得到全球化認識, 刺參需求量不斷增加, 刺參的苗種繁育和養殖業迅速發展, 養殖規模不斷擴大, 養殖產量日益提高。2011年我國刺參的養殖面積約為15萬hm2, 產量約11萬t, 產值約為200億元人民幣, 刺參已經成為我國北方沿海主要的海水養殖經濟種類。
刺參屬于溫帶種類, 主要分布于西太平洋北部,包括中國黃渤海海域、俄羅斯東部海岸、日本和韓國沿岸等區域。水溫對刺參的生長影響顯著, 刺參生長的適宜溫度為 5~20℃, 最適生長溫度為 10~16℃[3],當水溫升高到一定溫度, 刺參會停止活動, 進入“夏眠”狀態。隨著緯度的增加刺參進入夏眠的時間而推遲, 刺參的夏眠期最短2個月, 最長4個月, 一般在100 d左右。在夏眠期間刺參消化道萎縮, 靠消耗自身的能量維持生存, 體重明顯減輕。這一特殊習性延緩刺參生長速度, 延長養殖周期, 影響刺參養殖業的效益。近年來養殖業摸索出刺參南移養殖模式[4],一定程度上加速刺參生長, 獲得較好的結果, 但是由于春末到秋末的高溫限制, 養殖周期一般為冬季。為此利用育種技術培育具有高溫耐受性的刺參是縮短刺參養殖周期, 提高刺參養殖業經濟效益的有效途徑之一, 也是刺參良種培育的重要方向之一。本實驗室近年來利用高溫選育和定向培育獲得具有耐高溫性狀的群體, 對其高溫耐受性狀進行了初步檢測,確定其對于高溫的耐受性與普通群體相比提高1℃。
溫度是影響刺參生長、發育、繁殖的重要因素之一, 刺參對溫度變化響應機理的研究已逐步開展。Yang等[5]研究發現在一定恒溫(10~30℃)范圍內, 隨溫度的升高, 刺參耗氧率呈上升趨勢; 隨著溫度的升高刺參體內能量分配發生變化, 呼吸能顯著增加而生長能下降; 溫度變化會引起刺參消化酶及抗氧化酶等生理活性發生改變[6-7]。隨著刺參分子生物學的展開, 已經建立了溫度脅迫下刺參的消減文庫并對熱刺激下刺參熱休克蛋白表達量差異進行分析[8-9]。通過上述研究初步建立了溫度脅迫對刺參影響的生理生化及分子生物學研究方法, 但目前尚未見將這些測定方法用于耐溫群體性狀分析的報道。為此本研究利用存活率和功能基因表達兩個檢測指標, 對比不同群體子代高溫存活率及熱休克蛋白基因表達量的變化, 對定向選育耐溫群體子代的耐溫性進行探索, 初步驗證選育群體耐溫性狀的可遺傳性, 為刺參耐溫良種選育提供一定的理論依據。
1 材料與方法
1.1 實驗動物
2009年6月在山東煙臺東方海洋科技股份有限公司海參育苗場隨機選取定向選育刺參群體子一代幼參 100頭, 另選取相同數量的同期煙臺野生群體幼參作為對照組, 幼參平均體長為 1~2cm, 體質量為1.8 g±1.03 g。其中定向選育刺參為本實驗室2006年經過高溫選育并經 3年南移池塘養殖獲得的耐高溫群體。實驗前, 幼參置于0.5 m3水槽中暫養7 d, 水溫維持在 23 ℃ ±0.5 ℃ ,每天按時定量投喂自行配制的人工餌料(由鼠尾藻粉、馬尾藻粉、活性干海泥各1/3 組成)。
1.2 不同群體幼參溫度耐受性實驗
從兩個群體幼參中隨機選擇30只個體混合進行預實驗, 實驗在容積為0.35 m3的水箱中進行, 設置4個溫度, 每個溫度設置3個重復。實驗采取緩慢升溫方法, 溫度從 23℃緩慢升至 28℃、30℃、32℃、34℃, 平均升溫幅度 0.5℃/h; 到達最高溫度后維持24 h, 后緩慢降溫恢復到常溫, 另設置常溫對照組。恢復溫度后每隔 6 h觀察一次, 并及時撈出死亡幼參,待穩定后統計存活幼參數目, 確定正式實驗溫度。
于2009年7月6日至7月23日進行正式實驗。設置高溫實驗組(32℃)和對照組(23℃), 每個處理組設置3個重復, 每個重復放置10頭幼參。高溫實驗組首先快速從23℃升溫至30℃, 并在30℃維持5 d,隨后以每天升溫 0.5℃的速度緩慢升溫至達到 32℃后保持在此溫度 8 d(圖 1)。水箱溫度由實驗室溫度控制系統控制, 在溫度實驗期間各組保持正常飼養、充氣和換水, 水溫變化幅度控制在 0.1℃。實驗期間每天進行觀測, 記錄并撈出死亡個體, 實驗結束后記錄最后死亡及存活的刺參數量。
1.3 不同群體幼參熱休克蛋白基因表達量的差異
在自然水溫為 23℃時, 從不同群體中隨機選擇40只幼參直接放入 28℃水體中進行急性溫度刺激,在1、2、4、10、24、48 h隨機取出5只個體, 迅速保存于液氮中待測。
取刺參體壁參照Trizol說明書進行總RNA的提取, 并反轉成cDNA模板。反轉反應體系如下: 1 μL總 RNA, 0.5 μL oligo dT(10mmol/L), 0.25 μL RNase Inhibitor(40 U/μL), 0.5μL NTP(2.5mmol/L), 1 μL M-MLV反轉錄酶(200U)加水至10 μL。反轉錄條件如下: 42℃ 1 h, 94℃ 90 s, 4℃10 min。
利用Real time PCR 擴增反應(Mastercycler? ep realplex, Eppendorf)測定 Hsp90及 Hsp26基因表達量。根據 Genebank中已有的刺參 Hsp90序列(HQ-689677), Hsp26序列(HQ689678)及β-actin序列信息(EU668024)合成引物(表 1)。反應體系包括: 12.5 μL SYBR Green PCR Master Mix(Takara), 0.5 μL Forward primer(10μmol/L), 0.5 μL Reverse primer (10μmol/L),2 μL cDNA, 用水補充至終體積25 μL。反應條件如下: 95℃變性10 s, 然后95℃5 s, 59℃20 s, 72℃ 30 s進行 40個循環。溶解反應的條件為 65~92℃, 每升0.2℃保持1 s讀板記錄熒光量。獲得的溶解曲線都為單一峰, 確定產物特異性擴增。Hsp90及 Hsp26基因表達水平計算以β-actin為內參, 對得到的各樣品 Ct值進行均一化處理, 應用 2-ΔΔCt確定不同溫度應激時間的Hsp90及Hsp26基因的相對含量(表 1)。
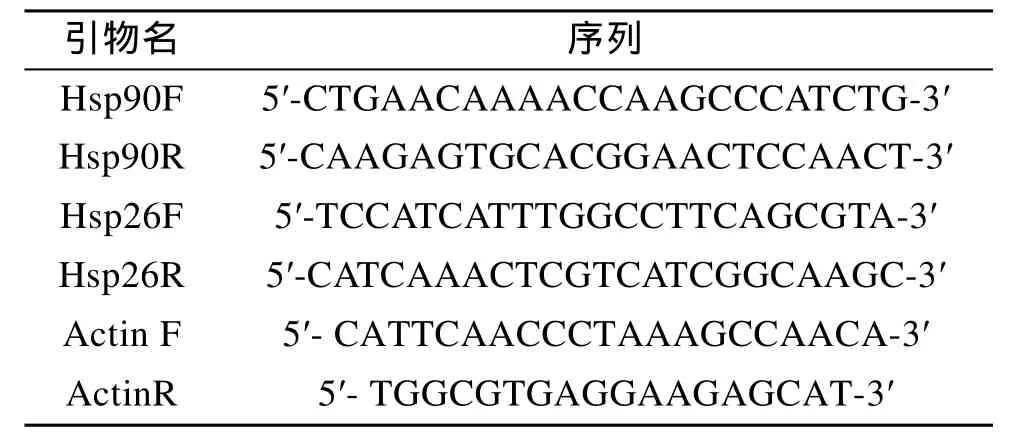
表1 引物序列信息Tab.1 Primer information in this experiment
1.4 數據處理
運用SPSS13.0軟件統計不同群體刺參幼參存活率及基因表達相對量的平均值和標準差, 并進行單因素方差分析(One-Way ANOVA)。P < 0. 05 表示有差異顯著性。所有的結果均以平均值±標準差來表示。
2 結果
2.1 不同群體子一代幼參耐高溫性能比較
在預實驗中采用 4個不同的溫度梯度對幼參進行溫度刺激, 整個過程及時撈出死亡個體, 記錄存活數量,計算存活率。結果顯示: 28℃和30℃刺激條件下混合群體刺參幼參存活率在 95%和 90%以上, 而溫度達到34℃時刺參幼參大量死亡, 在 32℃時刺參幼參的存活率為60%, 接近半數致死溫度, 故選擇32℃作為刺參幼參高溫存活率檢測溫度, 進行下一步大規模的實驗。
通過緩慢升溫和維持高溫的方式進行慢性實驗,實驗結果表明在緩慢升溫至30℃并維持在30℃這段時間里各群體子一代幼參沒有出現死亡, 但是明顯出現幼參黏附能力弱, 活動能力差的現象, 這與預實驗中獲得的結果相一致。隨著溫度逐步升高至32℃, 兩個群體子一代幼參都開始出現不同程度的個體死亡現象, 存活率不斷下降。定向選育群體子一代幼參在高溫脅迫下表現出與其親體相同的溫度耐受性, 在 30℃至 32℃的溫度變化過程中存活率始終高于野生群體。隨著時間的延長, 兩個群體不斷有幼參死亡, 待穩定后計算存活率。結果顯示, 定向選育群體子一代幼參存活率為 80.00±10.00, 與野生群體存活率(56.67±5.77)存在顯著性差異(P<0.05, 圖2)。
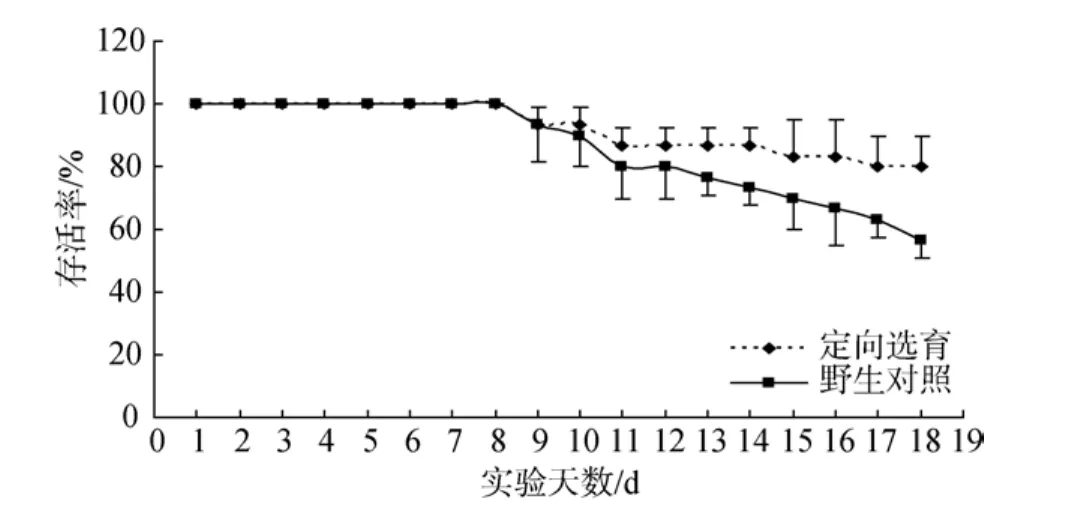
圖2 高溫刺激條件下不同群體存活率變化趨勢Fig.2 Survival trend of different population of A. japonicus under heat stress
2.2 高溫刺激下不同群體子一代幼參Hsp90及Hsp26基因表達量的變化
利用熒光定量PCR檢測發現在熱刺激過程中刺參 β-actin基因表達沒有明顯變化, 故選擇其作為內參基因評價熱休克蛋白基因表達量變化。實驗結果顯示隨著熱刺激時間的增加, 各個群體子一代幼參熱休克蛋白基因表達都呈現先升高后下降的趨勢,野生群體在熱刺激1 h時 Hsp90及Hsp26基因表達達到最高峰, 而定向選育群體則在熱刺激 2 h時Hsp90及 Hsp26基因表達達到最大。隨著時間的延長各群體子一代幼參熱休克蛋白基因表達逐漸下降,24 h時各群體基因的表達量幾乎恢復到刺激前水平。對比不同群體基因表達特征發現, 在常溫狀態下,定向選育群體熱休克蛋白基因含量略高于野生群體,但兩個群體差異不顯著; 高溫刺激誘導兩個群體子一代幼參熱休克蛋白基因表達量增加, 但是定向選育群體子一代幼參Hsp90及Hsp26基因最大表達量低于野生群體(P<0.05, 圖3)。
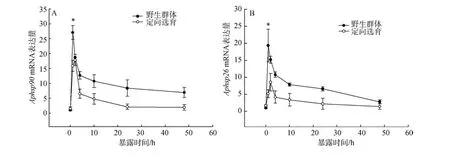
圖3 高溫刺激下不同群體子代幼參Hsp90(A)和Hsp26(B)基因表達量比較Fig.3 Comparison of Hsp90 (A) and Hsp26 (B) mRNA expression in different populations of A. japonicus under heat stress
3 討論
為了推進刺參養殖業的健康快速發展, 利用選育種技術開展優質高產抗逆品種的選育已經受到國內外學者的廣泛關注。目前國內關于刺參選育種的工作已起步, 常亞青等獲得中俄雜交群體, 并發現該群體具有較好的耐低溫能力[10]。魏玉峰等[11]對煙臺和青島海域的野生刺參群體進行選種繁育, 對不同選育組合稚幼參生長情況進行分析, 表明選育組合的稚幼參生長率高于自交對照組。
耐高溫群體的選育研究目前已經在魚類等海洋經濟物種中已廣泛開展, Brett等[12]在高溫條件下選育了虹鱒(Salmo graidneri Richard)群體, 發現其體長、體重高于對照組。作為中國主要經濟養殖品種之一, 刺參耐溫群體選育的研究目前較少。黃大宏等[13]選育獲得速生耐溫群體, 對其生長性狀進行檢測。崔靜等[14]研究了刺參南移養殖過程中的各項生理生化指標的變化, 并構建了南移養殖刺參cDNA文庫。本實驗室在近年來開展了部分高溫定向選育工作, 利用高溫脅迫定向選育獲得了部分耐高溫刺參群體,對該群體的耐溫性狀亦進行檢測, 發現選育群體比普通群體高溫耐受性提高了1℃。為了驗證該群體耐溫性狀是否穩定遺傳, 本實驗對定向選育群體子代的耐溫性進行驗證。
群體耐高溫性能的不同會受到內部因素和外部因素的雙重影響, 為了消除外部因素(包括鹽度、飼料的投喂等)對實驗的影響, 本實驗盡量使養殖條件達到一致, 從而減少這些環境因子對實驗造成的誤差, 以確保實驗獲得的耐溫性能差異主要來自于不同群體之間的差異。本實驗對比兩個群體子一代幼參高溫耐受性, 結果發現高溫脅迫條件下定向選育群體子一代幼參存活率高于野生群體幼參, 表現對高溫較好的耐受性。已有研究表明耐熱性與馴化溫度有相關性, 一定范圍內, 提高馴化溫度可以提高其耐熱性。在 20℃馴化 0.5 g的幼參亞致死溫度為30℃, 致死溫度為34℃[8]。在18℃馴化2~3 d, 1.8 g幼參的起始致死溫度(TL50)上限為25℃, 190 g成參為 26.8℃, 成參臨界熱最大值(CTM)為 29.2℃。在22℃馴化后幼參 TL50上限為 27.2℃, 成參為 28℃,成參CTM為29.5℃[15]。馴化是可逆的非遺傳性的轉變, 其引起的致死溫度的改變不能遺傳。而定向選育群體經歷了高溫選育, 篩選出的親體是對高溫具有耐受性的個體, 且該群體又經歷南移養殖定向培育,其不再是簡單的馴化, 因此其耐溫性狀存在遺傳的可能性。
熱休克蛋白(heat shock proteins, Hsps)是生物體在不利環境因素刺激下應激合成的一類具有重要生理功能的蛋白質分子伴侶, 異常溫度下生物體內Hsps的變化情況及功能研究是研究溫度脅迫的一個重要指標。大量研究表明Hsps水平的變化可以反映應激物的存在。溫度變化可導致襟疣海葵 Anthopleura elegantissima、海膽Paracentrotus lividus、貝類Hsps表達量顯著變化[16-18]。刺參遭受溫度急性變化時, Hsps也會做出快速積極響應。驟然升溫會導致刺參Hsp70的表達迅速升高, 在3 h時達到最大值,在12 h后持續下降, 直到恢復到接近初始水平[19]。本實驗室對定向選育群體在高溫及常溫條件下Hsp70的基因表達進行測定, 初步確定了Hsp70基因表達與群體耐溫性能的相關性[20]。前期由于刺參分子研究背景的缺乏, 溫度脅迫應激蛋白的研究主要集中于Hsp70, 在獲得刺參Hsp90和Hsp26基因全長的基礎上, 本實驗選取這兩個基因作為檢測指標來分析不同群體子一代個體耐溫性狀。結果表明在高溫刺激下各群體子一代幼參Hsp90和Hsp26基因表達量都增加, 變化趨勢中的相同性說明在高溫刺激下各群體的生理平衡都受到破壞, 誘導熱休克蛋白基因大量表達, 修復受損的蛋白質, 維持機體穩定性。但不同群體Hsp90和Hsp26基因表達存在差異,定向選育群體基因表達最高峰出現的時間晚于野生群體, 并且定向選育群體基因轉錄水平較野生對照組低。定向選育群體刺參經過高溫選育和南移養殖,其體內Hsps可能存在一定的積累, 子一代具有同親代刺參相同的Hsps組織積蓄性, 因此Hsps合成有滯后現象。
[1] 沈鳴. 海參的化學成分和藥理研究進展[J]. 中成藥,2001, 23(10): 758-761.
[2] 樊繪曾. 海參: 海中人參[J].中國海洋藥物, 2001,4(1): 37-44.
[3] Chen J. Present status and prospects of sea cucumber industry in China[J]. FAO Fisheries technical pater,2005, 25-38.
[4] 孫建璋, 莊定根, 陳蘭濤, 等. 刺參南移養殖技術研究[J]. 浙江海洋學院學報(自然科學版), 2006, 25(2):148-153.
[5] Yang H S, Yuan X T, Zhou Y, et al. Effects of body size and water temperature on food consumption and growth in the sea cucumber Apostichopus japonicus(Selenka) with special reference to aestivation[J].Aquaculture Res, 2005, 36: 1085-1092.
[6] Wang F, Yang H, Gao F, et al. Effects of acute temperature or salinity stress on the immune response in sea cucumber Apostichopus japonicus[J]. Comp Biochem Physiol A, 2008, 151: 491-498.
[7] Gao F, Yang H, Xu Q, et al. Effect of water temperature on digestive enzyme activity and gut mass in sea cucumber Apostichopus japonicus (Selenka), with special reference to aestivation[J]. Chinese Journal of Oceanology and Limnology, 2009, 27(4): 714-722.
[8] Dong Y W, Dong S L. Induced thermotolerance and expression of heat shock protein 70 in sea cucumber Apostichopus japonicus Selenka [J]. Fish Sci, 2008, 74: 573-578.
[9] Zhao H, Yang H, Zhao H, et al. Heat stress-mediated gene expression in the body wall of the Japanese sea cucumber Apostichopus japonicus[J]. Aquat Biol, 2011,12: 23-31.
[10] 于明志, 常亞青.低溫對不同群體仿刺參幼參某些生理現象的影響[J].大連水產學院學報, 2008, 23(1):22-63.
[11] 魏玉峰, 李成林, 張金盛, 等.選育刺參的生長發育優勢比較與分析[J].齊魯漁業, 2009, 26(3): 9-11.
[12] Brett W M, Anthony R C, Greg B M.A comparison of the heat tolerance and growth of a selected and non-selected line of rainbow trout, Oncorhynchus mykiss, in Western Australia[J].Aquaculture, 2004, 241:655-665.
[13] 黃大宏, 劉廣斌, 孫圓圓, 等.刺參 Apostichopus japonicus (Selenka)耐溫速生群體比較實驗初報[J].現代漁業信息, 2008, 23(8): 22-25.
[14] 崔靜, 李太武, 蘇秀榕, 等. 南移養殖的刺參(Apostichopus japonicus)cDNA文庫的構建及原肌球蛋白基因的研究[J].海洋與湖沼, 2010, 41(6): 850-856.
[15] 李明全, 徐鏡波. 10種海洋動物溫度耐受值的研究[J].海洋環境科學, 1992, 11(4): 29-32.
[16] Snyder M J, Ross S. Stress protein (HSP70 family)expression in intertidal benthic organisms: the example of Anthopleura elegantissima (Cnidaria: Anthozoa)[J].Sci Mar, 2004, 68: 155-162.
[17] Matranga V, Toia G, Bonaventura R, et al.Cellular and biochemical responses to environmental and experimentally induced stress in sea urchin coelomocytes[J].Cell Stress Chaperon, 2000, 5: 113-120.
[18] Halpin P M, Menge B A, Hofmann G E. Experimental demonstration of plasticity in the heat shock responses of the intertidal mussel Mytilus californianus[J].Mar Ecol Prog Ser, 2004, 276: 137-145.
[19] Dong Y W, Ji T T, Dong S L. Stress responses to rapid temperature changes of the juvenile sea cucumber(Apostichopus japonicus Selenka)[J].J Ocean Univ China, 2007, 6: 275-280.
[20] 劉廣斌, 楊紅生, 劉石林. 溫度選擇對刺參群體在不同溫度下生長及熱休克蛋白表達的影響[J].海洋科學,2010, 34(7): 25-30.

