血尿酸水平對急性缺血性卒中患者血管再通和梗死體積的影響
王運良,曾志磊,張曉席,尹紅蕾,李金鳳,耿 爽
血尿酸(uric acid,UA)主要經反應性氧元素(ROS)氧化為尿囊素。研究證實,UA具有雙重作用[1]。急性缺血性卒中產生大量的ROS為我們研究腦組織氧化應激提供便利條件,腦缺血時產生的過氧化氫、羥自由基及過氧化物等自由基瀑布式增多主要見于再灌注期間而不是發生于缺血期。因此,筆者選擇UA作為缺血性卒中的研究靶點,動態觀察UA和尿囊素濃度的變化對血管再通和梗死體積的影響,旨在為缺血性卒中的臨床預防和治療提供理論依據。
1 資料與方法
1.1 病例收集 2006年01月—2010年12月筆者所在醫院及鄭州大學第二附屬醫院神經內科診斷為急性缺血性卒中的住院患者176例,均經神經內科體檢和放射學檢查,ECG及常規血液學檢查。入選標準:①發病24 h以內;②非腔隙性卒中,改良的NIHSS評分5分或以上;③彌散加權成像(DWI)證實前腦循環缺血。排除標準:①后循環卒中;②靜脈梗塞;③急慢性腎功能不全;④DWI無缺血性損害;⑤沒有完成超聲心動和血管檢查(CT或MR血管成像)患者。本研究得到當地醫院倫理委員會批準及患者或家屬的知情同意。176例根據TOAST分類將卒中分為5個亞型。
1.2 研究方法
1.2.1 影像學檢查 所有患者完成核磁共振(MRI,1.5T,Siemens Germany),包括 DWI和血管成像(CT 或MRA)檢查,發病后72~96 h進行血管成像隨訪檢查,包括38例DSA,18例MR,120例CTA檢查。根據DWI缺血性損害對卒中亞型進行分類,其中血管再通組66例,非再通組110例。再通血管定義為:①早期血管造影無狹窄或DWI有急性栓塞表現但相關血管未閉塞;②早期血管閉塞,但以后血管造影發現動脈部分或全部再通。非再通血管定義為:與早期血管造影相比,相關閉塞血管無改變。用SCION成像軟件,半自動圖像分割法計算軸性DWI損傷體積=每層層厚乘以栓塞面積(層厚+層間距)。
1.2.2 實驗室檢查 患者入院后抽取血液標本,于入院24 h內,2 d,7 d,14 d 進行 mNIHSS評估和 UA、尿囊素檢查。各抽取肘靜脈血1次,應用尿酸酶—過氧化物酶偶聯法測定UA含量,外部質量控制顯示批內系數小于3.5%。采用高效液相色譜法測定尿囊素的濃度。
1.2.3 統計學分析 應用WSPSS11.0統計程序軟件包進行數據分析,分類變量如性別、危險因素、卒中亞型采用 χ2檢驗,實驗室檢查和 mNIHSS評分采用Student’s t檢驗。DWI損傷體積和實驗室變量之間的關系采用皮爾遜相關檢驗。以P<0.05為有統計學意義的差異。
2 結果
在入選的176例,根據血管檢查評估分為血管再通組66例及非再通組110例。除溶栓治療多見于血管再通組外,兩組間發病年齡、危險因素、早期實驗室檢查、mNIHSS評分、梗死體積、梗死部位無統計學差異(P>0.05),見表1。入院時兩組患者mNIHSS評分無明顯變化,隨時間延長評分逐漸降低,但血管再通組mNIHSS評分較非再通組降低更明顯(P<0.01),血UA水平按時間順序改變呈U型曲線,癥狀發作48 h時降至最低,然后逐漸上升。雖然兩組之間發病時血UA水平無明顯不同,但48 h血管再通組UA水平下降更明顯,14 d時高于非再通組平均值。與UA水平變化相似,血管再通組尿囊素濃度高于非再通組,尿囊素濃度增高的患者神經功能改善明顯,mNIHSS評分降低(表2)。且在血管再通組,血UA水平增高,DWI梗死體積增大。其血 UA在 <250、250~300及≥300 μmol/L時梗死體積(46.9 ±25.2)、(48.2 ±37.6)及(53.8 ±43.2)cm3(P <0.05)。
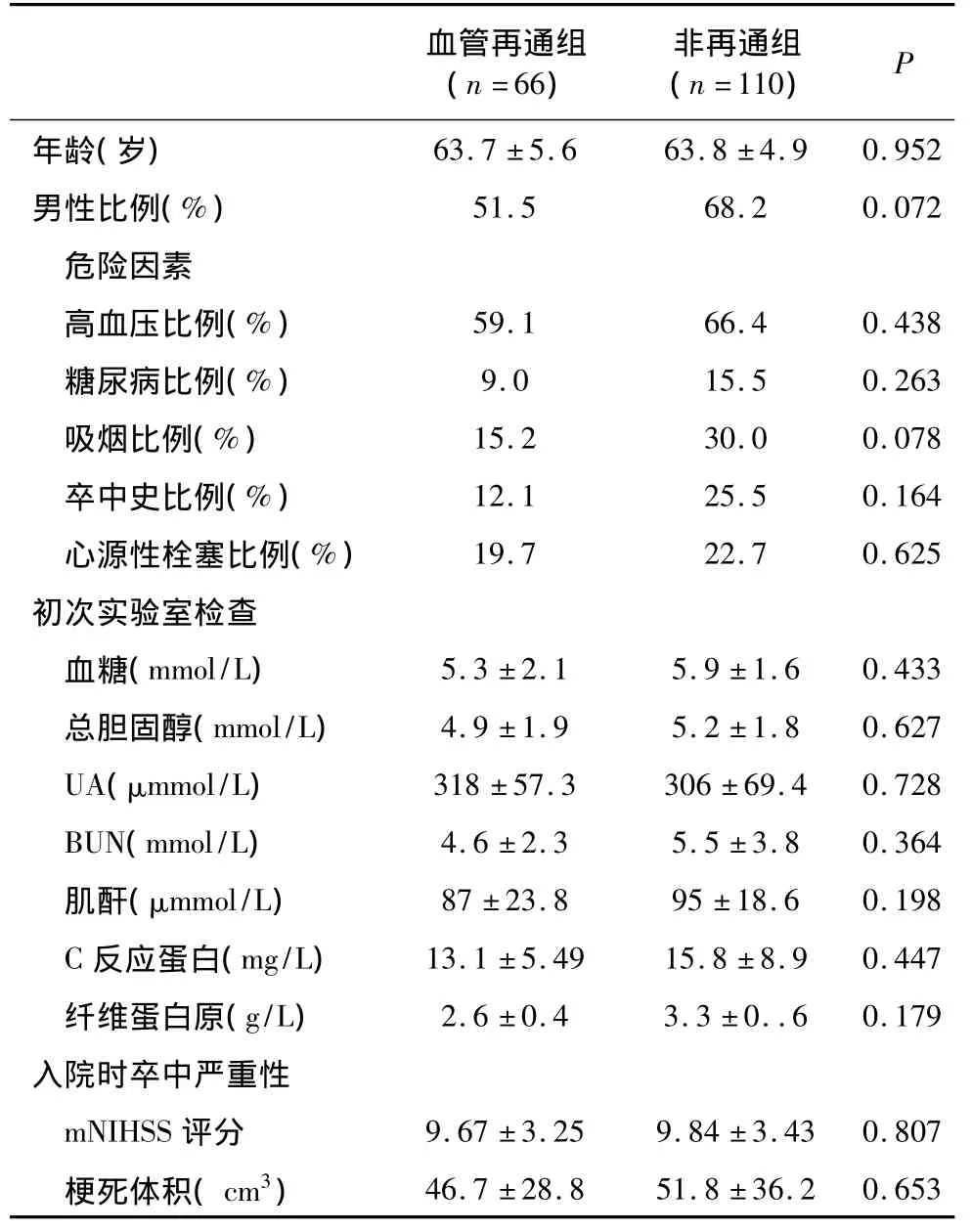
表1 兩組患者臨床一般資料
3 討論
有關尿酸與腦梗死關系的研究國內外已有不少報道,但對急性期血UA水平變化與血管再通關系的研究較少。筆者發現急性缺血性卒中血UA水平呈波動趨勢,早期期增高,48 h開始下降,以后逐漸恢復到基線狀態。與非再通組相比,血管再通組血UA水平和尿囊素水平明顯增高,與14 d臨床mNIHSS下降相一致。早期UA濃度變化與梗死體積相關,這種關系在血管再通組較非再通組更明顯。一般說來,腦組織缺血促使黃嘌呤脫氫酶到黃嘌呤氧化酶 (XO)的不可逆轉變,后者是缺血再灌注損傷期間UA產生的主要來源。UA在捕獲活性氧 (ROS)自由基擔當清道夫作用,成比例的復制抗氧化劑,促進黃嘌呤脫氫酶到OX的轉變[2]。但對急性卒中患者血UA改變的意義還不完全清楚,因此有關UA作用的臨床研究報道不一。筆者認為UA是一柄雙刃劍,盡管疾病過程導致UA產物增多可能有害,但提示UA對缺血性損傷的抗氧化有一定益處。
表2 兩組患者各時點mNIHSS評分和UA水平±s)
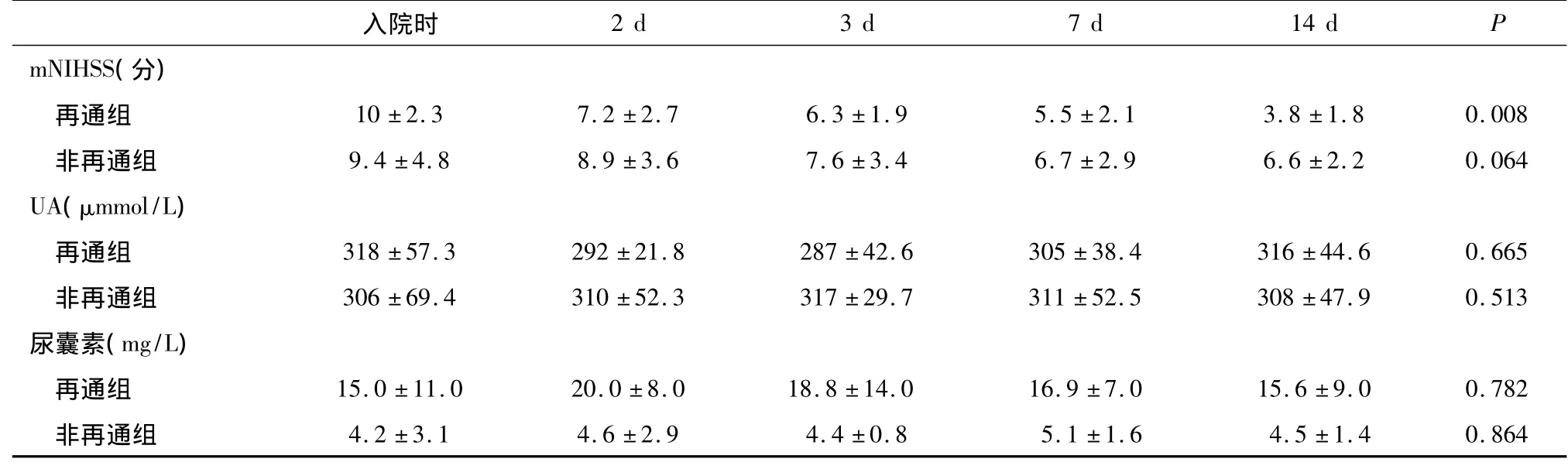
表2 兩組患者各時點mNIHSS評分和UA水平±s)
入院時 2 d 3 d 7 d 14 d P mNIHSS(分)再通組 10 ±2.3 7.2 ±2.7 6.3 ±1.9 5.5 ±2.1 3.8 ±1.8 0.008非再通組 9.4 ±4.8 8.9 ±3.6 7.6 ±3.4 6.7 ±2.9 6.6 ±2.2 0.064 UA(μmmol/L)再通組 318 ±57.3 292 ±21.8 287 ±42.6 305 ±38.4 316 ±44.6 0.665非再通組 306 ±69.4 310 ±52.3 317 ±29.7 311 ±52.5 308 ±47.9 0.513尿囊素(mg/L)再通組 15.0 ±11.0 20.0 ±8.0 18.8 ±14.0 16.9 ±7.0 15.6 ±9.0 0.782非再通組 4.2 ±3.1 4.6 ±2.9 4.4 ±0.8 5.1 ±1.6 4.5 ±1.4 0.864
筆者通過研究發現,梗死體積與早期血UA水平變化有關,48 h下降,以后逐漸升高,與國外研究結果有某些差異。Cherubini報道卒中患者平均UA水平低于基線,癥狀發作24 h內(3.26 mg/dl)低于對照組(4.61 mg/dl),7 d 后濃度升高達 4.07mg/dl[3]。Leinonen等也報道缺血性卒中患者癥狀發作2.2 d平均基線 UA水平3.66 mg/dl,7 d左右逐漸上升到3.8 mg/dl。對出血性腦損傷的研究發現,出血患者UA水平低于照組,此外,在出血體積、血UA和抗氧化劑濃度之間有自相矛盾的關系[4]。但在筆者的研究中,UA的順時性變化與以前急性卒中研究的UA波動類型相一致。而且,還發現血管再通或梗死體積相對較大的卒中患者UA和尿囊素水平明顯高,梗死體積與UA或尿囊素水平明顯相關,隨訪研究證實血管再通患者的這種關聯性更強,提示UA對大面積腦梗死、組織再灌注及代謝為尿囊素過程中產生過量自由基的清除中起一定作用,對再灌注損傷中具有明顯的抗氧化作用。
急性缺血性卒中有害的ROS主要被UA清除,UA是人體含量最豐富的天然抗氧化劑。最近報道,大劑量外源性白蛋白能消耗血漿ROS,通過減少ROS來預防急性缺血性卒中的氧化性損害,在血管再通患者引起明顯改善,尤其是在再灌注組織ROS增高狀態下,代替天然抗氧化劑UA發揮明顯的抗氧化作用[5]。最近對24例腦卒中患者的研究證實,接受重組纖溶酶原激活物(rTPA)和UA雙重治療的患者脂質過氧化作用的濃度降低,而且給予外源性UA通過減少毒性自由基活性或缺血/再灌期間激活XO的負性反饋機制有助于患者的恢復[6]。國外研究證實,氧化應激的總體數量與卒中體積或組織再灌注狀況有關,早期組織再灌注對挽救急性缺血性卒中半暗帶,幫助組織存活有益,但也可引起氧化應激成產生過量有害的自由基,過量的自由基產物引起腦水腫或由于BBB破壞加重腦出血。在急性缺血性卒中再灌注期間,給予有效的吞噬自由基或ROS的藥物能明顯減少卒中并發癥并延長卒中治療時間窗。因此,對急性缺血性卒中患者應用尿酸是一種潛在的有益治療。
總之,UA是急性缺血性卒中的一種消耗和再生性抗氧化劑,血UA水平的變化與梗死體積和血管再通狀況密切相關。血UA和尿囊素是急性卒中早期氧化應激能被檢測的指標,可能代表早期過量自由基的捕獲和缺血性卒中急性、亞急性期XO系統逐漸活化。
[1]Romanos E,Planas AM,Amaro S.et al.Uric acid reduces brain damage and improves the benefits of rt-PA in a ratmodel of thromboembolic stroke[J].JCereb Blood Flow Metab,2007,27(1):14-20.
[2]Meneshian A,Bulkley GB.The physiology of endothelial xanthine oxidase:from urate catabolism to reperfusion injury to inflammatory signal transduction[J].Microcirculation,2002,9(2):161 -175.
[3]Cherubini A,PolidoriMC,BregnocchiM,etal.Antioxidant profile and early outcome in stroke patients[J].Stroke,2000,31(22):2295-2300.
[4]Polidori MC,Mecocci P,Frei B.Plasma vitamin C levels are decreased and correlated with brain damage in patientswith intracranial hemorrhage or head trauma[J].Stroke,2001,32(8):898 -902.
[5]Seet RC,Kasiman K,Gruber J,etal.Is uric acid protective or deleterious in acute ischemic stroke?A prospective cohort study[J].Atherosclerosis,2009,5(1):56-64.
[6]Heo JH,Han SW,Lee SK.Free radicals as triggers of brain edema formation after atroke[J].Free Radic Biol Med,2005,39(1):51-70.

