激光穴位照射佐劑性關(guān)節(jié)炎大鼠的生物效應(yīng)累積及其鎮(zhèn)痛療效觀察
馬力佳,楊華元
(上海中醫(yī)藥大學(xué),上海 201203)
炎癥痛是臨床上最常見的病理性疼痛之一,它的病程遷延反復(fù),治愈難度大。已有實(shí)驗(yàn)證明半導(dǎo)體激光針灸對(duì)緩解炎性疼痛有很好的療效[1]。本實(shí)驗(yàn)采用傳統(tǒng)針刺治療與半導(dǎo)體激光穴位照射治療炎性疼痛,通過對(duì)AA大鼠血清中IL-1、IFN-γ、TNF-α含量的觀察,探討半導(dǎo)體激光鎮(zhèn)痛的療效以及其生物效應(yīng)的特性,為下一步深層次探索激光的生物效應(yīng)和指導(dǎo)臨床治療炎性疼痛提供實(shí)驗(yàn)研究基礎(chǔ)。
1 材料與方法
1.1 實(shí)驗(yàn)材料
1.1.1 實(shí)驗(yàn)動(dòng)物
清潔級(jí)健康成年SD大鼠80只,雄性,體重180~220 g,由上海中醫(yī)藥大學(xué)動(dòng)物實(shí)驗(yàn)中心提供。飼養(yǎng)環(huán)境溫度(24±2)℃,濕度控制在(45±5)%,適應(yīng)性飼養(yǎng)1星期,普通飼料喂養(yǎng),自由飲水。
1.1.2 主要儀器設(shè)備
YLS-12A型鼠尾光照測(cè)痛儀(北京吉安得爾科技有限公司),半導(dǎo)體激光發(fā)光管(上海科技京城),YJ82/1型雙路直流穩(wěn)壓電源(上海滬光儀器廠),華佗牌無菌針灸針(蘇州醫(yī)療用品廠)。
1.1.3 主要試劑
完全弗氏佐劑(Complete Freund’s adjuvant,CFA,購自美國 Sigma公司),水合氯醛(國藥集團(tuán)化學(xué)試劑有限公司),ELISA試劑盒(白介素細(xì)胞-1、腫瘤壞死因子α、干擾素γ,購自南京建成生物工程有限公司)。
1.2 實(shí)驗(yàn)方法
1.2.1 佐劑性關(guān)節(jié)炎大鼠模型制備
制備大鼠完全弗氏佐劑性外周急性炎癥痛模型,在嚴(yán)格無菌條件下,于每只大鼠右后足跖皮下注射弗氏完全佐劑0.1 mL。造模后4 h起大鼠右足足趾至踝關(guān)節(jié)逐漸出現(xiàn)紅腫疼痛,不能著地,跛行,各種行為學(xué)、形態(tài)學(xué)改變,痛閾值下降,示造模成功。
1.2.2 動(dòng)物選穴
穴位選擇大鼠右側(cè)足三里穴。足三里(后三里)位于膝關(guān)節(jié)后外側(cè),在腓骨小頭下約5 mm處。取穴方法參照《實(shí)驗(yàn)針灸學(xué)》[2]及根據(jù)大鼠形態(tài)、解剖、生理特點(diǎn)而定。針刺7 mm。
1.2.3 實(shí)驗(yàn)分組及干預(yù)方法
80只SD雄性大鼠隨機(jī)分為8組,每組10只。空白組、模型組大鼠置于大鼠固定器內(nèi)固定,每天固定1次,固定時(shí)間每日20 min。
激光照射3 d組、5 d組、7 d組:將大鼠置于大鼠固定器內(nèi)固定,取右側(cè)患肢足三里穴,激光照射20 min,每日 1次,分別治療 3 d、5 d、7 d。激光波長(zhǎng)650 nm,輸出功率5 mW,光斑直徑3 mm。
針刺3 d組、5 d組、7 d組:將大鼠置于大鼠固定器內(nèi)固定,用0.30 mm×25 mm毫針針刺右側(cè)患肢足三里穴20 min,行平補(bǔ)平瀉手法,每日1次,分別治療3 d、5 d、7 d。
1.2.4 取材
空白組、模型組與各治療組在各自療程結(jié)束并進(jìn)行體重測(cè)量,腫脹度測(cè)量及痛閾測(cè)定后,用 10%水合氯醛以0.3 mL/100 g腹腔注射麻醉,進(jìn)行眼眶后靜脈叢取血1.5 mL,分離血清,放置于﹣80℃低溫冰箱保存待測(cè)。
1.3 指標(biāo)檢測(cè)
1.3.1 體重及一般整體情況觀察
于造模前、治療后取材前觀察各組大鼠皮毛色澤、飲食、糞便、活動(dòng)度等一般情況,測(cè)量大鼠體重,觀察其變化規(guī)律。
1.3.2 痛閾測(cè)定
于造模前、造模后、治療后采用光照甩尾法進(jìn)行痛閾測(cè)定。為防止大鼠灼傷,設(shè)定鼠尾測(cè)痛儀功率為38 W,照射截止時(shí)間為 16.01 s,以防大鼠尾部灼傷。將待測(cè)大鼠用大鼠固定器固定,暴露整條尾巴,將尾尖對(duì)準(zhǔn)測(cè)痛儀上的黑線,尾尖部遮蓋住光斑。待大鼠穩(wěn)定后,按開始鍵計(jì)時(shí),當(dāng)鼠尾因熱輻射致疼痛而發(fā)生甩尾,尾尖離開光斑,計(jì)時(shí)自動(dòng)停止,記錄時(shí)間,單位為s。每只大鼠分別進(jìn)行3次測(cè)量,每隔5 min測(cè)量1次,最后取3次測(cè)量結(jié)果的平均值為該天測(cè)量的痛閾值。
1.3.3 踝關(guān)節(jié)周長(zhǎng)測(cè)量
各組大鼠于造模前及造模第3天進(jìn)行右后肢踝關(guān)節(jié)周長(zhǎng)測(cè)定,用大鼠固定器將大鼠固定,兩后肢外露,自然下垂。用帶刻度的無彈性軟尺沿大鼠右后肢內(nèi)外踝下緣平面繞踝一周,測(cè)得長(zhǎng)度即為踝周長(zhǎng)。為保證數(shù)據(jù)準(zhǔn)確性,操作者每次掌握同樣的力度進(jìn)行測(cè)量。
1.3.4 IL-1、TNF-α、IFN-γ、TLR4 含量的測(cè)定
大鼠血清樣本采用生物素雙抗體夾心酶聯(lián)免疫吸附法(ELISA)測(cè)定,以450 nm波長(zhǎng)依序測(cè)量各孔的吸光度(OD值),測(cè)定應(yīng)在加終止液后10 min以內(nèi)進(jìn)行。根據(jù)標(biāo)準(zhǔn)品的濃度及對(duì)應(yīng)的 OD值計(jì)算出標(biāo)準(zhǔn)曲線的直線回歸方程,再算出對(duì)應(yīng)的樣品濃度。
1.4 統(tǒng)計(jì)學(xué)方法
所有數(shù)據(jù)采用SPSS19.0軟件進(jìn)行分析,數(shù)據(jù)呈正態(tài)性分布,所有結(jié)果以平均值±標(biāo)準(zhǔn)差表示。各組組間差異采用單因素方差分析(One-way ANOVA),組間比較采用多重比較(LSD)分析,以P<0.05作為有統(tǒng)計(jì)學(xué)意義的標(biāo)準(zhǔn)。
2 結(jié)果
2.1 一般情況及體重、踝關(guān)節(jié)腫脹度變化
模型組與空白組大鼠相比,在造模期間活動(dòng)減少,精神萎靡,對(duì)外界刺激反應(yīng)較遲鈍,飲食減少,糞便稀溏,毛色晦暗,毛發(fā)凌亂,右足跛行。模型組大鼠踝關(guān)節(jié)在造模12 h出現(xiàn)右足紅、腫、觸摸膚溫發(fā)熱,尤其在造模后24 h更為明顯。與模型組比較,治療后各組的一般狀況有所改善,活躍度較高,進(jìn)食增加,毛發(fā)較順滑潔凈。
造模后模型組大鼠體重均值明顯小于空白組,具有統(tǒng)計(jì)學(xué)差異(P<0.05),而各治療組大鼠體重均值與空白組比較差異有統(tǒng)計(jì)學(xué)意義(P<0.05),且激光治療組大鼠體重高于針刺治療組,說明激光治療療效比針刺治療療效顯著。詳見表1。
造模后模型組與空白組對(duì)比,大鼠踝關(guān)節(jié)腫脹度具有差異性(P<0.05),顯示造模成功;所有治療組與模型組比較差異均具有統(tǒng)計(jì)學(xué)意義(P<0.05);且激光3 d、5 d、7 d組比較差異有統(tǒng)計(jì)學(xué)意義(P<0.05),針刺3 d組與針刺7 d組比較差異具有統(tǒng)計(jì)學(xué)意義(P<0.05);激光3 d組與針刺3 d組腫脹度比較差異有統(tǒng)計(jì)學(xué)意義(P<0.05),提示激光治療組消炎效果比針刺治療組作用快。詳見表2。
2.2 痛閾測(cè)量結(jié)果
造模后,模型組痛閾與空白組相比顯著降低,且具有統(tǒng)計(jì)學(xué)意義(P<0.05),顯示造模成功。治療后,激光組與針刺組痛閾比較差異具有統(tǒng)計(jì)學(xué)意義(P<0.05)。激光3 d組與針刺3 d組的痛閾比治療前有所提高,且兩組痛閾與模型組比較差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),且均在治療第5天出現(xiàn)最低值,治療第7天有所上升,激光治療第5天與第7天痛閾相比差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),針刺治療第3天與第5天痛閾相比差異具有統(tǒng)計(jì)學(xué)意義(P<0.05),說明激光與針刺治療均有鎮(zhèn)痛消炎作用,但激光治療顯效確比針刺治療及時(shí)。詳見表3。
表1 各組大鼠治療后體重比較(n=10)(±s,g)

表1 各組大鼠治療后體重比較(n=10)(±s,g)
注:與空白組比較1)P<0.05;與模型組比較2)P<0.05
組別 治療3 d 治療5 d 治療7 d空白組 193.60±10.102) 202.70±11.252) 212.20±11.022)模型組 170.40±9.061) 179.90±10.201) 189.60±10.221)激光組 166.00±16.961) 185.40±12.261) 184.50±10.181)針刺組 162.50±19.611) 178.50±5.641) 184.60±12.671)
表2 各組大鼠治療后踝關(guān)節(jié)腫脹度比較 (±s,cm)
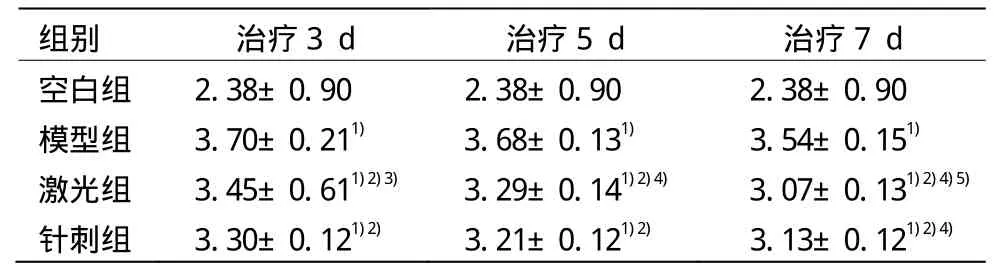
表2 各組大鼠治療后踝關(guān)節(jié)腫脹度比較 (±s,cm)
注:與空白組比較 1)P<0.05;與模型組比較 2)P<0.05;與針刺組比較 3)P<0.05;與同組治療 3 d比較 4)P<0.05;與同組治療 5 d比較 5)P<0.05
組別 治療3 d 治療5 d 治療7 d空白組 2.38±0.90 2.38±0.90 2.38±0.90模型組 3.70±0.211) 3.68±0.131) 3.54±0.151)激光組 3.45±0.611)2)3) 3.29±0.141)2)4) 3.07±0.131)2)4)5)針刺組 3.30±0.121)2) 3.21±0.121)2) 3.13±0.121)2)4)
表3 各組大鼠治療后痛閾比較 (±s,s)
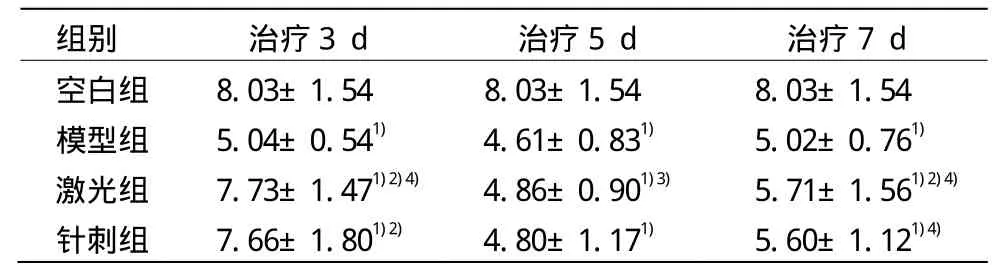
表3 各組大鼠治療后痛閾比較 (±s,s)
注:與空白組比較 1)P<0.05;與模型組比較 2)P<0.05;與針刺組比較 3)P<0.05;與同組治療5 d比較4)P<0.05
組別 治療3 d 治療5 d 治療7 d空白組 8.03±1.54 8.03±1.54 8.03±1.54模型組 5.04±0.541) 4.61±0.831) 5.02±0.761)激光組 7.73±1.471)2)4) 4.86±0.901)3) 5.71±1.561)2)4)針刺組 7.66±1.801)2) 4.80±1.171) 5.60±1.121)4)
2.3 大鼠血清中炎性細(xì)胞因子 IL-1、IFN-γ、TNF-α的含量
激光3 d組大鼠血清IL-1含量與模型組比較差異具有統(tǒng)計(jì)學(xué)意義(P<0.05)。激光組大鼠IL-1含量整體呈下降趨勢(shì),治療第3天到第5天下降較明顯,治療第7天達(dá)到最低值。針刺組第3天到第5天IL-1呈下降趨勢(shì),而治療第5天到第7天卻呈明顯上升趨勢(shì)。詳見圖1、圖2。
激光3 d組、針刺3 d組、針刺7 d組大鼠血清IFN-γ含量與空白組和模型組比較差異具有統(tǒng)計(jì)學(xué)意義(P<0.05)。激光組 IFN-γ含量呈上升趨勢(shì),且治療第3天到第5天上升較明顯,治療第5天到第7天趨于平緩;針刺治療第3天到第5天IFN-γ含量呈顯著上升,而針刺治療第5天到第7天IFN-γ含量呈下降趨勢(shì),但仍高于針刺3 d組。詳見圖3、圖4。
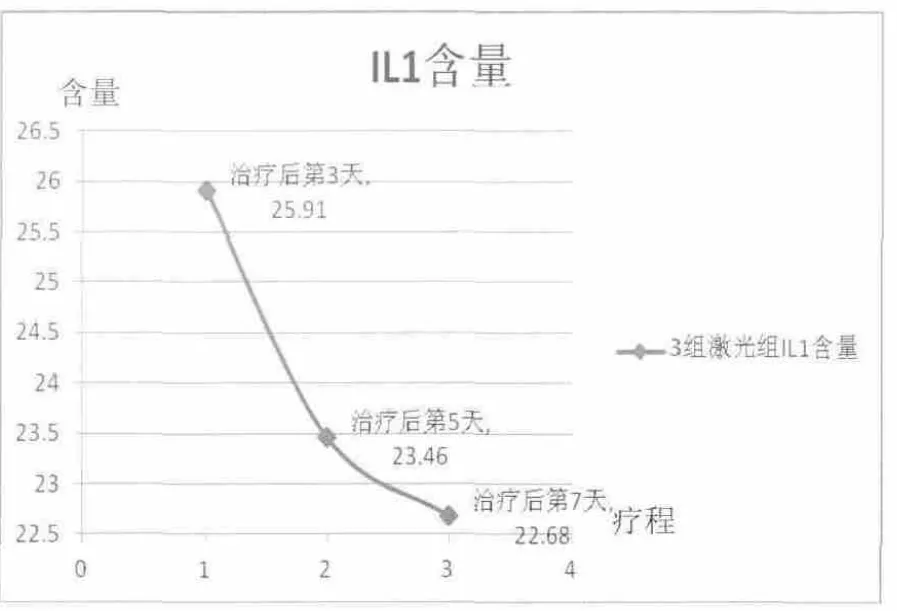
圖1 激光組大鼠血清IL-1含量(ng/mL)
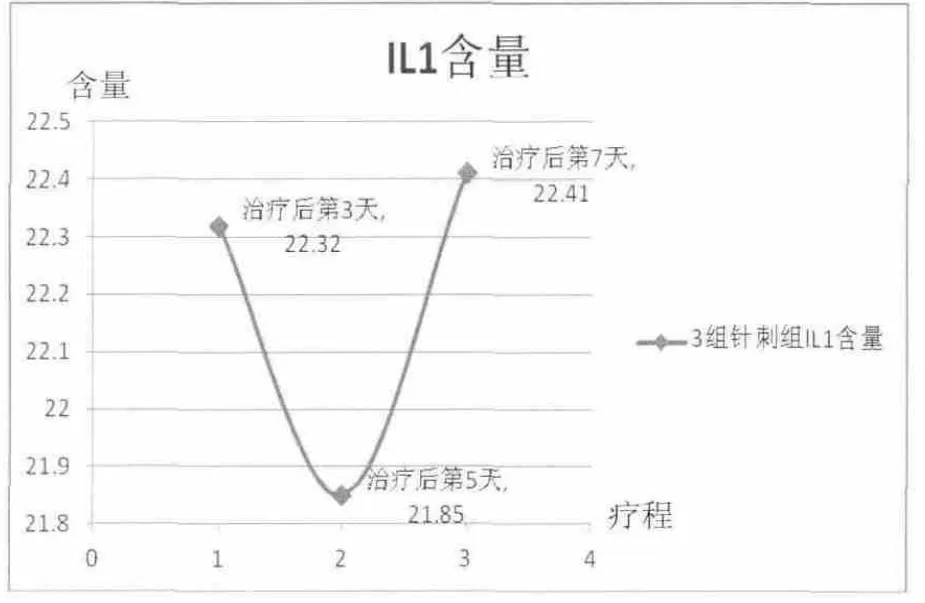
圖2 針刺組大鼠血清IL-1含量(ng/mL)
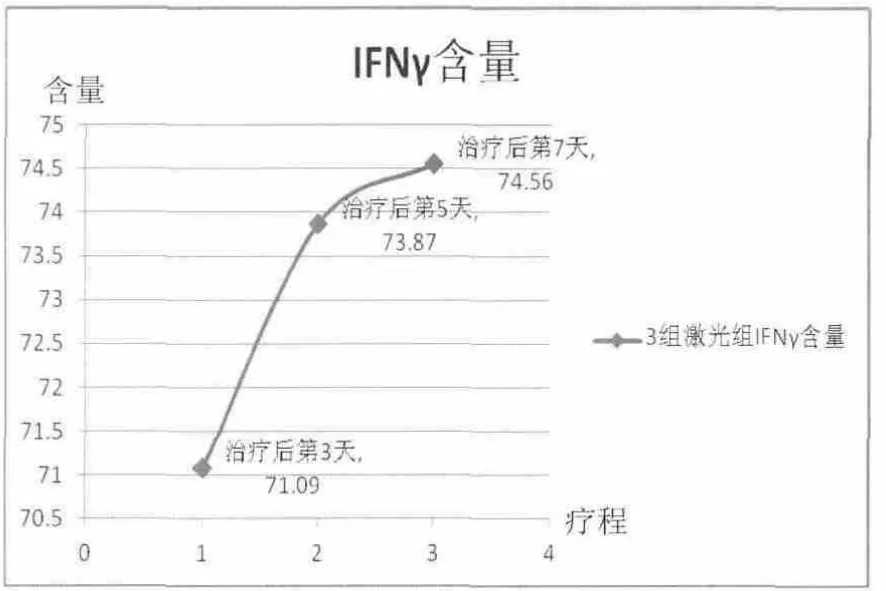
圖3 激光組大鼠血清IFN-γ含量(ng/mL)
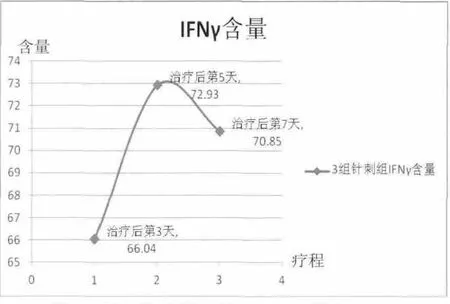
圖4 針刺組大鼠血清IFN-γ含量(ng/mL)
與空白組相比,針刺5 d組和針刺7 d組大鼠血清TNF-α含量具有顯著性差異(P<0.05);與模型組相比,激光3 d組TNF-α含量具有顯著性差異(P<0.05);與激光3 d組相比,針刺3 d組TNF-α含量具有顯著性差異(P<0.05)。激光組大鼠血清TNF-α含量整體呈下降趨勢(shì),且治療第5天到第7天下降趨于平緩。針刺治療第3天到第5天大鼠血清TNF-α含量呈明顯下降趨勢(shì),但第5天到第7天TNF-α含量卻呈輕微上升趨勢(shì)(詳見圖5、圖6)。以上均說明半導(dǎo)體激光穴位照射治療后,相關(guān)細(xì)胞因子均在治療第 5天出現(xiàn)轉(zhuǎn)折點(diǎn),即體現(xiàn)了激光照射治療具有拋物線特征。而在治療7 d后,上述指標(biāo)變化均呈緩慢增長(zhǎng)或者下降趨勢(shì),體現(xiàn)了隨激光照射時(shí)長(zhǎng)的增加,激光生物效應(yīng)的累積,顯示了其拋物線特性。
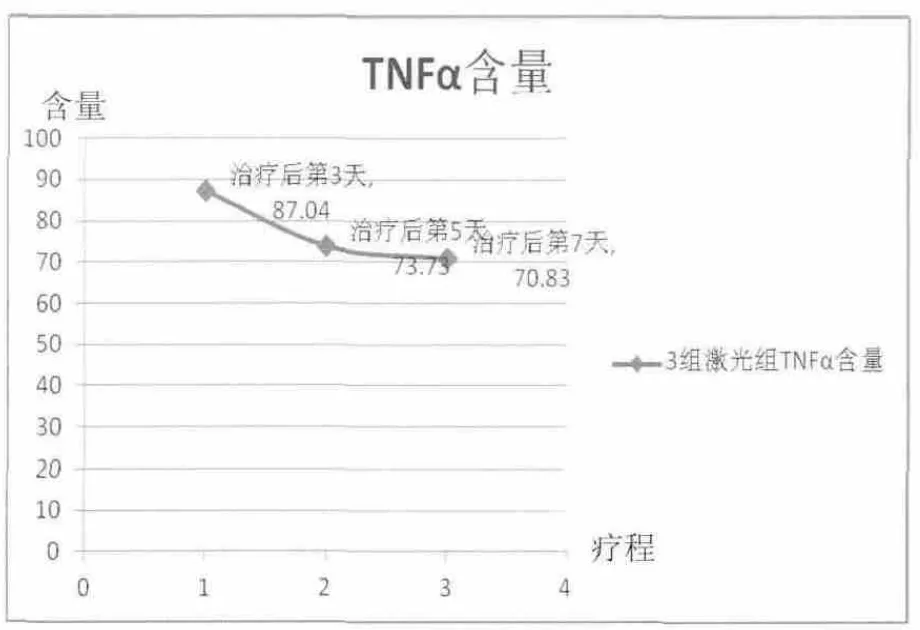
圖5 激光組大鼠血清TNF-α含量(ng/mL)
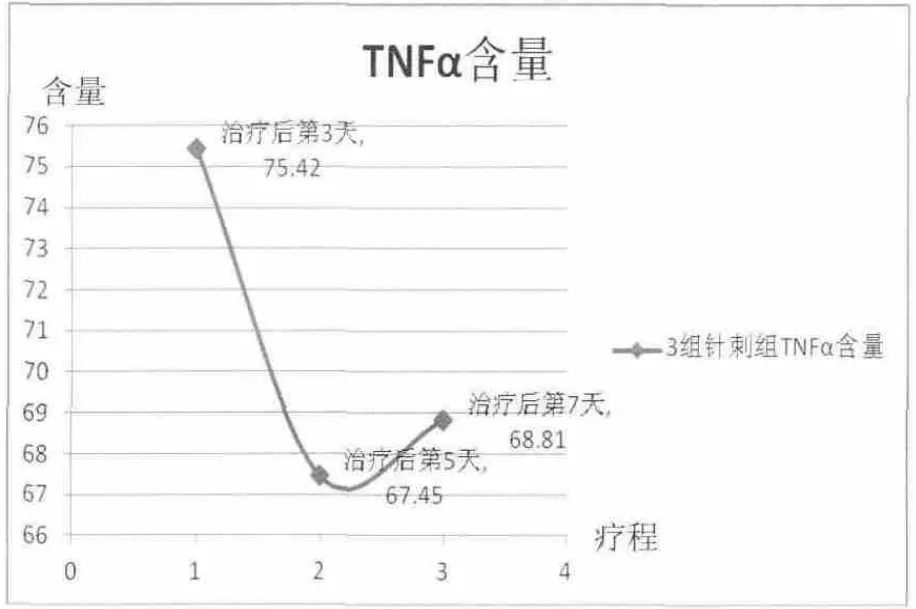
圖6 針刺組大鼠血清TNF-α含量(ng/mL)
3 討論
古代醫(yī)家對(duì)各種疼痛性疾病有一定的研究和認(rèn)識(shí),認(rèn)為疼痛產(chǎn)生的重要原因是“通則不痛,痛則不通”,如《素問·舉痛論》:“寒氣入經(jīng)而稽遲,泣而不行,客于脈外則血少,客于脈中則氣不通,故卒然而痛。”《靈樞·五癃精液別》:“髓液皆減而下,下過度則虛,虛故腰背痛而脛酸。”激光穴位照射代替?zhèn)鹘y(tǒng)的針灸療法,把激光技術(shù)與傳統(tǒng)中醫(yī)理論相結(jié)合產(chǎn)生的激光針灸作為行之有效的治療手段,被稱為“21世紀(jì)的綠色療法”[3]。激光針灸具有無痛、無菌、簡(jiǎn)便、安全、強(qiáng)度可調(diào)和適應(yīng)范圍廣等特點(diǎn),是一種符合現(xiàn)代醫(yī)學(xué)發(fā)展需要的全新治療方法[4-8]。本實(shí)驗(yàn)通過對(duì) AA大鼠的一般情況、體重、關(guān)節(jié)腫脹度、痛閾的觀察,證明了半導(dǎo)體激光照射和針刺足三里都能使AA大鼠關(guān)節(jié)紅、腫、熱等一般癥狀減輕,改善關(guān)節(jié)局部炎性組織病理性癥狀,但是半導(dǎo)體激光照射消炎鎮(zhèn)痛作用明顯優(yōu)于針刺療法,說明半導(dǎo)體激光治療急性炎性疼痛的療效更加及時(shí)有效。
在炎癥發(fā)展過程中,病理性疼痛作為一種自覺癥狀存在其中,可以抑制免疫功能,從而加重炎癥本身免疫功能的紊亂[9]。外周組織損傷后,會(huì)釋放各種炎癥因子[10],導(dǎo)致受損神經(jīng)末梢興奮或者敏感化,誘發(fā)疼痛和痛覺過敏并且維持其發(fā)展。其中免疫系統(tǒng)的重要介質(zhì)細(xì)胞因子(cytokines,CKs)介導(dǎo)和調(diào)節(jié)固有免疫的因子能夠識(shí)別病毒和細(xì)菌,引起細(xì)胞因子的分泌;由細(xì)胞誘發(fā)產(chǎn)生的腫瘤壞死因子(tumor necrosis facor,TNF)、白介素-1(interleukin-1,IL-1)和趨化因子可以征募吞噬細(xì)胞到達(dá)局部引起全身性應(yīng)答。本實(shí)驗(yàn)研究的細(xì)胞因子包括 IL-l、TNF-α、IFN-γ,它們是形成關(guān)節(jié)炎重要的炎癥介質(zhì),這些細(xì)胞因子相互作用,促進(jìn)炎細(xì)胞聚集活化,介質(zhì)釋放,引起發(fā)熱,同時(shí)下調(diào)基質(zhì)蛋白的合成、刺激基質(zhì)蛋白酶和環(huán)氧合酶等,并各自發(fā)揮不同的抗炎作用[11-12],采用半導(dǎo)體激光治療后,這些炎性指標(biāo)所反映的機(jī)體生物效應(yīng)累積現(xiàn)象不盡相同,這可能與它們各自的特性有關(guān)。
IL-1是一種重要的促炎細(xì)胞因子,也是重要的免疫調(diào)節(jié)分子,主要由單核吞噬細(xì)胞產(chǎn)生,由機(jī)體炎癥、發(fā)熱急性期蛋白質(zhì)合成,能誘導(dǎo)其他促炎細(xì)胞因子的釋放,啟動(dòng)、加強(qiáng)、延長(zhǎng)炎癥反應(yīng),具有致熱和介導(dǎo)炎癥的作用。Sweitzer等[13]發(fā)現(xiàn)SD大鼠腳底注射福爾馬林后注射部位的 IL-1β顯著增高,脊髓內(nèi)給予 IL-1抑制劑阻斷了福爾馬林誘導(dǎo)的傷害行為,顯示在疼痛模型中IL-1β能夠誘發(fā)痛覺過敏。有實(shí)驗(yàn)表明IL-l作用于內(nèi)皮細(xì)胞,促進(jìn)巨噬細(xì)胞、嗜中性粒細(xì)胞和淋巴細(xì)胞聚集,從而加重關(guān)節(jié)炎局部炎癥[14]。有學(xué)者[15]通過建立SD大鼠佐劑性關(guān)節(jié)炎(AA)模型實(shí)驗(yàn)表明,IL-l明顯降低AA大鼠B淋巴細(xì)胞增殖和腹腔巨噬細(xì)胞IL-1的產(chǎn)生,可恢復(fù)T淋巴細(xì)胞增殖反應(yīng)。提示IL-l可明顯減輕AA大鼠關(guān)節(jié)中炎性細(xì)胞浸潤(rùn)、滑膜增生、血管翳難成、軟骨和骨的破壞。此外,有研究發(fā)現(xiàn),IL-1抗體能有效地抑制小鼠膠原誘導(dǎo)性關(guān)節(jié)炎(collagen induced arthritis,CIA)關(guān)節(jié)軟骨和骨的破壞[16]。通過激光治療能減少血清中IL-1的含量,抑制其他促炎因子的釋放,控制炎性反應(yīng)。
TNF是由單核巨噬細(xì)胞產(chǎn)生具有廣泛生物學(xué)活性的多肽調(diào)節(jié)因子,在機(jī)體的免疫防衛(wèi)體系中起著十分關(guān)鍵的作用。它包括TNF-α和TNF-β,其中TNF-α與關(guān)節(jié)炎性疼痛的關(guān)系最為密切。TNF-α的作用機(jī)制類似于IL-1,因此,TNF-α和IL-1被稱為“姐妹細(xì)胞因子”,兩者的效應(yīng)及靶細(xì)胞的范圍有很大相似性。比如TNF-α可以通過刺激滑膜細(xì)胞和軟骨細(xì)胞合成 PGE2和膠原酶,引起軟骨與骨的破壞,促進(jìn)成纖維細(xì)胞增生;TNF-α與 IL-1常常又是同時(shí)合成分泌的,它們不但以自分泌方式刺激巨噬細(xì)胞的增加,而且也能促進(jìn)彼此的合成。它們?cè)诼?lián)合應(yīng)用時(shí)能產(chǎn)生很強(qiáng)的協(xié)同作用,例如將重組 IL-1注射到大鼠或家兔的關(guān)節(jié)內(nèi)能夠刺激關(guān)節(jié)軟骨的破壞,與 TNF-α聯(lián)合注射時(shí),促使軟骨破壞的程度遠(yuǎn)超過單獨(dú)注射IL-1所引起的效果[17]。通過本實(shí)驗(yàn)也發(fā)現(xiàn),激光和針刺足三里均能使大鼠血清中IL-1與TNF-α的含量明顯下降,AA大鼠的關(guān)節(jié)腫脹度明顯改善。說明TNF-α和IL-1能相互協(xié)調(diào)、促進(jìn),表現(xiàn)出協(xié)同性生物學(xué)效應(yīng)。
IFN-γ又稱為免疫干擾素,主要由T和NK細(xì)胞產(chǎn)生,它能誘導(dǎo)巨噬細(xì)胞、T細(xì)胞、B細(xì)胞等細(xì)胞主要組織相容性復(fù)合體(major histocompatibility complex Ⅰ、Ⅱ,MHC-Ⅰ、Ⅱ)類分子表達(dá),從而提高抗原呈遞能力。IFN-γ能夠抑制滑膜細(xì)胞增殖,減少血管翳形成,抑制破骨細(xì)胞活性,減少對(duì)關(guān)節(jié)軟骨破壞,下調(diào)體液免疫反應(yīng)。在動(dòng)物實(shí)驗(yàn)中[18],給RA模型小鼠使用抗 IFN-γ的抗體,可使RA緩解;而注射IFN-γ可使RA加劇。臨床有人給予人基因重組IFN-γ治療RA結(jié)果表明,IFN-γ對(duì)關(guān)節(jié)腫脹、晨僵改善明顯,淋巴細(xì)胞轉(zhuǎn)化率由治療前的異常升高降至正常范圍。可見 IFN-γ在關(guān)節(jié)炎疼痛中發(fā)揮重要體內(nèi)免疫調(diào)節(jié)作用,因此升高IFN-γ是治療炎性痛獲效環(huán)節(jié)之一[19]。在激光治療過程中,我們觀察到IFN-γ含量整體呈上升趨勢(shì),說明半導(dǎo)體激光照射能夠促進(jìn) IFN-γ的分泌;同時(shí) IFN-γ自身還能分泌 IL-1、TNF、IFN-α等細(xì)胞因子,所以在激光治療第5天到第7天IL-1、TNF-α的含量降低速度變緩,可能與IFN-γ含量增高呈正相關(guān)。
本實(shí)驗(yàn)采用的是650 nm半導(dǎo)體激光,為近紅外譜段,對(duì)生物組織的穿透深度和升溫作用均大于 He-Ne激光,它被組織吸收后產(chǎn)生的熱能和化學(xué)能非常小,不會(huì)傷害到組織,卻起到了對(duì)機(jī)體產(chǎn)生刺激調(diào)整作用。加上其脈沖輸出、光管壽命長(zhǎng)、體積小、價(jià)格低廉,所以是一種較理想的物理治療光源,素有人體黃金波段“生命之光”的美稱[20]。半導(dǎo)體激光照射AA大鼠足三里3 d后關(guān)節(jié)腫脹度明顯減輕,但7 d后腫脹度減輕程度沒有之前明顯;3 d治療后大鼠痛閾依舊是下降趨勢(shì),在經(jīng)過5 d治療后開始提高;IL-1與TNF-α的含量在治療3 d到治療5 d呈下降趨勢(shì),治療5 d到7 d兩者的含量雖有下降,但沒有之前明顯。此外,激光3 d組血清中 IFN-γ含量顯著提高,但治療 5 d到 7 dIFN-γ增量速度明顯變緩。這些證實(shí)了激光多次小劑量照射和一次大劑量照射所引起的生物效應(yīng)是一樣的,最終效應(yīng)依賴于激光的總能量。即隨著激光照射次數(shù)的增加,其刺激量增強(qiáng),反應(yīng)強(qiáng)度會(huì)出現(xiàn)峰值,再增加刺激次數(shù)時(shí),作用強(qiáng)度將明顯下降。因此,半導(dǎo)體激光照射消炎鎮(zhèn)痛作用在時(shí)間上明顯優(yōu)于針刺療法,說明半導(dǎo)體激光治療急性炎性疼痛時(shí)能縮短療程。但是它的治療效果并不是越來越明顯,而是趨于平緩,即激光穴位照射存在著一定的累積效應(yīng)。此外,半導(dǎo)體激光生物效應(yīng)的累積及其拋物線特性在檢測(cè)不同的指標(biāo)時(shí),會(huì)呈現(xiàn)不一樣的結(jié)果,這個(gè)與檢測(cè)指標(biāo)的特異性以及激光參數(shù)和生物特性,例如激光的波長(zhǎng)、功率、振動(dòng)模式和生物體穴位的吸光率、熱導(dǎo)率、靈敏度、弛豫時(shí)間等密切相關(guān)[21]。
本實(shí)驗(yàn)選用的是AA大鼠急性關(guān)節(jié)炎模型,急性炎癥主要造成的是局部炎性的改變,而慢性炎癥還可能有局部炎部組織發(fā)生變性和壞死及全身性不良反應(yīng)等繼發(fā)情況。隨治療時(shí)間延長(zhǎng),AA大鼠表現(xiàn)的急性炎癥反應(yīng)進(jìn)入了繼發(fā)狀態(tài),引起全身免疫反應(yīng)。激光治療主要起到消炎鎮(zhèn)痛的作用,且存在著生物效應(yīng)的累積,因此半導(dǎo)體激光在治療急性炎癥時(shí)效果比較明顯,對(duì)于慢性炎癥的治療激光療效可能并不如針刺治療的療效,這些還有待下一步研究。
[1]何懷,袁家齊,矯勇軼,等.半導(dǎo)體激光穴位照射的鎮(zhèn)痛作用及其機(jī)制初探[J].蘇州醫(yī)學(xué)院學(xué)報(bào),2000,20(3):206-208.
[2]林文注,王佩.實(shí)驗(yàn)針灸學(xué)[M].上海:上海科學(xué)技術(shù)出版社,1999:288.
[3]劉新,李勝利,陳家驊.半導(dǎo)體激光疼痛治療的研究[J].應(yīng)用激光,1997,17(4):186-190.
[4]劉曉艷,吳凡,王麗禎,等.CO2激光灸治療不同中醫(yī)證型膝骨關(guān)節(jié)炎療效觀察[J].上海針灸雜志,2012,31(10):699-702.
[5]祁宏,王麗禎,趙玲,等.復(fù)合激光穴位照射治療骨關(guān)節(jié)炎多中心對(duì)照研究[J].應(yīng)用激光,2013,33(4):469-472.
[6]鄧聰,老錦雄.激光針灸對(duì)退變性下頸椎不穩(wěn)患者血管活性因子的影響[J].內(nèi)蒙古中醫(yī)藥,2012,31(10):27.
[7]李湘齡,陳曉韻,金娜來,等.針刺與氦氖激光治療膝骨關(guān)節(jié)炎的臨床對(duì)比研究[J].上海針灸雜志, 2012,31(11):829-830.
[8]樊鳳杰,洪文學(xué),宋佳霖.激光針灸的研究現(xiàn)狀與展望[J].激光雜志,2010,(5):58-59.
[9]林獻(xiàn)忠,畢好生.疼痛、鎮(zhèn)痛與免疫[J].國外醫(yī)學(xué):麻醉學(xué)與復(fù)蘇分冊(cè),2003,24(2):75-79.
[10]Haddad JJ. On the enigma of pain and hyperalgesia: a molecular perspective[J]. Biochem Biophys Res Commun, 2007,353(2):217-224.
[11]陳紀(jì)藩.通痹靈對(duì)佐劑性關(guān)節(jié)炎大鼠滑膜細(xì)胞產(chǎn)生IL-1、TNF-α及PGE-2的影響[J].廣州中醫(yī)藥大學(xué)學(xué)報(bào),1999,16(1):30.
[12]蔡青,孟濟(jì)明.IL-1和TNF與類風(fēng)濕性關(guān)節(jié)炎[J].上海免疫學(xué)雜志,1998,18(1):62.
[13]Sweitzer SM, Colburn RW, Rutkowski M, et al. Acute peripheral inflammation induces moderate glial activation and spinal IL-1βexpression that correlates with pain behavior in the rat[J]. Brain Res,1999,829(1-2):209-221.
[14]武宏,李大可,王振華,等.激光穴位照射治療類風(fēng)濕關(guān)節(jié)炎及對(duì)血清IL-1、TNFα的影響[J].激光雜志,2002,23(3):87-88.
[15]Yang X, Chen L, Xu X, et al. TGF-β/Smad3 signals repress chondrocyte hypertrophic differentiation and are required for maintaining articular cartilage[J]. J Cell Biol, 2001,153(1):35-46.
[16]Joosten LA, Helsen MM, Saxne T, et al. IL-1α, β blockade prevents cartilage and bone destruction in murine type Ⅱ collagen-induced arthritis, Whereas TNF-α blockade only ameliorates joint inflammation[J]. J Immuno, 1999,163(9):5049-5055.
[17]Hirota Y, Tsukazaki T, Yonekura A, et al. Activation of specific MEKERK cascade is necessary for TGF-β signaling and crosstalk with PKA and PKC pathways in cultured rat articular chondrocytes[J].Osteoarthritis Cartilage, 2000,8(4):241-247.
[18]胡恒貴,尹向飛,蔣紅梅,等.核因子-κB誘騙劑處理的DC對(duì)膠原誘導(dǎo)性關(guān)節(jié)炎大鼠外周血IFN-υ、IL-1O、抗Ⅱ型膠原抗體水平的影響[J].中華微生物學(xué)和免疫學(xué)雜志,2011,31(10):870-874.
[19]唐福林,程蓉,曾學(xué)軍,等.人基因重組干擾素υ治療類風(fēng)濕關(guān)節(jié)炎的Ⅱ期臨床驗(yàn)證[J].風(fēng)濕病學(xué)雜志,1996,1(1):19.
[20]蘇華,李守春,王立軍,等.半導(dǎo)體激光器在醫(yī)療上的應(yīng)用及其前景展望[J].應(yīng)用激光,2006,26(2):125-130.
[21]劉國剛.論激光誘發(fā)生物效應(yīng)的累積[J].醫(yī)學(xué)物理,1989,6(3):46-49.

