西洋參莖葉總皂苷對缺血/再灌注大鼠心肌線粒體膜電位及細胞凋亡的影響*
李 冬, 劉 蜜, 陶天琪, 宋丹丹, 劉秀華△, 史大卓
心肌細胞凋亡廣泛存在于包括缺血性心臟病在內的多種心血管疾病中,對病情發展和預后起著重要作用[1-2]。在心肌缺血/再灌注(ischemia/reperfusion,I/R)損傷過程中,細胞內氧化應激的發生、Ca2+穩態失衡等均會引起細胞損傷,加重細胞凋亡[3]。如何有效保護缺血心肌組織,減輕I/R損傷后的細胞凋亡,是目前醫學研究領域的重要問題之一[4]。在心肌I/R損傷過程中,Ca2+超載和活性氧(reactive oxygen species,ROS)的大量產生會造成線粒體膜通透性轉換孔(mitochondrial permeability transition pore,mPTP)不可逆開放,大量分子質量小于1.5 kD的物質通過線粒體內膜,使線粒體膜電位(mitochondrial membrane potential,ΔΨm)迅速降低,導致離子平衡失調,線粒體腫脹。mPTP開放使細胞色素C(cytochrome C,Cyt C)從線粒體釋放入胞漿,激活線粒體凋亡通路,導致細胞凋亡、壞死,加重心肌損傷[5-6]。ΔΨm下降作為再灌注期mPTP開放后的特異性改變,能反映mPTP的開放程度,也是線粒體凋亡通路激活的早期變化之一[7]。
西洋參莖葉總皂苷(Panax quinquefolium saponin,PQS)是西洋參莖葉的主要活性成分。既往研究發現,PQS具有抗心肌缺血、減輕I/R損傷導致的心肌細胞凋亡[8-10]和改善心肌梗死后心室重構等作用[11],其機制與抑制過度內質網應激(endoplasmic reticulum stress,ERS)[12-14]、增強抗氧化酶活性、減少細胞內Ca2+超載等有關[15]。PQS能否通過維持再灌注后心肌細胞ΔΨm的穩定、抑制線粒體凋亡通路激活而發揮對I/R心肌的保護作用?目前尚無相關研究。因此,本實驗采用大鼠心肌I/R損傷模型,觀察PQS對心肌I/R損傷后ΔΨm及線粒體凋亡通路的影響,探討其保護I/R心肌和發揮抗凋亡作用的可能機制。
材料和方法
1 動物、試劑及儀器
清潔級健康雄性Sprague-Dawley大鼠,體質量(150±20)g,購自北京維通利華實驗動物技術有限公司[許可證號為 SCXK(京)2012-0001];PQS粉(純度為99.0%)由吉林省集安益盛藥業股份有限公司提供;環孢霉素A(cyclosporin A,CsA)購自諾華公司;末端脫氧核苷酸轉移酶介導的dUTP缺口末端標記 (TdT-mediated dUTP nick end labeling,TUNEL)試劑盒購自Promega;線粒體提取試劑盒購自凱基公司;兔抗人Bcl-2、Bax多克隆抗體和兔抗人Cyt C、GAPDH單克隆抗體均購自Cell Signal;兔抗人caspase-3多克隆抗體購自Merck Millipore;發光液Luminol Reagent購自Santa Cruz;其余化學試劑均購自Sigma-Aldrich;全自動生化分析儀(Cotas 8000,Roche);熒光酶標儀(Multiskan MK3,Thermo);激光共聚焦顯微鏡(FV1000,Olympus)。
2 I/R大鼠模型的制備和實驗分組
SD大鼠90只,適應性喂養1周,術前禁食12 h,自由飲水,按照文獻[16]報道的方法復制心肌I/R模型:以2%戊巴比妥鈉(2.3 mL/kg)腹腔注射麻醉后,使大鼠仰臥位固定于手術臺,氣管插管,呼吸機輔助呼吸,記錄標準導聯心電圖。胸骨正中切口,鈍性分離皮下組織及肌肉,于胸骨左緣3~4肋間開胸,打開心包膜,分離脂肪墊,于左心耳下緣1 mm處以7號針線在冠狀動脈左前降支 (left anterior descending coronary,LAD)下方穿縫合線,將充水(0.5 mL)的球囊墊于血管與結扎線間,結扎造成心肌缺血。心電圖監測顯示ST段抬高0.2 mV為造模成功,持續30 min后打開結扎線,抽出球囊,關胸,再灌注120 min。
健康成年SD大鼠 (280~320 g),隨機分為6組,每組15只。(1)假手術 (sham)組:與藥物組等量純凈水灌胃,每天1次,連續6周;(2)模型(I/R)組:與Sham組灌胃方式相同,結扎LAD 30 min,再灌注120 min;(3)PQS+I/R組:PQS水溶液 (200 mg·kg-1·d-1)灌胃,每天1次,連續6周后行I/R組操作;(4)CsA組:再灌注開始前10 minCsA(10 mg·kg-1)腹腔注射,開胸后穿線,不結扎LAD;(5)CsA+I/R組:CsA(10 mg·kg-1)腹腔注射,余操作同I/R組;(6)PQS+CsA+I/R組:再灌注開始前10 min,CsA(10 mg·kg-1)腹腔注射,余操作同PQS+I/R組。復灌120 min后,經頸動脈插管取血用于血清LDH含量測定,每組隨機選5只大鼠取全心行心梗面積檢測,另10只分別沿心臟長軸橫切心肌組織用甲醛固定制備組織切片,或取左室梗死危險區(area at risk,AAR)心肌組織迅速液氮冷凍后置于-80℃冰箱保存用于相關蛋白表達的檢測,并按文獻[17]報道的方法提取線粒體用于ΔΨm的測定。
3 方法
3.1 血清乳酸脫氫酶(lactate dehydrogenase,LDH)含量測定 經頸動脈插管取血約10 mL,肝素抗凝,靜止15~20 min后3 000 r/min離心10 min,收集血清,Eppendorf管分裝,液氮速凍后轉移至-80℃冰箱保存。以全自動生化分析儀(Roche)測定血清心肌損傷標志物LDH含量。
3.2 心肌梗死面積測定 按文獻[18]報道的方法,從LAD結扎點結扎LAD,經主動脈逆行灌注1%伊文思藍(Evans blue)2 mL,將非缺血區藍染,顯示出缺血區心肌組織,取出心臟,置于-20℃冰箱冷凍20 min,垂直心臟長軸橫切成厚度均為2 mm左右的5片心臟切片,用絲線按順序將其串起,置于2%的2,3,5-氯化三苯基四氮唑 (2,3,5-triphenyltetrazolium chloride,TTC)磷酸緩沖液中。37℃避光孵育30 min,置于10%甲醛溶液中過夜,封片。正常心肌組織呈藍色,缺血非梗死區為紅色,梗死區 (infarct size,IS)為灰白色,AAR為紅色與灰白色區域之和。掃描儀掃描成像,以Image-Pro Plus圖像分析軟件(Version 4.1)計算各部分面積。參考文獻[19]方法,缺血心肌面積用AAR面積與左心室 (left ventricle,LV)面積之比AAR/LV表示,梗死面積用IS/AAR表示。
3.3 心肌細胞凋亡測定 于左心室結扎部位以下垂直于心臟長軸橫切厚約1 cm的心肌組織,置于10% 甲醛溶液中固定1周,常規石蠟包埋,制備3 μm切片,采用TUNEL法進行細胞凋亡檢測[20]。激光共聚焦顯微鏡觀察,正常心肌細胞核呈藍色,凋亡細胞核呈深淺不一的綠色。每張切片于凋亡細胞分布區域隨機取5個高倍視野 (×60),計數每個視野中凋亡細胞數占總細胞數的百分比 (%),以凋亡指數(apoptotic index,AI)表示。
3.4 線粒體提取 依照線粒體提取試劑盒要求進行操作:取各組復灌120 min大鼠左室前壁AAR區心肌組織150 mg,用剪刀將其剪成2 mm×2 mm×2 mm大小碎塊放入冰水浴的玻璃勻漿器內,加入1.5 mL lysis buffer,上下研磨,將充分磨碎的組織液4℃離心5 min(800×g),取上清0.5 mL加入0.5 mL medium buffer,4 ℃離心10 min(15 000 ×g),離心后的上清含胞漿成分,將其留取后存于-80℃冰箱,沉淀物即為線粒體。向線粒體沉淀中加入0.2 mL wash buffer,以吸管吹打成懸液,4℃離心10 min(15 000×g),棄上清。向沉淀物中加入0.l mL store buffer,重懸后于 -80℃冰箱保存用于ΔΨm檢測。
3.5 ΔΨm測定 以陽離子熒光染色劑羰花青 (5,5′,6,6′-tetrachloro-1,1′,3,3′-tetraethyl benzimidalyl carbocyanine iodide,JC-1)標記線粒體,參照文獻[21]方法進行檢測。將 -80℃保存的線粒體懸液取出,冰槽內融化,用ΔΨm反應緩沖液 (0.21 mol/L甘露醇,0.07 mol/L蔗糖,5 mmol/L HEPES,pH 7.4)懸浮線粒體懸液 (含線粒體蛋白50 μg),緩沖體系為2 mL。加入1 μL解偶聯劑羰基氰化物間氯苯腙(carboxyl cyanidem chlorophenylhydrazone,CCCP)30℃ 10 min,隨后加入0.2 mmol/L JC-1染色液3 μL,室溫避光孵育10 min,進行ΔΨm測定。取100 μL上述反應液移至載玻片上,在激光共聚焦顯微鏡下進行觀察(單濾波):激發波長490 nm,散發波長590 nm,可見亮紅色熒光,如熒光強度顯著減弱,表明ΔΨm受到破壞。另取100 μL加入96孔板各孔中,即刻放進熒光酶標儀測定,檢測激發波長490 nm、散發波長590 nm下的熒光強度,結果以相對熒光單位(relative fluorescence unit,RFU)表示。
3.6 Western blotting 取大鼠左室前壁心肌組織(AAR區)40 mg,按文獻[22]報道方法提取總蛋白,與分離線粒體后留取的含胞漿成分的上清一起,用BCA法進行蛋白定量,-80℃冰箱保存。取上述蛋白提取液(含蛋白80 μg)進行聚丙烯酰胺凝膠電泳(SDS-PAGE,12%分離膠)。電泳分離后的蛋白電轉移至硝酸纖維素膜上,5%BSA封閉1 h,分別加入Bcl-2、Bax、Cyt C 和 GAPDH 單克隆抗體 (1∶1 000)和caspase-3多克隆抗體 (1∶100)4℃ 過夜孵育,其中caspase-3抗體可同時識別caspase-3酶原 (procaspase-3,分子量為32 kD)和剪切后的 caspase-3(cleaved caspase-3,分子量為17 kD);用1×TBST洗膜后,相應Ⅱ抗孵育1 h。化學發光ECL顯示蛋白條帶,采用Image-Pro Plus 4.1軟件分析蛋白條帶的吸光度[integrated absorbance,IA=平均吸光度(A)×面積],以靶蛋白IA與GAPDH IA的比值反映靶蛋白水平。
4 統計學處理
采用SPSS 17.0統計軟件處理。數據用均數±標準差 (mean±SD)表示,采用單因素方差分析(One-way ANOVA)進行多組間比較,q檢驗進行多組間兩兩比較;用卡方檢驗(Chi-square test)進行率的比較。以P<0.05為差異有統計學意義。
結 果
1 PQS對心肌I/R損傷的影響
1.1 血清LDH I/R組血清LDH含量顯著升高,為sham組的1.06倍(P<0.05),CsA組LDH含量與sham組比較無顯著差異(P>0.05);與I/R組比較,PQS+I/R、CsA+I/R及 PQS+CsA+I/R組血清LDH含量分別降低38.2%、31.0%和39.3%(P<0.05);CsA+I/R組、PQS+CsA+I/R組 LDH含量與PQS+I/R組比較無顯著差異 (P>0.05),見圖1。

Figure 1.Effect of PQS on serum activity of LDH after I/R.Mean±SD.n=10.*P<0.05 vs sham;#P<0.05 vs I/R.圖1 PQS對血清LDH含量的影響
1.2 心肌梗死面積 Sham組AAR/LV為(43.8±3.1)%,I/R組為(47.1±4.6)%,PQS+I/R組為(42.3±4.8)%,CsA組為(43.1±7.7)%,CsA+I/R組為(45.5±5.9)%,PQS+CsA+I/R組為(43.6±4.9)%,組間無顯著差異(P>0.05);sham組和CsA組大鼠無心肌梗死,I/R組 IS/AAR為(42.4±3.0)%;與I/R組相比,PQS+I/R組、CsA+I/R組和PQS+CsA+I/R組IS/AAR分別降低50.3%、38.7%和39.4%(P <0.05),PQS+I/R、CsA+I/R和PQS+CsA+I/R組間IS/AAR無顯著差異(P>0.05),見圖 2。

Figure 2.The effect of PQS on myocardial infarct size in the rats with Evans blue and TTC staining.Mean±SD.n=5.#P<0.05 vs I/R.圖2 PQS對心肌梗死面積的影響
1.3 心肌細胞凋亡 與sham組比較,I/R組心肌細胞AI升高6.08倍 (P<0.05),CsA組AI無顯著差異 (P>0.05);與I/R組比較,PQS+I/R組、CsA+I/R組和PQS+CsA+I/R組心肌細胞AI分別降低40.7%、46.4%和39.1%(P <0.05),PQS+I/R、CsA+I/R和PQS+CsA+I/R組間AI無顯著差異(P >0.05),見圖3。
2 PQS對ΔΨm的影響
激光共聚焦顯微鏡下觀察顯示,sham組線粒體紅色熒光強度較高,與sham組相比,I/R組熒光強度減弱,CsA組熒光強度無明顯變化;與I/R組相比,PQS+I/R組、CsA+I/R組和PQS+CsA+I/R組線粒體紅色熒光均顯著增強。熒光酶標儀結果顯示,sham組RFU值為23.2±4.0,I/R組 RFU值為8.9±2.2,和sham組相比降低61.3%(P<0.05),CsA組RFU值與sham組無顯著差異(P>0.05);PQS+I/R組、CsA+I/R組和PQS+CsA+I/R組 RFU值分別為14.7±3.3、16.9±0.9和16.1±3.7,較 I/R組升高64.2%、88.3%和79.4%(P<0.05),3組間RFU值無顯著差異 (P>0.05),見圖4。
3 PQS對凋亡因子Bcl-2和Bax蛋白表達的影響
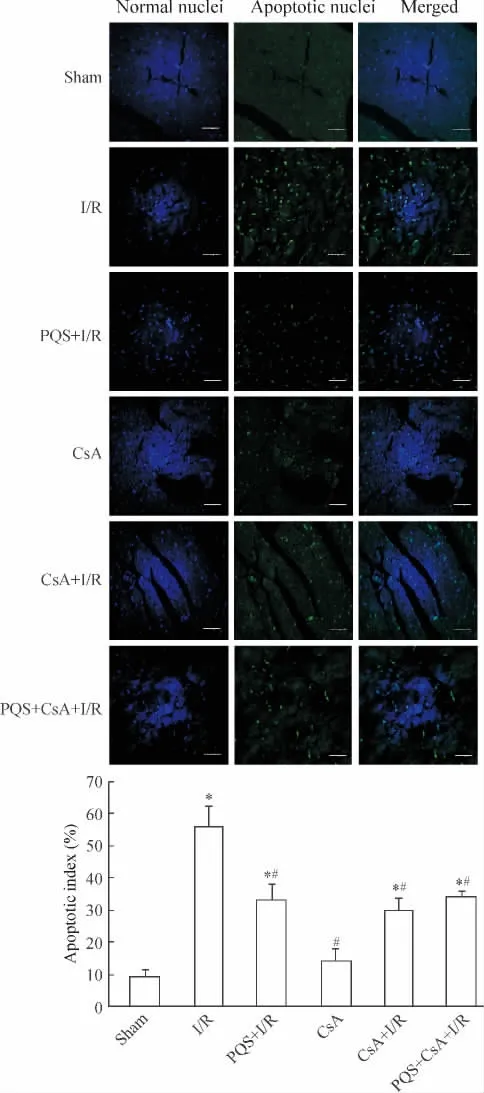
Figure 3.The effect of PQS on cardiomyocyte apoptotic index(TUNEL staining,×60,scale bar=20 μm).Mean±SD.n=10.*P<0.05 vs sham;#P<0.05 vs I/R.圖3 PQS對大鼠心肌細胞凋亡指數的影響
與sham組比較,I/R組 Bcl-2蛋白表達降低65.1%(P<0.05),Bax為 sham組的2.3倍 (P<0.05);CsA組Bcl-2和Bax蛋白表達與Sham組比較均無顯著差異(P>0.05);與I/R組相比,PQS+I/R組、CsA+I/R組和PQS+CsA+I/R組Bcl-2表達量分別為I/R組的1.9、1.8和2.0倍(P<0.05),Bax蛋白表達分別較 I/R組降低46.3%、44.6%和48.7%(P<0.05);PQS+I/R、CsA+I/R和 PQS+CsA+I/R組Bcl-2和 Bax蛋白表達無顯著差異(P >0.05),見圖5。
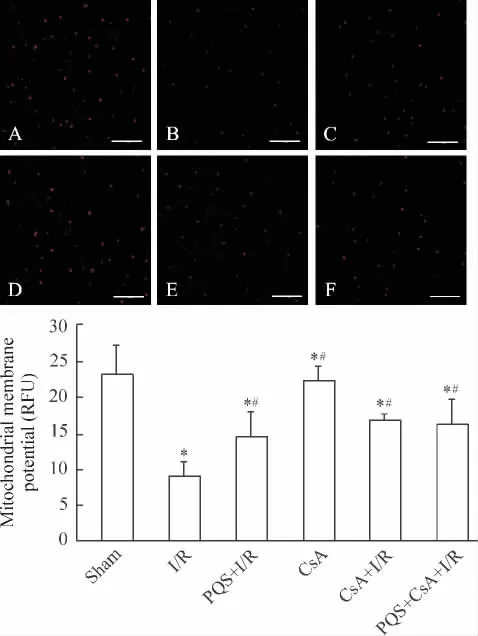
Figure 4.The effect of PQS on mitochondrial membrane potential(×600,scale bar=20 μm).A:sham group;B:I/R group;C:PQS+I/R group;D:CsA group;E:CsA+I/R group;F:PQS+CsA+I/R group.Mean±SD.n=10.*P<0.05 vs sham;#P<0.05 vs I/R.圖4 PQS對大鼠心肌細胞線粒體膜電位的影響
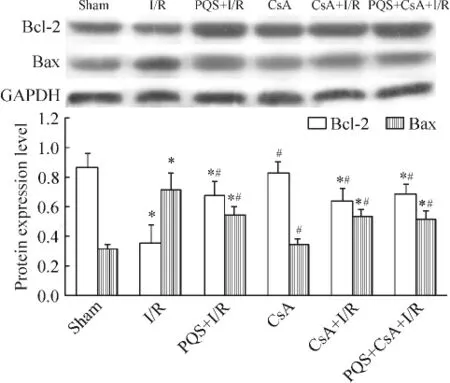
Figure 5.The effect of PQS on the expression of pro-apoptotic protein Bax and anti-apoptotic protein Bcl-2 in I/R myocardium.Mean±SD.n=8.*P<0.05 vs sham;#P<0.05 vs I/R.圖5 PQS對I/R心肌組織Bcl-2和Bax蛋白表達的影響
4 PQS對Cyt C蛋白表達的影響
與sham組相比,I/R組大鼠心肌組織胞漿中Cyt C蛋白表達量升高1.77倍 (P<0.05),CsA組胞漿Cyt C蛋白表達無顯著差異 (P>0.05);與I/R組比較,PQS+I/R組、CsA+I/R組和PQS+CsA+I/R組胞漿Cyt C蛋白表達量分別降低29.7%、32.5%和28.9%(P<0.05);PQS+I/R、CsA+I/R和 PQS+CsA+I/R組間胞漿Cyt C蛋白表達無顯著差異(P >0.05),見圖6。
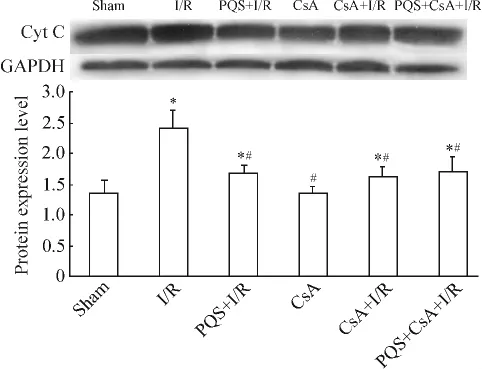
Figure 6.The effect of PQS on the expression of cytosolic Cyt C in I/R myocardium.Mean±SD.n=8.*P<0.05 vs sham;#P<0.05 vs I/R.圖6 PQS對I/R心肌組織胞漿中Cyt C蛋白表達的影響
5 PQS對cleaved caspase-3蛋白表達的影響
結果顯示,各組pro-caspase-3蛋白表達無明顯差異(P>0.05);與sham組比較,I/R組可明顯誘導大鼠心肌組織caspase-3蛋白剪切活化,其cleaved caspase-3蛋白表達水平顯著增加,為sham組的2.6倍(P<0.05),CsA組較sham組無明顯變化 (P>0.05);與I/R組相比,PQS+I/R組、CsA+I/R組和PQS+CsA+I/R組cleaved caspase-3蛋白表達量分別降低53.3%、47.3%和45.1%(P<0.05);PQS+I/R、CsA+I/R和PQS+CsA+I/R組間無顯著差異 (P>0.05),見圖7。
討 論
本實驗結果顯示,I/R可造成大鼠心肌細胞損傷,使血清LDH水平上升,心梗面積增大,細胞凋亡增多,ΔΨm下降,線粒體凋亡通路激活;PQS具有抗心肌I/R損傷作用,表現為降低I/R大鼠血清LDH水平,縮小心肌梗死面積,減少心肌細胞凋亡,抑制再灌注期ΔΨm降低,升高Bcl-2/Bax蛋白表達,減少Cyt C和cleaved caspase-3蛋白表達,提示PQS的I/R心肌保護作用與維持再灌注期ΔΨm穩定、抑制mPTP開放并減少mPTP開放后線粒體凋亡通路的激活有關。
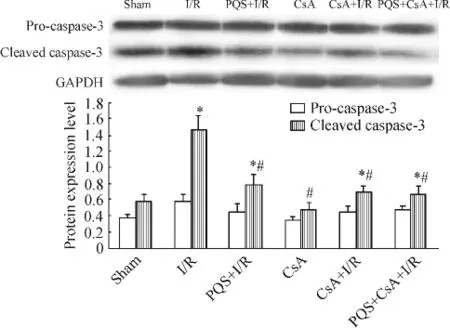
Figure 7.The effect of PQS on the expression of apoptotic effector enzyme caspase-3 in I/R myocardium.Mean±SD.n=8.*P<0.05 vs sham;#P<0.05 vs I/R.圖7 PQS對I/R心肌組織caspase-3活化的影響
心肌I/R損傷時細胞膜通透性增加,心肌酶漏出,LDH作為靈敏度較高的心肌酶之一,其含量變化能較準確地反映心肌損傷程度。本實驗結果顯示,PQS能顯著降低I/R后血清LDH含量,表明PQS可減輕I/R心肌損傷。心梗面積是反映心肌損傷程度的金指標[23],與I/R組相比,PQS能明顯縮小大鼠心梗面積,說明PQS對I/R心肌具有保護作用。
細胞凋亡是心肌I/R損傷的一個重要形式[24-25]。與缺血期相比,缺血后再灌注可加速細胞凋亡[26],且凋亡細胞主要存在于梗死周邊的心肌組織中[27]。本研究選用大鼠心肌AAR區進行TUNEL染色,顯示I/R能使凋亡細胞數量顯著增加,PQS治療可明顯降低凋亡細胞數量,AI值較I/R組下降,說明PQS具有抗I/R心肌細胞凋亡作用,與以往報道一致[13]。
在I/R過程中,線粒體基質內ROS的大量產生、Ca2+超載等均會造成線粒體腫脹,ΔΨm下降,mPTP開放[28-29]。mPTP開放又可進一步降低 ΔΨm,造成線粒體呼吸鏈解偶聯,mPTP不可逆開放[30];ΔΨm是衡量線粒體功能和mPTP開放程度的重要指標之一[31]。mPTP不可逆開放可使Cyt C從損傷的線粒體外膜向胞漿釋放,與凋亡蛋白酶活化因子1和caspase-9的蛋白前體形成凋亡小體,在dATP的輔助下激活caspase-9,使caspase-3活化,啟動caspase級聯凋亡反應,加劇I/R后的心肌細胞損傷[32-34]。作為線粒體凋亡通路下游的關鍵分子,caspase-3活化后的剪切形式cleaved caspase-3可反映細胞凋亡水平[35]。另外,Bcl-2家族在線粒體凋亡通路的激活中也發揮關鍵作用[36]。Bcl-2和Bax是Bcl-2家族中的重要成員,Bcl-2主要分布于線粒體外膜、內質網和核周膜,抑制細胞凋亡;Bax主要存在于胞質中,促進細胞凋亡。Bax能與mPTP的腺嘌呤核苷酸轉位酶(adenine nucleotide translocase,ANT)成分結合,導致mPTP開放,而 Bcl-2能抑制Bax和ANT的結合作用,Bcl-2/Bax對mPTP的調控位于線粒體凋亡通路的上游,也對mPTP開放及繼后的凋亡激活起到重要作用[37]。本研究通過激光共聚焦顯微鏡及熒光酶標儀對ΔΨm進行檢測,發現I/R能使心肌ΔΨm顯著降低,PQS能明顯提高心肌I/R損傷后ΔΨm水平;Western blotting結果顯示,與I/R組相比,PQS能使心肌Bcl-2蛋白表達升高,Bax、cleaved caspase-3和胞漿Cyt C蛋白表達下降。該結果提示,PQS能抑制再灌注期ΔΨm下降,并減少mPTP開放后線粒體凋亡通路的激活。
CsA是效果明確的mPTP特異性抑制劑,它可通過與mPTP上親環蛋白D(cyclophilin D,CyP-D)結合,抑制mPTP開放[38-40]。但作為具有免疫抑制作用的藥物,CsA也可引起嚴重的不良反應,如高血壓、鉀潴留、高鉀血癥和肝、腎功能衰竭等,限制了其臨床應用[41]。本研究結果顯示,CsA能降低I/R后血清LDH含量,減小心梗面積,減少心肌細胞凋亡,穩定ΔΨm水平,升高Bcl-2蛋白表達,降低 Bax、Cyt C和cleaved caspase-3蛋白表達,但與PQS組比較無顯著差異。此外,與PQS或CsA單獨使用比較,PQS與CsA聯合應用對以上各指標的作用亦無顯著差異,說明PQS和CsA對I/R心肌的保護作用、抗凋亡作用與對再灌注期ΔΨm的調控效果類似。
[1] Bialik S,Cryns VL,Drincic A,et al.The mitochondrial apoptotic pathway is activated by serum and glucose deprivation in cardiac myocyte[J].Circ Res,1999,85(5):403-414.
[2] Black SC,Huang JQ,Rezaiefar P,et al.Co-localization of the cysteine protease caspase-3 with apoptotic myocytes after in vivo myocardial ischemia and reperfusion in the rat[J].J Mol Cell Cardiol,1998,30(4):733-742.
[3] Hausenloy DJ,Yellon DM.The evolving story of“conditioning”to protect against acute myocardial ischemiareperfusion injury[J].Heart,2007,93(6):649-651.
[4] Yellon DM,Hausenloy DJ.Myocardial reperfusion injury[J].N Engl J Med,2007,357(11):1121-1135.
[5] Di Lisa F,Canton M,Menabò R,et al.Mitochondria and cardioprotection[J].Heart Fail Rev,2007,12(3-4):249-260.
[6] Kinnally KW,Peixoto PM,Ryu SY,et al.Is mPTP the gatekeeper for necrosis,apoptosis,or both?[J].Biochim Biophys Acta,2011,1813(4):616-622.
[7] Zamzami N,Marchetti P,Castedo M,et al.Reduction in mitochondrial potential constitutes an early irreversible step of programmed lymphocyte death in vivo[J].J Exp Med,1995,181(5):1661-1672.
[8] 王承龍,史大卓,殷惠軍,等.西洋參莖葉總皂苷對急性心肌梗死大鼠心肌VEGF、bFGF表達及血管新生的影響[J].中國中西醫結合雜志,2007,27(4):331-334.
[9] 王承龍,繆 宇,殷惠軍,等.西洋參莖葉總皂苷對急性心肌梗死大鼠心肌能量代謝的影響[J].中華老年心腦血管病雜志,2005,7(5):341-343.
[10]殷惠軍,張 穎,蔣躍絨,等.西洋參葉總皂苷對急性心肌梗死大鼠心肌細胞凋亡及凋亡相關基因表達的影響[J].中國中西醫結合雜志,2005,25(3):232-235.
[11]李廣闊,范金爽,李煥明.西洋參莖葉總皂苷對心室重構大鼠的保護作用[J].中國老年學雜志,2011,31(12):4634-4636.
[12] Wang C,Li YZ,Wang XR,et al.Panax quinquefolium saponins reduce myocardial hypoxia-reoxygenation injury by inhibiting excessive endoplasmic reticulum stress[J].Shock,2012,37(2):228-233.
[13]王 琛,劉 蜜,孫 勝,等.西洋參莖葉總皂苷通過抑制過度內質網應激減輕大鼠心肌缺血/再灌注損傷[J].中國病理生理雜志,2013,29(1):20-27.
[14]Liu M,Wang XR,Wang C,et al.Panax quinquefolium saponin attenuates ventricular remodeling after acute myocardial infarction by inhibiting CHOP-mediated apoptosis[J].Shock,2013,40(4):339-344.
[15]鞠傳靜,張志國,趙學忠,等.西洋參葉二醇組皂甙對大鼠實驗性心室重構的保護作用[J].中國老年學雜志,2007,27(22):2173-2175.
[16]趙秀梅,孫 勝,劉秀華.墊扎球囊法復制大鼠在體心肌缺血/再灌注模型[J].中國微循環,2007,11(3):206-208.
[17] Siripong P,Punate W,Kroekkiat C,et al.Mechanisms responsible for beneficial and adverse effects of rosiglitazone in a rat model of acute cardiac ischemia-reperfusion[J].Exp Physiol,2013,98(5):1028-1037.
[18] Liu XH,Grund F,Kanellopoulos GK,et al.Myocardial extracellular signal regulatory kinases are activated by laser treatment[J].J Cardiovasc Surg(Torino),2003,44(1):1-7.
[19] Redel A,Jazbutyte V,Smul TM,et al.Impact of ischemia and reperfusion times on myocardial infarct size in mice in vivo[J].Exp Biol Med,2008,233(1):84-93.
[20] Gavrieli Y,Sherman Y,Ben-Sasson SA.Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation[J].J Cell Biol,1992,119(3):493-501.
[21] Hassouna A,Loubani M,Matata BM,et al.Mitochondrial dysfunction as the cause of the failure to precondition the diabetic human myocardium[J].Cardiovasc Res,2006,69(2):450-458.
[22] Xu FF,Liu XH,Cai LR.Role of hypoxia-inducible factor-1 in the prevention of cardiomyocyte injury induced by hypoxic preconditioning[J].Acta Physiol Sin,2004,56(5):609-614.
[23]張 雷,顧爾偉,劉訓芹,等.乳化異氟醚后處理對兔在體心臟缺血/再灌注損傷的保護作用[J].中國藥理學通報,2009,25(10):1322-1326.
[24] Fliss H,Gattinger D.Apoptosis in ischemic and reperfused rat myocardium[J].Circ Res,1996,79(5):949-956.
[25] Krijnen PA,Nijmeijer R,Meijer CJ,et al.Apoptosis in myocardial ischaemia and infarction[J].J Clin Pathol,2002,55(11):801-811.
[26] Haunstetter A,Izumo S.Apoptosis:basic mechanisms and implications for cardiovascular disease[J].Circ Res,1998,82(11):1111-1129.
[27] Scarabelli TM,Gottlieb RA.Functional and clinical repercussions of myocyte apoptosis in the multifaceted damage by ischemia/reperfusion injury:old and new concepts after 10 years of contributions[J].Cell Death Differ,2004,11(Suppl 2):S144-S152.
[28] Lemasters JJ,Qian T,He L,et al.Role of mitochondrial inner membrane permeabilization in necrotic cell death,apoptosis,and autophagy[J].Antioxid Redox Signal,2002,4(5):769-781.
[29] Baines CP.The mitochondrial permeability transition pore and ischemia-reperfusion injury[J].Basic Res Cardiol,2009,104(2):181-188.
[30] Halestrap AP,Clarke SJ,Javadov SA.Mitochondrial permeability transition pore opening during myocardial reperfusion:a target for cardioprotection[J].Cardiovasc Res,2004,61(3):372-385.
[31] Halestrap AP,McStay GP,Clarke SJ.The permeability transition pore complex:another view[J].Biochimie,2002,84(2-3):153-166.
[32] Huttemann M,Helling S,Sanderson TH,et al.Regulation of mitochondrial respiration and apoptosis through cell signaling:cytochrome c oxidase and cytochrome c in ischemia/reperfusion injury and inflammation[J].Biochim Biophys Acta,2012,1817(4):598-609.
[33] Nakagawa T,Shimizu S,Watanabe T,et al.Cyclophilin D-dependent mitochondrial permeability transition regulates some necrotic but not apoptotic cell death[J].Nature,2005,434(7033):652-658.
[34] Gateau-Roesch O,Argaud L,Ovize M.Mitochondrial permeability pore and postconditioning[J].Cardiovasc Res,2006,70(2):264-273.
[35]Uchiyama T,Otani H,Okada T,et al.Nitric oxide induced caspase-dependent apoptosis and necrosis in neonatal rat cardiomyocytes[J].J Mol Cell Cardiol,2002,34(8):1049-1061.
[36] Lee Y,Gustafsson AB.Role of apoptosis in cardiovascular disease[J].Apoptosis,2009,14(4):536-548.
[37]高 琴,姜翠榮,于 影,等.線粒體乙醛脫氫酶2在心肌缺血后處理中的作用[J].中國藥理學通報,2010,26(8):1088-1092.
[38] Crompton M,Ellinger H,Costi A.Inhibition by cyclosporin A of a Ca2+-dependent pore in heart mitochondria activated by inorganic phosphate and oxidative stress[J].Biochem J,1988,255(1):357-360.
[39] Halestrap AP,Davidson AM.Inhibition of Ca2+-induced large-amplitude swelling of liver and heart mitochondria by cyclosporin is probably caused by the inhibitor binding to mitochondrial-matrix peptidyl-prolylcis-transisomerase and preventing it interacting with the adenine nucleotide translocase[J].Biochem J,1990,268(1):153-160.
[40] Griffiths EJ,Halestrap AP.Further evidence that cyclosporine A protects mitochondria from calcium overload by inhibiting a matrix peptidyl-prolyl cis-trans isomerase.Implications for the immunosuppressive and toxic effects of cyclosporine[J].Biochem J,1991,274(Pt 2):611-614.
[41] Li J,Iorga A,Sharma S,et al.Intralipid,a clinically safe compound,protects the heart against ischemia-reperfusion injury more efficiently than cyclosporine-A[J].Anesthesiology,2012,117(4):836-846.

