資沖顆粒對大鼠間充質干細胞生殖分化相關標記基因表達的影響
鄧延莉,萬 謙,陸 華
(1.成都中醫藥大學臨床醫學院,四川成都 610037;2.成都中醫藥大學第二臨床醫學院中西醫生殖實驗室,四川成都 610041;3.成都中醫藥大學第二臨床醫學院,四川成都 610041)
間充質干細胞 (mesenchymal stem cells,MSCs)是來源于發育早期中胚層的一類多功能干細胞,MSCs由于它的自我更新和多向分化潛能具有巨大的治療價值,并日益受到關注。其可在生化誘導劑、細胞生長因子等條件下向各方向分化,成為如肌細胞[1]、成骨細胞[2]、神經細胞[3]等各類細胞。國內研究中越來越多的實驗表明,中藥有可能干預間充質干細胞向體外的分化[4-6]。
資沖顆粒是根據經典方左、右歸丸而研制的一種補腎中藥復方。其由熟地、菟絲子等藥物組成,功效補腎化瘀、資沖調經。本課題組前期研究發現資沖顆粒能提高去勢雌小鼠的雌激素水平[7]及促進大鼠的卵泡發育[8-9]。臨床上資沖顆粒常用于促卵泡發育及排卵,療效較好。但資沖顆粒是否有誘導間充質干細胞體外向生殖細胞方向分化的可能,目前尚未見報道。
本次實驗選用大鼠成體間充質干細胞 (RMSC)為模型細胞,資沖顆粒大鼠含藥血清為檢測樣品,最終檢測資沖顆粒含藥血清干預后RMSC細胞形態、生殖細胞分化相關標記基因和細胞增殖的變化情況,現報道如下:
1 材料
1.1 實驗儀器 細胞培養箱 (Thermo公司,3111型);倒置顯微鏡 (Leica公司,DMI3000B型);酶標儀 (Thermo公司,Multiskan spectrum);定量PCR儀 (Bio-Rad公司,CFX96)。
1.2 細胞、藥物與試劑 RMSC購自中國科學院上海生命科學研究院生物化學與細胞生物學研究所,資沖顆粒大鼠含藥血清由四川省中藥研究所提供;α-MEM培養液、胎牛血清、細胞培養用雙抗(青霉素和鏈霉素)、磷酸緩沖液PBS(成都哈里公司);檢測試劑 MTT(美國 Sigma公司,M5655);RNA提取試劑盒 (美國 Molecular Research Center公司,TR 118);cDNA合成試劑盒(Fermentas公司,K1632);Sybr Green Qpcr試劑(Roche公司,04913850001)。
2 方法與結果
2.1 含藥血清及空白血清的制備 在體質量均一的情況下隨機將20只大鼠分成2組:含藥血清組組、空白血清組,每組10只,雌雄各半。含藥血清組灌服資沖顆粒,給藥劑量均為5.0 g/kg,給藥容量均為20 mL/kg,空白組大鼠灌服蒸餾水。分別于給藥后30、60、90 min眼底靜脈叢取血,血液靜置2 h,3000 r/min離心10 min,分離各組各不同時間段血清,將每組3個時間段的血清混勻,高效液相色譜 (High Performance Liquid Chromatography,HPLC)分析血清,過濾除菌備用。
2.2 細胞培養和誘導分化 含10%胎牛血清的α-MEM培養液在5%CO2,37℃條件下培養RMSC,以3×105細胞/孔的量接種于6孔板中。24 h后分別加入終質量分數為4.5%資沖顆粒大鼠含藥血清及空白大鼠血清進行連續干預72 h,每天鏡下顯微觀察,在干預24 h后和72 h后進行顯微采圖。
2.3 生殖細胞分化相關的標記基因的檢測 如“2.1”項所述干預六孔板中的大鼠間充質干細胞,72 h后提取相關細胞孔的RNA,并以此RNA為模板立即合成cDNA,-80℃保存。利用Sybr Green Qpcr試劑進行Qpcr實驗,檢測與生殖細胞分化相關的 Oct4、Stra8、Itga6、Itgb1、Scp3、Gdf9、Zp1、Zp3等8種基因的表達量變化情況,選大鼠β-Actin基因為內參基因。針對上述基因的引物信息如表1。
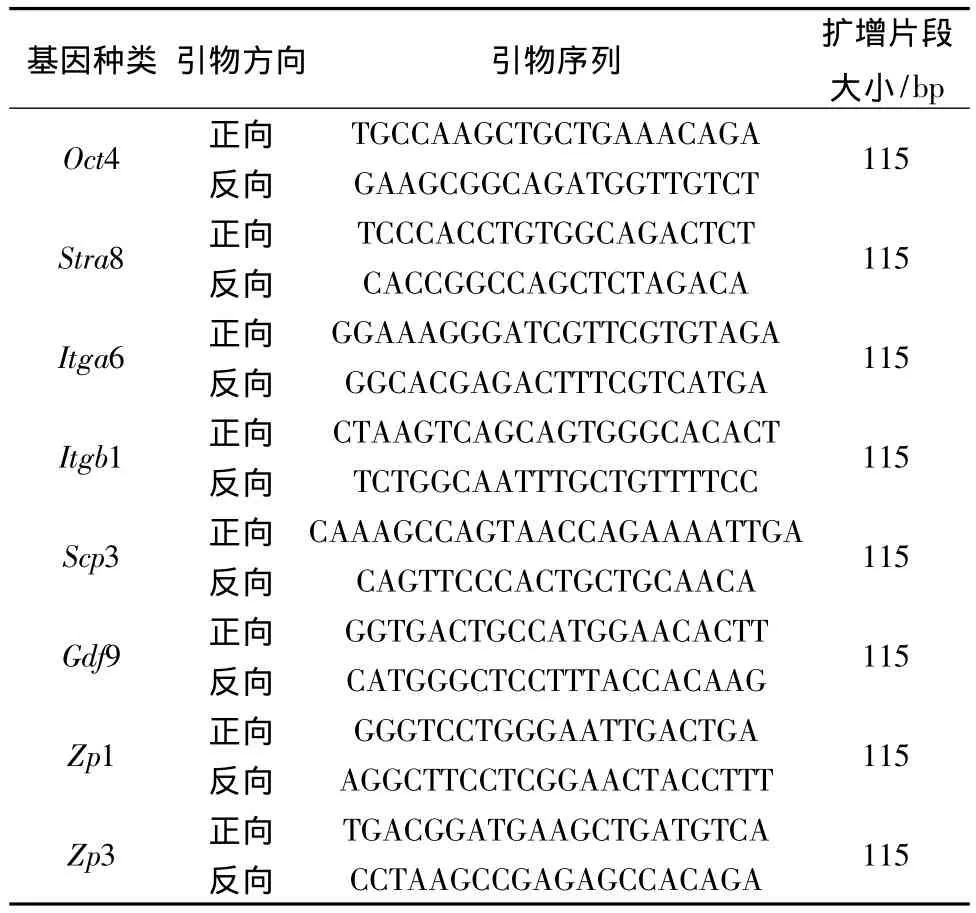
表1 針對8種標識基因及內參基因的引物信息Tab.1 Primer information of eight marker genes and the reference gene
2.4 細胞增殖情況的檢測 將RMSC以2×103細胞/孔的量接種于96孔板中,共接種50孔。24 h后,將50孔細胞平均分成兩組 (25孔/組),兩組分別加入終質量分數為4.5%的資沖顆粒大鼠含藥血清和空白大鼠血清,連續干預5 d,每天對每個干預條件的5個細胞孔進行MTT法檢測,連續測定5 d。
2.6 實驗結果
2.6.1 資沖顆粒大鼠含藥血清對RMSC形態學的影響 由圖1可見,終質量分數為4.5%的資沖顆粒大鼠含藥血清干預RMSC過程中,細胞數量增加,細胞呈梭形或多邊形,細胞集落多成放射狀或網狀,細胞逐漸融合,細胞之間界限不清;大鼠空白血清干預過程中,細胞形態類似于資沖顆粒大鼠含藥血清的干預情況;兩種血清干預之間的細胞形態學變化無明顯差異。
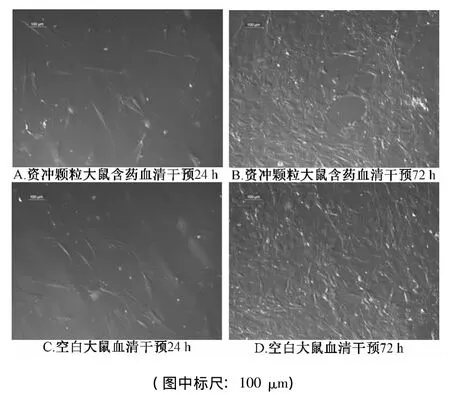
圖1 資沖顆粒大鼠含藥血清對RMSC形態學的影響Fig.1 Effect of the rat drug serum with Zichong Granules on the morphology of RMSC
2.6.2 資沖顆粒大鼠含藥血清對RMSC的多個生殖分化標識基因轉錄表達的影響 由表2可見,與大鼠空白血清比較,資沖顆粒大鼠含藥血清顯著影響了基因Stra8、Scp3和 Gdf9的轉錄表達 (P=0.0359、0.0071、0.0227);而對其它基因的表達影響不顯著 (P>0.05)。其中,基因Stra8被下調了56.13%,基因Scp3、Gdf9分別被上調了約3.6倍和9.5倍。
2.6.3 資沖顆粒大鼠含藥血清對RMSC細胞增殖的影響 通過Excel的回歸分析得到資沖顆粒大鼠含藥血清組及空白大鼠血清組的生長速率分別為0.1188和 0.1391(O.D.490 nm/d)。使用 SPSS 13.0軟件的協方差法對兩組生長速率進行了精確的比較,結果表明兩組生長速率沒有顯著差異(P=0.1074)。由此可見,資沖顆粒大鼠含藥血清對RMSC的細胞增殖未有顯著影響。

表2 資沖顆粒大鼠含藥血清對RMSC的多個生殖分化標識基因轉錄表達的影響 (n=3)Tab.2 Effect of the rat drug serum with Zichong Granules on the transcriptional expression of several marker genes for reproduction differentiation(n=3)
3 討論
現代社會不孕不育的發生率呈逐年上升趨勢,輔助生殖技術雖在治療不孕不育癥方面的得到了廣泛的應用,但對生殖細胞缺乏而導致的不孕不育癥束手無策。近年來實驗研究表明間充質干細胞在一定條件下有可能向生殖細胞分化[10-12],但對于利用中藥干預細胞分化的報道較少,且未見資沖顆粒相關報道。
從細胞形態和細胞增殖情況兩方面表明,資沖顆粒含藥血清與空白血清作用相似,在短時間內尚未見其明顯毒性。
Qpcr結果發現,含藥血清對 Gdf9、Stra8和Scp3的轉錄表達顯著影響。Gdf9及Stra8是雌、雄性生殖細胞分化方向的標記基因[13-14],在本實驗中Gdf9被顯著上調而Stra8表達顯著下調。資沖顆粒中多含中藥熟地、菟絲子等滋陰填精之品,提示資沖顆粒含藥血清對女性生殖細胞的發育或在某些環節上有一定促進作用,而對于Stra8基因表達下調的機制則需進一步深入研究。Scp3為減數分裂的標記基因[15],間充質干細胞向生殖細胞方向分化需Scp3表達上調,本次實驗結果表明含藥血清干預后的RMSC極有可能啟動了細胞減數分裂的進程使其向生殖細胞方向分化。
Oct4蛋白質在維持未分化的胚胎干細胞的自我更新中起關鍵作用[16],常被用做未分化細胞的標記,本研究中發現資沖顆粒并未顯著影響Oct4的表達,說明資沖顆粒的促分化作用可能并未通過Oct4。Itga6基因和Itgb1基因分別編碼整合素α6和整合素β1,而整合素α6和整合素β1是精原干細胞的標記物[17-18],本研究發現這兩種基因的表達未受影響,進一步說明資沖顆粒大鼠含藥血清并未誘導細胞向雄性生殖細胞分化。Zp1和Zp3是雌性分化后期的標識基因[19],本研究發現兩者的表達均未受影響,說明向雌性生殖細胞的分化可能還處于初期階段。
綜上所述,資沖顆粒有可能誘導RMSC向雌性生殖細胞方向分化。實驗補腎中藥資沖顆粒臨床上促女性卵泡發育的部分原因可能在于誘導了干細胞向新的雌性生殖細胞分化。
[1]Miao H Z,Tong S L,Xu B,et al.Multiplication of the lymphoid organ of Penaeus chinensis[J].Chin J Biotechnol,2000,16(2):221-224.
[2]Campagnoli C,Roberts I A,Kumar S,et al.Identification of mesenchymal stem progenitor cells in human first-trimester fetal blood,liver,and bone marrow[J].Blood,2001,98:2396-2402.
[3]Azizi S A,Stokes D,Augelli B J,et al.Engraftment and migration of human bone marrow stromal cells implanted in the brains of albino rats-similarities to astrocyte grafts[J].Proc Natl Acad Sci USA,1998,95:3098-3913.
[4]楊 鋒,唐德志,王擁軍,等.中藥誘導骨髓間充質干細胞的成骨分化[J].中國組織工程研究與臨床康復,2011,15(10):1847-1850.
[5]卞 琴,黃建華,王擁軍,等.3種補腎中藥有效成分對皮質酮致骨質疏松大鼠骨髓間充質干細胞基因表達譜的作用〔J〕.中西醫結合學報,2011,9(2):179-184.
[6]于 麗,張炳強,管英俊,等.香丹注射液誘導人臍血間充質干細胞向神經細胞的分化[J].中國組織工程研究與臨床康復,2009,13(14):2656-2660.
[7]段 恒,陸 華.資沖顆粒灌腸和灌胃對去勢小鼠雌激素水平的影響[J].北京中醫藥大學學報,2007,30(3):185-187.
[8]陸 華,段 恒.補腎中藥復方對不同發育階段大鼠卵泡發育的影響[J].浙江中醫雜志,2009,44(4):249-250.
[9]段 恒,陸 華.補腎中藥復方灌腸和灌胃對大鼠卵泡發育的影響[J].時珍國醫國藥,2010,22(4):857-858.
[10]Karim N,Jae H L,Nadja D,et al.Derivation of male germ cells from bone marrow stem cells[J].Lab Invest,2006,86(7):654-663.
[11]Li Caixia,Wang Fengying,Liang Zhiqing,et al.In vitro female germline potential of human umbilical cord-derived matrix stem cells[J].J Clin Rehabilit Tissue Eng Res,2010,14(40):7583-7587.
[12]呂 品,何 玲,柴惠霞.類胚體誘導臍帶間充質干細胞向生殖細胞的分化[J].中國組織工程研究,2012,16(23):4217-4221.
[13]Oulad-Abdelghani M,Bouillet P,Décimo D,et al.Characterization of a premeiotic germ cell-specific cytoplasmic protein encoded by Stra8,a novel retinoic acid-responsive gene[J].Cell Biol,1996,135(2):469-477.
[14]McGrath S A,Esquela A F,Lee S J.Oocyte-specific expression of growth/differentiation factor-9[J].Mol Endocrinol,1995,9(1):131-136.
[15]Yuan L,Liu J G,Zhao J,et al.The murine SCP3 gene is required for synaptonemal complex assembly,chromosome synapsis and male fertility[J].Mol Cell,2000,5(1):73-83.
[16]Pesce M,Sch?ler H R.Oct-4:gatekeeper in the beginnings of mammalian development[J].Stem Cells,2001,19(4):271-278.
[17]Kubota H,Avarbock M R,Brinster R L.Spermatogonial stem cells share some,but not all,phenotypic and functional characteristics with other stem cells[J].Proc Natl Acad Sci USA,2003,100(1):6487-6492.
[18]Phillips B T,Gassei K,Orwig K E.Spermatogonial stem cell regulation and spermatogenesis. [J].Philos T R Soc B,2010,365(1):1663-1678.
[19]Oehninger S.Biochemical and functional characterization of the human zona pellucida. [J].Reprod Biomed Online,2003,7(6):641-648.

