表面活性劑脂肪醇聚氧乙烯醚對鹽藻的毒性研究
耿慶華,姜 莉,張 侃,丁建峰
(1.沈陽出入境檢驗檢疫局,沈陽 110016;2.大連海洋大學 水產與生命學院,遼寧 大連 116023)
0 引 言
脂肪醇聚氧乙烯醚(AE),又稱為聚乙氧基化脂肪醇,是非離子表面活性劑中發展最快、用量最大的品種,廣泛用于日常生活中,如在洗滌行業作為洗手液、洗衣液、金屬清洗劑等的主要活性成分;在紡織印染行業作為紡織印染助劑起乳化作用;在造紙行業可作為脫墨劑,另外在農藥中可作為乳化劑等。隨著表面活性劑在人們生活中的大量應用,愈來愈多的表面活性劑會隨著廢水排放進入水環境中。由于人們環保意識的不斷加強,表面活性劑使用的安全性,以及對水環境的污染情況越來越受到關注和重視,人們開始擔心含有大量表明活性劑的生活和工業污水是否會對水生動植物造成危害,是否會通過食物鏈進入到人體而對健康造成危害。因而開展表面活性劑的安全性評價和毒性研究具有很重要的意義。
鹽藻(Dunaliellasalina)屬綠藻門,綠藻綱,團藻目,鹽藻科,鹽藻屬,是一種單細胞真核藻類。單胞藻具有利用太陽能效率高,營養豐富,生長繁殖迅速等重要特征,因而受到重視。在海洋環境中作為初級生產者,它們光合作用放出大量氧氣,是地球上生物圈中的氧氣循環的關鍵環節,并且吸收水中的富營養化成分作為碳源,是水體自凈的重要保障,在海洋環境中的地位尤其重要。又因為本研究所選用的鹽藻為餌料藻,它作為海洋食物鏈的低層基石,其受污染的程度直接影響海洋其他動植物的生存環境和健康狀況,研究表面活性劑對鹽藻的毒性,可以在一定程度反應出表面活性劑對海洋水環境的影響,其意義不言而喻。
因此,本實驗利用鹽藻作為試驗對象,研究不同濃度脂肪醇聚氧乙烯醚對鹽藻的毒性作用,為深入了解脂肪醇聚氧乙烯醚對鹽藻的毒性作用機制,以及開展對其安全性評價方法的研究提供理論依據。
1 材料與方法
1.1 實驗材料
1.1.1 實驗藻種
實驗所用鹽藻藻種取自大連海洋大學遼寧省水生生物學重點實驗室。培養海水取自大連市黑石礁近岸海域,沉淀后經0.45μm篩網過濾,煮沸消毒,冷卻曝氣后配制培養液,培養液選用f/2營養鹽配方,由大連海洋大學遼寧省水生生物學重點實驗室提供。脂肪醇聚氧乙烯醚,使用濾菌海水配制成濃度為1g/100mL的原液。
1.1.2 實驗儀器
光照培養箱(GXZ,寧波江南)、超聲波細胞破碎儀(scientz,寧波新芝)、低溫高速冷凍離心機(三洋,日本)、酶標儀(Bio-Tek,美國)。
1.2 實驗方法
1.2.1 鹽藻預培養
用于培養鹽藻5L三角燒瓶先用次氯酸浸泡24h,沖洗干凈后加入過濾海水4L,煮沸10min后自然冷卻,加入f/2培養液,接種處于指數生長期的原始鹽藻,放入光照培養箱進行培養。設定培養溫度為24℃,光照強度2 500~3 500Lux,光照周期:光期/暗期=14hr/10hr,每天上下午各搖瓶1次。試驗期間,每天用血球計數板計數,觀察鹽藻的生長情況。鹽藻密度達到時進行分裝。
1.2.2 實驗鹽藻分裝
用于實驗培養的250mL三角燒瓶先用高壓滅菌鍋滅菌20min,烘干后分別加入100mL預培養的密度為106個/mL鹽藻。分別加入脂肪醇聚氧乙烯醚原液,使其的終濃度分別為0、2.5、5.0、10.0、20.0、40.0mg/L,每組設3組重復。按2.2.1方法進行培養。
1.2.3 藻類細胞計數
實驗期間,每天各個培養瓶搖勻后分別吸取藻液1mL,加入5μL魯哥氏碘液固定后,使用血球計數板,顯微鏡下進行細胞計數并計算細胞密度。
1.2.4 測定樣品前處理
在實驗的第9d,每個培養瓶吸取15mL藻液,使用0.45μm的纖維素酯微孔濾膜過濾后用于葉綠素的測定。每組各另取50mL藻液,3 000r/min離心5min后,加入PBS緩沖液2mL,使用超聲波細胞破碎儀破碎藻細胞,8 000r/min離心5min,將上清液轉移到一個新的EP管中用于后續指標的測定。
1.2.5 葉綠素a含量的測定
葉綠素a的測定參照《海洋檢測規范 第七部分:近海污染生態調查和生物監測》(中華人民共和國國家標準[GB 17378.7—2007],由中華人民共和國國家質量監督檢驗檢疫總局和中國國家標準化管理委員會2007-10-18發布,2008-05-01實行)中的分光光度法。將過濾樣品的濾膜放入具塞離心管中,加入10mL丙酮溶液(丙酮∶水=900∶100),搖蕩,放置于冰箱儲存室中24h后,取出,4 000r/min離心10min,將上清液注入比色杯中。用丙酮做參比,分別在630、647、664、750nm波長處測定吸光值,并分別將波長630、647、664nm下測得的吸光值減去750nm下的吸光值,得到校正后的吸光值E630nm、
按下式計算葉綠素a的含量ρ:
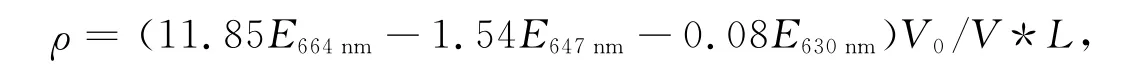
式中:V0為樣品提取液的體積(mL);V為藻液樣品實際用量(L);L為測定池光程(cm)。
1.2.6 可溶性蛋白含量、總谷胱甘肽(T-GSH)含量、丙二醛(MDA)含量、過氧化氫(H2O2)含量和銅-鋅超氧化物歧化酶(CuZn-SOD)等含量測定
鹽藻可溶性蛋白含量采用考馬斯亮藍法,測定使用南京建成生物工程研究所的蛋白測定試劑盒進行。總谷胱甘肽(T-GSH)含量采用微量酶標法,測定使用南京建成生物工程研究所的谷胱甘肽測試盒(A061-1)進行。丙二醛(MDA)含量使用南京建成生物工程研究所的植物丙二醛(MDA)測定試劑盒進行測定。過氧化氫(H2O2)含量使用分光光度法進行測定,使用南京建成生物工程研究所的過氧化氫(H2O2)測試盒(A064-1)進行測定。銅-鋅超氧化物歧化酶(CuZn-SOD)含量使用南京建成生物工程研究所的銅-鋅超氧化物歧化酶測定試劑盒進行測定。測定樣品使用上述1.2.4中處理后的藻類上清液,具體測定方法參照試劑盒提供的說明書進行。
1.2.7 數據統計
實驗數據使用SPASS 20.0軟件分析,結果用平均值±標準差(means±SD)表示,均采用單因素方差分析。
2 實驗結果
2.1 不同濃度AE對鹽藻生長的影響
不同濃度AE對鹽藻生長的影響結果如圖1所示。在實驗的0~192h內,含有濃度為2.0mg/L和4.0mg/L AE組的鹽藻生長受到了抑制,其他3個濃度組與對照組比未表現出較強的抑制作用。由以上實驗結果得出:較高濃度的AE在短期內對藻類的生長具有一定的抑制作用。
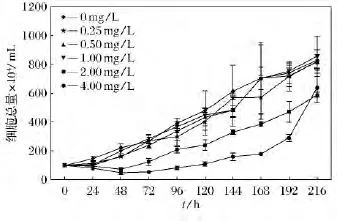
圖1 不同濃度AE對鹽藻細胞總數影響
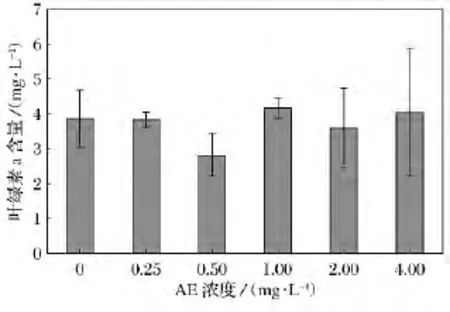
圖2 不同濃度AE對鹽藻葉綠素a含量影響
2.2 不同濃度AE培養下鹽藻葉綠素a含量比較
不同濃度AE對鹽藻葉綠素a含量影響比較如圖2所示。在不同濃度的AE中培養9d后,各組鹽藻葉綠素a的含量未表現出顯著差異。
2.3 不同濃度AE培養下鹽藻可溶性蛋白含量比較
不同濃度AE對鹽藻可溶性蛋白含量比較如圖3所示。在不同濃度的AE中培養9d后,4.0mg/L AE組鹽藻可溶性蛋白含量顯著低于對照組和低濃度(0.25mg/L)組(p<0.05)。
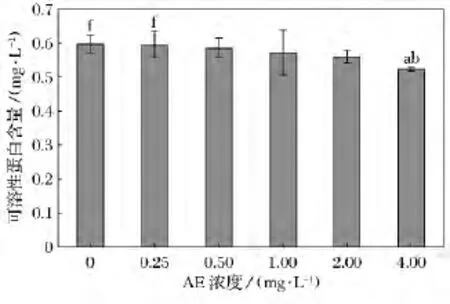
圖3 不同濃度AE對鹽藻可溶性蛋白含量影響
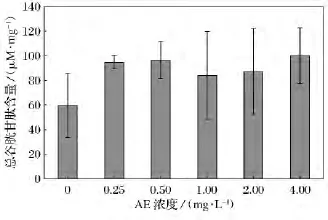
圖4 不同濃度AE對鹽藻總谷胱甘肽(T-GSH)含量影響
2.4 不同濃度AE培養下鹽藻總谷胱甘肽(T-GSH)含量比較
不同濃度AE對鹽藻T-GSH含量比較如圖4所示。在培養9d后,不同濃度的AE中鹽藻T-GSH的含量較對照組都有所升高,但各組與對照組比較差異不顯著。
2.5 不同濃度AE培養下鹽藻丙二醛(MDA)含量比較
經不同濃度AE處理的鹽藻 MDA含量比較如圖5所示。0.25mg/L組和4.0mg/L組與1.0mg/L組相比差異較大,且差異顯著(p<0.05);其他各組之間差異不顯著。
2.6 不同濃度AE培養下鹽藻過氧化氫(H2O2)含量比較
經不同濃度AE處理的鹽藻H2O2含量比較如圖6所示。2.0mg/L組和4.0mg/L組與0.25mg/L組和0.5mg/L相比差異顯著(p<0.05);其他各組之間差異不顯著。
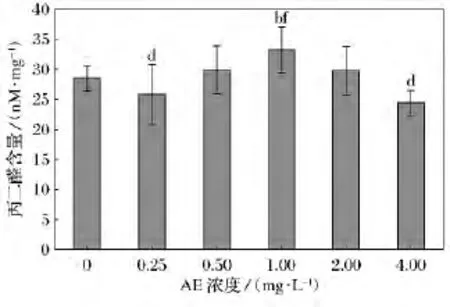
圖5 不同濃度AE對鹽藻丙二醛(MDA)含量影響
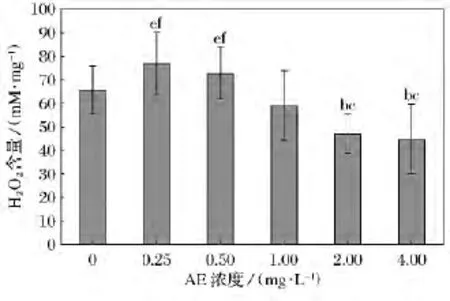
圖6 不同濃度AE對鹽藻過氧化氫(H2O2)含量影響
2.7 不同濃度AE培養下鹽藻銅-鋅超氧化物歧化酶(CuZn-SOD)含量比較
經不同濃度處理后,鹽藻中CuZn-SOD含量的比較如圖7所示。濃度為0.25mg/L和1.0 mg/L組顯著低于對照組和0.25mg/L組(p<0.05);濃度4.0mg/L組顯著高于與0.25、0.5和1.0mg/L組(p<0.05)。
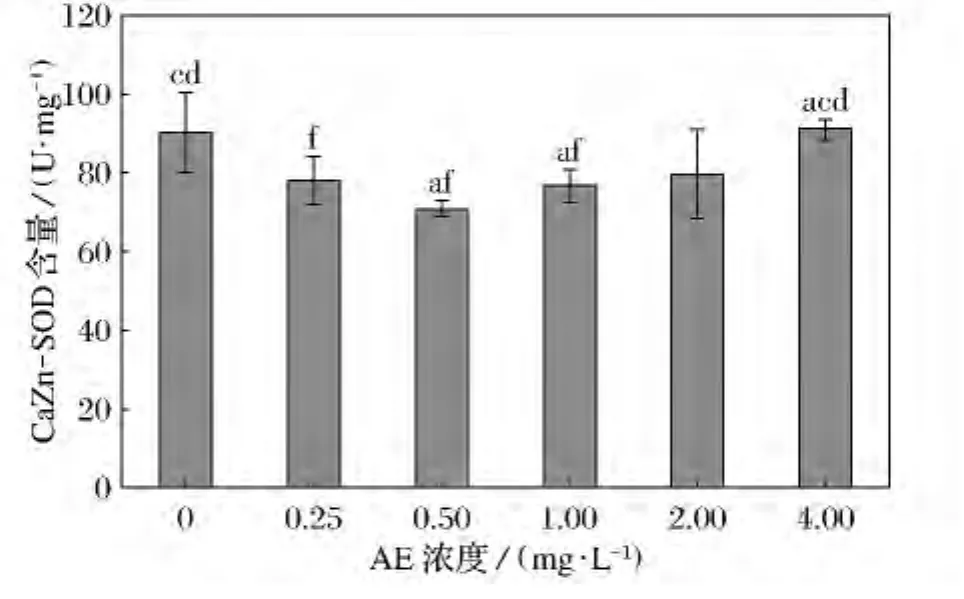
圖7 不同濃度AE對鹽藻銅-鋅超氧化物歧化酶(CuZn-SOD)含量影響
3 討 論
表面活性劑(又稱界面活性劑)是指能使目標溶液表面張力顯著下降的物質,以及降低兩種液體之間表面張力的物質。根據其在水中的電離性狀,合成表面活性劑可分為:陰離子型、陽離子型、非離子型和兩性電解質型4大類。非離子表面活性劑在水中不會解離,是中性化合物,其親水部分都含有羥基及多個醚鍵[1]。不與金屬離子或硬水作用,對酸堿也較穩定,是一類在表面活性劑的開發研究的進程中屬于新興的類別,本實驗所采用的脂肪醇聚氧乙烯醚就是屬于此類,廣泛用于洗滌行業、紡織印染行業、造紙行業和農藥中等日常生活的方方面面[2]。近年來,隨著人們環保意識的日益提高,同時由于生活工業污水等導致的環境災害事件頻發,對包括表面活性劑在內的化學制劑的安全問題為越來越多的研究人員所重視,人們擔心含有大量活性劑的生活和工業污水是否會對水生動植物造成危害,并通過食物鏈進入到人體而對健康造成危害。有研究表明:雖然聚氧乙烯類非離子型表面活性劑本身的毒性較低,但是某些種類聚氧乙烯類非離子型表面活性劑代謝產物的毒性很高,能夠對水生生物造成危害,如壬基酚聚氧乙烯醚的降解產物NP(烷基酚)是美國環境保護局出的70種環境激素的化學物質之一,具有致癌性、致畸性和致突變性,對水生生物具有一定的毒性作用[3]。
此前研究認為,脂肪醇聚氧乙烯醚(AE)結構穩定,是毒性最低的一類,對水生生物沒有表現出毒性[5]。但本研究中發現,較高濃度的AE(2.0mg/L和4.0mg/L)對鹽藻的生長表現出了一定的抑制作用。同時,4.0mg/L AE組鹽藻可溶性蛋白含量顯著低于對照組和0.25mg/L濃度組。表明高濃度AE抑制藻類生長和細胞內蛋白質的合成。其作用機理可能是由于AE具有強表面活性,容易吸附在具有膜層結構的藻細胞器表面,而影響和破壞其正常功能,導致整個細胞死亡[6]。另外,亦可能由于本研究使用的脂肪醇聚氧乙烯醚為工業用原料,可能含有其他對藻類生長具有抑制作用的成分導致。
藻類細胞3種色素包括葉綠素a、b和c 3種,其中尤以葉綠素a變化較為敏感,因此一般作為生理毒性指標。研究已經證實:水環境中的重金屬和有機污染物可以通過高濃度脅迫引起葉綠體膨脹破裂,類囊體膜解體和抑制葉綠素酸酯還原酶活性和影響氨基-γ-戊酮酸的合成兩條途徑而導致藻類葉綠素含量減少[7]。但在本研究中,雖然各濃度AE處理組鹽藻的生長速度不同,但葉綠素a的含量并未表現出顯著差異。這與周曉見的研究結果相一致,其原因可能是由于高濃度的AE導致脫鎂葉綠素a的含量顯著增加,說明表面活性劑脅迫下的藻類產生大量的脫鎂葉綠素,其游離于細胞之外,所以雖然細胞密度低,但葉綠素a含量卻很高[8]。
本研究中,鹽藻AE處理組中的CuZn-SOD活性的表現出不同的變化,其中AE濃度為0.25mg/L和1.0mg/L組鹽藻CuZn-SOD活性顯著低于對照組(p<0.05),而AE濃度4.0mg/L組鹽藻CuZn-SOD活性顯著高于與0.25、0.5和1.0mg/L組(p<0.05)。有研究表明:長時間較低濃度的污染物或者毒性較低的污染物對藻類相關酶活性會產生先誘導激活而后抑制的過程[9-10]。本研究0.25 mg/L和1.0mg/L組鹽藻CuZn-SOD活性顯著低于對照組,其原因可能是由于實驗周期較長而導致CuZn-SOD活性被抑制的結果。而4.0mg/L組鹽藻CuZn-SOD活性表現出較強的活性,可能是由于高濃度脅迫導致鹽藻細胞內產生過多的氧離子自由基誘導的結果。李睿等研究發現雙酚A對微藻SOD具有低濃度和高濃度誘導兩種現象[11],這與本研究所使用AE對鹽藻CuZn-SOD活性影響的結果相一致。
GSH作為一種抗氧化劑,是抗氧化系統的重要成分,谷胱甘肽系統中的各種抗氧化酶酶均以其為中心起作用。在本研究中,雖然各濃度AE處理組鹽藻T-GSH未表現出顯著差異,但是與對照組相比都有一定程度增加的趨勢。姜爽等相關研究發現,兩種多溴聯苯醚BDE-47和BDE-209脅迫下米氏凱倫藻GPx、GST、GR的活性出現先誘導激活而后抑制的過程[12]。表明GSH活性變化與脅迫時間有關,本研究出現的GSH升高現象應該與AE的脅迫有關。
H2O2作為藻類抗氧化系統中的一個中間產物,其變化可以反映機體抗氧化酶系統和非酶系統性能的狀態,從總體上反映機體防御體系抗氧化能力的高低[13]。而田丹等使用重金屬鎘脅迫小球藻和湛江等鞭金藻時發現,這兩中微藻內H2O2含量均出現了增加的過程[22]。而本研究中鹽藻H2O2含量在2個較低濃度處理組(0.25mg/L組和0.5mg/L)出現了增加的過程,這與上述研究的結果一致。而經2個較高濃度(2.0mg/L和4.0mg/L)AE處理的鹽藻H2O2含量卻出現了減少的現象,其原因可能是由于處理時間較長一部分藻細胞死亡所致,本研究中對鹽藻的計數結果也證實了這一可能。
活性氧能夠將脂肪酸轉化為有毒的過氧化物,破壞生物膜,造成MDA累積,因此MDA作為脂質過氧化的產物,可作為植物脂質過氧化的指標[14]。本研究中各處理組鹽藻MDA與對照組相比并未表現出顯著的差異,但0.25、0.5和1.0mg/L濃度組 MDA表現出隨處理濃度升高的過程,且1.0mg/L處理組鹽藻MDA濃度顯著高于0.25mg/L濃度處理組,這與田丹等使用重金屬鎘脅迫小球藻和湛江等鞭金藻MDA的變化趨勢相一致[13]。而2.0mg/L濃度組和4.0mg/L濃度處理鹽藻 MDA測定含量較低也可能與藻細胞數量較少有一定的關系。
本研究證實了不同濃度活化劑脂肪醇聚氧乙烯醚對鹽藻的生長具有抑制作用,導致體內活性氧含量、抗氧化酶CuZn-SOD活性、以及GSH和MDA等含量發生變化,初步證實AE對鹽藻具有一定的毒性作用,為活化劑AE的合理使用和安全評價提供了理論依據。
[1]王學川,邱白玉.表面活性劑的毒性問題[J].日用化學品科學,2005,28(6):22-26.
[2]牛金平,王軍.新型表面活性劑的結構特點與物化性能[J].日用化學品科學,2000,23(2):1-4.
[3]陳小泉,古國榜.烷基酚聚氧乙烯醚的環境行為和環境風險評價[J].日用化學工業,2001,12(6):30-33.
[4]秦松,林光恒.化學誘變劑在實驗海洋食物鏈中的流動以及遺傳毒性的檢測Ⅰ.無機誘變劑鎘(Ι)鎘在褐指藻中的吸著與積累[J].癌變· 畸變· 突變,1992,4(4):1-5.
[5]袁平夫,廖柏寒,盧明.表面活性劑 (LAS&NIS)的環境安全性評價[J].安全與環境工程,2004,11(3):31-34.
[6]陳孝花.除藻劑對黃絲藻藻華葉綠素a含量和抗氧化酶活性的影響[D].上海:上海海洋大學,2011.
[7]向蓓,趙文,王媛,等.Cd(Ⅱ)脅迫對鹽藻生長,抗氧化系統及線粒體膜電位的影響[J].大連海洋大學學報,2012,27(1):64-68.
[8]周曉見.表面活性劑對海洋微藻的生理生化影響[D].大連:大連海事大學,2000.
[9]彭金良,嚴國安,沈國興,等.a-萘酚對小球藻谷胱甘肽及其還原酶的影響[J].中國環境科學,2001,21(2):140-143.
[10]馬劍敏,蔡林林,胡靈衛,等.溴化1-己基-3-甲基咪唑對斜生柵藻谷胱甘肽及其代謝酶的影響[J].水生生物學報,2009,33(4):696-701.
[11]李睿,劉玉,譚鳳儀,等.雙酚 A對微小小環藻的毒性效應[J].中山大學學報:自然科學版,2006,45(3):110-113.
[12]姜爽.兩種多溴聯苯醚對四種海洋微藻的毒性效應研究[D].青島:中國海洋大學,2011.
[13]龐戰軍,周玫,陳瑗.自由基醫學研究方法[M].北京:人民衛生出版社,2000.
[14]何俊瑜,任艷芳,朱誠.鎘脅迫對鎘敏感水稻突變體活性氧代謝及抗氧化酶活性的影響[J].生態環境,2008,17(3):1004-1008.

