輻射相關microRNA研究進展
王瑜,付潔,宋海峰
1.軍事醫學科學院 放射與輻射醫學研究所,北京 100850;2.山東大學 生命科學學院,山東 濟南 250100
microRNA(miRNA)是真核生物中一類在轉錄后水平調節基因表達的長度約22核苷酸的非編碼小RNA,可通過與靶mRNA的3'非翻譯區(UTR)近乎完全互補結合,在轉錄水平使其降解,或與之不完全互補結合,在翻譯水平抑制蛋白合成,也可與靶mRNA的5'UTR相互作用上調蛋白的表達[1-3]。大量研究已表明,miRNA與腫瘤發生發展密切相關[4-5],可能成為新型診斷標志物和/或藥物靶標。
電離輻射作為一種高能物理損傷因素,可通過電離激發產生自由基并造成DNA分子損傷,導致大量電離輻射誘導基因如p21、ATM、p53等[6-10]的表達發生變化,從而廣泛影響細胞周期調控、DNA損傷修復和細胞凋亡等生物學反應過程,繼而誘發腫瘤。因此,電離輻射、DNA損傷和腫瘤之間有著密切的聯系。Ishii等[11]于2006年最早在小鼠胚胎干細胞中發現輻射可以誘導一些miRNA的表達,而這些miRNA在小鼠、禽類和人類中具有很高的保守性,他們首次提出miRNA在調控人類多能干細胞的DNA損傷中可能是潛在的治療手段。此后研究進一步證實,miRNA在輻射誘導的生物學反應過程中確實扮演重要角色。
目前,盡管研究者們已就miRNA-癌癥及輻射-癌癥的關系展開大量研究,但對于miRNA-輻射之間的關系研究仍處于起步階段。我們從以下3個方面闡述輻射相關miRNA的研究進展。
1 輻射調節miRNA表達
輻射既能誘導某些miRNA的表達,同時也能抑制某些miRNA的表達。輻射對于miRNA表達水平的調節通常與其輻射敏感性調節功能相關。如Wang Xiao-Chun[12]等通過比較術后放療敏感/抵抗患者的非小肺癌細胞的miRNA表達譜發現,與輻射抵抗的患者相比,輻射敏感患者有5個miRNA表達上調、7個miRNA表達下調,從而為篩選放療敏感miRNA標志物提供了理論依據。
電離輻射產生DNA損傷,主要可以通過轉錄和轉錄后水平調節miRNA的成熟、剪接等加工過程,但是否通過調節miRNA的降解過程尚待闡明[13]。因此,輻射在不同的組織和細胞中誘導miRNA的表達機制主要有:①DNA損傷調控miRNA的轉錄,其中,p53發揮了重要作用。當細胞受到外界刺激或DNA損傷時,p53可以直接轉錄生成miR-34a-c,后者進而通過下調下游一系列靶基因CDK4/6、CyclinD1/E2、E2F3、BCL2、MET、c-Myc等,對細胞周期、凋亡、增殖、侵襲轉移和分化等產生影響[14-15],因此miR-34a-c家族是目前公認的p53依賴的輻射調控分子。②DNA損傷調控miRNA的加工和成熟過程。p53/p63/p73可以通過RNA解旋酶p68與Drosha/DGCR8加工復合體相互作用,從而增強miR-16-1、miR-143和miR-145等的轉錄后成熟過程[16]。但目前輻射對于miRNA抑制表達的機制仍有待闡明。
研究表明,輻射調節miRNA表達的變化具有以下特性:①組織細胞特異性。Nikiforova[17-19]等發現,如Let7家族等miRNA,輻射對其表達的影響可以因細胞系不同而出現上調或下調的不同效果。②劑量特異性。Shin等[20]分別用20和40 Gy的137Cs射線照射A549細胞,培養24 h后發現20 Gy照射后有4個miRNA下調,而40 Gy照射后有2個不同于20 Gy變化的miRNA發生下調,8個miRNA發生上調。③時間特異性。Dickey[21]等發現,不同時間點(30 min、2 d、7 d)的miRNA變化譜不一樣。例如,haslet-7g在2 Gy γ射線照射后,其在30 min、2 d、7 d的變化分別為下降至1/1.01、上升1.03倍、下降至1/1.44。④性別特異性。Koturbash等[22]用1 Gy的 X射線照射小鼠腦部,分析腦部miRNA組學發現,相較于雄鼠,雌鼠的海馬中有3個miRNA表達顯著上調、4個顯著下調,在額皮質中有2個miRNA明顯下調,在小腦中有1個顯著上調,并指出這種輻射誘導miRNA表達譜差異的性別特異性可能與雌激素反應元件有關。⑤旁觀者效應。Chaudhry[23]等利用人類淋巴母細胞旁觀者效應模型系統研究發現,照射后miRNA的表達變化具有旁觀者效應,如let-7家族在受照細胞中是上調的,而在旁觀細胞中其大部分的表達是下調的。
2 miRNA參與輻射后DNA損傷
盡管目前確認上述一些轉錄因子,如p53等可以調節miRNA的表達水平,但這些蛋白自身也可以受到miRNA的調節。如miR-504和miR-133a就是p53和p63的負性調控因子[24-25]。
電離輻射后DNA分子可產生多種變化,如核苷堿基損傷、交聯、DNA單鏈和雙鏈斷裂等,其中雙鏈斷裂是導致各種輻射生物效應的關鍵損傷形式。miRNA參與輻射后DNA損傷主要是通過靶向DNA損傷相關基因進行調節,圖1綜合顯示了在雙鏈DNA 損傷應答通路中,對 ATM、H2AX、RAD52、BRCA1、p53、p63、E2F、p21、CDK等重要基因進行特異調節的miRNA-基因調控網絡[26]。miRNA對于DNA損傷相關基因的調節主要在3個不同層次實現:首先,miRNA調控能夠檢測DNA雙鏈斷裂的感應器基因,能夠傳播DNA損傷信號的調節器蛋白,包括53BP1[27]、BRCA1[28]等;其次,miRNA能夠調控傳感器蛋白,主要包括ATM[29]和ATR[30],它們可將DNA損傷信號傳遞給下游蛋白;第三,miRNA能夠調控實現DNA修復等過程的效應子蛋白,從而調控細胞周期、DNA損傷修復、凋亡等過程[31]。
據預測,30%的人類蛋白受miRNA調控,目前靶向輻射相關基因miRNA的功能研究只是冰山一角。細胞的輻射敏感性反映了DNA修復的效率,同時,NHEJ和HRR通路中核心元件的缺失導致了細胞輻射敏感性的細胞表型[32]。因此,miRNA介導的這些核心蛋白元件的負向調控,提供了調節細胞對于輻射或化學治療化合物的敏感性的新的途徑。
3 miRNA參與輻射生物學效應
3.1 miRNA參與輻射敏感性調節
miRNA通過調節電離輻射相關DNA損傷效應蛋白等內在因素,以及調節腫瘤微環境等外在因素來影響輻射敏感性,達到使細胞輻射敏感或輻射保護的目的。
在神經細胞瘤中,由N-myc介導調控ATM的miR-421異常表達會導致S期細胞周期檢查點的變化和增強細胞對輻射的敏感性[33]。Yan[34]和Chen[35]等的研究證明,miR-101通過靶向DNA雙鏈損傷中重要基因ATM和DNA-PKcs使其表達下調,從而增加腫瘤細胞的輻射敏感性。同時,Tan[36]等也證實miR-22以ATM依賴方式上調,并抑制PTEN的表達,使得輻射敏感性增加。此外,在不同的細胞系和模型中,let-7家族高表達均可以促進腫瘤細胞對輻射的敏感性[37-38],提示let-7可能成為提高患者放療療效的新靶點。相反,有些miRNA也可以保護細胞,減少輻射所致DNA損傷。Yang[39]等發現,在照射移植有肝癌細胞的裸鼠腫瘤實驗中,miR-210的下調可以降低細胞對輻射的耐受性。
miRNA對腫瘤微環境等外在因素的調節繼而影響輻射敏感性,主要通過低氧和血管生成2個因素實現。研究發現,miR-210在調控腫瘤微環境中發揮關鍵作用,它在低氧環境中充當了獨特而多效的角色“低氧miRNA”,通過激活細胞周期檢查點并降低caspase-8活性來抑制腫瘤細胞的死亡,或降低活性氧的水平來激活細胞不死性的水平[40-42]。
3.2 miRNA參與輻射誘導腫瘤
電離輻射具有致癌性,1902年報道了第一例與輻射相關的皮膚癌癥病例。研究表明,電離輻射作為基因毒劑,損傷DNA分子啟動細胞惡性轉化的程序,其關鍵點在于是否改變了某些關鍵基因(如癌基因、抑癌基因)的結構和功能,導致細胞增殖失調和向惡性轉化。DNA損傷及其引發的突變是大多數癌癥的誘因。
miRNA與腫瘤發生關系的首例報道源于對慢性淋巴細胞白血病(CLL)的分子生物學研究,在染色體13q14區域miR-15a和miR-16a的表達水平與正常細胞相比顯著下降,且miR-15a和miR-16a通過靶向B細胞CLL瘤基因調節腫瘤生成[43]。Zhu等證實miR-21參與輻射誘導肝癌的形成[44]。高劑量LET照射小鼠肝臟繼續喂養2年后,小鼠肝臟中miR-21是惟一上升6倍的miRNA,同時發現其靶蛋白PTEN和RECK的表達量減少,研究人員還注意到在2 Gy照射肝癌細胞后,激活蛋白AP-1(miR-21上游調控分子)在2 h內發生上調,2 h后則主要是ErbB/Stat3通路被激活,這些都促使miR-21表達增加,從而促進肝癌的形成。
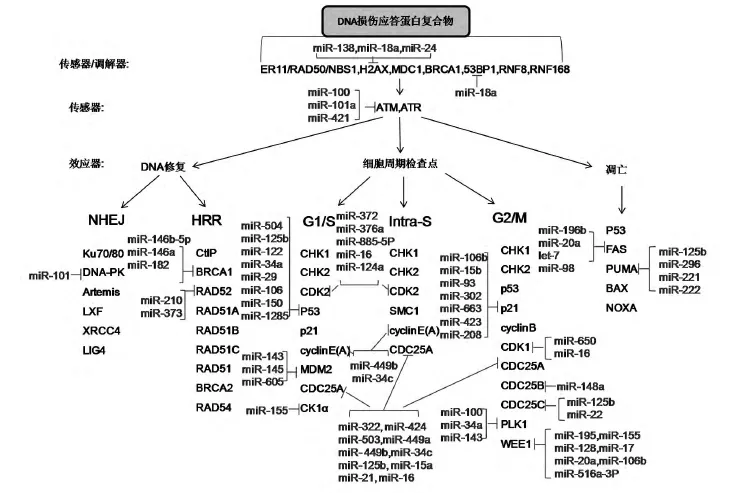
圖1 miRNA通過調控多條通路中核心蛋白元件來調節雙鏈DNA損傷應答
4 結語
腫瘤細胞的輻射抵抗性是目前采用放療治療腫瘤須克服的問題,深入闡明影響腫瘤輻射敏感性和耐受性的因素具有重要的科學意義和臨床意義。miRNA作為一種新型調節因子,深入研究電離輻射所致DNA損傷對miRNA調節的作用,以及miRNA如何通過靶向輻射相關基因,繼而參與調節電離輻射引起的生物效應,對揭示輻射相關生物學反應的分子生物學機制、放射病的治療與預防及潛在的放療等腫瘤治療手段的臨床應用價值具有重要意義。
[1]Bartel D P. MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[2]Lytle J R,Yario T A,Steitz J.A Target mRNAs are re?pressed as efficiently by microRNA-binding sites in the 5'UTR as in the 3'-UTR[J].Proc Natl Acad Sci USA,2007,104(23):9667-9672.
[3]?rom U A,Nielsen F C,Lund A H.MicroRNA-10a binds the 5'UTR of ribosomal protein mRNAs and enhances their translation[J].Mol Cell,2008,30(4):460-471.
[4]Farazi T A,Hoell J I,Morozov P,et al.MicroRNAs in hu?man cancer[J].Adv Exp Med Biol,2013,774:1-20.
[5]Krell J,Frampton A E,Stebbing J.MicroRNAs in the cancer clinic[J].Front Biosci(Elite Ed),2013,5:204-213.
[6]Matsuoka S,Ballif B A,Smogorzewska A,et al.ATM and ATR substrate analysis reveals extensive protein networks re?sponsive toDNA damage[J].Science,2007,316(5828):1160-1166.
[7]Hu W,Chan C S,Wu R,et al.Negative regulation of tumor suppressor p53 by microRNA miR-504[J].Mol Cell,2010,38(5):689-699.
[8]Matsumoto S,Sakata Y,Nakatani D,et al.Circulating p53-re?sponsive microRNAs are predictive indicators of heart failure after acute myocardial infarction[J].Circ Res,2013,113(3):322-326.
[9]Liu X,Li F,Zhao S,et al.MicroRNA-124-mediated regula?tion of inhibitory member of apoptosis-stimulating protein of p53 family in experimental stroke[J].Stroke,2013,44(7):1973-1980.
[10]Wu S,Huang S,Ding J,et al.Multiple microRNAs modulate p21Cip1/Waf1 expression by directly targeting its 30 untrans?lated region[J].Oncogene,2010,29(15):2302-2308.
[11]Ishii H,Saito T.Radiation-induced response of micro RNA expression in murine embryonic stem cells[J].Med Chem,2006,2(6):555-563.
[12]Wang X C,Du L Q,Tian L L,et al.Expression and func?tion of miRNA in post-operative radiotherapy sensitive and re?sistant patients of non-small cell lung cancer[J].Lung Can?cer,2011,72(1):92-99.
[13]Hu H,Gatti R A.MicroRNAs:new players in the DNA dam?age response[J].J Mol Cell Biol,2011,3(3):151-158.
[14]Bao J,Li D,Wang L,et al.MicroRNA-449 and microRNA-34b/c function redundantly in murine testes by targeting E2F transcription factor-retinoblastoma protein(E2F-pRb)pathway[J].J Biol Chem,2012,287(26):21686-21698.
[15]Cha Y H,Kim N H,Park C,et al.MiRNA-34 intrinsically links p53 tumor suppressor and Wnt signaling[J].Cell Cycle,2012,11(7):1273-1281.
[16]Boominathan L. The tumor suppressors p53,p63,and p73 are regulators of microRNA processing complex[J].PLoS One,2010,5(5):e10615.
[17]Dickey J S,Zemp F J,Martin O A,et al.The role of miR?NAin the direct and indirect effects of ionizing radiation[J].Radiat Environ Biophys,2011,50(4):491-499.
[18]Girardi C,De Pitta C,Casara S,et al.Analysis of miRNA and mRNA expression profileshighlights alterations in ionizing radiation response of humanlymphocytes under modeled micro?gravity[J].PLoS One,2012,7(2):e31293.
[19]Nikiforova M N,Gandhi M,Kelly L,et al.MicroRNA dysreg?ulation in human thyroid cells following exposure toionizing ra?diation[J].Thyroid,2011,21(3):261-266.
[20]Shin S,Cha H J,Lee E M,et al.Alteration of microRNA profiles by ionizing radiation in A549 human non-small cell lung cancer cells[J].Int J Oncol,2009,35(1):81-86.
[21]Dickey J S,Zemp F J,Martin O A,et al.The role of mi?croRNA in the direct and indirect effects of ionizing radiation[J].Radiat Environ Biophys,2012,50(4):491-499.
[22]Koturbash I,Zemp F,Kolb B,et al.Sex-specific radiation-in?duced microRNAome responses in the hippocampus,cerebel?lum and frontal cortex in a mouse model[J].Mutat Res,2010,722(2):114-118.
[23]Chaudhry M A,Omaruddin R A.Differential regulation of mi?croRNA expression in irradiated and bystander cells[J].Mol Biol(Mosk)[J].2012,46(4):634-643.
[24]Hu W,Chan C S,Wu R,et al.Negative regulation of tumor suppressor p53 by microRNA miR-504[J].Mol Cell,2010,38(5):689-699.
[25]Dong Y,Zhao J,Wu C W,et al.Tumor suppressor functions of miR-133a in colorectal cancer[J].Mol Cancer Res,2013,11(9):1051-1060.
[26]Wan G,Mathur R,Hu X,et al.microRNA response to DNA damage[J].Trends Biochem Sci,2011,36(9):478-484.
[27]Callen E,Di Virgilio M,Kruhlak M J,et al.53BP1 mediates productive and mutagenic DNA repair through distinct phos?phoprotein interactions[J].Cell,2013,153(6):1266-1280.
[28]Bouwman P,Aly A,Escandell J M,et al.53BP1 loss res?cues BRCA1 deficiency and is associated with triple-negative and BRCA-mutated breast cancers[J].Nat Struct Mol Biol,2010,17(6):688-695.
[29]Song L,Lin C,Wu Z,et al.miR-18a impairs DNA damage response through downregulation of ataxia telangiectasia mutat?ed(ATM)kinase[J].PLoS One,2011,6(9):e25454.
[30]Fokas E,Prevo R,Hammond E M,et al.Targeting ATR in DNA damage response and cancertherapeutics[J]. Cancer Treat Rev,2014,40(1):109-117.
[31]Chowdhury D,Choi Y E,Brault M E.Charity begins at home:non-coding RNA functions in DNA repair[J].Nat Rev Mol Cell Biol,2013,14(3):181-189.
[32]Jeggo P,Lavin M F.Cellular radiosensitivity:how much bet?ter do we understand it[J]?Int.J Radiat Biol,2009,85(12):1061-1081.
[33]Hu H,Du L,Nagabayashi G,et al.ATM is down-regulated by N-Myc-regulated microRNA-421[J].Proc Natl Acad Sci USA,2010,107(4):1506-1511.
[34]Yan D,Ng W,Zhang X,et al.Targeting DNA-PK and ATM with miR-101 sensitizes tumors to radiation[J].PLoS ONE,2010,5(7):e11397.
[35]Chen S,Wang H,Ng W L,et al.Radiosensitizing effects of ectopic miR-101 on non-small-cell lung cancer dells depend on the endogenous miR-101 level[J].Int J Radiation Oncol Biol Phys,2011,81(5):1524-1529.
[36]Tan G,Shi Y,Wu Z H.MicroRNA-22 promotes cell surviv?al upon UV radiation by repressing PTEN[J].Biochem Bio?phys Res Commun,2012,417(1):546-551.
[37]Chaudhry M A,Sachdeva H,Omaruddin R A.Radiation-in?duced micro-RNA modulation in glioblastoma cells differing in DNA-repair pathways[J].DNA Cell Biol,2010,29(9):553-561.
[38]Wagner-Ecker M,Schwager C,Wirkner U,et al.MicroRNA expression after ionizing radiation in human endothelial cells[J].Radiat Oncol,2010,5:25.
[39]Yang W,Wei J,Sun T,et al.Effects of knockdown of miR-210 in combination with ionizing radiation on human hepato?maxenograft in nude mice[J].Radiat Oncol,2013,8:102.
[40]Chan S Y,Loscalzo J.MicroRNA-210:a unique and pleiotro?pic hypox-amir[J].Cell Cycle,2010,9(6):1072-1083.
[41]Huang X,Le Q T,Giaccia A J.MiR-210-micromanager of the hypoxia pathway[J].Trends Mol Med,2010,16(5):230-237.
[42]Devlin C,Greco S,Martelli F,et al.miR-210:more than a silent player in hypoxia[J].IUBMB Life,2011,63(2):94-100.
[43]Cimmino A,Calin G A,Fabbri M,et al.miR-15 and miR-16 induce apoptosis by targeting BCL2[J].Proc Natl Acad Sci USA,2005,102(39):13944-13949.
[44]Zhu Y,Yu X,Fu H,et al.MicroRNA-21 is involved in ion?izing radiation-promoted liver carcinogenesis[J].IntJ Clin Exp Med,2010,3(3):211-222.

