大河影響下的陸架邊緣海沉積有機碳的再礦化作用
姚鵬,郭志剛,于志剛
(1.中國海洋大學 海洋化學理論與工程技術教育部重點實驗室,山東 青島266100;2.中國海洋大學 海洋有機地球化學研究所,山東 青島266100;3.復旦大學 環境科學與工程系,上海200433)
1 引言
大河影響下的陸架邊緣海(River-dominated Ocean Margins,Ri OMars)是陸海相互作用最重要的區域,在全球碳循環過程中發揮著重要作用[1—2]。陸源輸入的大量生源要素和有機質(以有機碳為主)維持了這一區域高的初級生產力和高的碳輸出通量[1,3],使得 Ri OMars系統成為有機碳,特別是陸源有機碳的主要沉積中心[4—7]。河流流量的季節變化、不同尺度的物理過程(潮汐、風暴、波流等)和底棲生物的擾動等因素的存在造就了Ri OMars系統活躍的沉積動力環境,系統內沉積物和有機碳的輸入和沉降、有機碳的循環等因此具有高度的時空變化性[1,8—9],從而使這一區域碳的源匯格局存在很大的不確定性[10—11]。物理和/或生物改造作用使得沉積物頻繁地再懸浮和移動,改變了本應隨時間和深度有序發生的有機碳早期成巖過程,將已經沉積下來并被新的沉積物覆蓋的有機碳再次暴露在氧化或次氧化環境而發生再礦化分解。在微生物作用下,Ri OMars系統中難降解的陸源有機碳可能受新形成的海源有機碳的引入所產生的激發效應(pri ming effects)影響而被更有效地分解[12]。這些作用使得Ri OMars系統雖然是有機碳的沉積中心,但并不一定是有機碳的保存中心[4,13]。本文對大河影響下陸架邊緣海沉積有機碳再礦化作用的速率測定方法、發生再礦化作用時的主要過程和特征進行了分析總結,以期對邊緣海再礦化作用及其對邊緣海碳匯的影響有一個更深入的認識。
2 基于O2消耗速率的沉積有機碳再礦化速率測定方法
沉積有機碳的再礦化作用是早期成巖過程中最重要的一個過程,有機碳經由再礦化實現了由有機向無機形式的轉化,構成生物地球化學循環中的重要一環。再礦化作用與包含重要生源要素碳、氮和磷的有機或無機分子相關,可用下式表示:
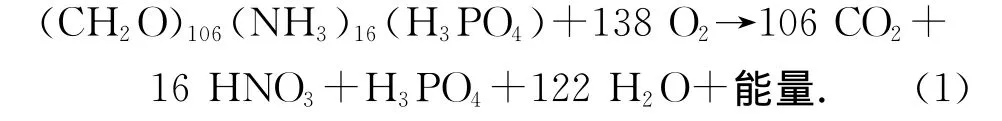
對于沉積有機碳再礦化速率的測定和計算正是基于式(1)。目前常用的主要是分別基于O2消耗速率和CO2產生速率的兩類方法。基于O2消耗速率的方法是通過測定沉積物-水界面溶解氧含量,計算O2從上覆水向沉積物的擴散通量,將其作為有機碳氧化所消耗的O2速率,然后按照C106∶O138的比例將其轉化成CO2的產生速率,并以此來代表有機碳的再礦化速率[14-15]。
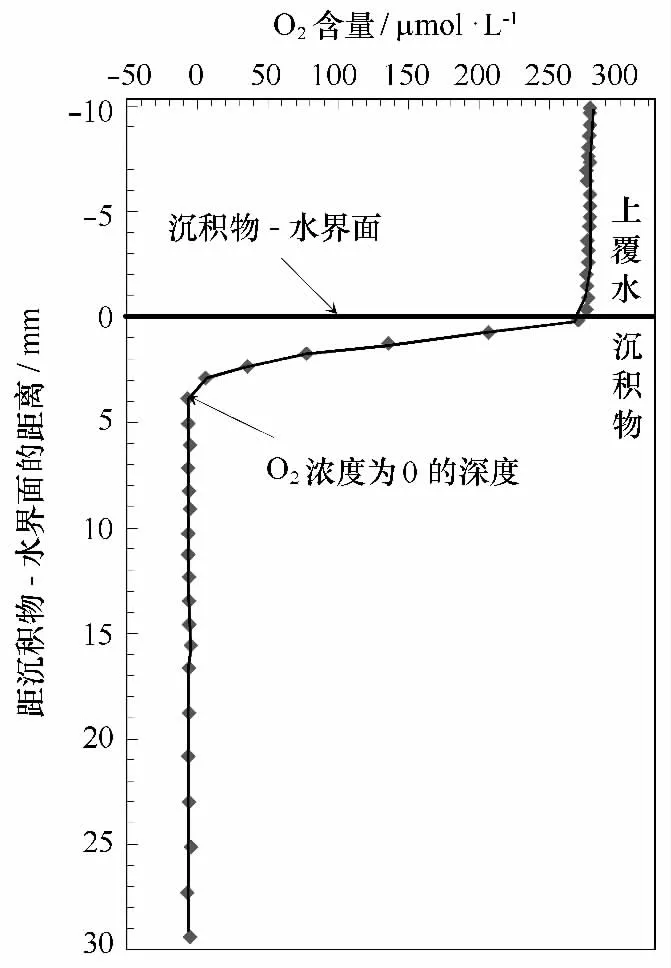
圖1 典型的沉積物-水界面O2垂直分布示意圖(重繪自文獻[14])
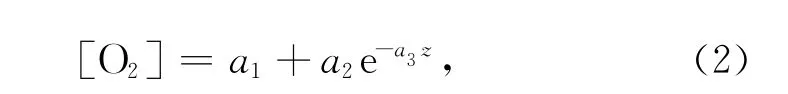
式中,z為沉積物深度,a1、a2和a3分別為指數函數的常數。根據菲克擴散定律,O2在沉積物-水界面的擴散通量FO2可描述為[15]:
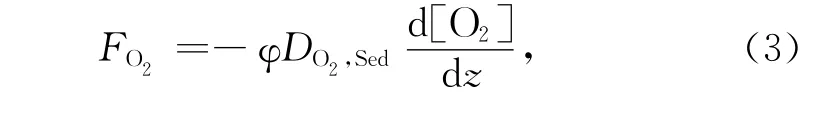
式中,φ為沉積物的孔隙度,一般在0.7~1.0之間,常取0.8[14]。DO2,Sed為O2在沉積物中的擴散系數,可由O2在水中的分子擴散系數估算[14]:

式中,DO2,water是溫度的線性函數,一般介于1×10-5~4×10-5cm2/s,溫度越低,擴散系數越小,24℃時約為2.3×10-5cm2/s[16]。
將式(2)、(4)分別代入式(3),并求導就得到:
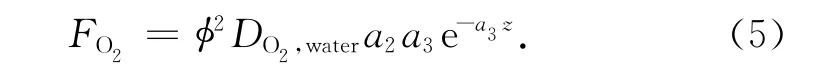
將各參數代入上式即可得到不同深度O2的擴散通量。當z=0 mm時,得到的即為O2穿越沉積物-水界面的擴散通量[mmol/(m2·d)],它實際上代表了沉積物中O2的消耗速率。據此,即可利用下式估算有機碳的再礦化速率(用CO2的產生速率來表示):
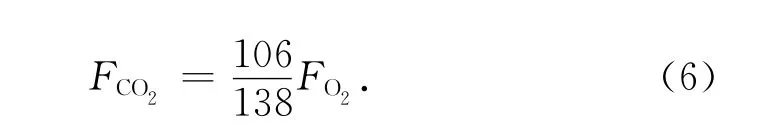
借助于氧微電極的發展[17],研究者現在可以獲得非常精細的沉積物-水界面溶解O2剖面。例如,Epping等[18]根據伊比利亞邊緣海沉積物中的溶解O2剖面,計算出的有機碳的氧化速率(以碳計)從陸架上的11 g/(m2·a),即2.51 mmol/(m2·d),減小到5 000 m水深處的2 g/(m2·a),即0.46 mmol/(m2·d)。在地中海西北的羅納河(Rh?ne River)河口及鄰近海域,Lansard等[19]通過氧微電極觀測到的總的O2吸收速率(擴散通量)變化范圍是5.2~29.3 mmol/(m2·d),據此計算出的有機碳再礦化速率為4.0~22.5 mmol/(m2·d),最大的再礦化速率發生于河口附近,這里的總有機碳含量也是最高的,且85%來自于陸源輸入。Neibauer[14]在赤道太平洋加拉帕戈斯群島(Galápagos Islands)附近開展的研究表明,由溶解氧剖面計算出的沉積有機碳再礦化速率在群島中最大的伊薩貝拉島西側水深1 080 m的站位約為1.21 mmol/(m2·d),而在伊薩貝拉島東側2 257 m和640 m水深的站位則分別為0.67 mmol/(m2·d)和0.54 mmol/(m2·d),上述站位對應的 O2穿透深度分別為7.2 mm、10.4 mm和12.1 mm。這些研究表明,在大洋區域或很少受河流影響的陸架邊緣海中,沉積有機碳的再礦化速率往往很低,但在受大河影響的陸架邊緣海(尤其是河口附近),情況完全不同,其沉積有機碳的再礦化速率可能高出幾倍到幾十倍,顯示大河影響下的陸架邊緣海對有機碳循環具有十分重要的影響。
基于沉積物-水界面溶解氧擴散通量的測定來估算沉積有機碳的再礦化速率,具有測量速度較快的優點,而且由于使用精密的步進馬達控制氧微電極,測量剖面通常只有幾或十幾毫米,測定比較精細和準確。但這種方法存在兩個問題:第一,儀器本身價格昂貴,也容易損毀,這主要是因為氧微電極的玻璃頭部極細,很容易在步進過程中折斷,尤其當沉積物是粗砂或有較多貝殼等硬質異物存在時;第二,這種方法考慮的只是沉積物-水界面很小的范圍內對溶解氧的吸收和消耗,雖然可以對O2能夠穿透的深度以內發生的再礦化速率進行較為精確的估算,但卻無法反映更多發生于沉積物次表層的復雜的有機碳分解和再礦化過程,這是因為在O2穿透深度以下的沉積物中,依然有更多的有機碳發生再礦化作用,如NO-3、Fe3+、Mn2+和SO2-4等都可以作為氧化還原反應的電子受體像O2一樣氧化有機碳,因此,這種基于沉積物-水界面溶解氧擴散通量的方法實際上并不能完全反映這一區域有機碳的分解和再礦化過程。
4.1.1 效果評價方法 將績效考核前2009年9月—2010年9月的質控成績與實行績效考核后2010年10月—2011年10月的質控成績對比,從護理管理質量考核(包括護士長工作質量、病區管理質量、分級護理質量、護理文件書寫)、患者與家屬滿意度、操作技能得分(包括“三基”與專科技術操作)3個方面進行比較。統計數據來自護理部月質控成績以及月滿意度問卷調查結果。其中每個月通過對10例患者和或家屬發放調查問卷,全年共計120份,調查其對護士工作的滿意度,回收有效率均98%。每個月對醫師、護士發放調查問卷各10份,全年共計240份,回收有效率均100%。
3 基于CO2產生速率的沉積有機碳再礦化速率測定方法
除了基于O2消耗速率的方法測定沉積有機碳再礦化速率,還可以通過測定沉積物間隙水中∑CO2(即溶解無機碳DIC)含量,計算∑CO2從沉積物向上覆水的擴散通量,以此求得有機碳氧化所產生的CO2速率,即有機碳的再礦化速率[20-21]。不過,通過沉積物間隙水中∑CO2的剖面變化計算的CO2通量,往往并不能用來直接代表有機碳的再礦化速率,因為間隙水中∑CO2不僅來自于有機碳的氧化分解,還可能來自于碳酸鹽的溶解和底層向上的擴散,特別是在以碳酸鹽沉積為主的深海環境。在這種情況下,可以通過測定間隙水中∑CO2的δ13C,建立基于質量平衡的端元模型來計算有機碳氧化、碳酸鹽溶解等對CO2產生的貢獻,即下式[20]:
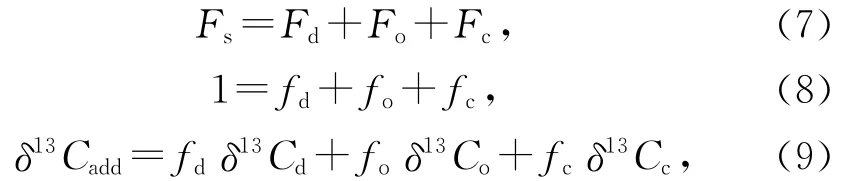
式中,Fs是∑CO2從沉積物向上覆水的擴散通量,可通過沉積物水界面的∑CO2的變化計算得到,Fd、Fo和Fc分別為深層沉積物中∑CO2的向上擴散、有機碳氧化和碳酸鹽溶解所貢獻的∑CO2通量,Fd可通過一定深度的∑CO2的變化計算得到;fd、fo和fc分別為3種∑CO2通量占∑CO2從沉積物向上覆水的擴散通量的比例;δ13Cadd為一定深度的沉積物中所增加的∑CO2的δ13C,可直接通過測定得到,同樣地,δ13Cd為從深層沉積物中向上擴散的∑CO2的δ13C,也可通過測定一定深度的∑CO2的δ13C得到;δ13Co和δ13Cc分別為有機碳氧化和碳酸鹽溶解所產生的∑CO2的δ13C,分別使用沉積有機碳和固體碳酸鹽的δ13C。這樣,在式(8)和(9)組成的聯立方程中,只有fo和fc是未知數,求解后得到有機碳氧化和碳酸鹽溶解所貢獻的∑CO2通量,即得到有機碳的再礦化速率。利用這種方法,Martin等[20]研究了西赤道大西洋Ceara Rise(水深超過3 000 m)的沉積物間隙水∑CO2擴散通量,結果表明在水深3 279 m的站位0~6.2 cm 深度的沉積物中fo和fc相當(0.43~0.46),對應的Fo和Fc均在0.25 mmol/(m2·d)左右,而在水深4 675 m的站位0~1.8 cm深度的沉積物中fo(0.05)要遠小于fd(0.50)和fc(0.45),相應的Fo只有0.03 mmol/(m2·d)左右,而1.8~7.5 cm深度的沉積物中有機碳分解所貢獻的∑CO2通量明顯增加(fo=0.44,Fo=0.08 mmol/(m2·d))。
這種方法基于多種假設,如體系處于穩態平衡狀態、有機碳氧化和碳酸鹽溶解過程中不存在同位素分餾等,適用于存在靜態沉積的深海環境,更多地應用于研究碳酸鹽沉積環境中碳酸鹽的溶解[20,22],而在專注于沉積有機碳再礦化作用的研究中,在大河影響下的陸架邊緣海這種高度動態的沉積環境的應用等都很少[21,23]。在大河影響下的陸架邊緣海,沉積有機碳再礦化速率的測定主要是通過培養實驗,直接測定沉積物樣品在一個時間序列中∑CO2的產生速率,并以此來表示有機碳的再礦化速率。在封閉培養體系中,來自深層沉積物∑CO2的向上擴散可以忽略,而在大河影響下的陸架邊緣海,由于受到陸源輸入的顆粒物的影響,碳酸鹽也不是主要的沉積形式,因此通過培養所產生的∑CO2可以認為主要來自于有機碳的再礦化分解。用來培養的沉積物樣品可以是表層樣品、整根柱狀樣品或分層后的柱狀樣品,常用的是整根柱狀樣品,在培養后再對樣品進行分層,然后取每層樣品中的間隙水,測定DIC含量,即∑CO2,再進行相應的計算[24]。該方法假定在培養過程中∑CO2的垂直剖面受非穩態擴散和零級反應控制,即:
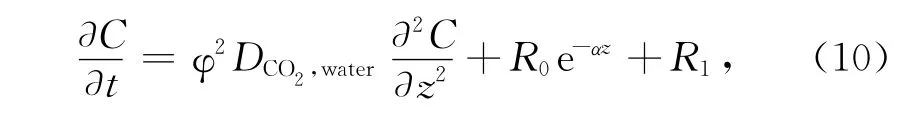
其中,

在初始條件下,
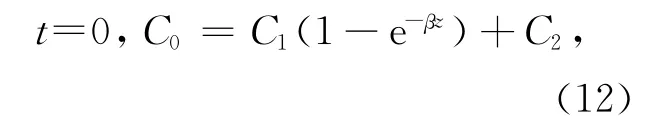
邊界條件:
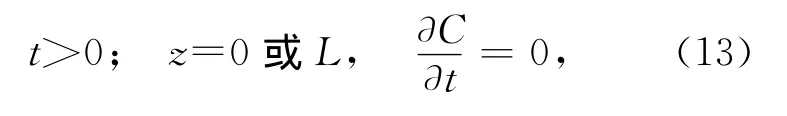
式中,C是∑CO2含量(μmol/L),是沉積物深度z和培養時間t的函數;φ為沉積物的孔隙度;DCO2,water是一定溫度下CO2在水中的分子擴散系數,在24℃時約為1.9×10-5cm2/s[16];R代表反應速率,即∑CO2的產生速率,R0、R1和α是R函數的常數(單位分別為μmol/(L·s)和cm-1);C1、C2和β是初始條件下∑CO2垂直分布曲線函數的常數,可通過曲線擬合得到。
對式(7)進行偏微分求解,可得到C(z,t)的解。因為培養時間和沉積物深度是已知的,實際上的未知數就是反應速率R函數的常數R0、R1和α[25]。在實際應用中,對不同培養時間得到的∑CO2垂直分布曲線進行函數擬合,即可求解R0、R1和α,因此除了起始時間外,至少還應有兩個時間點的培養樣品數據,理論上時間點越多,結果越優。在得到R0、R1和α后,結合沉積物柱長L,可求得整個沉積物柱累積反應速率或通量[mmol/(m2·d)]:
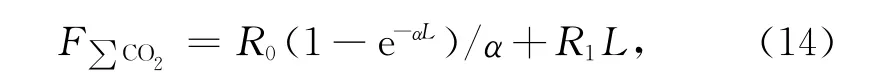
或使用下式簡單估算:

應用這一方法,Aller等人在亞馬孫河口、巴布亞灣等地開展了底邊界層中浮泥、移動泥中的有機碳再礦化作用的開創性研究,深化了人們對大河河口的泥質沉積、三角洲頂積層等在有機碳埋藏、保存和再礦化等方面獨特和重要作用的認識[4,24-29]。例如,作為輸沙量世界第一的亞馬孫河,其所輸送的泥沙受潮汐、上升流和波等的影響在南美東北海岸線形成了一條綿延1 600余千米,厚度0.5~2.0 m不等的“移動泥帶”[4],在該移動泥帶內凈的∑CO2累積產生速率超過43.2 mmol/(m2·d)[25]。在巴布亞灣飛河三角洲的頂積層[24],表層沉積物(0~20 cm)中∑CO2的產生速率最高達43.1 mmol/(m2·d),且主要發生在季風季節,表明物理擾動對再礦化作用有重要影響(圖2)[24]。通過對培養實驗中獲得的CO2進行δ13C分析,Aller等[24]還應用雙端元模型計算了不同來源有機碳再礦化對CO2產生的貢獻,發現超過50%的自河流入海的陸源有機碳在巴布亞灣表層沉積物中被氧化而分解,保存下來的部分只占輸入量的13%~27%,顯示了移動泥在有機碳再礦化方面的重要作用。與巴布亞灣同處新幾內亞島南部的阿魯海(Aru Sea)每年接收約30條河流輸送的427×106t的泥沙,接近亞馬孫年輸沙量的一半[30-31]。在阿魯海,沉積物培養實驗的深度積分DIC累積生產速率范圍是12.3~47.8 mmol/(m2·d),最高值處靠近此區域3條主要的河流,也是最長的河流Pulau River的河口[31]。
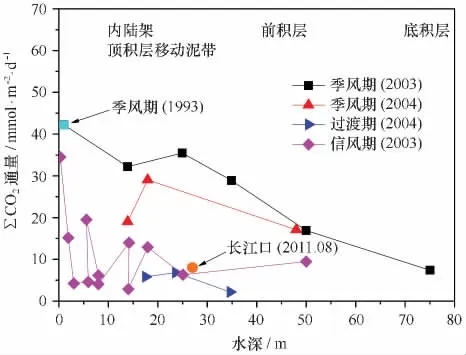
圖2 巴布亞灣沉積物中∑CO2產生速率隨深度和季節的變化(重繪自文獻[24],原數據為長江口再礦化培養結果)
總的來說,通過培養方法獲得的∑CO2產生速率,即有機碳再礦化速率,需要的時間周期較長,操作步驟多,計算過程相對也較復雜一些,但是這種方法測定的是有機碳再礦化的產物CO2,不但考慮了好氧條件下的有機碳分解過程,同時也包括了厭氧條件下的過程,如甲烷的厭氧氧化(AOM)[32],是一個綜合的結果,因而也是一個更為全面客觀的結果。
從上述結果還可以看出,目前通過測定培養過程中∑CO2產生速率的方法來研究沉積有機碳再礦化作用主要集中在熱帶海域。3個不同區域以及其他一些研究的結果[33]在數值上接近,而且明顯比用測定沉積物-水界面溶解氧擴散通量的方法獲得的其他海域的結果要高,說明熱帶海域確實是沉積有機碳的“焚化爐”,大部分進入這一區域的有機碳,特別是難降解的陸源有機碳會被“燃燒”而分解掉[27,31]。在溫帶海域,類似的研究還未見報道。我們的初步研究表明,在長江口泥質沉積區中心位置,表層沉積物中也發生著明顯的有機碳再礦化作用,簡單的估算表明表層15 cm以上的沉積有機碳再礦化速率平均為8.4 mmol/(m2·d)(深度平均結果),與熱帶海域在動力條件較弱的信風期間的結果相當(見圖2)[34]。在培養過程中,表層15 cm以上的間隙水∑CO2含量是逐漸升高的,但是15 cm以下卻是逐漸降低的,說明15 cm以下發生了明顯消耗CO2的反應,其消耗速率遠高于此處甲烷的沉積物水界面擴散通量,說明產甲烷菌將CO2還原成CH4并不是一個主要的過程,實際上其消耗速率與間隙水中常量陽離子,如Ca2+、Mg2+和K+等的消耗速率是接近的,表明自生碳酸鹽礦物的形成可能是再礦化作用中消耗CO2的主要過程[34]。實際上,在亞馬孫河口、巴布亞灣的沉積物培養實驗中也均發現了這一點[26-27]。更進一步的分析表明,沉積物中總有機碳(TOC)含量在培養過程中是逐漸降低的,但是其消耗速率遠高于間隙水中∑CO2的產生速率,表明大部分沉積有機碳的再礦化分解并不是直接形成DIC,而是可能先形成溶解有機碳(DOC),然后DOC再逐步分解形成DIC,圖3給出了邊緣海沉積有機碳再礦化作用中不同形式的碳之間的轉化過程[35]。與TOC向DOC的轉化相比,DOC向DIC的轉化速率要慢得多,因為DOC的活性范圍更大,很多都耐微生物降解[36-37]。最近幾年提出來的微生物碳泵(microbial carbon pu mp,MCP)理論強化了微生物在將脆弱的DOC轉化成難降解的DOC(Recalcitrant DOC),從而促進碳的埋藏方面的重要作用[38]。因此,在邊緣海沉積環境中應能觀察到DOC在系統中的積累,正如在法國吉倫特(Gironde)河口最大渾濁帶附近的浮泥層中所觀察到的[39]。
這些復雜生物地球化學過程的同時存在,無疑使得沉積有機碳再礦化作用的分析和解釋更加復雜,也說明僅僅分析沉積物間隙水中CO2的剖面變化不足以全面了解其中發生的有機碳再礦化分解、CO2與CH4的產生和消耗等過程。多種技術手段的同時運用,如間隙水中CO2和CH4的13C和14C分析,甚至生物標志物的分析等,可能有助于揭示培養過程中不同來源、不同年齡有機碳再礦化速率的差異及對∑CO2產生和消耗的貢獻,這應當是進一步完善基于CO2產生速率的沉積有機碳再礦化速率測定方法的一個重要方面。
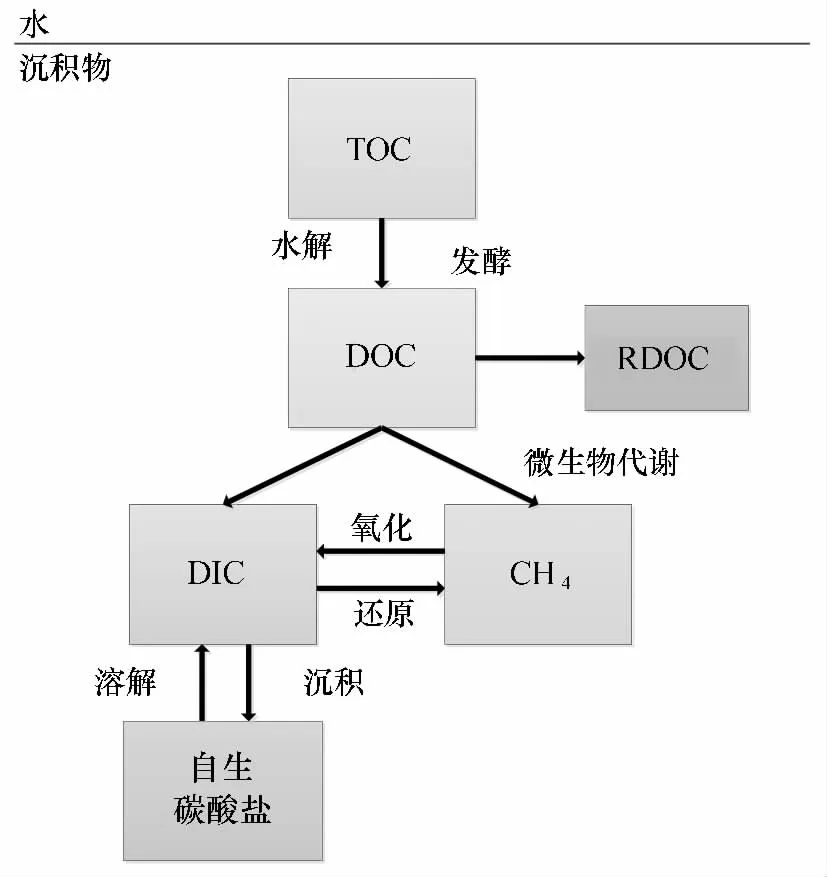
圖3 海洋沉積物中有機碳再礦化過程概念模型(重繪自文獻[35])
4 沉積有機碳再礦化作用的特征
除了對沉積有機碳再礦化速率進行直接或間接地測定之外,一些特征或參數還可以用來輔助判斷沉積有機碳是否可能或已經發生了明顯的再礦化分解。根據已有研究成果,概括起來講,沉積有機碳再礦化作用的特征主要體現在5個方面:
第一,表層沉積物呈現比較明顯的混合均勻特點。在物理和/或生物改造作用下(以物理改造作用為主),表層沉積物會發生比較明顯的周期性混合,混合層深度從幾厘米到幾米不等,但主要是表層幾十厘米。混合層是一個非穩態的沉積,與底層存在明顯的分界線,該層不但可以通過再懸浮發生縱向的混合,還可以在潮汐、流、重力的作用下發生橫向移動,故名“移動泥(mobile muds)”[4,28]。混合層的存在可以通過210Pb、137Cs等放射性同位素的垂向分布是否均勻來判斷。一般來說,沉積物中的放射性同位素是隨著時間逐漸衰變的(137Cs的相反),其活度應隨深度增加而逐漸減小,如果沉積物發生了混合,在混合層內就觀察不到明顯的衰變曲線。這種現象在亞馬孫河口[27]、巴布亞灣[24]、密西西比河口[1]以及長江口[40-41]等都有發現。
第二,有序發生的早期成巖過程被改變,形成了次氧化的氧化還原條件。由于混合層沉積物頻繁地發生再懸浮和再沉積,改變了本應有序發生的早期成巖過程,鐵和錳不斷地經歷再暴露和再氧化,發生反復的氧化還原循環,并與硫的氧化還原耦合在一起,從而形成次氧化的氧化還原條件,增強隨后的沉積有機碳缺氧降解過程。發生混合的沉積物中具有高含量的活性鐵(以Fe3+為主,300~400μmol/g),而間隙水中具有高含量的Fe2+,表明有很大一部分活性鐵被還原了;但是在混合層內被還原的活性鐵大部分并沒有形成硫化鐵礦物(FeS2),即黃鐵礦化程度低,主要是因為這些區域相對于一般的陸架沉積物缺少硫,C/S比值較高(約4~6)[26]。在沉積物混合層(次氧化帶)中由于SO的還原和硫的氧化同時存在,不發生凈的硫還原,S的δ34S垂向變化均勻,但是在混合層與底層(甲烷帶)的分界處,會發生凈的硫還原,間隙水中S會明顯降低,形成HS-,造成δ34S升高。總的來說,與一般的陸架沉積物相比,在這些區域沉積物中的間隙水富集34S,δ34S一般在10~30左右[42]。
第三,沉積物中有機碳的再礦化分解速率高,沉積物單位比表面積有機碳含量(TOC/SSA)低,有機碳的保存效率低。通常,具有較高沉積速率的區域,只要動力環境比較穩定,有機碳就會被有效地保存下來[43]。但這些區域由于處于河口三角洲附近,雖然因為受陸源輸入的影響而具有較高的沉積速率,卻由于動蕩的動力環境,有機碳保存率較低,一般只有20%左右(圖4)[4,24,43]。實際上,衡量不同河流和海域有機碳保存率的一個較好的指標是沉積物單位比表面積有機碳含量(TOC/SSA)。按照TOC/SSA比值的大小,以0.4 mg/m2和1.0 mg/m2作為分界線,可以將沉積物劃分為3類:一類是TOC/SSA大于1.0 mg/m2的,主要是高生產力上升流區域的沉積物,有機碳被很好地保存了下來;第二類是TOC/SSA在0.4~1.0 mg/m2之間的,主要是一般陸架海域沉積物(受大河影響較小)和河流中的懸浮顆粒物;第三類則是TOC/SSA小于0.4 mg/m2的,常見于深海沉積物,因為有機碳在漫長的沉降過程中已經發生了充分地降解,有機碳保存率自然很低[43](見圖5)。動力環境強的河口三角洲區域,如亞馬孫河口、飛河三角洲、密西西比三角洲等,其TOC/SSA通常也低于0.4 mg/m2,這是由于組成沉積物的顆粒雖然是較細的黏土和粉砂為主,本身具有較高的比表面積,應吸附或結合較多的有機碳,但因為發生了強烈的有機物再礦化分解作用,其TOC/SSA比值反而明顯低于陸地土壤或陸架邊緣海沉積物,而與深海沉積物相當[43]。我們在長江口和浙閩沿岸泥質區的初步研究表明,泥質區沉積物TOC/SSA比值小于0.4 mg/m2,而泥質區外的沉積物則在0.6 mg/m2左右,表明長江三角洲區域與亞馬孫、密西西比河三角洲一樣,都屬于沉積速率很高但有機碳保存率相對較低的區域。
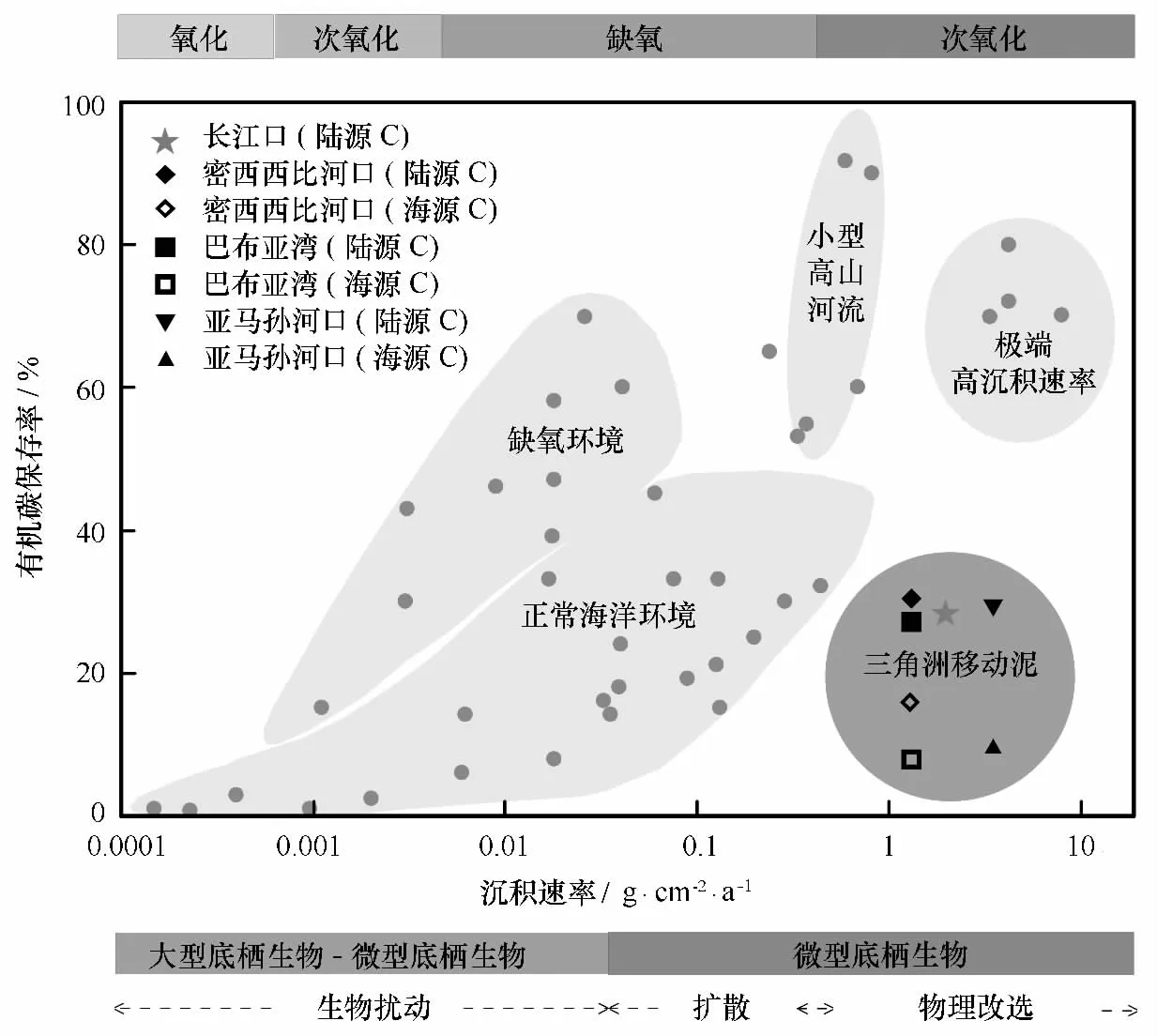
圖4 不同海洋環境中沉積有機碳的保存率隨沉積速率的變化(重繪自文獻[43])
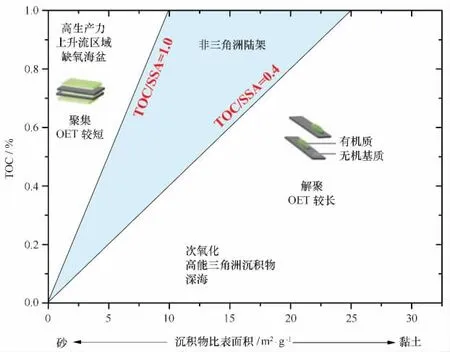
圖5 海洋沉積物中有機碳含量(TOC)與沉積物比表面積(SSA)之間的關系(重繪自文獻[43])
第四,可能形成富含鐵和錳的自生碳酸鹽礦物,發生“反風化作用”。反風化作用是指海洋沉積物中的元素通過化學反應結合在一起形成新的自生黏土礦物的過程[44-45],可用下式表示[46]:

式中“離子”表示堿金屬或堿土金屬離子、Fe2+、F-等。由上式可以看出,反風化作用發生將使得離子被重新結合到固體化合物中,在這一過程中,有機質是作為活性鐵氧化的底物。因此,當一個區域具有豐富的活性鐵鋁氧化物、活性有機質、生物硅、堿金屬和堿土金屬等離子的持續供給時,在次氧化的成巖條件下,就有可能發生反風化作用。顯然,有機碳再礦化作用越強的沉積環境,越有可能發生反風化作用。如前所述,我們在長江口泥質區沉積物不但觀察到了間隙水中∑CO2的產生(0~15 cm),還觀察到了∑CO2的消耗,而其消耗速率與常量陽離子的消耗速率是接近的,顯示了自生碳酸鹽礦物的可能形成,即反風化作用的發生[34]。在亞馬孫河口也已經觀察到了反風化作用存在,其沉積物間隙水中的Li+、K+、F-等明顯從上覆水向沉積物中擴散,Li+的擴散通量高達當地河流輸送通量的60%[45,47-49]。通常,自生黏土礦物主要是在低沉積速率的外陸架或深海才能形成,一般需要幾百年甚至上千年[45];但在河口三角洲特殊條件下,自生黏土礦物可以在較短的時間(如幾年內)形成,這無疑對C、Si、Li+、K+等元素的生物地球化學循環有重要意義。長久以來,對形成海洋自生礦物的反風化作用的重視遠不如對陸生礦物的風化作用[50],對沉積有機碳的再礦化作用和反風化作用的耦合了解就更少,在今后的工作中應當加強這方面的研究。
第五,微生物在沉積有機碳再礦化過程中發揮著重要作用。沉積有機碳的再礦化過程涉及一系列好氧或厭氧的古菌、細菌等微生物的作用,涉及發酵作用、甲烷產生和氧化、硝化反硝化、厭氧銨氧化、硫酸鹽還原等過程[28]。這些不同的微生物功能類群以有機碳為底物,以高價態的氧化物(如硫酸鹽、硝酸鹽等)作為電子受體,在其自身被還原成低價態形式的同時,將底物氧化生成CO[28]2。在一般的海洋環境中,表層沉積物中的生物量主要由大型底棲生物貢獻,但是在動力條件強、表層沉積物混合明顯的河口三角洲,如亞馬孫河口、巴布亞灣三角洲,微生物和大型底棲生物的相對量截然不同,沉積物中微生物的生物量幾十倍于底棲動物[4]。在巴布亞灣海床上部,微生物群落具有豐富的多樣性,高的細菌生物量和周轉率與高的底沉積物再礦化速率相一致,反映了細菌對物理擾動、新鮮有機碳的輸入等的快速響應[51]。在沉積有機碳再礦化過程中,新鮮的海洋自生有機碳作為易降解的有機碳被優先分解,但是通常認為難降解的陸源有機碳(如木質素)在這一過程中也能發生顯著的降解,這種現象被稱為“激發效應(pri ming effects)”。這是一個從土壤研究中借用的概念,表示外源有機物的加入顯著改變土壤有機碳的礦化速率[52]。在河口邊緣海沉積有機碳的再礦化過程中,“激發效應”如何促進或抑制難降解的陸源有機碳的分解,微生物在其中究竟起了什么樣的作用目前還了解很少。
應當指出的是,對大河影響下陸架邊緣海沉積有機碳再礦化作用的研究,目前主要集中在熱帶河口,已有一些針對溫帶河口(如密西西比河口、長江口等)沉積物的類似研究,初步結果表明也具有上述某些特點,但并不如熱帶河口三角洲那樣明顯。溫帶河口陸架邊緣海的情況具體是怎樣的,兩者的差異以及控制機制是什么?這些都需要更深入的研究。
5 結語
總的來說,目前對于大河影響下的邊緣海系統沉積有機碳的再礦化作用的研究和認識是不足的。不同區域、不同流量和輸沙量、不同河口沉積類型的大河影響下的陸架邊緣海沉積有機碳再礦化速率差異有多大?河流、潮汐、波浪、風暴和生物擾動如何影響沉積有機碳的再礦化分解?不同來源、不同年齡的顆粒和溶解有機碳在再礦化過程中的關系是怎樣的,是互相促進還是抑制?熱帶和溫帶河口再礦化作用是否有差異,其機制是什么?微生物究竟是如何在其中發揮作用的?這些都是需要今后深入研究的十分重要的問題,只有這些問題研究清楚了,才能對大河影響下的陸架邊緣海有機碳的源匯格局有更清楚的認識。
亞馬孫河口、巴布亞灣三角洲等處的相關工作已經為這一類研究提供了一個很好的范例和參考,但仍然有需要突破之處,比如之前的研究均是針對某一特定區域采用一種測定方法的研究,既缺少使用同一種方法在不同區域之間的比較研究,也沒有在同一個地點對兩種再礦化速率的測定方法進行比較,前者可以用于了解影響再礦化作用的因素,而后者有助于在使用不同方法的研究之間進行比較。另外,之前的研究多僅限于再礦化過程中沉積物間隙水O2和CO2的變化,對于被再礦化的沉積有機碳本身的變化缺少認識,作為解析有機碳來源和歸宿的有力工具的化學生物標志物在再礦化過程中又是如何變化的也不清楚。是否可以將沉積有機碳、生物標志物的變化也作為再礦化速率測定的指標或參數?這些問題和思路當是今后研究的關鍵切入點。
作為我國著名的世界級河流,長江、黃河和珠江河口及其鄰近海域,特別是長江口-東海內陸架泥質區沉積有機碳的埋藏、保存和再礦化作用無疑更應引起我國研究者的關注,對于其認識的逐步加深將為深入理解這些大河影響下的陸架邊緣海生源要素的生物地球化學循環、陸海相互作用過程等奠定更為堅實的科學基礎。
[1]Mckee B A,Aller R C,Allison M A,et al.Transport and transformation of dissolved and particulate materials on continental margins Influenced by major rivers:benthic boundary layer and seabed processes[J].Continental Shelf Research,2004,24:899-926.
[2]Bianchi T S,Allison M A.Large-river delta-front estuaries as natural“recorders”of global environ mental change[J].Proceedings of the National Academy of Sciences,2009,106:8085-8092.
[3]Dagg M,Benner R,Lohrenz S E,et al.Transformation of dissolved and particulate materials on continental shelves influenced by large rivers:plume processes[J].Continental Shelf Research,2004,24:833-858.
[4]Aller R C.Mobile deltaic and continental shelf muds as suboxic,fluidized bed reactors[J].Marine Chemistry,1998,61:143-155.
[5]Hedges J I,Keil R G.Sedimentary organicmatter preservation:an assessment and speculative synthesis[J].Marine Chemistry,1995,49:81-115.
[6]Meade R H.River-sediment inputs to major deltas[M]//Milli man J D,Haq B U.Sea-level Rise and Coastal Subsidence.London:Kluwer,1996:63-85.
[7]Burdige D J.Preservation oforganicmatter inmarine sediments:controls,mechanisms,and an imbalance in sediment organic carbon budgets?[J].Chem Rev,2007,107:467-85.
[8]Hedges J I,Keil R G,Benner R.What happens to terrestrial organicmatter in the ocean?[J].Org Geochem,1997,27:195-212.
[9]Gordon E S,Go?i M A.Sources and distribution of terrigenous organicmatter delivered by the Atchafalaya River to sediments in the northern gulf of Mexico[J].Geochim Cosmochi m Acta,2003,67:2359-2375.
[10]Borges A V.Do we have enough pieces of the jigsaw to integrate CO2 fluxes in the Coastal Ocean?[J].Estuaries,2005,28:3-27.
[11]Cai W J,Dai M H,Wang Y C.Air-sea exchange of carbon dioxide in ocean margins:A province-based synthesis[J].Geophysical Research Letters,2006,33,L12603.
[12]Bianchi T S.The role of terrestrially derived organic carbon in the coastal ocean:A changing paradigm and the pri ming effect[J].PNAS,2011,108(49):19473-19481.
[13]Zonneveld K A F,Versteegh G J M,Kasten S.Selective preservation oforganicmatter in marine environments-processes and impact on the fossil record[J].Biogeosciences Discussions,2009,6:6371-6440.
[14]Neibauer J.Carbon remineralization rates in marine sediments beneath areas of high and low pri mary productivity in the Galapagos Archipelago[D].Washington:University of Washington,2006.
[15]Sauter E J,Schlüterm,Suess E.Organic carbon flux and remineralization in surface sediments from the northern North Atlantic derived from pore-water oxygen microprofiles[J].Deep-Sea Research I,2001,48:529-553.
[16]Libes S M.Introduction to marine biogeochemistry[M].2nd ed.Amsterdam:Academic Press,2009:161.
[17]許昆明,胡融剛.微電極技術在沉積物化學原位測量中的應用[J].地球科學進展,2006,21(8):863-869.
[18]Epping E,van der Zee C,Soetaert K,et al.On the oxidation and burial oforganic carbon in sediments of the Iberian margin and Nazare canyon(NE Atlantic)[J].Progress in Oceanography,2002,52:399-431.
[19]Lansard B,Rabouille C,Denis L,et al.Benthic remineralization at the land-ocean interface:Case study of the Rh?ne River(NW Mediterranean Sea)[J].Estuarine,Coastal and Shelf Science,2009,81:544-555.
[20]Martin W R,Mc Nichol A P,Mc Corkle D C.The radiocarbon age of calcite dissolving at the sea floor:esti mates from pore water data[J].Geochimica et Cosmochi mica Acta,2000,64:1391-1404.
[21]Papadimitriou S,Kennedy H,Thomas D N.Rates oforganic carbon oxidation in deep sea sediments in the eastern North Atlantic from pore water profiles of O2and theδ13C of dissolved inorganic carbon[J].Marine Geology,2004,212:97-111.
[22]Martin W R,Sayles F L.CaCO3dissolution in sediments of the Ceara Rise,western equatorial Atlantic[J].Geochimica et Cosmochi mica Acta,1996,60(2):243-263.
[23]Ogrinc N,Faganeli J,Pezdic J.Determination oforganic carbon remineralization in near-shore marine sediments(Gulf of Trieste,Norther n Adriatic)using stable carbon isotopes[J].Organic Geochemistry,2003,34:681-692.
[24]Aller R C,Blair N E,Brunskill G J.Early diagenetic cycling,incineration,and burial of sedimentary organic carbon in the central Gulf of Papua(Papua New Guinea)[J].Journal of Geophysical Research,2008,113,F01S09.
[25]Aller R C,Blair N E,Xia Q,et al.Remineralization rates,recycling and storage of carbon in Amazon shelf sediments[J].Continental Shelf Research,1996,16:753-786.
[26]Aller R C,Blair N E.Early diagenetic remineralization of sedimentary organic C in the Gulf of Papua deltaic complex(Papua New Guinea):Net loss of terrestrial C and diagenetic fractionation of C isotopes[J].Geochi mica et Cosmochimica Acta,2004,68:1815-1825.
[27]Aller R C,Blair N E.Carbon remineralization in the Amazon-Guianas mobile mudbelt:a sedimentary incinerator[J].Continental Shelf Research,2006,26:2241-2259.
[28]于志剛,姚鵬,甄毓,等.河口底邊界層生物地球化學過程研究進展[J].海洋學報,2011,33(5):1-8.
[29]姚鵬,于志剛,郭志剛.大河影響下的邊緣海沉積有機碳輸運與埋藏及再礦化研究進展[J].海洋地質與第四紀地質,2013,33(1):154-160.
[30]Milliman J D,Farnsworth K L.River discharge to the coastal ocean:a global synthesis[M].Cambridge University Press,2011:392.
[31]Alongi D M,Wirasantosa S,Wagey T,et al.Early diagenetic processes in relation to river discharge and coastal up welling in the Ar u Sea,Indonesia[J].Marine Chemistry,2012,140/141:10-23.
[32]Regnier P,Dale A W,Arndt S,et al.Quantitative analysis of anaerobic oxidation of methane(AOM)in marine sediments:A modeling perspective[J].Earth-Science Reviews,2011,106:105-130.
[33]Suykens K,Sch midt S,Delille B,et al.Benthic remineralization in the northwest European continental margin(northern Bay of Biscay)[J].Continental Shelf Research,2011,31:644-658.
[34]Yao P,Zhao B,Yu Z G,et al.Burial,preservation,and remineralization of sedimentary organic carbon in mud deposits of a temperate large-river delta-front estuary[J].Marine Chemistry,2013.Submitted.
[35]Alperin M J,Albert D B,Martens C S.Seasonal variations in production and consumption rates of dissolved organic carbon in an organic rich coastal sediment[J].Geochi mica et Cosmochimica Acta,1994,58:4909-4930.
[36]Hansell D A.Recalcitrant Dissolved Organic Carbon Fractions[J].Annual Review of Marine Science,2013,5:421-445.
[37]Jiao N Z,Zheng Q.The microbial carbon pump:from genes to ecosystems[J].Applied and Environmental Microbiology,2011,77:7439-7444.
[38]Jiao N,Herndl G J,Hansell D A,et al.Microbial production of recalcitrant dissolved organicmatter:Long-term carbon storage in the global ocean[J].Nature Reviews Microbiology,2010,8:593-599.
[39]Abril G,Etcheber H,Le Hir P,et al.Oxic/anoxic oscillations and organic carbon mineralization in an estuarine maxi mu m turbidity zone(The Gironde,France)[J].Li mnology and Oceanography,1999,44:1304-1315.
[40]Su C C,Huh C A.210Pb,137Cs and239;240Pu in East China Sea sediments:sources,pathways and budgets of sediments and radio nuclides[J].Marine Geology,2002,183:163-178.
[41]Hao Y C,Guo Z G,Yang Z S,et al.Tracking historical lead pollution in the coastal area adjacent to the Yangtze River Estuary using lead isotopic compositions[J].Environ mental Pollution,2008,156:1325-1331.
[42]Aller R C,Madrid V,Chistoserdov A,et al.Unsteady diagenetic processes and sulfur biogeochemistry in tropical deltaicmuds:Implications for oceanic isotope cycles and the sedimentary record[J].Geochimica et Cosmochi mica Acta,2010,74:4671-4692.
[43]Blair N E,Aller R C.The fate of terrestrial organic carbon in the marine environ ment[J].Annu Rev Mar Sci,2012,4:17.1-17.23.
[44]Mackenzie F T,Kump L R.Reverse weathering,clay mineral formation,and oceanic element cycles(Perspective)[J].Science,1995,270:586-587.
[45]Michalopoulos P,Aller R C.Rapid clay mineral formation in Amazon delta sediments:Reverse weathering and oceanic elemental cycles[J].Science,1995,270:614-617.
[46]Mackenzie F T,Garrels R M.Chemical mass balance bet ween rivers and oceans[J].Am J Sci,1966,264:507-525.
[47]Rude P D,Aller R C.Fluorine uptake by Amazon continental shelf sediments and its impact on the global fluorine cycle[J].Cont Shelf Res,1994,14:883-907.
[48]Michalopoulos P,Aller R C,Reeder R J.Conversion of diatoms to clays during early diagenesis in tropical,continental shelf muds[J].Geology,2000,28,1095-1098.
[49]Michalopoulos P,Aller R C.Early diagenesis of biogenic silica in the Amazon delta:Alteration,authigenic clay formation,and storage[J].Geochimica et Cosmochi mica Acta,2004,68(5):1061-1085.
[50]France-Lanord C,Derry L A.Organic carbon burial forcing of the carbon cycle from Hi malayan erosion[J].Nature,1997,390:65-67.
[51]Aller J Y,Aller R C,Kemp P F,et al.Fluidized muds:a novel setting for the generation of biosphere diversity through geologic time[J].Geobiology,2010,8:169-178.
[52]Kuzyakov Y,Friedel J K,Stahr K.Review of mechanisms and quantification of pri ming effects[J].Soil Biology &Biochemistry,2000,32:1485-1498.

