富勒烯與β淀粉樣肽低聚體結合的分子動力學模擬
周曉穎 郗文輝 韋廣紅
(應用表面物理國家重點實驗室,計算物質科學教育部重點實驗室,復旦大學物理系,上海 200433)
1 引言
一系列重大疾病與蛋白或多肽的淀粉樣聚集有關,如阿茲海默氏癥(AD)、帕金森癥、二型糖尿病等.1,2其中阿茲海默氏癥,由于患者眾多,一直備受人們的關注.3,4AD患者會出現出一系列神經退行性癥狀,如記憶功能退化、語言及認知能力的喪失等,嚴重時將致死.AD發病幾率隨著年齡增長呈現幾何級數增長,在美國AD已經成為僅次于心臟病和癌癥的第三大致死疾病.由于目前尚沒有治療AD的特效藥物,對AD的研究受到各界人士的廣泛重視.5,6通常認為AD的成因主要與大腦內的Aβ、Tau等蛋白的錯誤折疊和淀粉樣聚集密切相關.Aβ是一種通過多種分泌酶剪切淀粉質前體蛋白而得到的多肽,長度約為37-43個氨基酸,其中以Aβ40和Aβ42這兩種具有神經細胞毒性的淀粉樣聚集體最為常見.7-9Aβ40在大腦內的濃度數倍于Aβ42,但后者具有更強的毒性.正常狀態下Aβ并不具有特定的三維結構,其本身的生理功能也尚不清楚;然而在病理狀態下,Aβ會在大腦內形成淀粉樣纖維并大量沉淀,最終形成光學顯微鏡下可見的斑塊.10通過電鏡、固相核磁共振(ss-NMR)等多種實驗手段,人們已經大致了解該淀粉樣聚集體的分子結構特征.11-13Aβ40/42通過鏈間平行β片,排列成可以無限延伸的原纖維;進而多條原纖維之間互相纏繞,最終形成電鏡下可觀察到的細長纖維狀的聚集體.14有實驗表明,Aβ在聚集過程中形成的低聚物和纖維均具有神經毒性,15是導致AD的原因之一.研究如何破壞或抑制Aβ的淀粉樣聚集,對理解Aβ的聚集機理以及開發治療AD的方案具有重要意義.
雖然Aβ可以在試管中自發從可溶單體狀態聚集為淀粉樣沉淀,但是在細胞內,Aβ處于一個復雜的溶液環境,將受到諸多因素的影響,如pH、16,17小分子18或納米顆粒19-21等.不同因素會對Aβ聚集產生促進或抑制作用,因此若干治療策略都是基于某種調控機制來抑制或破壞Aβ的聚集過程.22碳納米顆粒,作為納米顆粒的一種,具有如工藝成熟、表面修飾便利、生物毒性低等一系列優點,在藥物運輸、表面催化等領域均有廣泛運用.23-25不少富勒烯或石墨烯等碳納米顆粒相關的實驗和模擬側重于淀粉樣聚集蛋白體系.26-29最近一系列的研究工作表明,碳納米顆粒的曲率等物理化學性質將對淀粉樣多肽及非淀粉樣多肽的吸附和聚集產生一定的影響.27,30,312003年Kim和Lee32發現修飾后的富勒烯可以有效抑制全長Aβ的聚集,這一結果為開發C60類抗聚集藥物提供了良好的指引方向.Andujar等33利用分子對接研究了富勒烯與Aβ的結合位點,得到了在有序的β-sheet頂部的位點為能量有利的結合位點,并采用分子動力學模擬研究了富勒烯在此結合位點上與Aβ的相互作用及其對Aβ結構的破壞,此結果為理解富勒烯的抑制效應提供了一些初步的思路,但有一些不清楚的地方,例如:(1)如果不用對接方法,而是采用分子動力學模擬,從富勒烯與Aβ沒有接觸的狀態出發,是否能找到更多的結合位點?(2)從此狀態出發富勒烯結合Aβ的動力學過程是怎樣的?(3)富勒烯在不同位點上對Aβ低聚體的結構有什么樣的影響?這些問題均有待進一步的深入研究.
為了回答上述問題,本工作中利用分子動力學(MD)模擬的方法,從富勒烯與Aβ沒有接觸(即二者之間的原子間的最近距離為2.0 nm)的狀態出發,研究了富勒烯與Aβ42聚集體的結合及相互作用的動力學過程.我們不僅得到了與之前研究結果吻合的位點,而且發現了新的重要位點.在核心疏水區域,觀察到C60擠入多肽表面疏水口袋的現象.在N端的位點中,富勒烯具有破壞其末端β結構的能力.通過分析結合的動力學特征及結合能,發現了富勒烯在淀粉樣多肽表面結合所特有的溝槽滾動機制.這些結果對理解富勒烯抑制Aβ聚集的聚集機制給出了更全面的解釋,為相關抗聚集藥物分子的設計提供了有益的思路.
2 模擬方法
2.1 Aβ42與富勒烯的模擬體系
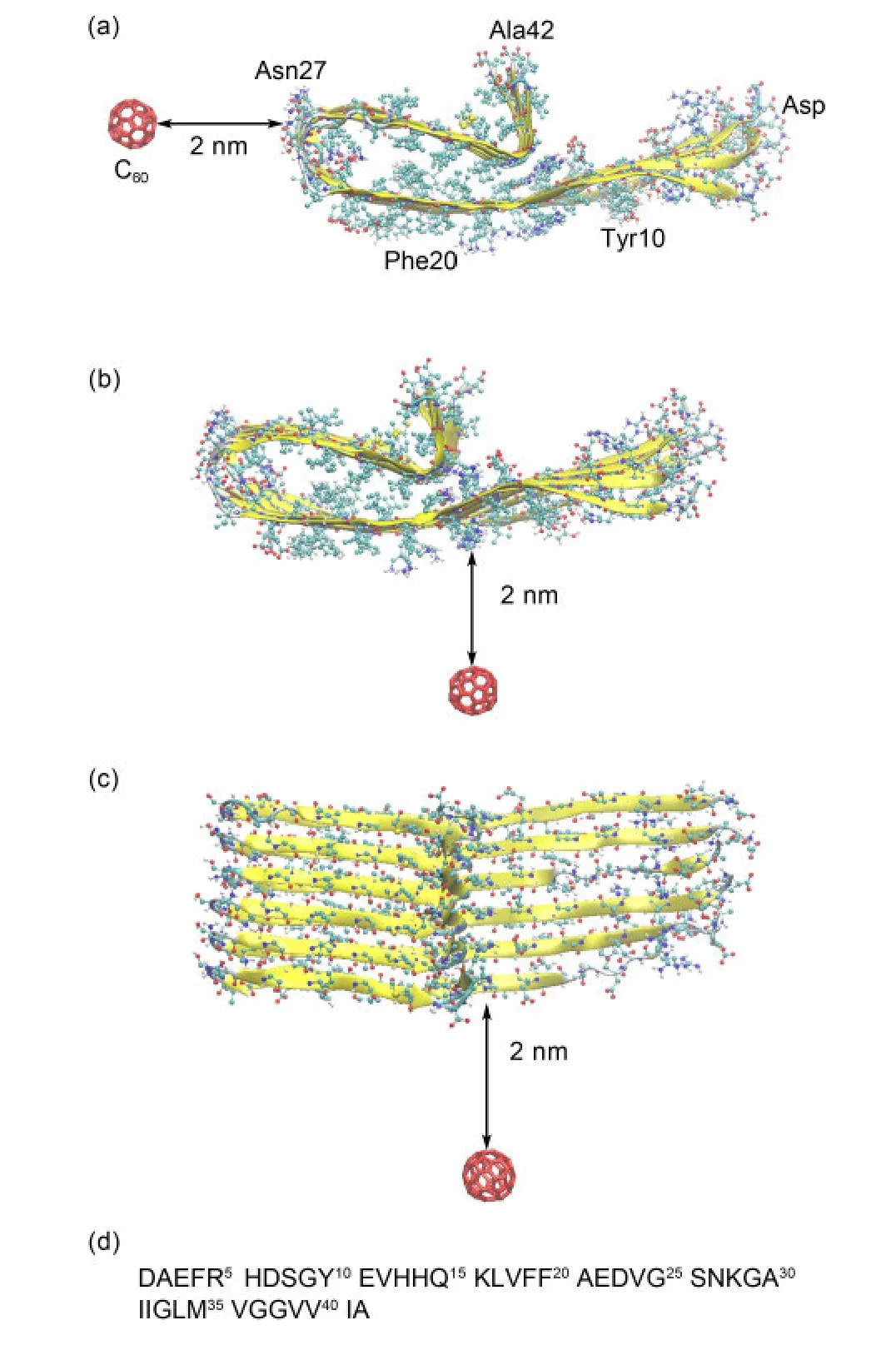
圖1 Aβ42六聚體與富勒烯模擬體系的三種初始結構Fig.1 Three different initial conformations of Aβ42 hexamer-fullerene system
本文中的分子模擬選取Aβ42和富勒烯C60分子作為研究體系,見圖1.其中多肽體系選取1-42全長Aβ的六聚體,其序列見圖1(d).Aβ的聚集體具有多種形貌,實驗上通過各種手段已經獲得若干種Aβ的聚集體結構.所有結構均具有U turn形狀且鏈間平行β片結構的共性,但細節卻存在差異.13如N端部分的結構,有些工作認為N端的若干殘基處于無規構象,12,34而另一些工作則解出N端具有結構特征,35,36這種多結構與淀粉樣多肽聚集形貌的多樣性是吻合的.本文中采用了Ma和Nussinov36于2006年提出的Aβ1-42結構,該結構的特征是Aβ的N端的1-16號殘基形成β片結構,而17-42號殘基的結構則與Luhrs等12的結果相似.我們選取了該結構的六聚體作為研究對象.相對于富勒烯分子,多肽體系的尺寸可以近似認為是無限長的原纖維.C60的結構和參數則使用Roccatano等37于2011年得到的結果.
為了消除初始構象對模擬采樣的影響,我們選取了三種不同的初始狀態,見圖1中(a-c).三種初始構象中,多肽的初始結構完全相同,C60與多肽體系的最近距離均為2 nm,但放在了不同的位置.在初始構象(c)中,C60放置于Aβ的生長軸方向,而(a,b)中則位于與(c)方向垂直的平面內.水盒子的邊界設為2 nm,由于模擬采取了周期邊界條件,C60位于相反方向的初始構象也可以被考慮在內.從每個初始構象出發,進行了10條模擬,共計30條.作為對照組,沒有C60的純多肽體系也單獨進行了相同條件的模擬.
2.2 分子動力學模擬細節及分析方法
本工作使用全原子層次的分子動力學模擬(MD)及顯式水模型.所有的模擬均采用Gromacs 4.5.3軟件包38計算,多肽體系選用GROMOS 43a1力場39參數,溶液分子則使用簡單點電荷(SPC)模型.40靜電計算使用了Particle-Mesh-Ewald(PME)方法,41靜電及范德華作用的截斷半徑分別為0.9和1.4 nm,因此初始構象中多肽和C60之間沒有直接相互作用.蛋白體系及溶液分子的鍵長分別使用LINCS算法42及SETTLE算法43加以約束,故積分步長設為2 fs.整個模擬過程中,溫度始終保持310 K,壓強為一個標準大氣壓.由于不同的模擬中多肽與C60結合的過程不同,因此模擬的時間也各不相同.所有的模擬都在二者緊密結合不再分開后至少延長5 ns,故模擬時間從10 ns到40 ns不等,詳情見后,而對照組的多肽體系則模擬了50 ns.
所有的軌跡均采用VMD軟件仔細加以觀察監測.所有的分析均采用AmberTool2013工具包44內提供的工具完成,結合位點的分析統一采用每條軌跡中C60結合多肽后的最后5 ns軌跡.二級結構傾向性(SSP)分析采用DSSP算法;45而分子的溶劑可及表面積(SASA)使用Connolly46提出的方法.Cluster構象分析則使用Averagelinkeage算法,47對應的代表結構均為cluster分析方法得到的代表構象(Representative structure).在所有的分析中,水分子均已剔除.
為了計算富勒烯的結合能,我們運用了分子力學-泊松波爾茲曼表面積(MM-PBSA)方法,并使用廣義Born模型(GB model)方法計算溶劑化效應.48MM-PBSA計算方法見下述公式(1).體系的結合能ΔG等于復合物自由能Gcomplex減去對應單體的自由能Gligand和Greceptor,故結合能包括(見下面公式(2)):真空中的范德華相互作用能ΔEvdW和靜電能ΔEcoul、極性和非極性溶劑化自由能(ΔGGB,ΔGsurf)以及振動熵ΔS的貢獻.在模擬中,由于富勒烯上的碳原子不帶電,故第二項靜電能為零;第三項通過GB方法計算得到,而第三項與第四項之和則為總的溶劑化效應.Amber的MM-PBSA方法中計算振動熵的算法并不適用于本工作的體系,44且以前類似的工作中也略去這一項的貢獻,33故本文中不予考慮.所有力場參數均被轉化為Amber格式以保持一致,并利用idecomp方法計算了每個殘基對結合能的貢獻.49
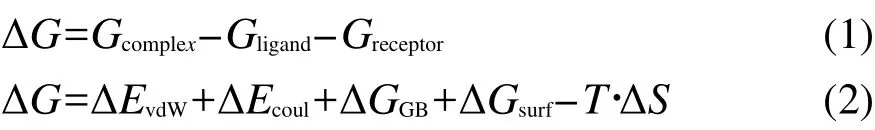
3 結果與討論
3.1 結合的動力學過程
在所有的模擬中,不論是否存在C60,Aβ的主鏈β結構均沒有發生嚴重破壞,絕大多數主鏈間氫鍵在模擬的過程中保持穩定.在所有的模擬中,富勒烯經過不同的時間,最終均能夠到達多肽表面,并且與其緊密結合.在我們的工作中,當富勒烯與多肽重原子之間的最近距離小于0.4 nm(略大于兩個碳原子的vdW半徑之和)并持續1 ns以上時,認為富勒烯已結合在多肽上.圖2展示了不同軌跡中二者結合所需的時間.為了便于對比,此圖中將不同軌跡按照結合所需時間的長短進行了排序.可以看出不同的模擬中,結合所需的時間差別很大,從約1 ns到大于30 ns不等.圖2中三種不同線型的曲線分別表示不同的初始構象,可以看出結合的時間與系統的初始構象沒有關系.這從一個方面說明我們的模擬采樣較好.
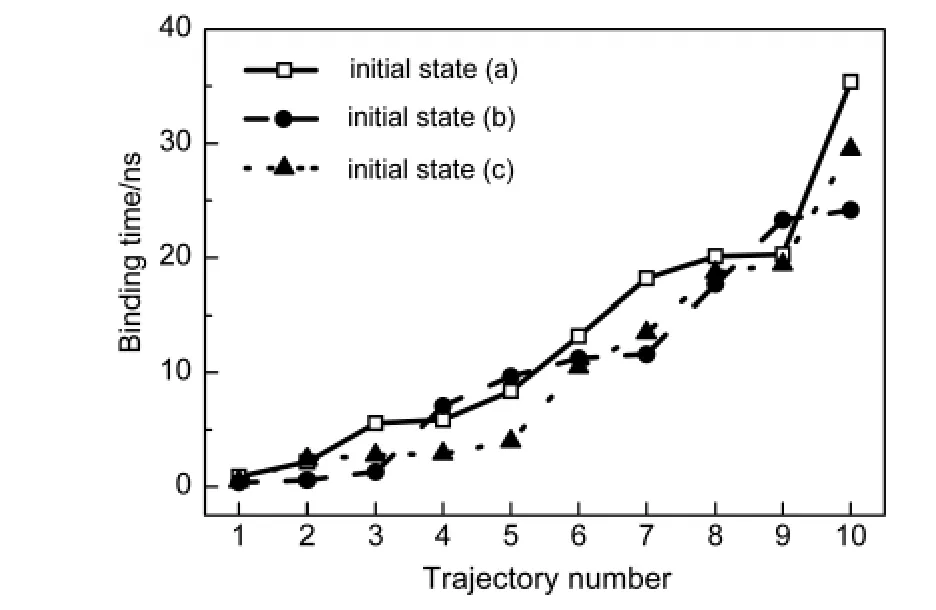
圖2 不同模擬軌跡中C60結合到Aβ多肽上所用的時間Fig.2 Time for fullerene binding to Aβ hexamer in different simulated trajectories
通過觀察所有的模擬軌跡,發現C60在靠近多肽的初期,會在其表面發生小幅度的滾動,有時還可以離開多肽.經過若干次的嘗試過程,最終C60將到達某個位置與蛋白緊密結合.一旦到達這種結合狀態,富勒烯的運動幅度將大大降低,通常只能在附近0.5 nm的幅度內搖擺,不會再離開多肽表面.圖3展示了兩條不同的模擬軌跡中系統的構象變化(a,b)及對應軌跡中C60與多肽最近原子之間的距離.我們分別計算了多肽與富勒烯復合物體系(實線)和多肽(虛線)的均方根偏差(RMSD),而參考結構為最后5 ns模擬的cluster聚類代表結構.可以看出多肽的結構一直處于平均約0.3 nm的漲落之中;整個體系的均方根偏差在開始時變動幅度較大,而在后半段中則與代表多肽的紅線幾乎重合,這說明結合前C60在不斷移動,而結合后則穩定在其結合位點附近,只發生很小幅度的漲落.而從圖3(c,d)中可以看出,在最終結合前,富勒烯分子可以不止一次地靠近多肽,并且再次離開.這說明C60在蛋白表面的結合是具有選擇性的,不夠好的結合位置將被拋棄.在所有的模擬中,這種緊密結合狀態至少可以穩定存在5 ns.我們從每個初始構象隨機選擇一條軌跡,在其結合到多肽之后,繼續延長30 ns的模擬,結果顯示在這個時間尺度內C60仍然不會離開多肽表面.因此我們認為達到了這種穩定結合態后,系統的狀態將趨于平衡,結合位點不會再發生大幅度變化,將該結合位置定義為C60結合的一個位點.這說明一定時間長度的模擬即可表征這種結合態,下文中針對結合態的分析均基于穩定結合后的最后5 ns數據.
3.2 結合位點的分類及結合能
本工作的關注點之一為采用分子動力學模擬的方法研究富勒烯與Aβ的結合位點,此外,兩者的結合機制也是研究的重點.將所有30條模擬的結合態中C60每個時刻的質心位置計算出來,一起顯示在多肽表面,結果見圖4.圖中多肽結構選取的是對照組中50 ns模擬的cluster中心結構,而每個C60的質心則用一個紫色點顯示.可以看出結合位點具有下述特征.首先,結合位點并非隨機分布在多肽表面,而是集中在某幾類區域;其它位置則很少出現或完全沒有.如Aβ的核心疏水區(CHC)17-21號殘基、βturn位置附近(22-30號殘基)、C端的纖維生長方向上等.這意味30個結合位點可以歸為有限的幾類.我們根據C60結合位置附近的氨基酸序號,將其分為如下6類位點:N-terminal 1-5位點、Y10-H14位點、CHC位點(16KLVFFA21)、Turn 24-26位點、Turn 27-31位點、C-terminal位點等.另有2條軌跡中的結合位置只出現了一次,分別位于F4H6附近及N端7號氨基酸附近,故不予歸類而統稱others.所有類型的結合位點均在圖4中用箭頭標明.此處CHC位點與前人得到的結果是一致的,而由于對方使用的Aβ結構中N端1-16號殘基并非β結構的緣故,其N端區域的位點與我們的結果沒有可對照性.33
圖3 Aβ-fullerene體系的均方根偏差及Aβ和C60最小距離(d min)隨時間演化Fig.3 Time evolution of RMSD ofAβ-fullerene complex and the minimum distance between Aβ and C60(d min)
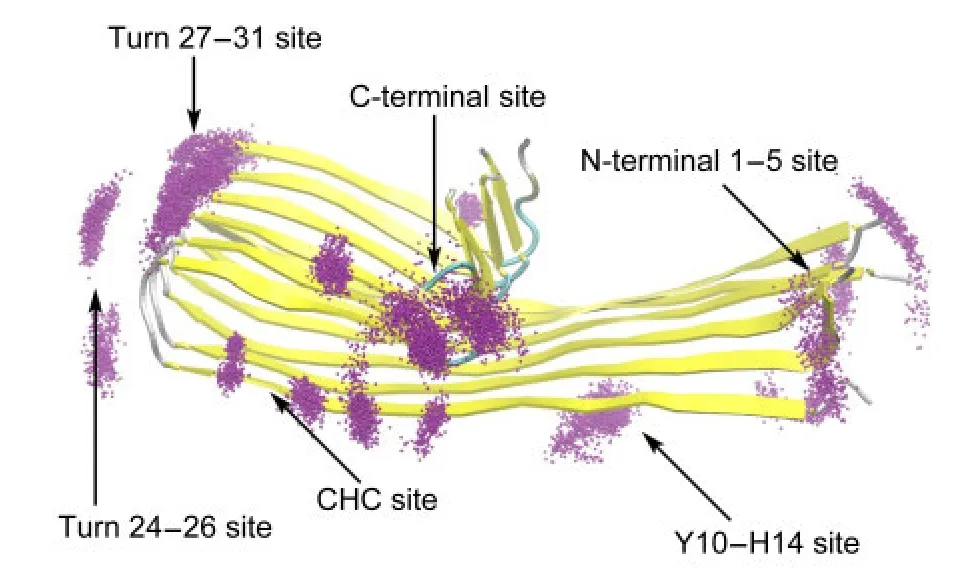
圖4 所有的結合位點上C60的質心位置分布Fig.4 Positions of fullerene′s mass center at all binding sites
其次,結合位點的分布表明了結合位點的振動范圍.在多數模擬軌跡中,C60的擺動幅度極小,如CHC位點及C-terminal位點;而N-terminal位點看似擺動幅度較大,實則是多肽末端自身的振動所導致的,故該位點實際的擺動幅度與CHC位點類似;有趣的是Turn端兩個位點及Y10-H14位點,富勒烯的晃動幅度明顯高于其它位點.C60的擺動方向沿著纖維的生長方向,由于淀粉樣聚集體結構中的重復性,當其擺動時,C60在肽鏈間的相同位置平移,這種平移運動并不需要克服大的能量勢壘.
另外,通過觀察所有軌跡,發現除一條軌跡外,幾乎不存在結合后結合位置跨位點的移動.在僅有的一個例外中,觀察到富勒烯從C-terminal位點緩慢轉移到了CHC位點,并穩定于此.考慮到C-terminal位點與CHC位點在空間位置上距離較近,這一結果并不意外.沒有出現大規模的跨位點轉移行為一方面說明了位點分類的合理性,另一方面也暗示各個結合位點之間存在一定的能量勢壘,C60想要從一個結合的好的位置通過表面滾動到達另一個較好的位點,要跨越的能量代價較大,故極少觀察到這種現象.
為了進一步理解各個結合位點之間的差異,同時分析各種相互作用在結合機制中所起的作用,我們計算了所有位點的結合能,結果見表1.在所有的位點中,范德華作用對于穩定結合起主導作用,而因為設定所有C60上的碳原子電荷為零,故二者間沒有直接靜電作用項.溶劑的效應由GB作用(ΔGGB)和表面能(ΔGsurf)共同構成,總值大于零,這與富勒烯的強疏水性是吻合的.從總的結合能可以看出結合最強的兩個位點為Turn 27-31和CHC位點;其它類的兩個位點的結合能也較強.N-terminal、Y10-H14及C-terminal這三個位點的結合能則很接近,Turn 24-26位點最弱.另外結合能的均方差較小,這表明每個位點分類中的各個軌跡之間的結合能相近,從另一個方面再次論證了位點分類的合理性.在前人的工作中,33CHC位點是結合能最強的位點,這與我們的結論是基本吻合的,而數值上的不同則歸因于所使用的力場之間的巨大差異.
為了進一步驗證模擬不受初始構象的影響,我們將三種初始構象所得到各個結合位點的數量列出,結果見圖5,可以看出從不同初始構象出發能得到同一個位點,從同一個初始構象出發可得到多類位點,說明結合位點對初始構象的依賴性不大.這進一步說明了模擬采樣的結果較好.
3.3 富勒烯對Aβ42核心疏水區間結構的影響
Kim和Lee32的實驗工作中觀測到了C60對Aβ聚集有抑制效果.因此我們的目的并非僅限于分析結合位點,而是期望能夠理解其抑制聚集的機制.他人的模擬工作中,限于分子對接方法的局限性,并不能全面回答這一問題.33在我們的模擬工作中雖然沒有看到C60大規模破壞Aβ結構的現象,然而,在CHC位點的一條軌跡中,我們觀察到了富勒烯擠入CHC位置附近疏水口袋的趨勢.為了更加詳細地研究這個現象,我們將CHC位點的五條模擬軌跡在C60結合后延長了20 ns.如圖6(a-d)所示,當碳球結合到CHC位點后,碳球逐漸擠入兩層β片之間,與位于從F19到I32的整個β-turn區域的氨基酸均有或多或少的接觸,尤其是側鏈方向朝向內部的F19、A21、K28、A30及I32,并降低這一帶殘基二級結構的穩定性.通過分析碳球的溶劑可及表面積,可以發現C60在~1.5 ns時結合到該位點,之后富勒烯通過不斷調整位置,擠入多肽CHC區域,期間伴隨著其SASA的變化,最后溶劑可及表面積穩定在約1.2 nm2,如圖6(e)中的紅線所示.可見富勒烯確實有擠入Aβ結構內部的趨勢.從圖6(c,d)中可以看出,在20和30 ns時C60對多肽turn端結構的破壞作用大于10 ns時的,turn處的幾個殘基偏離附近的多肽而靠向富勒烯分子.并非所有CHC位點均存在這種現象,通過計算另外四條CHC位點軌跡中C60的SASA(圖6(e)中的藍、黑、灰、綠線),可以看出其它模擬中C60的SASA在結合后保持穩定,并沒有顯著降低趨勢.

表1 富勒烯在每個位點的結合能Table 1 Binding energy of fullerene at each binding site

圖5 從不同初始構象出發得到的各結合位點軌跡數目Fig.5 Counts of trajectories leading to different binding sites,starting from different initial states
這一鉆孔現象為我們提供了一種抑制聚集機制的可能解釋:即由于CHC位點上氨基酸的疏水性,多肽能與C60之間產生極佳的結合性.當C60結合到該位點時,擠入該疏水口袋會提供更好的疏水匹配,減少疏水表面積,從而提高溶劑分子的構象熵.且二者之間的結合很緊密,因此不會大幅度降低側鏈間的疏水堆積效應.考慮到CHC區域對Aβ聚集的關鍵作用,50C60擠入這一位置將會對原纖維的生長產生阻礙效應.
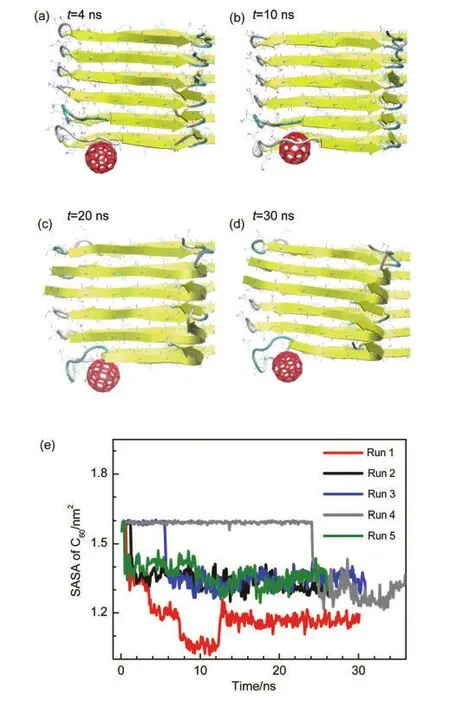
圖6 C60擠入Aβ原纖維核心疏水區域的趨勢Fig.6 Tendency for C60to insert into the CHC region of Aβ protofibril
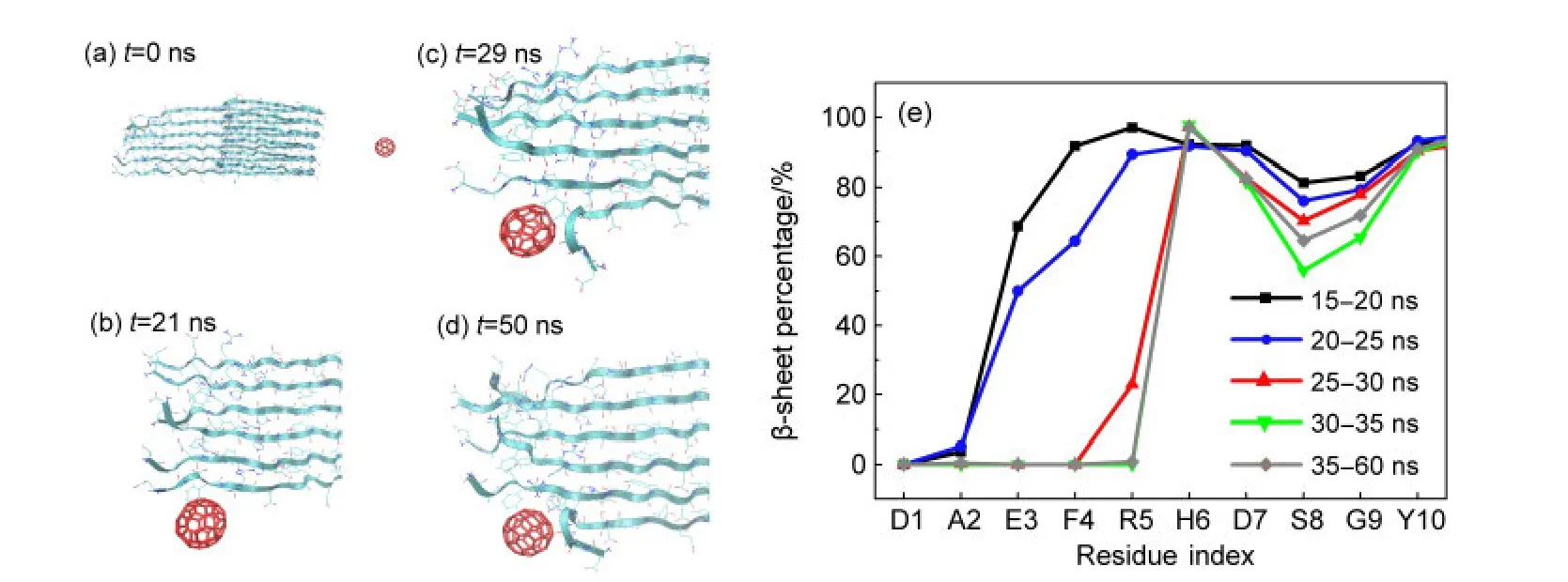
圖7 C60對Aβ蛋白N端β片結構的破壞Fig.7 Disruption of the β-sheet structure of Aβ peptides′N-terminal region by C60
3.4 富勒烯對蛋白N端二級結構的破壞
在所有三十條模擬中,沒有觀察到大幅度的Aβ二級結構破壞.然而在N-terminal位點的某條軌跡中,發現了富勒烯對Aβ結構的局部破壞現象,其結果見圖7.其中圖7(a-d)展示了不同時刻系統的構象,在t=21 ns時,C60開始結合到該位點,此時2-6號的氨基酸仍然保持其β二級結構;隨著時間演進,C60將Aβ最外側的鏈逐漸拉開,一個個的破壞其鏈間的主鏈氫鍵,從而破壞其β結構,從t=29 ns時刻可以看到這種破壞作用已經開始發生,對氫鍵有了一定程度的破壞.為了進一步觀察這種破壞效應,將該模擬延長了30 ns,結果發現這個時間尺度內破壞效應沒有進一步增加的趨勢.圖7(e)中展示了最外側Aβ1-10號殘基的β片百分比隨時間的變化,在尚未有直接作用前,3-10號殘基均以β片構象為主,而富勒烯與多肽結合后,3-5號殘基的β片依次隨時間降低,最終完全破壞;而7-9號殘基的β結構亦略有下降.而在30-60 ns時間段,β結構沒有顯著的變化.
這一β結構破壞過程完整地展示了一種富勒烯破壞Aβ聚集體結構的機制:首先結合至Aβ聚集體生長面的N端殘基,進而與N端殘基的鏈間氫鍵競爭,逐步破壞氫鍵,拉開β片;破壞幾個氫鍵后,就擠入兩條肽鏈之間,阻止氫鍵的復原.由于Aβ自身結構的穩定性和短模擬時間的局限性,模擬尚不能采樣到破壞整條Aβ的二級結構的事件,這可能與模擬中所采用的富勒烯的低濃度有關,在實驗中,當C60的濃度很低時,其抑制聚集的效果亦不顯著.可以推想隨著富勒烯濃度的增高,多個C60會同時結合到這一位點,必將大大增強對主鏈氫鍵的破壞作用,同時多個C60的結合可以更有效地阻止β結構的復原.這一抑制機制很可能與上節中CHC位點的機制相輔相成,從不同路徑破壞Aβ自身的結構穩定性,從而發揮其抑制聚集的效應.
3.5 富勒烯在淀粉樣纖維表面的溝槽滾動機制
由于淀粉樣纖維中結構單元的重復性,聚集蛋白或多肽能夠形成具有周期性的表面形貌.當某些位置的氨基酸主鏈及側鏈處于一種特定的構象時,將形成沿著生長軸方向的溝槽,其大小恰好可以容納富勒烯分子.我們在Aβ42聚集體表面的Turn 27-31位點和Y10-H14位點觀察到了這一溝槽,見圖8(a,c).在Turn 27-31位點N27、K28及G29的主鏈形成一個很好的彎曲,配合N27指向外側的側鏈,恰好產生一個能夠容納C60的弧形區域.由于G29、A30都是沒有側鏈或側鏈很小的殘基,且甘氨酸具有很強的主鏈構象柔性,故這一位置主鏈的柔軟和側鏈的缺失為形成半徑合適的溝槽提供了很好的幫助.而在Y10-H14位點,則通過指向兩側的Y10和V12的側鏈形成這一溝槽,H14的側鏈則從旁輔助.Y10與V12均具有很強的疏水性,且Y10的側鏈芳香環能夠與富勒烯直接接觸,通過芳香環堆積作用形成較強的相互作用,故這一位點的溝槽更多的是靠側鏈的疏水作用及特異相互作用實現的.
通過觀察模擬軌跡,發現在這兩個位點的模擬中,C60的晃動幅度比其它位點要大,可以在同一氨基酸位置從鏈二到鏈五來回擺動,從圖4位點分布中可以證實這一點,在這兩個位點大量紫色的點沿著纖維生長方向排布在多肽表面,形成狹長的帶狀分布,而與其它位點的質心分布形式大不相同.為了進一步分析這種溝槽內的滾動現象,我們分析了每個殘基所有位點的平均結合能,見圖8(e),其中紅色的區域表示結合能強,藍色則反之.可以看出在Y10-H14及N27-I31殘基位置形成了獨特的縱向帶狀條紋.為了便于理解,圖8(b)和(d)中將對應位點附近每個殘基按照其平均結合能著色,對應氨基酸的側鏈已標明.一個有趣的現象是在這兩個位點中,處于中部的肽鏈對應殘基的結合能強于兩側末端肽鏈,這表明位于這一溝槽內的富勒烯滾動時,將不傾向于到達末端而是偏好于停留在中部.末端這一能量勢壘將阻止C60從纖維的中部跨越到生長面上,從而隔離開這兩個位點與生長面上的位點,如CHC和C-terminal位點.
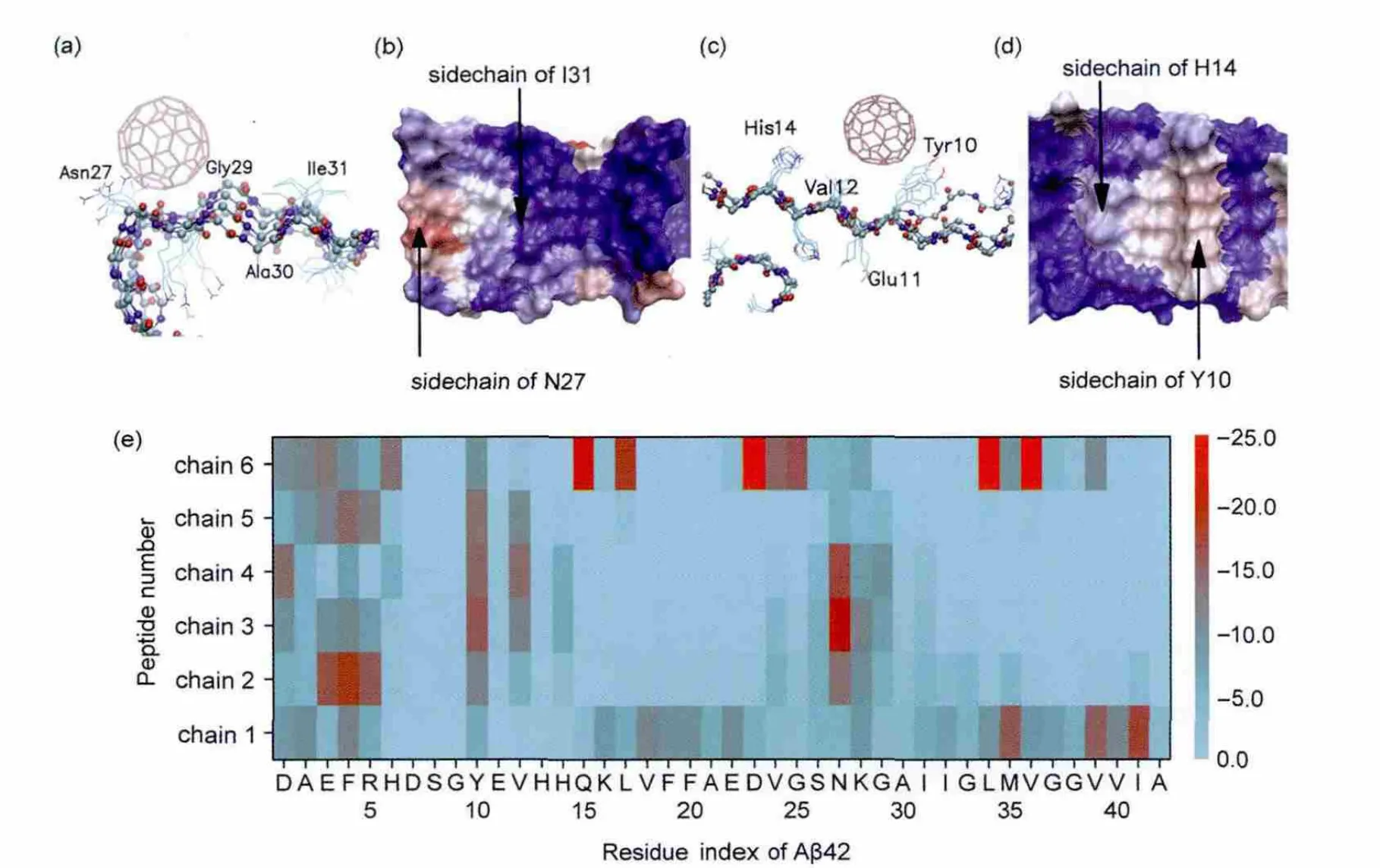
圖8 C60結合到Aβ原纖維表面的溝槽部位的傾向Fig.8 Tendency of C60binding to the groove on the surface of Aβ protofibril
這種沿著蛋白表面溝槽滾動的現象是淀粉樣聚集蛋白所獨有的特征;因為只有周期重復性的結構,才能形成可延伸的重復側鏈排布,從而形成這種溝槽.C60作為典型的完全對稱的球狀小分子,在周期性側鏈形成的表面溝槽內滾動時,幾乎不存在能量勢壘,從而能夠很輕易地移動.考慮到所有的淀粉樣聚集蛋白均能在表面形成或多或少的各種半徑的溝槽,這一特殊的“溝槽滾動機制”具有普遍意義,并在預測其它聚集多肽與碳球類衍生物的聚集行為及結合位點時提供一定的幫助.
4 結論
本工作采用分子動力學模擬系統地研究了富勒烯在Aβ42聚集體表面的結合過程,并得到了多類結合位點.C60與Aβ的結合并不是隨機的,而是在經歷一系列嘗試過程后,最終找到某個穩定的結合位點.絕大多數情況下結合后C60將穩定在結合位點附近,而某幾類位點中富勒烯能夠沿著纖維生長軸方向大幅度滾動.共得到六類主要結合位點,其中CHC位點及Turn 27-31位點具有最強的結合穩定性.二者之間的結合通過范德瓦爾斯相互作用穩定,而溶劑化效應則起相反作用.
在兩個位點中觀察到了C60對Aβ二級結構的破壞.其一位于核心疏水區域,C60具有擠入多肽兩片β片中間的趨勢,從而降低附近殘基的β結構穩定性,這一位點不但在前人的結果中也發現過,并且早已被認為對聚集過程具有重要作用;其二位于N端末尾,C60能夠破壞纖維生長端Aβ的3-5號殘基的主鏈氫鍵,從而破壞其β片結構,這一直接破壞過程對于理解富勒烯抑制Aβ聚集機制提供了很好的解釋.實際過程中兩種機制很可能相輔相成,共同發揮抑制聚集的作用.
另外,發現了富勒烯與淀粉樣多肽聚集體結合的一種特殊機制,即溝槽滾動機制.由于淀粉樣聚集體的結構重復性,蛋白表面沿纖維生長方向能形成特定形貌的溝槽,而富勒烯因其結構的對稱性,能夠在槽內滾動.這一機制有助于預測富勒烯在其它淀粉樣肽聚集體表面的結合位點及其結合行為.
(1)Chiti,F.;Dobson,C.M.Annu.Rev.Biochem.2006,75,333.doi:10.1146/annurev.biochem.75.101304.123901
(3)Selkoe,D.J.Physiol.Rev.2001,81,741.
(4)Selkoe,D.J.Jama-J.Am.Med.Assoc.2000,283,1615.doi:10.1001/jama.283.12.1615
(5)Blennow,K.;de Leon,M.J.;Zetterberg,H.Lancet 2006,368,387.doi:10.1016/S0140-6736(06)69113-7
(6)Selkoe,D.J.Nature 1999,399,A23.
(7)Hardy,J.;Selkoe,D.J.Science 2002,297,353.doi:10.1126/science.1072994
(8)LaFerla,F.M.;Green,K.N.;Oddo,S.Nat.Rev.Neurosci.2007,8,499.doi:10.1038/nrn2168
(9)Reinhard,C.;Hebert,S.S.;De Strooper,B.Embo.J.2005,24,3996.doi:10.1038/sj.emboj.7600860
(10)Finder,V.H.;Glockshuber,R.Neurodegener.Dis.2007,4,13.doi:10.1159/000100355
(11)Rauk,A.Chem.Soc.Rev.2009,38,2698.doi:10.1039/b807980n
(12)Luhrs,T.;Ritter,C.;Adrian,M.;Riek-Loher,D.;Bohrmann,B.;Doeli,H.;Schubert,D.;Riek,R.Proc.Natl.Acad.Sci.U.S.A.2005,102,17342.doi:10.1073/pnas.0506723102
(13)Tycko,R.Annu.Rev.Phys.Chem.2011,62,279.doi:10.1146/annurev-physchem-032210-103539
(14)Straub,J.E.;Thirumalai,D.Annu.Rev.Phys.Chem.2011,62,437.doi:10.1146/annurev-physchem-032210-103526
(15)Walsh,D.M.;Selkoe,D.J.J.Neurochem.2007,101,1172.doi:10.1111/j.1471-4159.2006.04426.x
(16)Ma,K.;Clancy,E.L.;Zhang,Y.B.;Ray,D.G.;Wollenberg,K.;Zagorski,M.G.J.Am.Chem.Soc.1999,121,8698.doi:10.1021/ja990864o
(17)Peralvarez-Marin,A.;Barth,A.;Graslund,A.J.Mol.Biol.2008,379,589.doi:10.1016/j.jmb.2008.04.014
(18)Liu,F.F.;Dong,X.Y.;Sun,Y.Acta.Phys.-Chim.Sin.2010,26,1643.[劉夫鋒,董曉燕,孫 彥.物理化學學報,2010,26,1643.]doi:10.3866/PKU.WHXB20100613
(19)Saraiva,A.M.;Cardoso,I.;Pereira,M.C.;Coelho,M.A.;Saraiva,M.J.;Mohwald,H.;Brezesinski,G.ChemBioChem 2010,11,1905.doi:10.1002/cbic.201000237
(20)Bitan,G.;Kirkitadze,M.D.;Lomakin,A.;Vollers,S.S.;Benedek,G.B.;Teplow,D.B.Proc.Natl.Acad.Sci.U.S.A.2003,100,330.doi:10.1073/pnas.222681699
(21)Cabaleiro-Lago,C.;Quinlan-Pluck,F.;Lynch,I.;Dawson,K.A.;Linse,S.ACS Chem.Neurosci.2010,1,279.doi:10.1021/cn900027u
(22)Cummings,J.L.New Engl.J.Med.2004,351,56.doi:10.1056/NEJMra040223
(23)Kolosnjaj,J.;Szwarc,H.;Moussa,F.Toxicity Studies of Fullerenes and Derivatives.In Bio-Applications of Nanoparticles;Springer:New York,2007;p 168.
(24)Geckeler,K.E.;Samal,S.Polym.Int.1999,48,743.doi:10.1002/(SICI)1097-0126(199909)48:9<743::AID-PI246>3.0.CO;2-4
(25)Jensen,A.W.;Wilson,S.R.;Schuster,D.I.Bioorgan.Med.Chem.1996,4,767.doi:10.1016/0968-0896(96)00081-8
(26)Li,C.X.;Mezzenga,R.Nanoscale 2013,5,6207.doi:10.1039/c3nr01644g
(27)Todorova,N.;Makarucha,A.J.;Hine,N.D.M.;Mostofi,A.A.;Yarovsky,I.PLoS Comput.Biol.2013,9(12),e1003360.
(28)Podolski,I.Y.;Podlubnaya,Z.A.;Kosenko,E.A.;Mugantseva,E.A.;Makarova,E.G.;Marsagishvili,L.G.;Shpagina,M.D.;Kaminsky,Y.G.;Andrievsky,G.V.;Klochkov,V.K.J.Nanosci.Nanotechnol.2007,7,1479.doi:10.1166/jnn.2007.330
(29)Huang,H.M.;Ou,H.C.;Hsieh,S.J.;Chiang,L.Y.Life Sciences 2000,66,1525.doi:10.1016/S0024-3205(00)00470-7
(30)Guo,J.;Li,J.;Zhang,Y.;Jin,X.;Liu,H.;Yao,X.Plos One 2013,8,e65579.
(31)Zuo,G.;Zhou,X.;Huang,Q.;Fang,H.;Zhou,R.J.Phys.Chem.C 2011,115,23323-23328.doi:10.1021/jp208967t
(32)Kim,J.E.;Lee,M.Biochem.Biophys.Res.Commun.2003,303,576.doi:10.1016/S0006-291X(03)00393-0
(33)Andujar,S.A.;Lugli,F.;Hofinger,S.;Enriz,R.D.;Zerbetto,F.Phys.Chem.Chem.Phys.2012,14,8599.doi:10.1039/c2cp40680b
(34)Petkova,A.T.;Yau,W.M.;Tycko,R.Biochemistry 2006,45,498.doi:10.1021/bi051952q
(35)Lu,J.X.;Qiang,W.;Yau,W.M.;Schwieters,C.D.;Meredith,S.C.;Tycko,R.Cell 2013,154,1257.doi:10.1016/j.cell.2013.08.035
(36)Ma,B.Y.;Nussinov,R.Curr.Opin.Chem.Biol.2006,10,445.doi:10.1016/j.cbpa.2006.08.018
(37)Hezaveh,S.;Samanta,S.;Milano,G.;Roccatano,D.J.Chem.Phys.2011,135(16),164501.doi:10.1063/1.3643417
(38)Hess,B.;Kutzner,C.;van der Spoel,D.;Lindahl,E.J.Chem.Theory Comput.2008,4,435.
(39)van Gunsteren,W.F.;Billeter,S.;Eising,A.;Hünenberger,P.H.;Krüger,P.;Mark,A.E.;Scott,W.;Tironi,I.G.Biomolecular Simulation:the GROMOS96 Manual and User Guide;Vdf Hochschulverlag AG an der ETH Zürich:Zürich,1996.
(40)Berendsen,H.;Postma,J.;Van Gunsteren,W.;Hermans,J.Intermolecular Forces 1981,11,331.
(41)Darden,T.;York,D.;Pedersen,L.J.Chem.Phys.1993,98,10089.doi:10.1063/1.464397
(42)Hess,B.;Bekker,H.;Berendsen,H.J.;Fraaije,J.G.J.Comput.Chem.1997,18,1463.doi:10.1002/(SICI)1096-987X(199709)18:12<1463::AID-JCC4>3.0.CO;2-H
(43)Miyamoto,S.;Kollman,P.A.J.Comput.Chem.1992,13,952.doi:10.1002/jcc.540130805
(44)Case,D.A.;Darden,T.A.;Cheatham,T.E.,III;Simmerling,C.L.;Wang,J.;Duke,R.E.;Luo,R.;Walker,R.C.;Zhang,W.;Merz,K.M.;Roberts,B.P.;Wang,B.;Hayik,S.;Roitberg,A.;Seabra,G.;Kolossvai,I.;Wong,K.F.;Paesani,F.;Vanicek,J.;Liu,J.;Wu,X.;Brozell,S.R.;Steinbrecher,T.;Gohlke,H.;Cai,Q.;Ye,X.;Wang,J.;Hsieh,M.J.;Cui,G.;Roe,D.R.;Mathews,D.H.;Seetin,M.G.;Sagui,C.;Babin,V.;Luchko,T.;Gusarov,S.;Kovalenko,A.;Kollman,P.A.AMBER 11;University of California:San Francisco,2010.
(45)Kabsch,W.;Sander,C.Biopolymers 1983,22,2577.doi:10.1002/bip.360221211
(46)Connolly,M.L.J.Appl.Crystallorg.1983,16,548.doi:10.1107/S0021889883010985
(47)Shao,J.Y.;Tanner,S.W.;Thompson,N.;Cheatham,T.E.J.Chem.Theory Comput.2007,3,2312.
(48)Onufriev,A.;Bashford,D.;Case,D.A.J.Phys.Chem.B 2000,104,3712.
(49)Kopitz,H.;Zivkovic,A.;Engels,J.W.;Gohlke,H.ChemBioChem 2008,9,2619.doi:10.1002/cbic.200800461
(50)Tjernberg,L.O.;N?slund,J.;Lindqvist,F.;Johansson,J.;Karlstr?m,A.R.;Thyberg,J.;Terenius,L.;Nordstedt,C.J.Biol.Chem.1996,271,8545.doi:10.1074/jbc.271.15.8545

