體外循環術后腎血流搏動指數與急性腎損害的相關性研究*
劉 慧,付 勇,李明星△,廖 斌,陳曉梅,于風旭,鄧明彬,李 新
(瀘州醫學院附屬醫院:1.超聲診斷科;2.心胸外科,四川瀘州 646000)
急性腎損害(acute kidney injury,AKI)是體外循環手術(cardio pulmonary bypass,CPB)常見并發癥,研究表明體外循環手術結束當時對腎功能影響已經存在[1-2]。血清肌酐(Crea)和尿素氮(Urea)是目前臨床常用的腎功能參考指標,但在腎損害早期,血尿素氮、肌酐值通常增高不明顯,只有腎實質嚴重損害,血尿素氮、肌酐濃度才會急劇升高,因此不能反映早期的腎功能損害[3]。應用彩色多普勒超聲檢測腎血流,存在無創、實時等優點。本院通過運用彩色多普勒血流顯像(color doppler flow imaging,CDFI)技術測量腎主動脈、段動脈的血流搏動指數(pulsatility index,PI),探討其與CPB術急性腎損害的可能關系,為體外循環術后AKI的發生提供及時、可靠的診斷依據。
1 材料與方法
1.1 實驗儀器 生化試劑(西門子試劑),真空采血管(金典生化器材有限公司),塑料離心管(盛邦實驗器材有限公司),eppendorf微量可調移液器(德國),安必潔醫用超聲耦合劑(重慶安碧捷生物技術有限公司),Stockert SⅢ型體外循環機(德國),白洋X5型臺式離心機(北京),α7型彩色多普勒超聲儀(日本ALOKA),全自動生化分析儀(西門子ADVIA2400),微量注射泵(泰爾茂),心電監護儀(邁瑞醫療電子有限公司),冷凍冰箱(海爾公司),麻醉呼吸機(德爾格)。
1.2 納入標準 31例心臟病患者納入研究對象,所有患者術前經腎功能Urea、尿酸(UA)、Crea檢測無異常,經術前彩色多普勒超聲檢測無腎、輸尿管結石,無腎積水、腎囊腫、腎動脈狹窄、腎臟占位病變。據急性腎損傷網絡(acute kidney injury network,AKIN)對于 AKI的診斷及分級[4],最終將14例術后腎功能滿足AKI標準患者納入研究。本研究通過瀘州醫學院附屬醫院倫理委員會批準。該組患者先心病矯治術2例,瓣膜置換術11例,冠脈搭橋術1例,年齡(44.86±18.94)歲,體質量(50.21±17.65)kg,主動脈阻斷時間(1.35±0.54)h,體外循環時間(1.76±0.61)h,手術時間(4.23±0.55)h。
1.3 體外循環手術及術后處置 常規體外循環手術下行瓣膜置換術、先心病矯治術、冠脈搭橋術。患者術后均ICU治療,呼吸機輔助呼吸,有創動脈及心電監護,視患者循環及心功能狀況給予多巴胺3~8μg·kg-1·min-1、多巴酚丁胺3~8μg·kg-1·min-1、腎上腺素升壓0.05~0.2μg·kg-1·min-1、硝普鈉0.3~1.0μg·kg-1·min-1,強心、改善微循環治療。
1.4 血液標本采集及檢測 于術前、術后1、2、4、8、16、24h行血液標本采集并離心分離血漿凍存備用。應用全自動生化分析儀對血漿標本進行Urea、UA、Crea指標檢測。
1.5 彩色多普勒超聲檢測 使用ALOKA-prosoundα7彩色多普勒超聲診斷儀,探頭使用中心頻率為3.0Hz,調整儀器設置,總增益為100,根據不同患者調整到最合適深度,但是每一個患者術前及術后所調整的深度保持一致,根據計算血流速度的公式V=fdc/2f0cosθ可以看出,角度小于30°時,對血流速度的影響最小,所以在實驗過程中保持聲束與血流方向夾角小于30°[5-6]。在腎門部測量腎主動脈,腎竇部測量腎段動脈,均測量3次后取平均值,并且盡量在術后每個時間點的數據采集時與術前所測量的位置保持一致,減少由于測量手法及選擇測量部位的不同造成的測量誤差,脈沖多譜勒法測量左、右腎主動脈、腎段動脈PI。所有超聲圖像存盤,并應用超聲儀器軟件系統進行圖像數據分析。整個研究中使腎臟圖像清晰顯示。所有對象均由同一人操作,術前腎主動脈、段動脈血流檢測如圖1、2。
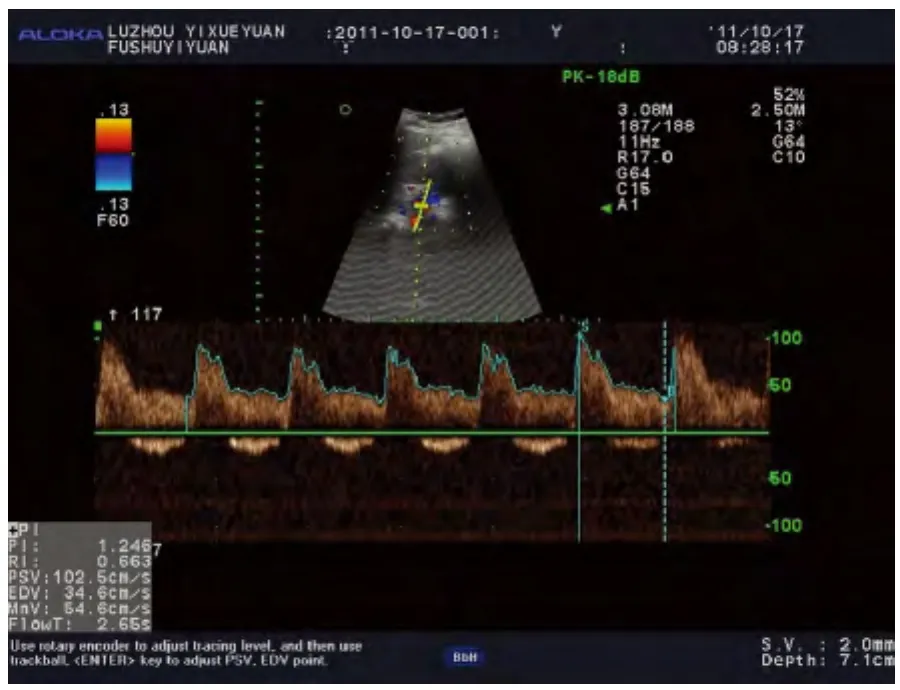
圖1 術前腎主動脈血流頻譜
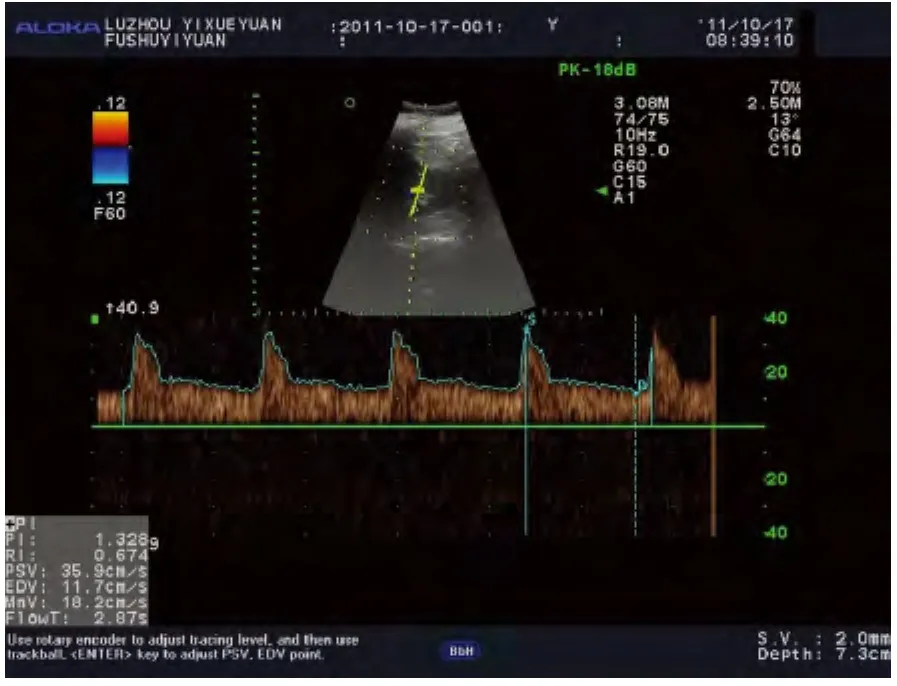
圖2 術前腎段動脈血流頻譜
1.6 統計學處理 用SPSS Statistics17.0統計軟件對數據進行統計,將左右腎動脈血流參數合并計算,取其均值代表每例患者的血流參數。數據均采用表示;兩組間比較采用t檢驗,以P<0.05為差異有統計學意義;變量間相互關系采用直線相關與直線回歸分析,計算相關系數r值及回歸方程,以P<0.05為差異有統計學意義。
2 結 果
2.1 腎功能比較 通過對患者術前、后各時間點腎功能Urea、UA、Crea指標進行比較,各指標較術前均增高(表1)。
2.2 腎血流PI比較 通過對患者術前、后各時間點腎血流指標PI進行比較,結果見表2。
2.3 腎功能與腎血流PI直線相關與回歸分析
表1 各時點腎功能指標比較±s,μmol/L)
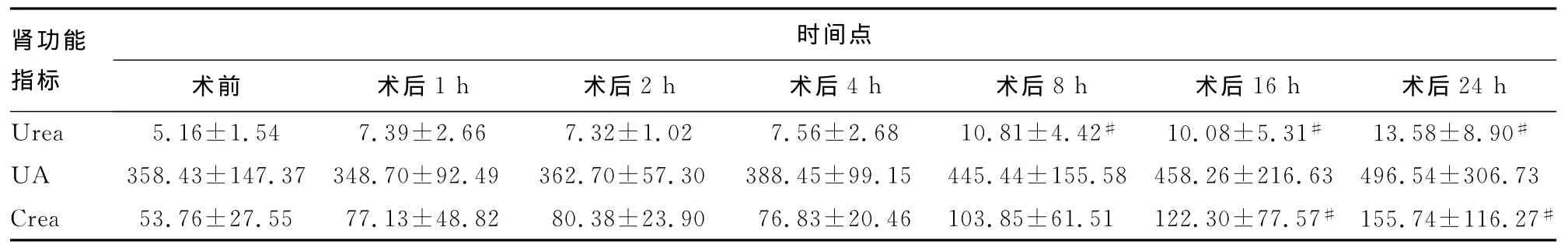
表1 各時點腎功能指標比較±s,μmol/L)
#:P<0.05,與術前比較。
24h Urea 5.16±1.54 7.39±2.66 7.32±1.02 7.56±2.68 10.81±4.42# 10.08±5.31# 13.58±8.90腎功能指標時間點術前 術后1h 術后2h 術后4h 術后8h 術后16h 術后#UA 358.43±147.37 348.70±92.49 362.70±57.30 388.45±99.15 445.44±155.58 458.26±216.63 496.54±306.73 Crea 53.76±27.55 77.13±48.82 80.38±23.90 76.83±20.46 103.85±61.51 122.30±77.57# 155.74±116.27#
表2 各時點腎血流PI改變比較±s,μmol/L)
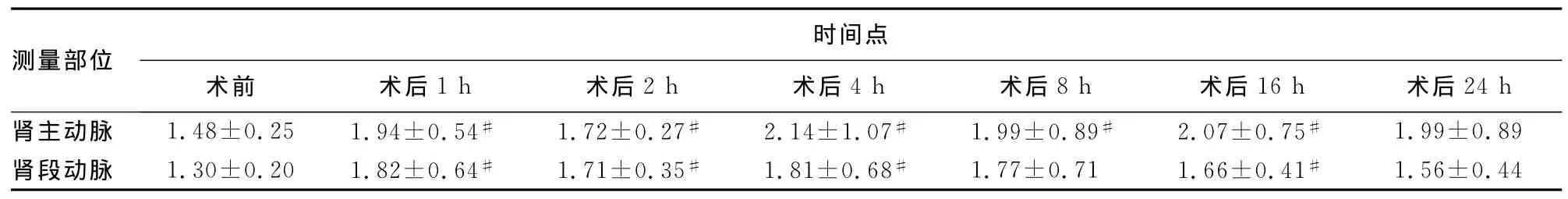
表2 各時點腎血流PI改變比較±s,μmol/L)
#:P<0.05,與術前相比較。
測量部位24h腎主動脈 1.48±0.25 1.94±0.54# 1.72±0.27# 2.14±1.07# 1.99±0.89# 2.07±0.75#時間點術前 術后1h 術后2h 術后4h 術后8h 術后16h 術后1.99±0.89腎段動脈 1.30±0.20 1.82±0.64# 1.71±0.35# 1.81±0.68# 1.77±0.71 1.66±0.41#1.56±0.44
2.3.1 直線相關性分析 腎主動脈PI與Urea呈正相關(r=0.499,P<0.05),PI與 UA呈正相關(r=0.561,P<0.05),PI與Crea呈正相關(r=0.561,P<0.05);腎段動脈PI與 Urea呈正相關(r=0.497,P<0.05),PI與 UA 呈正相關(r=0.503,P<0.05),PI與Crea呈正相關(r=0.591,P<0.05)。
2.3.2 直線回歸分析 (1)針對各組將Urea指標作為應變量Y,以腎主動脈的PI作為自變量X,進行直線回歸分析,直線回歸方程分別為:Y=3.083 X+2.665,腎段動脈PI作為自變量X,進行直線回歸分析,直線回歸方程分別為:Y=3.799 X+1.945;(2)針對各組將UA指標作為應變量Y,以腎主動脈的PI作為自變量X,進行直線回歸分析,直線回歸方程分別為:Y=124.903 X+174.890,以腎段動脈PI作為自變量X,進行直線回歸分析,直線回歸方程分別為:Y=144.048 X+152.591;(3)針對各組將Crea指標作為應變量Y,以腎主動脈的PI作為自變量X,進行直線回歸分析,直線回歸方程分別為:Y=41.219 X+7.976,以腎段動脈的PI作為自變量X,進行直線回歸分析,直線回歸方程分別為:Y=56.057 X-9.155。
3 討 論
體外循環手術時,小兒體循環灌注流量為1.20~1.25L·min-1·m-2,成人體循環灌注壓一般需要維持在60~80 mm Hg,灌注壓反應了血容量、有效灌注流量、血管阻力三者之間的密切關系,過低的灌注壓均會造成組織灌注不足,尤其對于缺血敏感的腎臟,可能造成腎損害。研究表明CPB術后發生AKI與CPB低灌注壓以及低灌注壓持續時間相關,當平均動脈壓<60mm Hg,CPB對腎功能潛在性影響較明顯[7],CPB時間大于90min腎功能損害頻率增加;Passaroni等[8]研究認為,體外循環手術結束當時對腎功能影響已經存在,甚至發展為急性腎功能衰竭。
腎血流搏動指數PI=(PSV-EDV)/MNV[9],該指標可作為反映動脈某一橫斷面的順應性和血流彈性阻力,能對腎實質損害的程度進行客觀的評價。通過對高血壓患者腎動脈血流指數研究,發現隨著患者高血壓病情進展,血肌酐和尿酸水平升高,腎血流PI值也增高,且與血肌酐和尿酸呈正相關,表明該指標能較好的反應血液動力學改變和血管的順應性變化[9-10]。Cicoira等[11]通過對慢性腎功能衰竭患者6個月的隨訪發現腎血流PI是腎功能下降的獨立預測指標。
在本實驗中通過患者術前、后腎血流PI的檢測,腎血流PI值術后的16h較較術前均有明顯增高,并且術后4h增高最為明顯,腎功能Urea、Crea改變分別發生在術后8h和16 h。術后腎血流改變表明腎在低灌注后,存在腎血管順應性的改變,CDFI檢測其PI升高,可能存在腎血流灌注下降;腎血流恢復灌注后腎功能受損仍短時間未得到恢復,表現為Urea、Crea進行性的增高,與PI存在相關性,但Urea、Crea水平明顯增高主要發生在術后16、24h,通過PI與腎功能直線回歸相關分析,腎主動脈、段動脈PI與腎功能指標存在較高相關。這些可能與腎血管早期發生的傳入血管擴張傳出血管收縮的病理生理改變有關,通過這種代償機制,以保持在低心排血量和低血流量條件下,保持腎濾過壓、濾過分數以提高和保護腎血流和腎小球濾過率。這種代償機制在輕到中度低心輸出量狀態下,能夠對腎功能起保護作用;在這種情況下腎功能主要依賴于心輸出量和腎血流,在心輸出量嚴重降低的情況下,腎血流代償失衡,結果腎功能不全便出現[11],表現為患者Urea、Crea水平明顯增高主要發生在術后16、24h。腎脈沖壓力升高,入球小動脈壓力和腎血管阻力上升腎血流量和腎小球濾過率下降,這有助于解釋腎損害患者早期具有較高的PI值[12]。
本實驗中腎功能Urea、Crea改變分別發生在術后8h和16h,而腎血流PI值在術后1h即發生明顯改變,表明該檢測指標較腎功能指標改變在AKI的發生中出現變化更早。淺低溫低灌注對腎血流PI存在影響,尤其PI值大于1.49表明腎損害已經存在[13-14]。通過腎血流PI的檢測能夠反應早期腎損害,兩者存在明顯的正相關[15]。通過本實驗,可以看出彩色多普勒超聲作為一種無創檢測PI手段,與腎功能改變存在明顯相關性,能為早期AKI的發生提供可靠的診斷依據。
[1]Passaroni AC,Silva MA,Martins AS,et al.Use of nefidipine and acute kidney injury incidence in postoperative of myocardial revascularization surgery with cardiopulmonary bypass[J].Rev Bras Cir Cardiovasc,2010,25(1):32-37.
[2]Mariscalco G,Lorusso R,Dominici C,et al.Acute kidney injury:a relevant complication after cardiac surgery[J].Ann Thorac Surg,2011,92(4):1539-1547.
[3]Fischer UM,Weissenberger WK,Warters RD,et al.Impact of cardiopulmonary bypass management on postcardiac surgery renal function[J].Perfusion,2002,17(6):401-406.
[4]Wamock DG.Towards a definication and classification of acute kidney injury[J].J Am Soc Nephrol,2005,16(11):3149-3150.
[5]楊平亮,戴雙波,宋海波,等.經食管超聲監測心血管術中腎血流的應用研究[J].四川大學學報:醫學版,2009,40(1):166-169.
[6]Yang PL,Wong DT,Dai SB,et al.The feasibility of measuring renal blood flow using transesophageal echocardiography in patients undergoing cardiac surgery[J].Anesth Analg,2009,108(5):1418-1424.
[7]Kanji HD,Schulze CJ,Hervas-Malo M,et al.Difference between pre-operative and cardiopulmonary bypass mean arterial pressure is independently associated with early cardiac surgery-associated acute kidney injury[J].J Cardiothorac Surg,2010,5:71.
[8]Passaroni AC,Silva MA,Martins AS,et al.Use of nefidipine and acute kidney injury incidence in postoperative of myocardial revascularization surgery with cardiopulmonary bypass[J].Rev Bras Cir Cardiovasc,2010,25(1):32-37.
[9]Adibi A,Ramezani M,Mortazavi M,et al.Color Doppler indexes in early phase after kidney transplantation and their association with kidney function on six month follow up[J].Adv Biomed Res,2012,1:62.
[10]胡慶鷹,崔煒,吳格日勒,等.彩色多普勒超聲檢查腎動脈阻力指數、搏動指數的研究進展[J].影像與介入,2009,6(23):76-77.
[11]Cicoira M,Conte L,Rossi A,et al.Renal arterial pulsatility predicts progression of chronic kidney disease in chronic heart failure patients[J].Int J Cardiol,2013,167(6):3050-3051.
[12]Bonapace S,Rossi A,Cicoira M,et al.Aortic distensibility independently affects exercise tolerance in patients with dilated cardiomyopathy[J].Circulation,2003,107(12):1603-1608.
[13]譚麗玲,陳志軍,劉俊,等.腎血流灌注指數評價腎功能的價值[J].山東醫藥,2012,52(23):53-54.
[14]Radermacher J,Mengel M,Ellis S,et al.The renal arterial resistance index and renal allograft survival[J].N Engl J Med,2003,349(2):115-124.
[15]Alwaidh MH,Cooke RW,Judd BA.Renal blood flow velocity in acute renal failure following cardiopulmonary bypass surgery[J].Acta Paediatr,1998,87(6):644-649.

