不同氮水平對中美山楊幼苗生物量、氮濃度及其季節變化的影響1)
李海霞,周志軍,張建瑛,邢亞娟
(黑龍江省林業科學研究所,哈爾濱150081)
氮素既是植物生長最重要的結構物質,又是植物生理代謝中最活躍、無處不在的重要物質—酶的主要成分[1],所以氮素對植物生理代謝和生長有重要作用。它的供應量及其有效性制約著林木的生長速度及生長狀態,比其他任何一種營養元素更能限制植物的生產力[2-3]。在氮養分脅迫條件下,植物能夠通過自身調節使植物做出形態和生理上的適應性反應,以增加其在脅迫條件下的生存機會[4]。
中美山楊(PopulusdavidianaandP.tremuloides)是我國東北地區最重要的用材樹種之一,本文以中美山楊幼苗為試驗材料,研究不同供氮水平對中美山楊幼苗根、莖、葉生物量分配以及氮濃度隨季節變化的影響,進一步明確不同供氮水平對中美山楊生長的影響機制。
1 材料與方法
1.1 材料來源
本試驗所用苗木為兩年生的中美山楊播種苗,試驗在溫室中進行。
1.2 試驗設置
2012年4月將供試苗木根部用清水漂洗后,用0.5%高錳酸鉀溶液消毒,再用蒸餾水漂洗3次。然后分別移至裝有河砂的缽中栽培,每缽植苗1株。幼苗供給如下全營養液:4 mmol/L NH4NO3、1 mmol/L KH2PO4、1 mmol/L KCl、1 mmol/L CaCl2·6H2O、0.6 mmol/L MgSO4·7H2O、0.021 mmol/L FeCl3·6H2O、6μmol/L MnCl2·4H2O、0.016 mmol/L H3BO3、0.3μmol/L ZnCl2、0.3μmol/L CuCl2·2H2O、0.3 μmol/L Na2MoO4·2H2O,必要時用Ca(OH)2或H2SO4把pH值調整到5.5~6.0。5月末進行不同濃度的梯度處理。
在氮濃度處理中設置如下4個濃度,括號中為相應處理表示符號:1mmol/L(N1)、4 mmol/L (N4)、8 mmol/L (N8)、16 mmol/L (N16),通過調節NH4NO3濃度來實現,(其中N8為正常供氮濃度),每個處理均為5株。在進行氮濃度處理時,其他營養成分不變。每3天澆1次營養液,每次每缽澆50 mL,澆灌營養液在8:00~9:00進行。每日8:00~9:00和17:00~18:00分2次澆水,每次每缽約100 mL[5]。
1.3 測定指標與方法
對中美山楊幼苗進行季節性取樣測定,7~9月份每月取樣1次,共3次。每次每處理隨機挑選3株苗木進行全株收獲,測定根、莖和葉的鮮重,然后置于75℃烘箱里烘干至恒質量,分別測出干質量。將每株樣品的根、莖和葉粉碎,3株作為3個重復,采用濃H2SO4-H2O2消煮,過濾,定容,用multiN/C2100s碳氮分析儀測定全氮含量。
2 結果與分析
2.1 氮濃度處理下中美山楊幼苗各部分生物量及其分配
生物量是光合產物積累的結果,氮的供應狀況明顯影響著植物對碳同化物質的分配格局。不同氮濃度處理明顯影響中美山楊幼苗生物量的累積。由表1可見,7月份采樣時,各個氮處理下幼苗根、莖和葉生物量均隨N供給濃度的增加而增加,在高N供應下達最大,這三者導致了單株總生物量在高N供應下最大,為7.76g/株,8月份,各個N處理下的幼苗莖和葉生物量均隨N供給濃度的增加而增加,在高N供應下達最大,由于根的生物量在N8下最大,導致單株總生物量在適量供氮下最大,為9.98g/株,超過N8水平總生物量稍有下降,為9.85g/株,下降了1.3%。9月份隨著供N濃度的增加,中美山楊葉的生物量逐漸增加,供N濃度為8mmol/L時達到最大,為2.62g/株,比供N不足時(1.78 g/株)增加了47.1%。莖生物量在供N不足時(1mmol/L)值最小,為2.57g/株,并隨著供N水平的增加而增加,在供N濃度為16mmol/L時達最大,為3.94g/株,增加了53.31%。葉和莖導致地上部分在供N為8mmol/L時最大,為6.15 g/株,但當超過正常供N時,地上生物量又變小(5.75 g/株),減少了6.5%。而根的變化有所不同,在供N濃度4mmol/L時達最大,為6.88 g/株。葉、莖和根這3個器官生物量的變化最終導致幼苗全株總生物量在1~16mmol/L的供N范圍內隨供N水平增加而增加,在16mmol/L時達最大,比低N供應增加了11.22%。
在不同季節,中美山楊各部分生物量分配比例不同。從7月份到9月份,分配到葉中的生物量比例逐漸降低,平均降低了12.5%,而根系的生物量比例N1和N4逐漸增加,N8和N16有所降低,總體上平均增加了3.75%。研究認為,根系和葉片的生長具有相關性[6],葉片作為碳的“源”,向根系提供碳和代謝所需的能量,而根系為地上部分提供養分和水分。
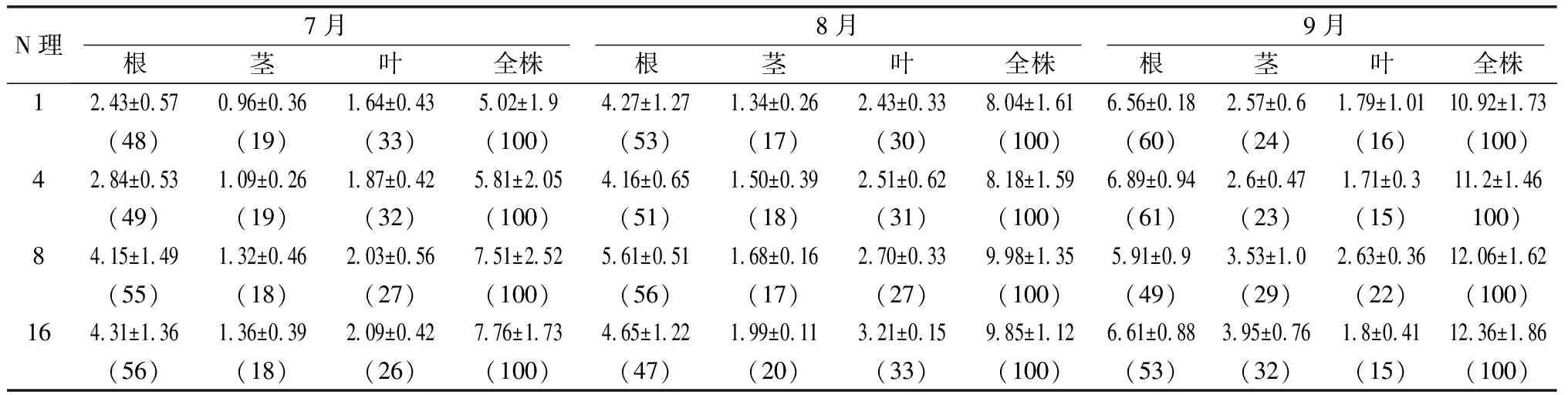
表1 不同N處理下山楊幼苗根、莖、葉和全株生物量及其分配 g
2.2 氮濃度處理下中美山楊根、莖、葉中的全氮濃度
2.2.1 氮濃度處理下中美山楊根系中的全氮濃度
氮是諸礦物質養分中限制植物生長最嚴重的大量元素之一,它直接限制著森林生產力。Jones[7]認為植物根系的氮吸收能力與根系內部含量負相關,當土壤養分含量非常豐富或者施肥量過高時,葉片和根系的氮含量與土壤養分供給量不成正比,但當土壤養分成為限制性資源時,根系養分含量和葉片養分含量也相應降低。
不同氮處理下中美山楊幼苗根系全氮濃度變化情況如圖1。在整個生長階段,隨供氮水平提高,山楊幼苗根系中全氮濃度也明顯提高,7、8、9月份不同處理間根系全氮濃度差異均呈顯著水平(P值分別為0.00,0.00和0.00)。7月份和9月份在高N水平(16mmol/L)下根系氮濃度達到最大,分別為11.36mg/g和14.48mg/g,8月份則在正常供N下達最大為10.19mg/g。8月份不同處理下根系全氮濃度變幅為6.45~10.19 mg/g,高低相差1.5倍,9月份變幅為7.07~14.49mg/g,高低相差2.05倍。說明越到生長后期,不同處理之間差別越大。
從不同生長階段來看,從7月份到9月份中美山楊根系氮濃度持續上升,在生長末期氮濃度平均達到生長初期的1.16倍,說明隨著苗木的生長,根系中氮在不斷的積累,濃度加大。根系是樹木生長發育過程中最重要的營養器官,也是養分貯藏的重要器官,在生長末期大量的養分轉移到根系中貯藏[8-9]。
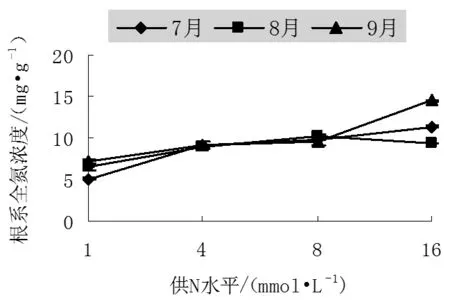
圖1 不同氮處理下中美山楊幼苗根系中全氮濃度
2.2.2 氮濃度處理下中美山楊莖中的全氮濃度
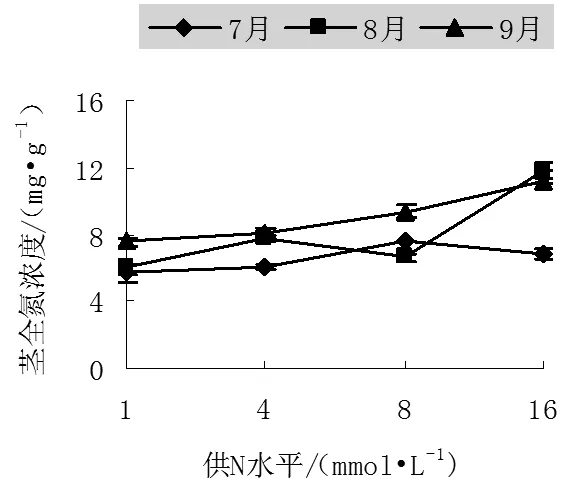
圖2 不同氮處理下中美山楊幼苗莖中全氮濃度
不同季節山楊莖中全氮濃度表現為7月份不同處理之間變化不明顯,8月份和9月份均是在高N處理下達最大,分別為11.7mg/g和11.21mg/g,比N1分別增加了95.01%和48.4%,N16是N1的1.98和1.48倍,這說明越到生長后期,不同處理間的差別越小,也就是說輸送到地上部分的養分逐漸減少。
2.2.3 氮濃度處理下中美山楊葉片中的全氮濃度
葉片的光合作用是森林生產力的主要實現者。當養分供給速度降低時,單位重量葉片氮含量顯著降低,并導致葉片光合能力顯著降低[10]。增加土壤中的養分含量通常可改善葉片氮狀態,并由此而提高葉片的光合作用。從試驗的結果來看,不同供N濃度處理下山楊幼苗葉中全氮濃度差異顯著,隨著供N水平的增加,葉中全氮濃度增加,均在高N處理(N16)下達最大,其中7月份為18.32mg/g、8月份為17.22mg/g、9月份為20.17mg/g,比N1分別增加了39.73%、33.99%和45.38%。
不同季節葉片全氮濃度也有一定的變化。幼苗生長初期,N4處理下全氮濃度較高,8月份各個處理下全氮濃度相對于7月份有所下降,而到了生長末期(9月份)除了N4外其余各處理葉片中全氮濃度增加,N1、N8、N16比生長初期提高了1.06、1.05、1.1倍。
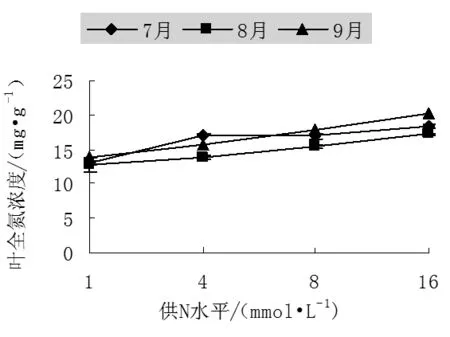
圖3 不同氮處理下中美山楊幼苗葉中全氮濃度
3 討論
3.1 氮素供應對幼苗生物量分配的影響
在自然條件下,土壤中的礦質營養有限或有效性較低,通常限制樹木的生長發育。因此,在氮缺乏的土壤環境中,增加這些營養供應會促進樹木生長。在本試驗中,7月份和9月份幼苗總生物量均出現在高氮供應下,8月份幼苗生物量出現在適量供氮水平下。供N濃度增加能夠提高山楊總生物量和各部分生物量,但各部分生物量比例會發生變化。
3.2 氮素供應對幼苗體內養分含量的影響
植物體內在一定環境下,植物的養分吸收量取決于根系的供應量和植物器官的生長和行使正常功能對養分的需要量[11]。H?gberg等[12]認為,當土壤養分含量非常豐富或者施肥量過高時,葉片和根系的養分含量與土壤養分供給量不成正比。但是,當土壤養分成為限制性資源時,根系養分含量和葉片養分含量相應降低。
本試驗發現,中美山楊體內養分濃度與外界養分供應濃度有著密切關系。總體來看,山楊根莖葉對外部養分供應狀況反應都比較敏感,供氮濃度降低時,根、莖、葉中的全氮濃度也降低。隨供氮水平的增加,葉片全氮濃度顯著上升,8月份與氮水平呈正相關(r=0.992),整個生長季均是在高氮水平下最大。
[1]趙平,孫谷疇,彭少麟.植物氮素營養的生理生態學研究[J].生態科學, 1998(2).
[2]Cassman K G, Kropf M J, Gaunt J, et al. Nitrogen use efficiency of rice reconsidered: what are the key constraints? [J] Plant Soil, 1993, 155/156:359-362.
[3]Crawford N M, Glass A D M. Molecular and physiological aspects of nitrate uptake in plants [J]. Trends in plant Science, 1998, 3: 389-395.
[4]李春儉,張福鎖.營養脅迫及其適應性反應的調節//馮鋒,張福鎖,楊新泉.植物營養研究-進展與展望[A].北京:中國農業大學出版社,2000.
[5]李海霞,李正華,戴偉男,等.氮磷水平對中美山楊幼苗碳氮積累與分配的影響[J].西南林業大學學報,2013,33(3):8-14.
[6]Hendricks JJ, Nadelhoffer KJ, Aber JD. Assessing the role of fine roots in carbon and nutrient cycling [J]. Trends Ecol Evol, 1993, 8:174-178.
[7]Jones, H.E., Hogberg, P., and Ohlsson, H.Nutrient assessment of a forest fertilization experiment in northern Sweden by root bioassays [J]. Forest Ecology and Management, 1991, 64:59-69.
[8]沈善敏,宇萬太,張璐,等.楊樹主要營養元素內循環及外循環研究Ⅰ.落葉前后各部位養分濃度及養分貯量變化[J].應用生態學報,1992,3(4):296-301.
[9]沈善敏,宇萬太,張璐,等.楊樹主要營養元素內循環及外循環研究Ⅱ.落葉前后各部位養分在植株體內外的遷移和循環[J].應用生態學報,1993,4(1):27-31.
[10]Carswell F. E., J.Grace, M.E.Lucas and Jarvis P.G. Interaction of nutrient limitation and elevated CO2 concentration on carbon assimilation of a tropical tree seedling (Cedrelaodorata) [J].Tree Physiology.2000, 20:977-986.
[11]Lauchli A, Bieleski RL.張禮中,毛知耘譯.植物的無機營養[M].北京:農業出版社,1992:104-106.
[12]Peter H?gberg, Lars H?gbom, and Helga Schinkel.Nitrogen-related root variables of trees along an N-deposition gradient in Europe [J]. Tree Physiology, 1998, 18:823-828.

