bcl-2、bag-1與老年大腸癌患者的關系
劉亞莉 鄭紀寧 陳 龍 申興彬
(承德醫(yī)學院基礎學院護理學院,河北 承德 067000)
大腸腺瘤屬癌前病變,與大腸癌密切相關〔1〕。大腸癌發(fā)病與飲食結構、腸道慢性炎癥、遺傳、大腸腺瘤等因素有關〔2〕。本研究觀察老年大腸癌、大腸腺瘤患者組織中bcl-2、bag-1的表達及其在大腸癌的轉移、發(fā)展中的相互關系。
1 資料與方法
1.1研究對象 2008~2013年我院手術治療并經術后病理證實的35例大腸腺瘤標本,50例大腸癌標本。另外,選取30例大腸癌或大腸腺瘤手術患者的正常大腸黏膜標本作為對照組。術前都沒有接受任何的抗腫瘤治療。3組臨床資料均無統(tǒng)計學差異(P均>0.05)。見表1。
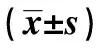
表1 3組患者臨床信息比較
1.2研究方法 使用免疫組化SP法測定bag-1、bcl-2表達。bag-1、bcl-2抗體、試劑盒均由福州邁新生物公司提供。標本全部采用10%甲醛溶液固定,用石蠟包埋,按4 μm行連續(xù)切片,行SP法免疫組化染色,染色之前的標本切片需通過抗原修復處理,一抗冷凍過夜,行二氨基聯(lián)苯胺(DAB)顯色及蘇木素復染。陽性判斷標準:用10×40倍光鏡隨機觀察視野5個,每個視野觀察100個細胞。bag-1染色陽性是胞質和胞核呈棕黃色,陽性細胞比例>10%為陽性(+)。bcl-2染色胞質棕黃色為染色陽性,染色陽性細胞比例>5%稱為陽性(+)〔3〕。
1.3統(tǒng)計學方法 采用SPSS19.0軟件進行t檢驗、χ2檢驗。
2 結 果
2.13組bag-1、bcl-2表達差異 3組bag-1、bcl-2陽性表達率差異顯著(P<0.01),見表2。

表2 3組bag-1、bcl-2陽性表達差異(n)
2.2bag-1、bcl-2陽性表達與大腸癌病理特征相關性 bag-1的陽性表達與分化程度顯著相關(P=0.008),且分化越低,其陽性表達率越高;bag-1與Duke分期也明顯相關(P=0.012)。bcl-2陽性表達與分化程度顯著相關(P=0.010),分化越低,其陽性表達率越高,而與Duke分期無明顯相關性(P=0.064)。見表3。

表3 bag-1、bcl-2陽性表達與大腸癌病理特征相關性(n)
3 討 論
本研究說明bcl-2蛋白過表達是發(fā)生大腸癌的早期表現(xiàn),這與Sinicrope等〔4〕研究結果相一致。提示bcl-2蛋白作為一種抑制細胞凋亡的基因,其表達過度可以延長細胞的壽命,延長已經遭遇DNA受損的細胞的生存期,來增加其他基因的突變機會,比如p53基因的點缺失和突變,ras基因突變,以致腫瘤的出現(xiàn)〔5〕。且Watson等〔6〕發(fā)現(xiàn),只要大腸腺癌轉變?yōu)橄侔蜁饾u丟失了bcl-2的表達,抑制凋亡的能力減弱,細胞凋亡相對增強,這時細胞增殖就會明顯占有優(yōu)勢,腫瘤能夠生長,此結果與本組研究相近。本研究還證實bcl-2表達的變化,與大腸癌的分化程度明顯相關,而與Duke分期并無顯著關系,此與Watson等〔6〕的研究結果相一致。
bag-1基因的重要功能可能是:Hsc70/Hsp70肽結合區(qū)域與bag-1的C-末端的BAG區(qū)域相結合,蛋白底物與高表達的Hsc70/Hs70ATP酶區(qū)相互作用進而促進細胞增殖〔7〕。此外,它可以激活Raf-1蛋白信號級聯(lián)途徑來調節(jié)細胞的增殖信號,還可以跟酪氨酸的激酶受體(如血管內皮生長因子、肝細胞生長因子等)、細胞核的激素受體結合,通過調整功能來促發(fā)腫瘤。在正常組織中,bag-1幾乎不表達,但是在大腸癌、前列腺癌、乳腺癌中均存在陽性表達〔8〕。從正常的大腸黏膜,到大腸腺瘤的發(fā)生及發(fā)展的過程中,bag-1異常表達起到了一定的作用;在大腸黏膜從良性轉化為惡性的過程中,bag-1的高表達參與其中,此與Takayama等〔9〕的實驗結果相符。本研究表明bag-1的高表達參與了腫瘤發(fā)展過程,從而表明bag-1蛋白的高表達抑制凋亡,促進細胞的增殖增強腫瘤細胞轉移的能力〔10〕。因此,bag-1蛋白的高表達可以作為預測大腸癌的轉移潛能及不良預后的一項新的生物學的指標。Takayama等〔9〕認為許多腫瘤抗細胞凋亡的機制是由bcl-2和bag-1的高表達引發(fā)的。bag-1雖不屬于bcl-2的家族成員,但卻可以上調bcl-2功能,其與bcl-2結合成復合物,增強抗凋亡能力。
4 參考文獻
1Prasad S,Yadav VR,Sung B,etal.Ursolic acid inhibits growth and metastasis of human colorectal cancer in an orthotopic nude mouse model by targeting multiple cell signaling pathways:chemosensitization with capecitabine〔J〕.Clin Cancer Res,2012;18(18):4942-53.
2Citronberg J,Bostick R,Ahearn T,etal.Effects of ginger supplementation on cell-cycle biomarkers in the normal-appearing colonic mucosa of patients at increased risk for colorectal cancer:results from a pilot,randomized,and controlled trial〔J〕.Cancer Prev Res (Phila),2013;6(4):271-81.
3Kim SL,Kim SH,Trang KT,etal.Synergistic antitumor effect of 5-fluorouracil in combination with parthenolide in human colorectal cancer〔J〕.Cancer Lett,2013;335(2):479-86.
4Sinicrope FA,Evans DB,Leach SD,etal.bcl-2 and p53 expression in resectable pancreatic adenocarcinomas: association with clinical outcome〔J〕. Clin Cancer Res,1996;2(12):2015-22.
5Yan X,Shen H,Jiang H,etal.External Qi of Yan Xin Qigong inhibits activation of Akt,Erk1/2 and NF-κB and induces cell cycle arrest and apoptosis in colorectal cancer cells〔J〕.Cell Physiol Biochem,2013;31(1):113-22.
6Watson AJ,Merritt AJ,Jones LS,etal. Evidence of reciprocity of bcl-2 and p53 expression in human colorectal adenomas and carcinomas〔J〕.Br J Cancer,1996;73(8):889-95.
7Sun NF,Meng QY,Hu SY,etal.Correlation between the expression of the BAG-1 gene and clinicopathologic factors in colorectal cancer〔J〕.J Cancer Res Clin Oncol,2011;137(10):1419-24.
8Kim SL,Trang KT,Kim SH,etal.Parthenolide suppresses tumor growth in a xenograft model of colorectal cancer cells by inducing mitochondrial dysfunction and apoptosis〔J〕.Int J Oncol,2012;41(4):1547-53.
9Takayama S,Sato T,Krajewski S,etal.Cloning and functional analysis of BAG-1: a novel Bcl-2-binding protein with anti-cell death activity〔J〕.Cell, 1995;80(2):279-84.
10Vaish V,Piplani H,Rana C,etal.NSAIDs may regulate EGR-1-mediated induction of reactive oxygen species and non-steroidal anti-inflammatory drug-induced gene (NAG)-1 to initiate intrinsic pathway of apoptosis for the chemoprevention of colorectal cancer〔J〕.Mol Cell Biochem,2013;378(1-2):47-64.

