白藜蘆醇對白細胞介素-1β誘導的軟骨細胞凋亡及增殖能力的影響
楊建輝 呂建國 聶會勇 申曉東
(西安交通大學醫學院第一附屬醫院康復中心,陜西 西安 710061)
軟骨細胞凋亡在骨關節炎(OA)的發生、發展中發揮重要作用〔1〕。細胞凋亡增加,必然導致軟骨基質的降解,基質合成減少,且對促進基質合成增加的治療措施效果不佳〔2〕。白藜蘆醇是一種非黃酮類多酚化合物,具有抗衰老、抗氧化、抗炎、抗腫瘤活性、調控細胞凋亡、雌激素調節及免疫調節等多種生物學活性〔3,4〕。本實驗以IL-1β誘導的軟骨細胞凋亡模擬體內炎性環境下軟骨細胞變化,研究白藜蘆醇對軟骨細胞凋亡及增殖能力的影響。
1 材料與方法
1.1實驗試劑 重組人白細胞介素(rhIL)-1β(Pepro-Tech);胰蛋白酶,Ⅱ型膠原酶,DMEN/F12培養基,胎牛血清(Gibco);Hoechst 33342,羅丹明-123(Rhodamine-123)(Sigma);TUNEL試劑盒,SABC試劑盒(武漢博士德公司);MTT,DMSO(Amresco);RNA酶抑制劑(RNase,TAKaRa);白藜蘆醇溶液由西安交通大學醫學院實驗中心提供。
1.2含藥血清和正常兔血清的制備 將白藜蘆醇按體表面積折算動物的等效劑量〔5〕,再用生理鹽水配成8 ml溶液給新西蘭大白兔灌胃,正常兔血清則以生理鹽水8 ml灌胃。連續2次灌胃,中間間隔2 h,在末次灌胃的3 h后,乙醚和氯胺酮復合麻醉下腹主動脈采血,4℃冰箱過夜后,離心2 500 r/min×25 min,抽取血清,56℃、30 min滅活,經0.45 μm濾膜抽濾除菌、分裝,-20℃保存備用。
1.3軟骨細胞的分離與培養 無菌條件下取1個月齡新西蘭大耳白兔肩、膝關節軟骨,將軟骨塊用D-Hank液漂洗,剪碎至1 mm3大小,加入0.2%Ⅱ型膠原酶,置振蕩器上,37℃震蕩消化1 h,然后再加入0.25%胰蛋白酶作用30 min后,將游離出的帶有酶溶液的軟骨細胞用吸管吸出,120目尼龍網篩過濾,獲取軟骨細胞,細胞活力分析儀檢測細胞活力>95%。將消化所得的細胞懸浮于含10%胎牛血清、100 U/ml青霉素、100 μg/ml鏈霉素的DMEM/F12培養基中,密度105/ml(Vi-cell細胞活力分析儀計數)接種于6孔板,24孔板或96孔板,置37℃,5% CO2,95%濕度培養箱中培養。48 h后視細胞貼壁情況更換培養液,以后每2天更換培養液1次,待細胞80%匯合后,培養基中加入不同處理因素。實驗分為5組,A組(對照組):培養液中無任何刺激因子,每孔加入正常兔血清100 μl;B組:培養液含10 ng/ml IL-1β+正常兔血清100 μl;C組:培養液含10 ng/ml IL-1β+10%含白藜蘆醇血清100 μl;D組:培養液含10 ng/ml IL-1β+20%含白藜蘆醇血清100 μl;E組:培養液含10 ng/ml IL-1β+40%含白藜蘆醇血清100 μl;每組設4個復孔,連續培養24 h后進行檢測。實驗重復5次。
1.4指標檢測及方法
1.4.1細胞形態學觀察 細胞培養24 h后,將各組細胞置于倒置相差顯微鏡下觀察細胞形態、核分裂象的變化。
1.4.2TUNEL法檢測細胞凋亡 將對照組和各試驗組培養的軟骨細胞,以1×104/ml接種在放有預處理蓋玻片的6孔培養板中進行細胞爬片,貼壁培養,待細胞爬片良好長成單層時,移除孔內的液體。3%過氧化氫室溫處理10 min。加0.01 mol/L Tris-HCl緩沖液(TBS),1∶200新鮮稀釋蛋白酶K 37℃消化15 min,每片加入20 μl TdTDIG-d-UTP標記緩沖液的混合液(1∶1∶18)中,37℃標記2 h。加封閉液50 μl/片,室溫30 min,甩掉封閉液,不洗,用抗體稀釋液1∶100稀釋生物素化抗地高辛抗體,混勻后50 μl/孔加之標本片上。置樣品于濕合中,37℃反應30 min。0.01 mol/L TBS洗2 min×3次。用抗體稀釋液1∶100稀釋SABC,混勻后加至蓋玻片上。37℃反應30 min。0.01 mol/L TBS洗5 min×4次。DAB顯色,蘇木素輕度復染。0.01 mol/L TBS洗,蒸餾水洗。脫水,透明,封片,顯微鏡觀察。TUNEL法檢測細胞凋亡結果判定:切片中軟骨細胞細胞核內呈現棕黃色顆粒者為陽性結果。每張切片光鏡下計數10個400倍視野,凋亡指數=凋亡細胞數/細胞總數×100%。
1.4.3凋亡細胞核檢測 Hoechst 33342是一種能與DNA特異性結合的熒光染料,在培養液中加入Hoechst 33342至終濃度2%,室溫下避光染色30 min后,PBS洗滌2次,置于熒光顯微鏡下觀察(激發波長355 nm,發射波長465 nm)。
1.4.4MTT比色法檢測 選經加入處理因素培養24 h的96孔板細胞,每孔加入5 mg/ml MTT溶液50 μl,作用4 h,棄上清后加入150 μl DMSO,震蕩混勻15 min后,在酶標儀上測定490 nm波長的吸光度值(A490),計算抑制率。
1.4.5流式細胞儀檢測細胞周期和增殖指數 選取加入處理因素培養24 h的6孔板細胞,胰蛋白酶消化收集各孔細胞,1 000 r/min離心5 min,棄上清,冷PBS洗2次,70%乙醇固定,4℃過夜。上機前離心去乙醇,冷PBS洗滌后將細胞重懸于1 ml冷PBS中,RNase(10 μg/ml)37℃孵育30 min,加入碘化丙啶(PI,50 μg/ml)染色5 min后上機檢測。增殖指數(PI)=(S+G2/M)/(G0/G1+S+G2/M)。
1.5統計學分析 采用SPSS11.5軟件進行單因素方差分析。
2 結 果
2.1細胞形態變化 見圖1。正常軟骨細胞在鏡下呈片狀貼附,形態成類圓形、多邊形或多角形,胞質內可見折光顆粒,周圍有細長的突起,胞核明顯呈圓形或橢圓形,核仁清晰,染色質均勻分布,部分細胞胞體增大,可見核分裂象,表現出S期和G2/M的細胞特征。經IL-1β處理的軟骨細胞呈去分化表現,細胞胞質回縮,細胞體積縮小,細胞內出現空泡,核分裂象減少。不同濃度的白藜蘆醇+IL-1β處理后的軟骨細胞,形態上與正常細胞無明顯區別。
2.2白藜蘆醇對IL-1β誘導軟骨細胞凋亡的影響 A組細胞凋亡率平均僅為3.2%,經IL-1β誘導(B組)的軟骨細胞凋亡率高達25.5%,二者差異有統計學意義(P<0.01)。含10%、20%、40%白藜蘆醇血清組和IL-1β共同作用后(C組、D組、E組)的軟骨細胞凋亡率分別為19.4%,11.8%,5.3%;與B組相比差異有統計學意義(P值分別為0.0361、0.0082、0.0067);C、D、E組組間,差異有統計學意義(P<0.05),且隨白藜蘆醇濃度的增加,細胞凋亡率逐漸降低,表明白藜蘆醇對軟骨細胞凋亡有明顯抑制作用,且呈劑量依賴性。
2.3核形態學變化 見圖2。正常軟骨細胞核呈類圓形,染色質均勻分布,經IL-1β處理的軟骨細胞中有許多出現典型的凋亡核特征,核濃縮、核碎裂,凋亡小體形成,核分裂象減少。經不同濃度白藜蘆醇處理后的軟骨細胞,細胞凋亡明顯減少。
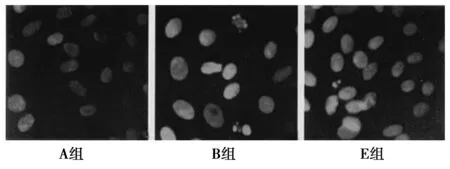
圖1 不同處理組軟骨細胞形態學變化比較(×200)
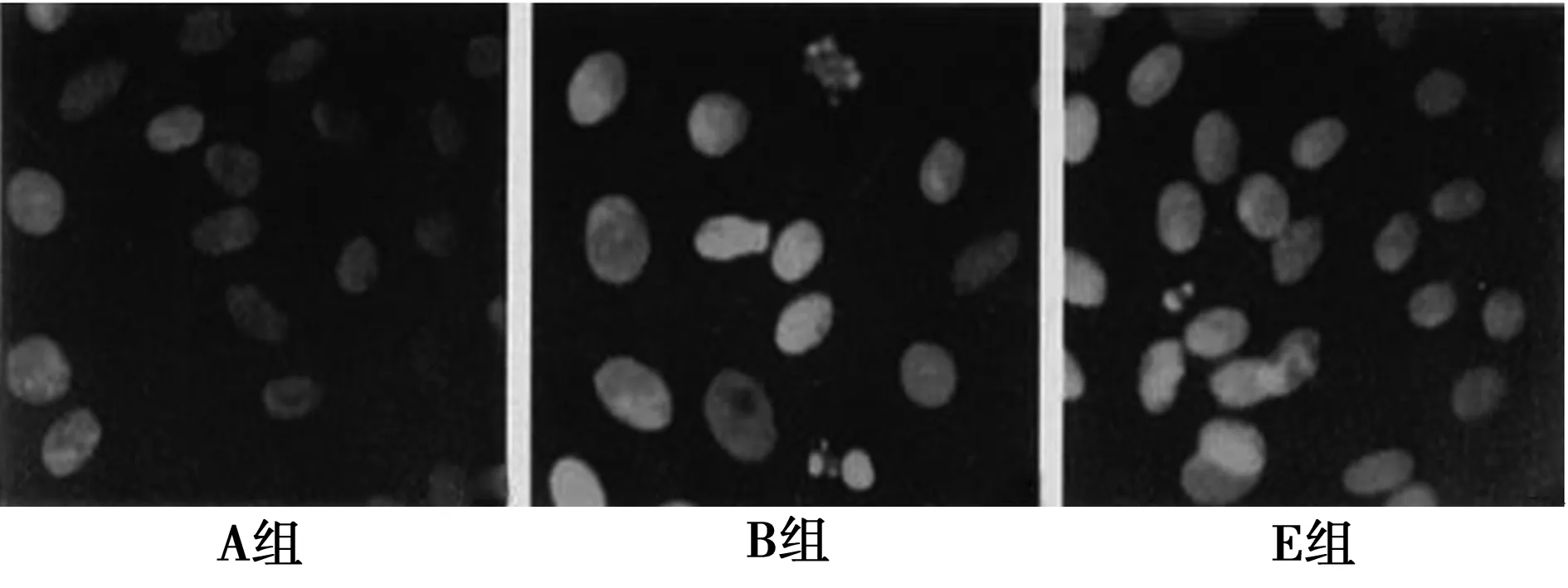
圖2 各組細胞核形態學變化Hoechst 33342熒光染色(×800)
2.4MTT檢測結果 見表1。IL-1β能明現抑制軟骨細胞生長,抑制率達61.3%。10%、20%、40%白藜蘆醇組對IL-1β作用的軟骨細胞均有保護作用,其抑制率分別為33.2%、24.3%、13.4%,呈劑量依賴性。
表1 不同處理組細胞周期分布及增殖指數±s,%)
2.5流式細胞儀檢測結果 見表1。正常軟骨細胞增殖能力旺盛,細胞PI達到23.4%;IL-1β處理的軟骨細胞PI明顯低于正常細胞,僅為7.3%,具有分裂象的S期和G2/M期細胞明顯減少;而加入白藜蘆醇組S期和G2/M期細胞明顯增多,PI明顯高于IL-1β誘導組,細胞增殖能力恢復,呈劑量依賴趨勢。
3 討 論
研究證實了軟骨細胞凋亡在OA發病中的主要作用,也為抑制軟骨細胞凋亡作為治療手段提供了依據〔6〕。由于關節軟骨內不含血管和軟骨細胞被軟骨基質所包繞,機體內的巨噬細胞無法清除已經發生凋亡的軟骨細胞,存留的凋亡小體通過釋放基質金屬蛋白酶等酶類加速軟骨組織的降解〔1〕。
研究表明前炎性介質IL-1β、NO在OA發病中起著重要的作用,可以誘導軟骨細胞凋亡〔7〕。IL-1β是存在于骨關節炎軟骨及滑液中的重要炎性因子,不僅抑制軟骨基質的合成,加速膠原和蛋白多糖的降解,而且抑制軟骨細胞增殖,誘導軟骨細胞凋亡,通過一系列級聯反應引起關節軟骨的破壞和炎癥反應〔8,9〕,已作為人工制作OA模型的誘導劑而廣泛使用〔10〕。
白藜蘆醇是植物為抵抗外界刺激如紫外線、真菌、病毒感染或機械損傷而產生的一種植物抗毒素,存在于多種植物中。體外實驗中白藜蘆醇可抑制白細胞介素(IL)-1β誘導的軟骨基質的降解〔11〕,并可抑制IL-1β對軟骨細胞caspase-3(細胞凋亡的主要執行者)的激活,故認為白藜蘆醇可在體外抑制軟骨細胞的凋亡〔12〕。在脂多糖誘導的實驗性關節炎中,予關節腔內注射白藜蘆醇,可明顯減少軟骨基質蛋白多糖的丟失及軟骨的破壞〔13〕。NO是OA發病機制中的重要介質,可以誘導軟骨細胞凋亡,在OA模型狗的實驗中,抑制NO,可以降低軟骨細胞的凋亡率,減輕軟骨的破壞〔14,15〕。予OA模型兔口服白藜蘆醇,關節滑液中NO的水平明顯降低〔16〕。本實驗顯示白藜蘆醇能明顯抑制IL-1β誘導的軟骨細胞凋亡。
4 參考文獻
1Hashimotos C,Ochs R,Komiyas F,etal.Linkage of chondrocyte apoptosis and cartilage degradation in human osteoarthritis〔J〕.Arthritis Rheum,1998;41(13):1632-8.
2Chen MH,Wang JL,Wong CY,etal.Relationship of chondrocyte apoptosis to matrix degradation and swelling potential of osteoarthritic cartilage〔J〕.J Formos Med Assoc,2005;104:264-72.
3Brisdelli FD,Andrea G,Bozzi A.Resveratrol:a natural polyphenol with multiple chemopreventive properties〔J〕.Curr Drug Metab,2009;10(6):530-46.
4Fabris S,Momo F,Ravagnan G,etal.Antioxidant properties of resveratrol and piceid on lipid peroxidation in micelles and monolamellar liposomes〔J〕.Biophys Chem,2008;135(1-3):7683.
5詹紅生,趙詠芳,馮 偉.含藥血清方法在中藥調節骨與軟骨代謝基礎研究中的應用〔J〕.中國骨傷,2000;3(11):661-2.
6包樂媛,李會強,畢曉陽,等.人滑膜細胞的分離培養與鑒定〔J〕.中國醫學檢驗雜志,2004;5(2):386-8.
7Jatvinen K,Vuolteenaho K,Nieminen R,etal.Selective inNOS inhibitor 1 400 W enhances anti-catabolic IL-10 and reduces destructive MMP-10 in OA cartilage.Survey of the effects of 1 400 W on inflammatory mediators produced by OA cartilage as detected by protein antibody array〔J〕.Clin Exp Rheumatol,2008;26(2):275-82.
8Pelletier JP,Martel-Pelletier J.Evidence for the involvement of interleukin-1 in human osteoarthritic cartilage degradation:protective effect of NSAID〔J〕.J Rheumatol Suppl,1989;18(14):19-27.
9Kobayashi M,Squires GR,Mousa A,etal.Role of interleukin-1 and tumor necrosis factor alpha in matrix degradation of human osteoarthritic cartilage〔J〕.Arthritis Rheum,2005;52(9):128-35.
10de IsIa NG,StoItz JF.In vitro inhibition of IL-1 beta catabolic effects on cartilage:a mechanism involved on diacerein anti-OA properties〔J〕.Biorheology,2008;45(34):433-8.
11Ming LEI,Shi-qing LIU,Yu-lan LIUetal.Resveratrol protects bone marrow mesenchymal stem cell derived chondrocytes cultured on chitosan-gelatin caffolds from the inhibitory effect of interleuin-1β〔J〕.Acta Pharmacol Sin,2008;29(11):1350-6.
12Shakibaei M,John T,Seifarth C,etal.Resveratrol inhibits IL-1 beta-induced stimulation of caspase-3 and cleavage of PARP in human articular chondrocytes in vitro〔J〕.Ann N Y Acad Sci,2007;1095(13):554-63.
13Elmali N,Baysal O,Harma A,etal.Effects of resveratrol in inflammatory arthritis〔J〕.Inflammation,2007;30(8):1-6.
14Pelletier IP,Jovanovic DV,Lascau Coman V,etal.Selective inhibitor of inducible nitric oxide synthase reduces progression of experimental osteoarthritis in vitro:possible link with the reduction in chondrocyte apoptosis and caspase-3 level〔J〕.Arthritis Rheum,2000;43(10):1290-9.
15Surazynski A,Miltyk W,Czarnomysy R,etal.Hyaluronic acid abrogates nitric oxide-dependent stimulation of collagen degradation in cultured human chondrocytes〔J〕.Pharmacol Res,2009;60(1):46-9.
16童 敏,高 戈,高潔生,等.白藜蘆醇對骨關節炎模型兔關節液中一氧化氮水平的影響〔J〕.新鄉醫學院學報,2007;24(1):49-52.

