RNA干擾畸胎瘤細胞源性生長因子基因對人肝細胞癌HepG2增殖和侵襲的影響
王海燕,黃愛民,晉 雯,高凌云,高美欽(福建醫科大學基礎醫學院病理學系,福建醫科大學腫瘤研究室,福建 福州 350004)
·論著·
RNA干擾畸胎瘤細胞源性生長因子基因對人肝細胞癌HepG2增殖和侵襲的影響
王海燕,黃愛民*,晉 雯,高凌云,高美欽
(福建醫科大學基礎醫學院病理學系,福建醫科大學腫瘤研究室,福建 福州 350004)
目的探討RNA干擾畸胎瘤細胞源性生長因子(PC cell-derived growth factor,PCDGF)基因對肝細胞癌細胞HepG2增殖和侵襲的影響。方法采用脂質體法將PCDGF-shRNA表達載體瞬時轉染人肝細胞癌細胞HepG2,逆轉錄-聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR)和免疫蛋白印跡(Western Blot)檢測轉染后細胞PCDGF mRNA和蛋白的表達,噻唑藍(thiazolyl blue tetrazolium bromide,MTT)比色法檢測轉染后HepG2細胞體外增殖能力,體外侵襲實驗檢測轉染后HepG2細胞侵襲能力。結果轉染后,與未轉染組(未轉染質粒和脂質體)、脂質體組(轉染空脂質體)和陰性質粒組(轉染陰性質粒)相比,轉染組(轉染PCDGF-shRNA質粒) HepG2細胞的PCDGF mRNA和蛋白表達水平明顯降低(P<0.01),細胞的增殖能力受到抑制(P<0.01),細胞的侵襲能力也明顯降低(P<0.01)。結論RNA干擾PCDGF基因可抑制肝細胞癌細胞的體外增殖及侵襲能力,PCDGF基因可能成為腫瘤基因治療的新靶點。
肝腫瘤;RNA干擾;細胞增殖;腫瘤浸潤
肝細胞癌是最常見的惡性腫瘤之一,其病死率在全球惡性腫瘤中居第3位。我國肝癌的發病率近年來呈上升趨勢,其侵襲力強,術后易復發轉移。因此,對肝癌侵襲、轉移相關指標的研究在腫瘤預后和指導臨床治療方面具有重要意義。畸胎瘤細胞源性生長因子(PCcell-derivedgrowthfactor,PCDGF),也稱為顆粒素-上皮素前體 (granulin-epithelinprecursor,GEP),是近年來發現的一種自分泌的生長因子。研究[1]發現PCDGF具有高致瘤活性,能促進某些上皮和間葉源性腫瘤的增殖、侵襲。關于PCDGF與肝細胞癌的研究國內外報道較少。本研究采用脂質體介導的基因轉染技術,將PCDGF-shRNA表達載體轉染肝細胞癌細胞株HepG2,探討其對肝癌細胞增殖、侵襲等生物學行為的影響,以期為肝癌的早期診斷及治療奠定基礎。
1 資料與方法
1.1 材料及試劑:從基因數據庫(Genebank)中檢索出人類PCDGF基因序列(NM002087.2);含PCDGF一段特異序列的PCDGF-shRNA質粒及陰性質粒由上海吉凱基因化學技術有限公司構建并提供。肝癌細胞株HepG2購自中科院上海細胞庫,由本中心實驗室保存。DMEM培養基購自美國Hyclone公司,胎牛血清購自杭州四季青公司,脂質體Lipofectamine購自美國Invitrogen公司,PCR引物由上海生工生物工程有限公司合成,TripureIsolationReagent試劑盒購自德國Roche公司,逆轉錄試劑盒購自日本Takara公司,PCR試劑盒購自北京百泰克公司,兔抗人PCDGF多克隆抗體購自美國ProteintechGroup公司,辣根過氧化物酶標記的羊抗兔IgG購自上海碧云天公司,噻唑藍(thiazolylbluetetrazoliumbromide,MTT)購自美國Sigma公司,基質膠(Matrigel)、纖維黏連蛋白(Fibronectin)購自美國BD公司;Transwell小室購自美國Corning公司。
1.2 方法
1.2.1 細胞培養及轉染:肝癌細胞株HepG2用含有10%胎牛血清的DMEM培養基,置37℃、5%CO2培養箱內培養。待細胞生長至70%~80%融合作為待轉染細胞,轉染前4h更換上述培養液1次。載體轉染采用脂質體轉染試劑Lipofectamine2000,轉染操作按照試劑說明書進行,分別轉染能表達PCDGF-shRNA的質粒和陰性質粒。轉染后4~6h后更換細胞培養液繼續培養。將轉染PCDGF-shRNA質粒和陰性質粒的HepG2細胞分別命名為轉染組和陰性質粒組,轉染空脂質體的HepG2細胞命名脂質體組,未轉染的HepG2細胞命名為未轉染組。轉染后熒光顯微鏡下觀察細胞轉染情況,計算轉染率。轉染率=熒光細胞數/全部細胞數×100%。
1.2.2 逆轉錄聚合酶鏈反應(reversetranscription-polymerasechainreaction,RT-PCR)檢測PCDGFmRNA的表達:轉染48h后分別提取轉染組、陰性質粒組、脂質體組與未轉染組細胞的總RNA,隨后逆轉錄成cDNA。根據GeneBank的基因序列并應用軟件PrimerDesigner5.0設計引物。PCDGF正義鏈5′-ACTCCTGCATCTTTACCGTCTC-3′,反義鏈5′-CTCACAGCAGGTAGAACCATCA-3′,預計目的基因產物為458bp。內參為β-actin,正義鏈5′-GCGTGACATTAAGGAGAAGC-3′,反義鏈5′-CCACGTCACACTTCATGATGG- 3′,產物長度240bp。PCR反應總體積為25μL,反應體系為2×PCRMasterMix12.5μL,上下游引物各1μL,cDNA模板1μL,去離子水補足至25μL。擴增條件為94℃預變性5min;94℃ 30s,58℃ 30s,72℃ 30s,循環30次;最后72℃延伸7min。擴增產物2%的瓊脂糖凝膠進行電泳,凝膠成像分析系統拍照并分析。
1.2.3 免疫蛋白印跡(WesternBlot)檢測PCDGF蛋白的表達:轉染48h后提取各組細胞總蛋白,進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(8%分離膠和4%濃縮膠)。將蛋白轉印至聚偏二氟乙烯膜,以5%脫脂奶封閉2h,加入兔抗人PCDGF多克隆抗體(1∶200),4℃過夜,TBS-T(TrisBufferedSalinewithTween20)洗膜10min×3次,后加入辣根過氧化物酶標記的羊抗兔IgG(1∶1 000)二抗,37℃孵育2h,TBS-T洗膜10min×5次,化學發光試劑顯色1~2min,用X光片顯影,以β-actin作為內參照。圖像用凝膠成像分析系統分析。
1.2.4MTT法檢測細胞增殖能力:轉染24h后,將轉染組、陰性質粒組、脂質體組及未轉染組細胞,每孔按4×103個細胞數接種于96孔細胞培養板中,于37℃,5%CO2培養箱中培養。分別于接種后24h、48h、72h、96h、120h,每孔加入20μL的MTT(5g/L)混勻,37℃,5%CO2培養箱中孵育4h,終止培養,小心吸棄孔內培養上清液,每孔加入150μL二甲基亞砜(dimethylsulfoxide,DMSO),振蕩10min,以波長570nm酶標儀檢測,吸光度(A)值表示細胞增殖情況,每組設3個復孔,實驗重復3次。
1.2.5 體外侵襲實驗:在Transwell侵襲小室聚碳酸酯膜外側滴加10μLFibronectin(0.5g/L)風干,膜內側加入20μLMatrigel(原液12g/L,用無血清DMEM培養液按1∶6稀釋),風干。轉染后24h,將轉染組、陰性質粒組、脂質體組和未轉染組細胞分別重懸于無血清DMEM培養液,于小室上室內分別加入200μL(含4×104個細胞)上述細胞懸液,下室加600μL含10%胎牛血清的DMEM培養液,置37℃,5%CO2培養箱中培養48h。取出小室棄除上室液體,用棉簽擦盡上室膜面未穿膜的細胞,室溫下甲醇固定10min,常規蘇木精-伊紅染色,中性樹膠封片,400倍光鏡下計數5個視野的侵襲細胞數,取其平均值,以侵襲細胞的相對數目表示腫瘤細胞的侵襲能力,每組實驗重復3次。
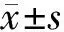
2 結 果
2.1 細胞轉染效率的測定:將PCDGF-shRNA質粒和陰性質粒轉染肝癌HepG2細胞,轉染后24~72h倒置熒光顯微鏡下觀察綠色熒光蛋白的表達,48h熒光表達最強,轉染效率達到55%(圖1)。故后續試驗采用轉染48h后進行。
2.2 各組PCDGFmRNA、PCDGF蛋白的表達和細胞侵襲能力:轉染48h后,RT-PCR及WesternBlot檢測顯示轉染組PCDGFmRNA和蛋白表達均低于未轉染組、脂質體組和陰性質粒組(P<0.01);而未轉染組、脂質體組、陰性質粒組PCDGFmRNA和蛋白表達差異均無統計學意義(P>0.05)。細胞侵襲能力實驗顯示轉染PCDGF-shRNA后,轉染組細胞穿膜細胞數也均明顯低于未轉染組、脂質體組和陰性質粒組(P<0.01)。見表1,圖2~4。
2.3 各組細胞增殖能力檢測:為了探討PCDGF-shRNA對HepG2細胞增殖能力的影響,本實驗應用MTT法測定未轉染組、脂質體組、陰性質粒組和轉染組細胞的A570nm值,結果顯示,隨著培養時間的延長,未轉染組、脂質體組、陰性質粒組和轉染組均有增殖,4組在組間、不同時點以及組間和不同時點的交互作用差異均有統計學意義(P<0.01)。轉染組增殖能力明顯低于未轉染組、脂質體組和陰性質粒組。見表2。


GroupsPCDGFmRNAPCDGFproteinCellnumberofinvadingthroughmembranceNon?transfection0.978±0.0130.775±0.02454.500±0.707Liposome0.961±0.0040.753±0.06350.500±13.435Negativevector0.948±0.0150.717±0.05747.500±9.192Transfection0.385±0.057?#△0.366±0.018?#△17.333±4.726?#△ F273.77854.86512.039 P0.0000.0000.003
*P<0.01vsnon-transfection group #P<0.01vsliposome group △P<0.01vsnegative vector group


GroupsA570nmvalue24h48h72h96h120hNon?transfectiongroup0.194±0.0410.296±0.0240.428±0.0210.573±0.0300.764±0.107Liposomegroup0.187±0.0260.275±0.0240.418±0.0420.544±0.0150.732±0.072Negativevectorgroup0.146±0.0470.266±0.0420.399±0.1270.540±0.0480.652±0.085Transfectiongroup0.113±0.0220.187±0.0130.241±0.0160.250±0.0250.270±0.026GroupsF=76.185 P=0.000TimeF=310.892 P=0.000Time·GroupsF=16.435 P=0.000
3 討 論
腫瘤的發生是一個內外因素相互作用的復雜的多步驟過程,它與調控細胞增殖和分化的作用因素失衡致使細胞生長失控密切相關。一些生長因子如表皮生長因子、胰島素樣生長因子、成纖維細胞生長因子、皮質激素等被發現在腫瘤細胞中是表達異常的,生長因子及其受體的過度表達是參與調控細胞生長與惡性表型轉化的因素之一[2]。PCDGF是近年來發現的一種生長因子,它最早是從鼠畸胎瘤PC細胞系條件培養基中純化的一種相對分子質量88 000的糖蛋白,是生長因子家族中相對分子質量最大的成員。研究[3-4]發現PCDGF具有多種生物學功能,如參與胚胎發育、傷口修復、炎癥調節、神經退行性病變。在腫瘤的發生發展中PCDGF同樣發揮重要作用。它與某些上皮和間葉源性腫瘤如乳腺癌[5]、卵巢癌[6]、皮膚鱗癌[7]、惡性膠質瘤[8]等的發生侵襲以及腫瘤細胞的增殖與存活密切相關。在肝細胞癌中Cheung等[9]研究也顯示肝癌組織中PCDGF的表達較非瘤組織和正常肝組織顯著增高,它的強陽性表達與肝癌早期肝內復發密切相關。Park等[10]通過動物實驗揭示抑制PCDGF表達可抑制裸鼠體內肝癌細胞的生長。這些現象均提示PCDGF促進了腫瘤的生長、浸潤和轉移。
RNA干擾( RNA interference,RNAi) 是近年來基礎與臨床研究的熱點之一[11]。它是由雙鏈RNA(double-stranded RNA,dsRNA) 介導的特異性降解相應序列的mRNA,導致靶基因的沉默,是一種抑制特定基因產物表達的有效方法,在腫瘤及干細胞等前沿研究領域顯示出巨大的潛能。
本研究前期實驗發現PCDGF在肝癌細胞株HepG2高表達,故選用HepG2細胞作為實驗細胞模型。本研究利用脂質體2000將PCDGF-shRNA表達載體瞬時轉染肝癌HepG2細胞,結果顯示轉染組、陰性質粒組與未轉染組、脂質體組相比,轉染組、陰性質粒組均有熒光的表達,表明成功將質粒轉染入細胞中,轉染率達55%。利用RT-PCR以及Western Blot檢測轉染后PCDGF mRNA和蛋白的表達,結果顯示轉染組的PCDGF mRNA和蛋白表達水平均較陰性質粒組、脂質體組和未轉染組明顯降低(P<0.01)。細胞增殖實驗結果顯示轉染組細胞的增殖能力受到抑制(P<0.01)。這與梁佳等[12]采用 RNA干擾技術特異性沉默PCDGF基因在鼻咽癌細胞株HNE-1中的表達,抑制癌細胞的異常增殖相一致。其原因是與PCDGF通過激活絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)途徑、磷脂酰肌醇-3-激酶(phosphatidylinositol 3′-kinase,PI3K) 途徑和局部黏附激酶(Focal adhesion kinase,FAK) 途徑來調控細胞的增殖和凋亡有關。因此,沉默PCDGF基因可能通過抑制上述途徑調控細胞增殖及細胞周期相關基因的表達,影響肝癌細胞HepG2的體外增殖。Transwell是檢測癌細胞侵襲實驗的經典模型,已被廣泛應用于探討癌細胞侵襲的相關研究中。本研究采用Transwell小室檢測沉默PCDGF基因對HepG2細胞體外侵襲能力的影響。實驗發現與未轉染組、脂質體組、陰性質粒組相比,轉染組細胞體外侵襲能力明顯降低(P<0.01)。這與鄭慶豐等[13]針對PCDGF的短發卡RNA可降低Eca-109食管癌細胞株的侵襲能力相一致。表明干擾PCDGF可以影響肝癌的惡性生物學行為,降低肝細胞癌的侵襲潛能。
總之,RNA干擾技術通過抑制PCDGF基因表達,對肝癌增殖侵襲起抑制作用。相信隨著對肝癌作用及調控機制的深入研究和分子生物學技術的飛速發展,PCDGF可望成為肝癌基因治療的新靶點和輔助診斷的指標。(本文圖見封二)
[1] LI LQ,HUANG HL,PING JL,et al.Clinicopathologic and prognostic implications of progranulin in breast carcinoma[J].Chin Med J (Engl),2011,124 (13):2045-2050.
[2] FENG Y,DAI X,LI X,et al.EGF signalling pathway regulates colon cancer stem cell proliferation and apoptosis[J].Cell Prolif,2012,45(5):413-419.
[3] PRIYANKA N,KUMARI M,KALRA N,et al.Crevicular fluid and serum concentrations of progranulin and high sensitivity CRP in chronic periodontitis and type 2 diabetes[J].Dis Markers,2013,35(5):389-394.
[4] BOZZALI M,BATTISTONI V,PREMI E,et al.Structural brain signature of FTLD driven by granulin mutation[J].J Alzheimers Dis,2013,33(2):483-494.
[5] LI LQ,MIN LS,JIANG Q,et al.Progranulin expression in breast cancer with different intrinsic subtypes[J].Pathol Res Pract,2012,208(4):210-216.
[6] DIAZ-CUETO L,ARECHAVALETA-VELASCO F,DIAZ-ARIZAGA A,et al.PKC signaling is involved in the regulation of progranulin (acrogranin/PC-cell-derived growth factor/granulin-epithelin precursor) protein expression in human ovarian cancer cell lines[J].Int J Gynecol Cancer,2012,22(6):945-950.
[7] HUANG K,HUANG C,SHAN K,et al.Significance of PC cell-derived growth factor and cyclin D1 expression in cutaneous squamous cell carcinoma[J].Clin Exp Dermatol,2012,37(4):411-417.
[8] WANG M,LI G,YIN J,et al.Progranulin overexpression predicts overall survival in patients with glioblastoma[J].Med Oncol,2012,29(4):2423-2431.
[9] CHEUNG ST,CHEUNG PF,CHENG CK,et al.Granulin-epithelin precursor and ATP-dependent binding cassette (ABC)B5 regulate liver cancer cell chemoresistance[J].Gastroenterology,2011,140(1):344-355.
[10] PARK MY,PARK YS,NAM JH.RNA interference against granulin-epithelin precursor prevents hepatocellular carcinoma growth:its application as a therapeutic agent[J].Int J Oncol,2011,39(4):853-861.
[11] SINDHU A,ARORA P,CHAUDHURY A.Illuminating the gateway of gene silencing:perspective of RNA interference technology in clinical therapeutics[J].Mol Biotechnol,2012,51(3):289-302.
[12] 梁佳,林力,壽鑄,等.鼻咽癌畸胎瘤細胞源性生長因子表達及siRNA對HNE-1細胞株增殖的抑制[J].第三軍醫大學學報,2012,34(15):1572-1575.
[13] 鄭慶豐,柳碩巖,王海燕,等.RNA干擾畸胎瘤源性生長因子基因對食管鱗癌細胞生物學行為的影響[J].中華胃腸外科雜志,2013,16(9):874-877.
(本文編輯:許卓文)
INTERFERENCEOFPCCELL-DERIVEDGROWTHFACTORRNAONPROLIFERATIONANDINVASIONOFHUMANHEPATOCELLULARCARCINOMACELLLINEHEPG2
WANGHaiyan,HUANGAimin*,JINWen,GAOLingyun,GAOMeiqin
(DepartmentofPathology,CollegeofBasicMedicalSciences,TumorResearchInstitute,FujianMedicalUniversity,Fuzhou350004,China)
ObjectiveToinvestigatetheeffectofPCcell-derivedgrowthfactor(PCDGF)RNAonhepatocellularcarcinomacellsHepG2invitro.MethodsThePCDGF-shRNAexpressionvectorwastransfectedintohepatocellularcarcinomacellsHepG2bylipofectiontechnology.TheexpressionofPCDGFmRNAandproteinweredetectedbyreversetranscription-polymerasechainreaction(RT-PCR)andWesternBlot,respectively.TheabilityoftumorcellproliferationwasdeterminedbyMTTassay.TheeffectofPCDGFexpressiononinvasionwasalsoidentifiedbytranswellchambersystem.ResultsTheexpressionofPCDGFmRNAandproteinwerebothdecreasedinthetransfectiongroupthaninthenon-transfectiongroup,liposomegroupandnegativevectorgroup(P<0.01).TheMTTshowedcellproliferationactivitywasinhibitedinthetransfectiongroup(P<0.01).Transwellexperimentsshowedthatcellinvasionabilitywaslowerinthetransfectiongroupcomparedwiththatinthenon-transfection,liposomeandnegativevectorgroups(P<0.01).ConclusionPCDGFRNAinterferencecaninhibittheproliferationandinvasionabilitiesofhepatocellularcarcinomacellsinvitro.PCDGFgenemaybethenewtargetofgenetherapy.
liverneoplasms;RNAinterference;cellproliferation;neoplasminvasivess
2014-04-02;
2014-04-22
福建省教育廳課題(JA10133);福建省衛生廳青年科研課題(2010-1-19)
王海燕(1971-),女,福建龍海人,福建醫科大學基礎醫學院講師,醫學碩士,從事腫瘤病理研究。
*通訊作者。E-mail:aimin@mail.fjmu.edu.cn
R735.7
A
1007-3205(2014)11-1291-05
10.3969/j.issn.1007-3205.2014.11.015

