2-甲酰苯胺-3-甲基苯并吡喃酮化合物的合成研究*
茹婷婷,丁曉巖
(吉林建筑大學 基礎科學部,吉林 長春 130118)
2-甲酰苯胺-3-甲基苯并吡喃酮化合物的合成研究*
茹婷婷,丁曉巖
(吉林建筑大學 基礎科學部,吉林 長春 130118)
介紹了一種以廉價易得的乙酰乙酰苯胺類化合物為反應原料,使其和二硫化碳發生化學反應,生成乙酰基二硫縮烯酮類化合物,該化合物在堿性條件下與芳香環類化合物發生反應得到2-甲酰苯胺-3-甲基苯并吡喃酮.
乙酰乙酰苯胺;二硫縮烯酮;苯并吡喃酮
苯并吡喃酮衍生物具有比較廣泛的應用價值,根據不同的分子結構該類化合物可分為:苯并-a-吡喃酮和苯并-r-吡喃酮兩大類.苯并-a-吡喃酮類化合物具有顯著的生物活性和藥理作用,其在抗血凝結、抗癌和抗病毒等方面有明顯的作用.此外,苯并吡喃酮類化合物在可見光區范圍內有很強的熒光性,可以利用這種特殊性質作為非線性光學生色團和激光染料、熒光探針、熒光增白劑等等.有文獻報道可以使鏈狀的α-羰基二硫縮烯酮類化合物發生Vilsmeier-Haack反應,一步就可以高效的制備吡啶類化合物.還有文獻報道肉桂酰基二硫縮烯酮類化合物與二胺類化合物發生多米諾反應后,可以高產率地制備噻吩并噻喃酮類化合物.因此,本文介紹了一種以α-乙酰基二硫縮烯酮為反應原料,使其與芳香類化合物發生付-克烷基化反應,高產率地制備2-甲酰苯胺-3-甲基苯并吡喃酮的合成方法.
1 實驗部分
1.1 試劑與儀器
VARIANUNITY-500MHz核磁共振儀(內標TMS,溶劑CDCl3);MAGNA-IR560型紅外光譜儀(KBr壓片法);Agilient1100LCMsD型質譜儀;GSA- 0.25 型 250毫升高壓反應釜;PE-2400自動元素分析儀;電天平;旋片式真空泵;三用紫外線分析儀;旋轉蒸發儀;79-l型磁力加熱攪拌器;高效薄層板;柱層析分離柱.
1.2α-乙酰基二硫縮烯酮的合成

圖1 α-乙酰基二硫縮烯酮的合成
取一只200mL的三頸瓶,向其中放入反應原料無水碳酸鉀(10.0mmol,1.5g)和乙酰乙酰苯胺(5.0mmol,0.9g),加入DMF(10mL)作為反應溶劑常溫反應20min.然后將反應體系溫度控制在0~5℃之間,向體系中慢慢滴加二硫化碳(5.5mmol,0.4mL),觀察到反應體系變紅.用玻璃棒攪拌0.5h后,向反應液中慢慢滴加反應物溴乙烷(11.0mmol,0.9mL),控制在30min內滴完.常溫下繼續攪拌反應液8~10h.用TLC監測反應直到底物完全消失,把反應體系倒入冰水里,析出黃色沉淀,真空泵抽濾,用水洗滌黃色固體產物1(圖1),得到產物約1.52g,計算反應產率約96 %.
1.3α-羥基二硫縮烯酮的合成

圖2 α-羥基二硫縮烯酮的合成
取一只25mL圓底燒瓶,向其中加入化合物11mmol(0.182g)和無水乙醇(8mL),不斷攪拌下慢慢加入NaBH41.3mmol(0.048g),常溫下反應15min.采用TLC監測直到反應物完全消失,加入10mL水,用CH2Cl2萃取反應體系后,蒸干溶劑得到產物2(圖2)約0.165g,計算產率約為88%.
1.4 2-甲酰苯胺-3-甲基苯并吡喃酮的制備

圖3 2-甲酰苯胺-3-甲基苯并吡喃酮的制備
取一只25mL圓底燒瓶,向其中加入化合物2(1mmol,0.213g)、5mLCH2Cl2和對甲苯酚(2mmol,0.216g).慢慢加入AlCl3(1mmol,0.142g),常溫下反應1h,用TLC監測反應直到反應物2完全消失,加入10mL水,用HCl調節體系pH值為酸性,用CH2Cl2萃取反應體系后,采用柱層析提純得到產物(圖3)30.187g,計算產率約為78%.
2 結果與討論
2.1 取代基對化合物3合成的影響
在合成2-甲酰苯胺-3-甲基苯并吡喃酮的過程中,通過實驗發現不同取代基R對反應有不同的影響,且得到不同結構的產物.當取代基R為酯基(-COOMe,-COOEt)時,得到的產物是兩個烷硫基均被取代的苯并吡喃酮類化合物.當取代基R為腈基(-CN)時,得到的產物是一個烷硫基與酚羥基發生分子內取代,一個烷硫基不發生反應而被保留下來.當R為酰胺基(-CONHPh)時侯,發生付-克烷基化反應,兩個烷硫基均不發生反應而全被保留下來.出現這種情況的是因為取代基吸電子能力不同,其大小順序為:酯基>腈基>酰胺基,所以導致β位的烷硫基親電能力逐漸減弱.
2.2 反應機理的研究
綜合反應現象和實驗結果,提出了下面可能的反應機理:化合物2 在酸的作用下得到碳正離子A,中間體A不穩定比較容易與芳烴發生付-克烷基化反應,被引進到芳環上的固定位置,當鏈型硫代縮烯酮結構被引入到羥基鄰位的時候,羥基進一步和硫代縮烯酮結構部分發生反應.當取代基R為酯基時,烷硫基被羥基取代后會發生水解反應生成香豆素類化合物;當取代基R為腈基時,烷硫基被羥基取代之后不會發生水解反應,最終得到產物苯并吡喃類化合物;當取代基R為酰胺基時,烷硫基不被羥基取代,在強酸性條件下,苯胺基被羥基取代而得到化合物7(如圖4).
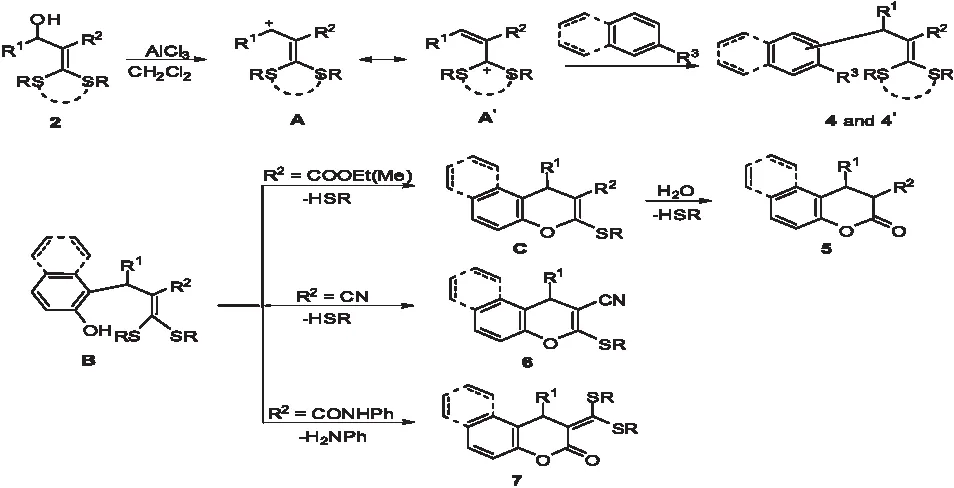
圖4 硫代縮烯酮上不同取代基對產物的影響
2.3 所合成化合物的結構表征
化合物1:黃色固體;熔點74~76oC;1HNMR(CDCl3,500MHz)δ:3.38~3.39(m,2H),3.43~3.44(m,2H),3.88(s,3H),10.01(s,1H);13CNMR(CDCl3,125MHz)δ:36.6,38.0,51.8,115.6,165.9,184.1,185.8;IR(KBr,cm-1):2949,1692,1635,1251;MS(ESI)m/z205[(M+1)]+;Anal.Calcd(found)for:C7H8O3S2:C,41.16(41.28);H,3.95(3.88).
化合物2:無色液體;1HNMR(CDCl3,500MHz)δ:2.13(s,1H),3.37~3.45(m,4H),3.78(s,3H),4.50(s,2H);13CNMR(CDCl3,125MHz)δ:36.6,39.0,51.7,62.6,115.4,165.7,166.2;IR(KBr,cm-1):3446,2946,1655,1278;(ESI)m/z207[(M+1)]+;Anal.Calcd(found)for:C7H10O3S2:C,40.76(40.89);H,4.89(4.96).
化合物3:白色固體;1HNMR(CDCl3,500MHz)δ:1.35(d,J=7.0Hz,3H),2.33(s,3H),3.52(dd,J=6.5,7.0Hz,1H),3.56(d,J=6.0Hz,H),3.71(s,3H),6.96(d,J=8.5Hz,1H),7.03(s,1H),7.07(d,J=8.0Hz,1H);13CNMR(CDCl3,125MHz)δ:19.3,20.8,33.3,52.9,53.5,116.7,125.1,127.4,129.2,134.7,148.3,164.7,167.8;IR(KBr,cm-1):2970,1762,1733,1536,1465,1266;MS(ESI)m/z235[(M+1)]+.
3 結論
本實驗方法的優點是選擇廉價易得的化學藥品為反應原料,所用試劑和催化劑也比較常見,反應發生的條件較為簡單,所制備的產物在抗癌、抗病毒等方面有顯著的作用.
[1]董環文,李科,鄭燦輝,等.3-胺基取代苯并吡喃酮類化合物的設計合成及抗腫瘤活性[J].化學學報,2009,67(8):819-820.
[2]鄭玉國,薛偉,郭晴晴,等.三唑席夫堿苯并吡喃酮衍生物的合成及其抗病毒活性[J].合成化學,2013,20(3):316-318.
[3]董環文,劉玨瑩,張月莉,等.3-取代苯基苯并吡喃酮類化合物的設計合成及抗腫瘤活性[J].中國藥物化學雜志,2010,20(4):252-254.
(責任編輯:水行)
2013-09-10
茹婷婷(1985-),女,吉林長春人,碩士,講師.
吉林省教育廳“十一五”科學技術研究項目(吉教科合字2010第314號)
O
A
1008-7974(2014)01-0038-02

