玉屏風散對Hepa1-6肝癌荷瘤小鼠T淋巴細胞表型的影響※
姚 霏 張露蓉 江國榮
(南京中醫藥大學附屬蘇州市中醫醫院吳門醫派研究院,江蘇 蘇州 215009)
實驗研究
玉屏風散對Hepa1-6肝癌荷瘤小鼠T淋巴細胞表型的影響※
姚 霏 張露蓉 江國榮△
(南京中醫藥大學附屬蘇州市中醫醫院吳門醫派研究院,江蘇 蘇州 215009)
目的探討玉屏風散對肝癌荷瘤小鼠T淋巴細胞表型的影響。方法以皮下接種腫瘤細胞建立荷瘤C57BL/6小鼠模型,隨機分為模型對照組、玉屏風散組(20、25、30 g生藥/kg),并選取不荷瘤小鼠為正常對照組,每組各5只。玉屏風散組按20 mL/kg灌以生藥濃度為1.00、1.25、1.50 g/mL)的玉屏風散濃縮液,每日1次,正常對照組與模型對照組灌以等容積0.9%氯化鈉注射液,連續給藥2周。2周后處死小鼠制備脾細胞懸液,應用免疫熒光標記法,采用流式技術檢測和分析小鼠脾臟中CD4+CD25+、CD4+CD69+、CD8+CD69+、CD8+CD44+、CD8+CD44+CD62L-及CD8+CD44+CD62L+T細胞比例的變化。結果與正常對照組比較,玉屏風散組脾CD4+CD25+T細胞比例均下降(P<0.05,P<0.01);CD4+CD69+、CD8+CD69+、CD8+CD44+、CD8+CD44+CD62L-和CD8+CD44+CD62L+T細胞比例均增加(P<0.05,P<0.01)。與模型對照組比較,玉屏風散組脾CD8+CD44+和CD8+CD44+CD62L-T細胞比例均無變化(P>0.05);玉屏風散20 g生藥/kg組、25 g生藥/kg組CD8+CD69+T細胞比例增加(P<0.05);玉屏風散30 g生藥/kg組CD4+CD25+T細胞比例有降低趨勢,差異無統計學意義(P>0.05);CD4+CD69+和CD8+CD69+T細胞比例均下降(P<0.05,P<0.01);CD8+CD44+CD62L+T細胞比例增加(P<0.01)。結論玉屏風散通過降低CD4+CD25+調節性T細胞比例,促進CD8+T細胞活化,增加記憶型CD8+T細胞比例,從而改善肝癌小鼠免疫紊亂狀態,發揮抗腫瘤作用。
玉屏風散;肝腫瘤;疾病模型,動物;小鼠;T淋巴細胞;表型
玉屏風散為中醫扶正固表的經典名方,出自元·朱丹溪的《丹溪心法》,由黃芪、白術、防風3味藥材組方而成。現代藥理研究證明玉屏風散具有增強機體免疫力的功能[1-2],可促進荷瘤小鼠T細胞的增殖[3]。本實驗室前期研究也表明玉屏風散具有微弱的直接抑瘤作用,主要通過對肝癌荷瘤小鼠免疫調節發揮抗腫瘤效應,提高機體特異性T細胞的免疫功能尤其明顯[4]。
T細胞是機體極為重要的免疫細胞,其介導的免疫應答在抗腫瘤免疫中發揮重要作用。它表面存在諸多表面分化抗原CD,包括CD4+T細胞和CD8+T細胞2個亞群,在T細胞的活化過程中發揮重要功能,同時也是鑒定T細胞亞群的重要表面標志[5]。CD4+代表輔助性T細胞,CD8+代表抑制性和細胞毒性T細胞,CD4+、CD8+彼此相互調節,表現出輔助和抑制的作用,是免疫系統的核心[6]。當二者比例失調,這種對立統一的關系被破壞,導致免疫狀態失衡,產生免疫功能紊亂。CD4+CD25+T細胞作為一類調節性T細胞[7],在腫瘤患者中表現為比例升高,提示該類細胞在腫瘤免疫中起下調作用[8]。CD69分子被稱為活化誘導分子(AIM)[9],靜止的T淋巴細胞一般不表達CD69,T細胞通過T細胞抗原受體(TCR)接受CD3/TCR復合物、植物血凝素(PHA)、蛋白激酶C激活物佛波酯(PMA)等刺激信號后,細胞表面就合成和表達一些新的糖蛋白,包括CD69、白細胞介素-2(IL-2)受體CD25、轉鐵蛋白受體CD71,這些分子被稱為活化標志,其中最早表達的是CD69[10-11],刺激后1~2 h即可在T細胞表面發現[12],可用于評價T淋巴細胞的活化狀態及活化效率。CD44及選擇素-L(Selectin-L,亦稱CD62L)為最主要的淋巴細胞歸巢受體,介導淋巴細胞與組織中高內皮小靜脈(HEV)的內皮細胞相互作用,參與淋巴細胞再循環。而且,細胞活化可致其表面的CD62L脫落。因此,通常認為CD44+CD62L-為效應T細胞的表達,而CD44+CD62L+為記憶型T細胞的表達。
本研究在前期研究的基礎上,進一步圍繞T細胞不同功能的亞群,觀察玉屏風散對荷瘤肝癌小鼠T細胞免疫調節的影響及機制,為臨床應用玉屏風散治療肝癌提供實驗依據。
1 材料與方法
1.1 材料
1.1.1 實驗動物 SPF級近交C57BL/6純系雄性小鼠25只,體質量(20±2) g,購自蘇州愛爾麥特科技有限公司實驗動物中心,許可證號:SCXK(蘇)2009-001。
1.1.2 實驗藥物 黃芪、白術、防風均由蘇州市春暉堂藥業有限公司提供(批號均為100601)。按黃芪∶白術∶防風為3∶1∶1的比例,加入加3倍量低溫水,浸泡0.5 h,再加入5倍量水,回流提取1.5 h,過濾;取藥渣再加入6倍量水,回流提取1 h,合并2次濾液。濾液濃縮適量,使得到濃度為1.00 g、1.25 g、1.50 g/mL(折合生藥)的濃縮液,-4 ℃密封保存備用。
1.1.3 細胞株 Hepa1-6小鼠肝癌細胞,由蘇州大學生命科學院惠贈。
1.1.4 試劑 DMEM培養液(GIBCO公司,批號1320158);胎牛血清(杭州四季青生物工程材料有限公司,批號100511);疊氮鈉(NaN3,上海化學試劑供應站,批號890425);Anti-Mouse CD4 FITC(eBioscience公司,批號E00078-133);Anti-Mouse CD8a PerCP-Cy5.5(eBioscience公司,批號E08300-1630);Rat Anti-Mouse CD44 R-PE(invitrogen公司,批號282899G);Anti-Mouse CD62L APC(eBioscience公司,批號E07168-1630);Anti-Mouse CD25 APC(eBioscience公司,批號E07105-1631);Anti-Mouse CD69 FITC(eBioscience公司,批號E07175-1225);碳酸氫鉀、氯化銨、乙二胺四乙酸二鈉(EDTA-Na2)、磷酸緩沖鹽(PBS)、流式細胞儀檢測緩沖液(FACS buffer)等試劑均為國產分析純試劑。
1.1.5 儀器 微量移液器,美國eppendorf公司;賀利氏二氧化碳培養箱,美國科峻儀器公司;Leica DMIL倒置顯微鏡,德國徠卡儀器有限公司;Z 320K低溫高速離心機,德國HERMLE公司;流式細胞儀,美國BD公司。
1.2 實驗方法
1.2.1 分組及給藥 選取20只小鼠適應性飼養3 d后用于種瘤。無菌條件下,取對數生長期的Hepa1-6細胞用于實驗。將Hepa1-6細胞消化后,用PBS稀釋成1×107/mL的細胞懸液,接種于小鼠右腋皮下,每只接種0.2 mL以形成實體瘤,當捫及接種小鼠皮下結節直徑約達5 mm時,將小鼠隨機分為4組,每組5只。選取5只不荷瘤小鼠為正常對照組。分組當日開始給藥,玉屏風散組按20 mL/kg給予生藥濃度為1.00、1.25、1.50 g/mL的玉屏風散濃縮液灌胃,正常對照組與模型對照組灌以等容積0.9%氯化鈉注射液灌胃,每日1次,連續給藥2周。
1.2.2 脾細胞懸液的制備 小鼠末次給藥24 h后給予放血斷髓處死,快速剖開腹腔,取脾,去除周圍的結締組織,稱質量記錄,剪碎脾臟,在毛玻片上磨細,過200目尼龍網,收集濾液,1 000 r/min離心5 min,棄上清液,加入10~15 mL紅細胞裂解液,混懸脾細胞,靜置10~20 min后1 000 r/min離心5 min,棄上清,再用PBS洗一遍細胞,最后加1 mL FACS buffer重新懸浮細胞。以上操作均在冰上進行。利用細胞計數板,鏡下計數并記錄。
1.2.3 免疫熒光標記法檢測 于96孔板中加入50 μL 用FACS buffer懸浮好的脾細胞,加入50 μL 已經用FACS buffer稀釋好的各抗體(CD4、CD8、CD25、CD69、CD44及CD62L),與細胞混勻(每孔約1×105~6個細胞),4 ℃避光孵育30 min。每孔加入150 μL FACS buffer洗滌細胞,1 200 r/min離心5 min。棄200 μL上清液,加200 μL FACS buffer洗滌細胞2遍,1 200 r/min離心5 min。加200 μL FACS buffer,轉移到流式管中,上流式細胞儀檢測。每個樣本收集10 000個細胞用于數據分析,采用FLOWJO軟件處理樣品數據。
2 結 果
2.1 玉屏風散對Hepa1-6肝癌荷瘤小鼠CD4+CD25+T細胞比例的影響 見表1。
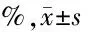
組 別nCD4+CD25+T細胞正常對照組53.14±0.42模型對照組52.54±0.39?玉屏風散20g生藥/kg組53.28±0.96玉屏風散25g生藥/kg組53.08±0.86玉屏風散30g生藥/kg組52.00±0.56??
與正常對照組比較,*P<0.05,**P<0.01
由表1可見,與正常對照組比較,模型組和玉屏風散30 g生藥/kg組CD4+CD25+T細胞比例均明顯下降(P<0.05,P<0.01)。與模型對照組相比,玉屏風散20、25 g生藥/kg組CD4+CD25+T細胞比例有上升趨勢,玉屏風散30 g生藥/kg組CD4+CD25+T細胞比例有進一步降低趨勢,但差異均無統計學意義(P>0.05)。玉屏風散各劑量組之間互相比較,隨著劑量增加,CD4+CD25+T細胞比例呈現逐步降低,但組別之間均無顯著變化(P>0.05)。
2.2 玉屏風散對Hepa1-6肝癌荷瘤小鼠CD4+CD69+、CD8+CD69+T細胞比例的影響 見表2。
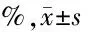
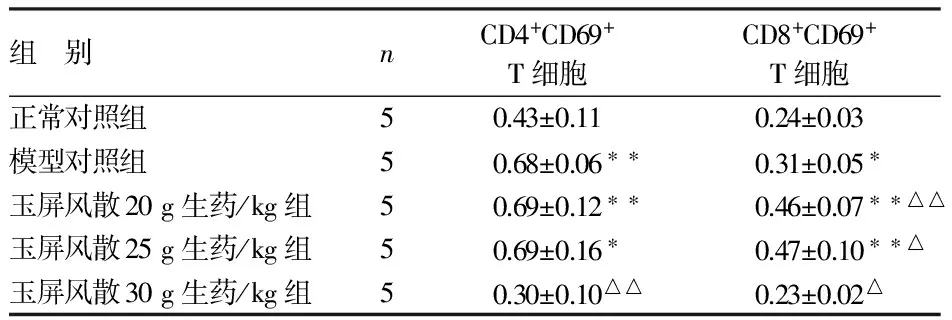
組 別nCD4+CD69+T細胞CD8+CD69+T細胞正常對照組50.43±0.110.24±0.03模型對照組50.68±0.06??0.31±0.05?玉屏風散20g生藥/kg組50.69±0.12??0.46±0.07??△△玉屏風散25g生藥/kg組50.69±0.16?0.47±0.10??△玉屏風散30g生藥/kg組50.30±0.10△△0.23±0.02△
與正常對照組比較,*P<0.05,**P<0.01;與模型對照組比較,△P<0.05,△△P<0.01
由表2可見,與正常對照組比較,模型對照組和玉屏風散20、25 g生藥/kg組CD4+CD69+、CD8+CD69+T細胞比例明顯增加(P<0.05,P<0.01);但玉屏風散30 g生藥/kg組CD4+CD69+和CD8+CD69+T細胞比例均略有下降(P>0.05)。與模型對照組相比,玉屏風散20、25 g生藥/kg組CD4+CD69+T細胞比例無變化(P>0.05),CD8+CD69+T細胞比例則明顯增加(P<0.05);但玉屏風散30 g生藥/kg組CD4+CD69+和CD8+CD69+T細胞比例均明顯下降(P<0.05,P<0.01)。
2.3 玉屏風散對Hepa1-6肝癌荷瘤小鼠CD8+CD44+、CD8+CD44+CD62L-及CD8+CD44+CD62L+T細胞比例的影響 見表3。
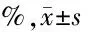

組 別nCD8+CD44+T細胞CD8+CD44+CD62L-T細胞CD8+CD44+CD62L+T細胞正常對照組535.87±1.4024.99±1.3310.88±1.84模型對照組545.09±5.45?31.02±5.9114.08±2.77玉屏風散20g生藥/kg組550.12±6.52??35.59±7.04?14.54±2.62?玉屏風散25g生藥/kg組549.59±6.41??34.62±7.12?14.99±2.84?玉屏風散30g生藥/kg組551.09±5.12??31.08±4.57?20.00±1.71??△△
與正常對照組比較,*P<0.05,**P<0.01;與模型對照組比較,△△P<0.01
由表3可見,與正常對照組比較,模型對照組和玉屏風散組的CD8+CD44+T細胞比例均明顯增高(P<0.05,P<0.01);玉屏風散組的CD8+CD44+CD62L-和CD8+CD44+CD62L+T細胞比例同樣明顯增加(P<0.05,P<0.01)。與模型對照組相比,玉屏風散組CD8+CD44+和CD8+CD44+CD62L-T細胞比例變化不明顯(P>0.05);而玉屏風散30 g生藥/kg組的CD8+CD44+CD62L+T細胞比例明顯增加(P<0.01)。
3 討 論
前期實驗結果表明,在腫瘤狀態下,玉屏風散對CD4+T和CD8+T比例無影響,也無劑量依賴性,反映玉屏風散在一定劑量范圍內,發揮對免疫系統的調節作用,以維持免疫系統的穩定[4]。
CD4+CD25+T細胞比例下降,表現為T細胞免疫的增強;高劑量的玉屏風散(30 g生藥/kg)可以使其進一步下降,提示玉屏風散可以通過降低CD4+CD25+調節性T比例,上調荷瘤小鼠的免疫狀態,達到抗腫瘤的效應。玉屏風散20 g、25 g生藥/kg可以使荷瘤小鼠脾臟中CD8+CD69+T細胞比例進一步明顯增加(P<0.05),這提示玉屏風散有促進CD8+T淋巴細胞活化的作用,發揮T淋巴細胞,尤其是細胞毒性T細胞殺傷腫瘤細胞的作用。但玉屏風散30 g生藥/kg劑量組明顯降低荷瘤小鼠脾臟中CD4+CD69+和CD8+CD69+T細胞比例(P<0.05,P<0.01),且降低至正常小鼠的水平,這其中的作用機制還有待于進一步的研究。這可能與玉屏風散對免疫調節作用主要體現維持機體內的免疫平穩狀態有關。荷瘤小鼠脾臟中CD8+CD44+CD62L-和CD8+CD44+CD62L+T細胞比例均增高,表明荷瘤小鼠細胞毒性T細胞活性增強;玉屏風散可以保持這種增高狀態,而且高劑量玉屏風散(30 g生藥/kg)可進一步增加荷瘤小鼠脾臟中CD8+CD44+CD62L+T細胞的比例(P<0.01),提示玉屏風散可保持荷瘤小鼠細胞毒性T細胞活性的免疫增強狀態,并增加記憶型CD8+T細胞比例,增強了荷瘤小鼠對Hepa1-6腫瘤細胞的特異性T細胞免疫的激活。
玉屏風散對Hepa1-6肝癌小鼠免疫調節的機制可能是通過降低CD4+CD25+調節性T細胞比例,促進CD8+T淋巴細胞活化,增加記憶型CD8+T細胞比例,從而改善荷瘤小鼠免疫紊亂狀態,達到抗腫瘤的效應。但由于實驗方法的局限性,需要進一步采用原位種植荷瘤小鼠模型或基因敲除誘導型腫瘤模型,觀察玉屏風散對腫瘤免疫調節的特點。
[1] 周若梅,李來秀.玉屏風口服液的藥理學研究[J].陜西中醫,2004,25(1):71-73.
[2] 周春權,姚欣,林靜瑜,等.玉屏風粗多糖的提取及藥理實驗[J].海峽藥學,2004,16(2):38-40.
[3] 張紅軍,唐小云,鞠寶玲,等.玉屏風散對S180荷瘤小鼠腫瘤生長及免疫功能的影響[J].細胞與分子免疫學雜志,2008,24(7):683-685.
[4] 張露蓉,姚霏,江國榮.玉屏風散對Hepa1-6肝癌荷瘤小鼠免疫調節的影響[J].東南大學學報:醫學版,2014,33(1):34-39.
[5] 李鳳銘,陳劍華,孫雪文,等.加味玉屏風散對60Coγ照射小鼠T淋巴細胞免疫功能的影響[J].時珍國醫國藥,2011,22(5):1179-1180.
[6] 王月飛,趙紅曄,王玉閣,等.玉屏風散生物轉化液對免疫抑制小鼠細胞免疫的干預作用[J].中國實驗方劑學雜志,2010,16(14):176-178.
[7] Piccirilllo CA,Shevach EM.Naturally-occurring CD4+CD25+immunoregulatory T cells: central players in the arena of peripheral tolerance[J].Semin Immunol,2004,16(2):81-88.
[8] Terabe M,Berzofsky JA.Immunoregulatory T cells in tumor immunity[J].Curr Opin Immunol,2004,16(2):157-162.
[9] Testi R,D'Ambrosio D,De Maria R,et al.The CD69 receptor: a multipurpose cell-surface trigger for hematopoietic cells[J].Immunol Today,1994,15(10):479-483.
[10] Ziegler SF,Ramsdell F,Alderson MR.The activation antigen CD69[J].Stem Cells,1994,12(5):456-465.
[11] Simms PE,Ellis TM.Utility of flow cytometric detection of CD69 expression as a rapid method for determining poly-and oligoclonal lymphocyte activation[J].Clin Diagn Lab immunol,1996,3(3):301-304.
[12] 付立奎,劉寧寧,高立生.CD69分子在腫瘤抗原體外活化H22肝癌腹水瘤小鼠脾淋巴細胞的表達[J].河北醫學,2010,16(6):649-652.
(本文編輯:李珊珊)
·信息·
2013年度中國藥學發展獎頒獎
5月7日,2013年度中國藥學發展獎頒獎大會在京舉行,中國藥科大學王廣基院士榮獲特殊貢獻獎。來自中國科學院上海藥物研究所、軍事醫學科學院毒物藥物研究所等單位的17位專家分別獲得創新藥物獎、康辰骨質疏松醫藥研究獎以及食品藥品質量檢測技術獎。
中國藥學發展獎是經科技部首批批準的26個全國性獎項之一,是由社會力量設立的全國性醫藥學獎項,每兩年頒獎一次。該獎項旨在獎勵在醫藥學領域作出突出貢獻或取得重大科技成果的醫藥學科技工作者,促進醫藥事業的發展。此次會議由中國藥學發展獎獎勵工作委員會和中國藥學會聯合主辦。
InfluenceofYupingfengpowderonTlymphocytesphenotypeinHepa1-6HCCtumor-bearingmice
YAOFei,ZHANGLurong,JIANGGuorong.
Wu’sInstituteofMedicalSchool,SuzhouHospitalofTraditionalChineseMedicineAffiliatedtoNanjingUniversityofTraditionalChineseMedicine,Jiangsu,Suzhou215009
ObjectiveTo research the effect of Yupingfeng powder on T lymphocytes phenotype in Hepa1-6 HCC tumor-bearing mice.MethodsA tumor-burdened C57BL / 6 mice model were established by injecting Hepa1-6 cells into mice intradermally. Model mice were randomly divided into model group,low-,middle-,and high-dose (20,25,30g crude drug/kg) Yupingfeng powder group. Not tumor-burdened mice were chosen in the control group. Yupingfeng powder concentrated solution was given in low-,middle-,and high-dose (20,25,30 g crude drug/kg) Yupingfeng powder group,once a day. Control group and model group was fill in with the same amount of saline solution,for two weeks in a row. After two weeks CD4,CD8,CD25,CD69,CD44 and CD62L were analyzed by immunofluorescence method and flow cytometry.ResultsCompared with control group,the proportion of CD4+CD25+T Cells in Yupingfeng powder group were reduced (P<0.05,P<0.01); the proportion of CD4+CD69+,CD8+CD69+,CD8+CD44+,CD8+CD44+CD62L-and CD8+CD44+CD62L+T Cells were increased (P<0.05,P<0.01). There was no difference between model group and Yupingfeng powder group on the proportion of CD8+CD44+and CD8+CD44+CD62L-T cells (P>0.05). The ratio of CD8+CD69+T Cells in mid and low dose Yupingfeng powder group were increased (P<0.05); the proportion of CD4+CD25+T Cells had reducing trend in high dose group,but did not have any statistical significance; the proportion of CD4+CD69+and CD8+CD69+T Cells both reduced (P<0.05,P<0.01); the proportion of CD8+CD44+CD62L+T Cells increased (P<0.01).ConclusionYupingfeng powder have antineoplastic effects which are embodied in these areas,it can reduce the ratio of CD4+CD25+regulatory T Cell,improve the activation of CD8+T cells,raise the ratio of memory CD8+T cells and then improve the immunologic derangement state of C57 mice.
Yupingfeng powder; Liver cancer; Disease models; Animal; Mouse; T lymphocytes; Phenotype
※ 項目來源:2009—2010年度江蘇省中醫藥科技項目(編號:LZ09119);蘇州市2009年度高層次人才資助項目(編號:2009-07);2009年蘇州市科教興衛青年科技項目(編號:SWKQ0928);蘇州市2010年度第四批科技發展計劃(應用基礎研究)項目(編號:SYS201053)
△ 通訊作者:江蘇省蘇州市中醫醫院吳門醫派研究院,江蘇 蘇州 215009
姚霏(1985—),女,中藥師,學士。研究方向:主要從事中藥與腫瘤免疫工作。
R289.5;R735.7;R331.125
A
1002-2619(2014)05-0742-04
2013-06-21)

