(S)-(-)-norlaudanosine和(S)-(-)-O,O-dimethylcoclaurine的合成*
丁 偉,呂 霞,劉世領,朱瑞恒,施小新
(華東理工大學 藥學院 制藥工程系,上海 200237)
·研究簡報·
(S)-(-)-norlaudanosine和(S)-(-)-O,O-dimethylcoclaurine的合成*
丁 偉,呂 霞,劉世領,朱瑞恒,施小新
(華東理工大學 藥學院 制藥工程系,上海 200237)
N-Ts homoveratrylamine(2)was prepared byN-sulfonylation of 3,4-diemthoxydopamine.(±)-Norlaudanosine(5a)and (±)-O,O-dimethylcoclaurine(5b)were synthesized by Pictet-Spengler reaction of 2with styryl methyl ethers catalyzed by PTS and removal of Ts group.(S)-(-)-5aand (S)-(-)-5bwere obtained by half-equivalent resolution withN-Ac-L-phe.The structures were confirmed by1H NMR,13C NMR,IR,MS and HR-ESI-MS.
Pictet-Spengler reaction;norlaudanosine;O,O-dimethylcoclaurine;synthesis;resolution
芐基四氫異喹啉類化合物在自然界中廣泛存在[1-2]。相關研究表明這類結構化合物具有廣泛的生理活性[3-5],可方便地轉化成其它生物堿,如阿樸啡類生物堿、嗎啡類生物堿、小檗堿類生物堿、二芐基四氫異喹啉類生物堿等[6-7]。
norlaudanosine(5a)是合成多種藥物分子的關鍵中間體[3],而O,O-dimethylcoclaurine(5b)是合成去甲烏藥堿的前體[8]。目前這兩個化合物的單一構型主要通過不對稱合成或消旋體拆分制得。但是文獻報道的不對稱合成方法需要使用價格昂貴的手性催化劑[8-9]或手性輔基[10-11],而傳統的全量拆分方法[12-13]需要用到高劑量的拆分劑,造成拆分劑的浪費。
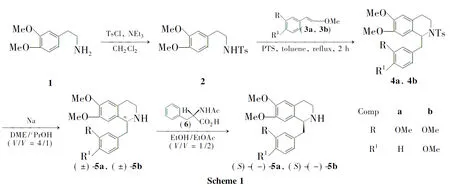
本文以高藜蘆胺(1)為起始原料,經N-磺酰化反應制得高藜蘆磺酰胺(2);2分別與芳乙烯甲醚(3a和3b)經對甲苯磺酸(PTS)催化的Pictet-Spengler反應后用金屬鈉脫除Ts基團合成了(±)-5a和(±)-5b;使用半量拆分法,以N-乙酰-L-苯丙氨酸(6)為拆分劑,將(±)-5a或(±)-5b拆分制得(S)-(-)-5a和(S)-(-)-5b(Scheme 1),其結構經1H NMR,13C NMR,IR,MS和HR-ESI-MS確證。并對拆分條件進行了優化,首次報道了(S)-(-)-5b的拆分方法。
1 實驗部分
1.1 儀器與試劑
SGW X-4型顯微熔點儀(溫度未校正);WZZ-1S型自動旋光儀;Bruker ADVANCE 400MHz型核磁共振儀(CDCl3為溶劑,TMS為內標);NICOLET IR 550型紅外光譜儀(KBr壓片);HP 5989A型質譜儀;Shimadzu LC-20A型高效液相色譜儀[手性柱:Chiralcel OD;流動相:正己烷/異丙醇=80/20(V/V),流速:1.0mL·min-1;UV檢測波長:220nm]。
所用試劑均為分析純。
1.2 合成
(1)2的合成
在反應瓶中依次加入15.00g(27.59mmol),CH2Cl250mL和NEt34.18g(41.39mmol),冰水浴冷卻,攪拌下分批(5次)加入對甲苯磺酰氯(TsCl)5.15g(27.04mmol),自然升至室溫,反應2h(TLC檢測)。加1mol·L-1鹽酸20mL,分液,有機層用10% K2CO3溶液(10mL)洗至堿性,無水MgSO4干燥,蒸干得淡黃色固體,用20%甲醇(3×15mL)洗滌,干燥得白色固體28.25g,產率91%,m.p.131℃~132℃;1H NMRδ: 2.40(s,3H),2.68(t,J=6.8Hz,2H),3.16(t,J=6.7Hz,2H),3.78(s,3H),3.83(s,3H),4.39(s,1H),6.54(d,J=1.7Hz,1H),6.60(dd,J=1.7Hz,1H),7.25(d,J=3.7Hz,1H),7.27(s,1H),7.65(d,J=8.2Hz,2H);IRν:3110,2980,1590,1510,1330,1260,810,550cm-1;EI-MSm/z(%): 335[M+,36],184(15),151(100),91(29)。
(2)4的合成(以4a為例)
在反應瓶中依次加入21.00g(2.98mmol)和甲苯15mL,攪拌下依次加入3,4-二甲氧基苯乙烯基甲醚(3a)0.70g(3.58mmol)和PTS 11mg(0.06mmol),回流反應2h。冷卻至室溫,用1mol·L-1K2CO3溶液(2mL)洗滌,無水MgSO4干燥,濃縮后用乙醇重結晶(加入少量晶種)得N-磺酰化norlaudanosine(4a)1.33g。
用類似的方法合成4b。
4a:白色固體,產率90%,m.p.143℃~145℃;1H NMRδ: 2.34(s,3H),2.34~2.43(m,1H),2.53~2.66(m,1H),3.01(dd,J=13.5Hz,7.2Hz,1H),3.12(dd,J=13.5Hz,5.8Hz,1H),3.28~3.39(m,1H),3.56~3.65(m,1H),3.66(s,3H),3.74(s,3H),3.79(s,3H),3.85(s,3H),5.08(dd,J=6.5Hz,1H),6.20(s,1H),6.43(s,1H),6.51(d,J=1.8Hz,1H),6.56(dd,J=8.1Hz,1.8Hz,1H),6.72(d,J=8.1Hz,1H),7.13(d,J=8.1Hz,2H),7.52(d,J=8.3Hz,2H);13C NMRδ: 21.5,26.9,39.8,43.9,55.7,55.8(2C),55.9,57.5,110.2,110.9,111.2,112.9,122.1,125.6,127.1,127.4,129.4,130.2,137.3,143.0,146.9,147.8(2C),148.6;IRν:2935,1612,1518,1462,1292,1231,1148,1112,1027,976,811,564cm-1;HR-ESI-MSm/z: Calcd for C27H32NO6S{[M+H]+}498.1950,found 498.1950。
N-磺酰化O,O-dimethylcoclaurine(4b): 白色固體,產率92%,m.p.129℃~131℃;1H NMRδ: 2.27(s,3H),2.31~2.42(m,1H),2.48~2.61(m,1H),2.90(dd,J=13.5Hz,7.6Hz,1H),3.05(dd,J=13.5Hz,5.9Hz,1H),3.26~3.37(m,1H),3.55(s,3H),3.56~3.62(m,1H),3.70(s,3H),3.72(s,3H),4.99(dd,J=6.8Hz,1H),6.04(s,1H),6.36(s,1H),6.65~6.75(m,2H),6.82~6.91(m,2H),7.05(d,J=8.1Hz,2H),7.45(d,J=8.3Hz,2H);13C NMRδ: 21.5,26.9,39.8,43.4,55.2,55.7,55.8,57.7,110.2,111.1,113.7,125.4,127.1,127.4,129.8,130.9,137.3,143.0,146.7,147.7,158.4;IRν:2935,1615,1519,1460,1321,1248,1156,1112,813,564cm-1;HR-ESI-MSm/z: Calcd for C26H30NO5S{[M+H]+}468.1845,found 468.1843。
(3)(±)-5的合成[以(±)-5a為例]
在反應瓶中依次加入4a1.00g(2.01mmol)和混合溶劑[V(DME)∶V(iPrOH)=4∶1]20mL,攪拌使其溶解;加入小鈉絲0.92g (40mmol),劇烈攪拌下于35℃~ 40℃反應1h(TLC檢測)。冰水浴冷卻,加入碎冰5g破壞剩余小鈉絲,旋蒸除去有機溶劑,用乙酸乙酯(15mL)萃取,有機相用水(10mL)洗滌,洗液用乙酸乙酯(10mL)萃取,合并有機相,用無水MgSO4干燥,旋蒸除溶得無色油狀液體,用乙醇10mL溶解,滴加濃鹽酸0.3mL,于室溫攪拌30min,蒸干溶劑(析出固體),用乙酸乙酯(2mL)洗滌,過濾,濾餅干燥得白色鹽酸鹽固體0.72g。用1mol·L-1的K2CO3溶液(10mL)中和,用乙酸乙酯(2×10mL)萃取,合并有機相,用無水MgSO4干燥,蒸干得無色油狀液體(±)-5a0.64g。
用類似方法合成(±)-5b。
(±)-5a:產率92%;1H NMRδ: 1.85(br s,1H),2.64~2.80(m,2H),2.81~2.97(m,2H),3.09~3.28(m,2H),3.84(s,3H),3.86(s,6H),3.88(s,3H),4.13(dd,J=9.1Hz,4.1Hz,1H),6.60(s,1H),6.67(s,1H),6.76(s,1H),6.78~6.86(m,2H);13C NMRδ: 29.5,40.9,42.2,55.81,55.84,55.9,56.0,56.8,109.3,111.2,111.8,112.3,121.4,127.4,130.3,131.4,147.0,147.4,147.6,148.9;IRν:3598,3331,2933,2831,1734,1608,1514,1463,1216,1113,1028,803cm-1;EI-MSm/z: 343[M+,1],206(1),192(100),176(7),151(3)。
(±)-5b: 無色油狀液體,產率91%;1H NMRδ: 1.95(s,1H),2.62~2.80(m,2H),2.80~2.95(m,2H),3.10~3.25(m,2H),3.79(s,3H),3.81(s,1H),3.85(s,3H),4.10(dd,J=9.4Hz,4.1Hz,1H),6.59(s,1H),6.63(s,1H),6.82~6.89(m,2H),7.13~7.20(m,2H);13C NMRδ: 29.5,40.7,41.8,55.2,55.8,55.9,56.9,109.4,111.8,114.0,127.3,130.3,130.6,131.0,146.9,147.4,158.2;IRν:3330,2935,2829,1610,1469,1300,1245,1179cm-1;HR-ESI-MSm/z: Calcd for C19H23NO3{[M+H]+}314.1756,found 314.1743。
(4)(S)-(-)-5的合成[以(S)-(-)-5a為例]
2 結果與討論
2.1 Pictet-Spengler反應條件優化
實驗中我們首先嘗試了1和3的Pictet-Spengler反應,發現反應需過量酸催化且收率很低(20%~30%);之后參考文獻[15]方法嘗試了高藜蘆羧酰胺與3的Pictet-Spengler反應,發現反應仍需過量三氟乙酸催化,收率中等(62%);最后改用高藜蘆磺酰胺2與3進行Pictet-Spengler反應,收率很高,且只需2mol%PTS催化。
對于2與3的Pictet-Spengler反應,若選用乙酸或苯甲酸等弱酸作催化劑,則反應幾乎不能進行;若用較強的Lewis酸,如三氟化硼乙醚、四氯化鈦、氯化鐵、氯化鋁等作催化劑,則原料3容易分解,反應較亂;而選用中強酸PTS作催化劑,收率較高。
2.2 拆分條件優化
對于(±)-5a的手性拆分,王保成[12]用1.06eq.N-乙酰-D-苯丙氨酸為拆分劑,以97%的純度和32%的產率制得(R)-(+)-5a;Hill等[13]用1.00eq.N-乙酰-L-亮氨酸作拆分劑,以97%的純度和40%的產率制得(R)-(+)-5a。本文用0.50eq.6為拆分劑,以99%的純度和34%的產率制得(S)-(-)-5a,相比文獻方法,減少拆分劑的用量,避免了浪費。
考察了以6為拆分劑時不同溶劑對拆分效果的影響,結果見表1。從表1可以看出,用AcOEt作溶劑時,產率較高,但ee值不高;而用EtOH作溶劑時,產率不高,但ee值很高;而用EtOH/AcOEt(V/V=1/2)混合溶劑作溶劑時,產率和ee值均較高。
(±)-5b的手性拆分未見文獻報道,本文首次通過拆分制得(S)-(-)-5b。其最佳拆分條件與(±)-5a一致。

表1 溶劑對拆分(±)-5a的影響Table1 Effect of solvents on resolution of (±)-5a
aV/V=1/2;b由手性柱Chiralcel OD測定
3 結論
首次通過Pictet-Spengler反應合成了(S)-(-)-norlaudanosine和(S)-(-)-O,O-dimethylcoclaurine。在文獻方法的基礎上對(±)-norlaudanosine的拆分進行了改進,并且首次對(±)-O,O-dimethylcoclaurine的手性拆分進行了研究。
[1] Hesse M.Thieme Pocket Textbook of Organic Chemistry[M].Thieme:Stuttgart,1978.
[2] Liscombe D K,MacLeod B P,Loukanina N,etal.Evidence for the monophyletic evolution of benzylisoquinoline alkaloid biosynthesis in angiosperms[J].Phytochemistry,2005,66:1374-1393.
[3] Khorana N,Markmee S,Ingkaninan K,etal.Evaluation of a new lead for acetylcholinesterase inhibition[J].Med Chem Res,2009,18:231-241.
[4] Li Y,Zhang H B,Huang W L,etal.Design and synthesis of tetrahydroisoquinoline derivatives as potential multidrug resistance reversal agents in cancer[J].Bioorg Med Chem Lett,2008,18:3652-3655.
[5] Zou Z H,Lan X B,Qian H,etal.Synthesis and evaluation of furoxan-based nitric oxide-releasing derivatives of tetrahydroisoquinoline as anticancer and multidrug resistance reversal agents[J].Bioorg Med Chem Lett,2011,21:5934-5938.
[6] Kitamura M,Hsiao Y,Otha M,etal.General asymmetric synthesis of isoquinoline alkaloids.Enantioselective hydrogenation of enamides catalyzed by BINAP-ruthenium(Ⅱ)complexes[J].J Org Chem,1994,59:297-310.
[7] Huang W J,Singh O V,Chen C H,etal.Synthesis of (±)-Glaucine and (±)-Neospirodienone via an one-pot Bischler-Napieralski reaction and oxidative coupling by a hypervalent iodine reagent[J].Helvetica Chimica Acta,2004,87:167-174.
[8] Poy M K,Lee D K,Kim D H,etal.Enantioselective synthesis of (R)-(+)- and (S)-(-)-higenamine and their analogues with effects on platelet aggregation and experimental animal model of disseminated intravascular coagulation[J].Bioorg Med Chem Lett,2008,18:4110-4114.
[9] Werner F,Blank N,Opatz T.Synthesis of (-)-(S)-norlaudanosine,(+)-(R)-O,O-dimethylcoclaurine,and (+)-(R)-salsolidine by alkylation of anα-aminonitrile[J].Eur J Org Chem,2007,3911-3915.
[10] Pedrosa R,Andres C,Iglesias J M.A novel straightforward synthesis of enantiopure tetrahydroisoquinoline alkaloids[J].J Org Chem,2001,66:243-250.
[11] Munchhof M J,Meyers A I.A novel asymmetric route to the 1,3-disubstituted tetrahydroisoquinoline,(-)-argemonine[J].J Org Chem,1996,61:4607-4610.
[12] 王保成.四氫罌粟堿的拆分研究[J].化工時刊,2009,23:28-29.
[13] Hill D A,Turner G L.Neuromuscular blocking agents[P].US 5453510,1995.
[14] Yamazaki N,Suzuki H,Aoyagi S,etal.Lewis acid-mediated nucleophilic alkylations on chiral [6,3a,4]oxadiazaindano[5,4-a]isoquinolines.Asymmetriy synthesis of 1-alkyl substituted tetrahydroisoquinolines[J].Tetrahedron Lett,1996,37:6161-6164.
[15] Comins D L,Thakker P M,Baevsky M F.Chiral auxiliary mediated pictet-spengler reactions:Asymmetric syntheses of (-)-laudanosine,(+)-glaucine and (-)-xylopinine[J].Tetrahedron,1997,53:16327-16340.
2014-02-27
國家自然科學基金資助項目(20972048);上海市教育發展基金資助項目(03SG27)
丁偉(1986-),男,漢族,浙江紹興人,博士研究生,主要從事藥物合成的研究。
施小新,教授,博士生導師,Tel.021-64252052,E-mail: xxshi@ecust.edu.cn
以高藜蘆胺為起始原料,經N-磺酰化反應制得高藜蘆磺酰胺(2);2分別與芳乙烯甲醚經對甲苯磺酸催化的Pictet-Spengler反應后用金屬鈉脫除Ts基團合成了(±)-norlaudanosine(5a)和(±)-O,O-dimethylcoclaurine(5b);使用半量拆分法,以N-乙酰-L-苯丙氨酸為拆分劑,制得(S)-(-)-5a和(S)-(-)-5b,其結構經1H NMR,13C NMR,IR,MS和HR-ESI-MS確證。
Pictet-Spengler反應;norlaudanosine;O,O-dimethylcoclaurine;合成;拆分
O625.3;O626.3
A
1005-1511(2014)05-0679-04
Synthesisof(S)-(-)-norlaudanosineand(S)-(-)-O,O-dimethylcoclaurine
DING Wei, LU Xia, LIU Shi-ling, ZHU Rui-heng, SHI Xiao-xin
(Department of Pharmaceutical Engineering,School of Pharmacy,East China University of Science and Technology,Shanghai 200237,China)

