響應面法優化土茯苓總黃酮的提取工藝
★ 王敏 胡夢梅 陳文龍 盧傳禮 朱偉
(廣州中醫藥大學第二臨床醫學院 廣東 廣州 510000)
土茯苓為百合科植物光葉菝葜(SmilarglabraRoxb.)的干燥根莖,其性味甘、淡、平,歸肝、胃經,具有解毒,除濕,通利關節之功,可用于梅毒及汞中毒所致的肢體拘攣,筋骨疼痛;濕熱淋濁,帶下,癰腫,瘰疬,疥癬等疾病[1]。化學成分研究表明,土茯苓根莖含有甾體皂甙、黃酮及黃酮甙類、苯丙素類、鞣質等成分[2]。在各類成分中,黃酮類化合物被認為是土茯苓中最重要的活性成分[3]。目前,在土茯苓總黃酮提取工藝研究方面,多采用正交實驗設計[4,5],其注重如何科學合理地安排實驗,可同時考慮幾種因素,尋找最佳因素水平組合,但它不能在給出的整個區域上找到因素和響應值之間的一個明確的函數表達式即回歸方程。
響應面分析法(response surface methodology, RSM)是一種優化多變量系統的有效試驗工具,可采用多元二次回歸方程來擬合多個因素與響應值之間、因素與因素之間的函數關系,找出各因素的最佳組合和響應值的最優值,有效地解決多變量問題。由于響應面分析法在優化研究中具有實驗次數少、精確度高、降低成本、提高產出、優化加工條件、解決生產過程中實際問題等優點,已被廣泛用于生物、化學、食品等領域[6,7]。因此,本實驗采用響應面法,以總黃酮提取率為響應值,考察提取時間、乙醇濃度、提取溫度、料液比等提取條件之間交互作用對總黃酮提取率的影響,優化土茯苓總黃酮的最佳工藝條件。
1 材料與方法
1.1 材料 土茯苓藥材購自康美中藥飲片(批號:12120527),經廣東省中醫院藥學部陳燕芬主任中藥師鑒定為百合科光葉菝葜(SmilarglabraRoxb.)的干燥根莖,符合2010版《中國藥典》的規定。原料經干燥,粉碎,過200目篩后得到均勻粉末,避光、干燥保存備用。蘆丁(≥99%,成都曼斯特生物科技有限公司);其他試劑均為國產分析純,實驗用水為去離子水。
1.2 總黃酮的提取 準確稱取2 g土茯苓粉末置于大小適中的錐形瓶內,按不同的料液比(1∶10~1∶60 g/mL)加入一定濃度的乙醇溶液(15~90%,v/v),搖均,放置于一定溫度(25~75℃)的恒溫水浴中,提取一段時間(10~60 min),4000 r/min離心20 min,取出上清液,按上述步驟重復2次,合并上清液,定容,4℃避光保存,待測。
1.3 總黃酮的含量測定 采用亞硝酸鈉-硝酸鋁-氫氧化鈉顯色體系,以蘆丁為基準,進行總黃酮的含量測定[6]。
1.3.1 蘆丁標準曲線的制作 精密稱取蘆丁對照品0.004 0 g,70%乙醇溶解,并定容至10 mL,搖均,得質量濃度為400 μg·mL對照品溶液,4℃避光保存,備用。將對照品溶液用70%乙醇溶液稀釋成一系列濃度(0,25,50,100,150,200,400 μg/mL)溶液。分別取0.5 mL上述溶液加入0.075 mL亞硝酸鈉溶液(5%),搖均,放置6 min;然后分別加入0.075 mL硝酸鋁溶液(10%),搖勻,放置6 min;再分別加入1 mL氫氧化鈉溶液(4%),搖均,放置10 min后,490 nm波長處測定吸光度值,每組反應液平行3次。以吸光度(Y)為縱坐標,以蘆丁質量濃度(X)為橫坐標,繪制標準曲線,得回歸方程Y=0.001 8X+0.037 3(r=0.999 7),蘆丁在濃度25~400 μg/mL范圍內與吸光度呈良好的線性關系。
1.3.2 樣品中總黃酮的提取率計算 取待測樣品溶液0.5 mL,用70%乙醇溶液進行適當稀釋,按1.3.1節方法測定樣品的吸光度,按下式計算總黃酮的提取率:
1.4 響應面實驗設計 通過單因素預試驗,選擇提取時間、乙醇濃度、提取溫度、料液比4個因素,采用Design Expert 7.0.0 統計分析軟件中Box-Behnken的實驗設計,設計4因素3水平的響應面試驗,利用響應面實驗結果,確定土茯苓中總黃酮的最佳提取條件。試驗因素與水平設計見表1。

表1 Box-Behnken試驗設計因素與水平的編碼
2 結果與分析
2.1 各因素單獨對總黃酮提取率的影響

圖2 各因素單獨對總黃酮提取率的影響
單因素實驗分別考察了提取時間、乙醇濃度、提取溫度以及料液比4個因素,以總黃酮提取率作為評價指標,在確定其他參數不變的情況下改變其中一個參數進行單因素實驗,實驗結果見圖2。從圖2A中可以看出總黃酮提取率隨著時間的增加而升高,藥材與溶劑接觸的時間延長有利于土茯苓中總黃酮的溶出;在20 min時提取率達到最大,隨后緩慢下降至平緩。圖2B表明提取溫度越高,土茯苓總黃酮提取率越好,其可能的原因在于溫度升高促進了溶劑分子的熱運動,同時降低了溶劑的黏性,更利于溶劑對于細胞壁的穿透性[5],但溫度在65℃時提取率趨于平緩,故選取65℃為佳。由圖2C可見總黃酮提取率隨乙醇濃度升高而增加,當乙醇濃度超過一定范圍時,提取率反而下降,這可能是由于黃酮易溶于中等或者中等偏上極性的溶劑中[9],故選取55%為宜。圖2D結果表明,料液比增加,總黃酮提取率先上升后降低,當料液比超過1∶20時,提取率增長速度降低趨于平緩,雖在1∶40處提取率達到最大,但考慮到若采用較大的料液比時,一方面增加了乙醇的用量,另一方面也增加了后續工藝的難度,最終導致生產成本的增加,故選擇1∶20為宜。
2.2 響應面優化工藝實驗結果
2.2.1 Box-Behnken實驗設計與回歸模型的建立 根據單因素實驗結果以及Box-Behnken設計原理,以提取時間(X1)、乙醇濃度(X2)、提取溫度(X3)和料液比(X4)四個因素為自變量,總黃酮提取率為響應值,設計了共29個實驗組的響應面分析實驗,每組實驗平行3次,試驗方案和結果見表2。
2.2.2 建立模型回歸方程與顯著性檢驗 利用Design Expert 7.0.0軟件對表2的結果進行多元線性回歸擬合,得到總黃酮提取率(Y)對提取時間(X1)、乙醇濃度(X2)、提取溫度(X3)、料液比(X4)的二次多項回歸方程:
Y=35.31+1.82X1+1.14X2+1.67X3+15.45X4+3.24X1X2+2.73X1X3+6.71X1X4+0.43X2X3+4.22X2X4+1.53X3X4-8.46X12-6.32X22-7.22X32-5.96X42
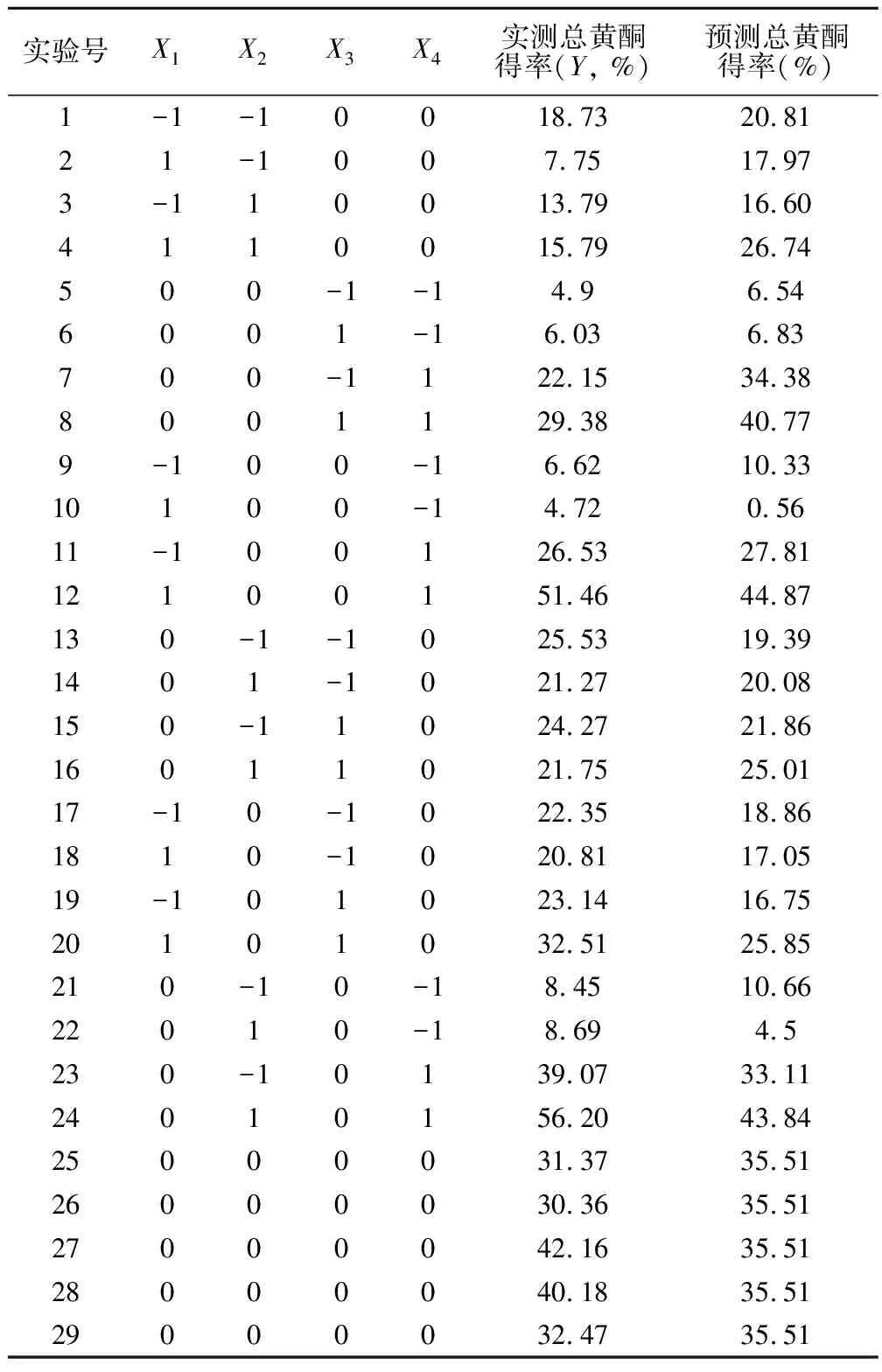
表2 Box-Behnken試驗設計與結果
為考察上述回歸方程的有效性及各因素對提取率的影響程度,對上述回歸模型進行方差分析,結果見表3。由表3可以看出模型極顯著(Prob>F值為0.009 1小于0.01),而失擬項(Lack of Fit)不顯著(Prob>F值為0.132 2大于0.05),說明該方程對試驗擬合較好。單個因素X4和二次項X12對響應值的影響顯著。
2.2.3 響應面優化工藝分析 為了進一步研究相關變量之間的交互作用,利用Design Expert 軟件模擬了影響因素對總響應因子交互影響的3D響應曲面圖(圖3),將其中兩個因素固定在零水平,考察另外兩個因素之間的交互作用。從曲面圖和對應的等高線的形狀可以直觀反映出兩自變量交互作用的顯著程度,圓形表示兩因素交互作用不顯著,橢圓形表示兩因素交互作用顯著[10,11]。
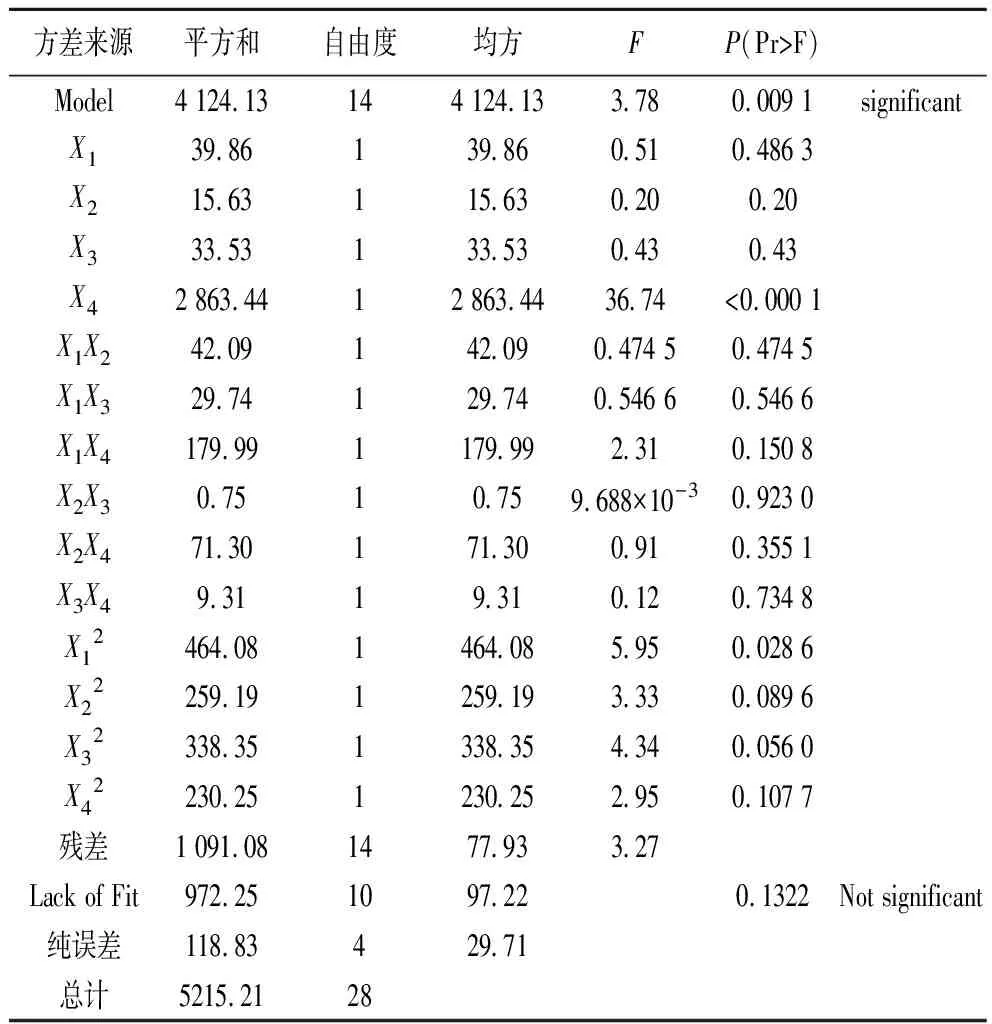
表3 響應面分析法對總黃酮提取率的方差分析結果
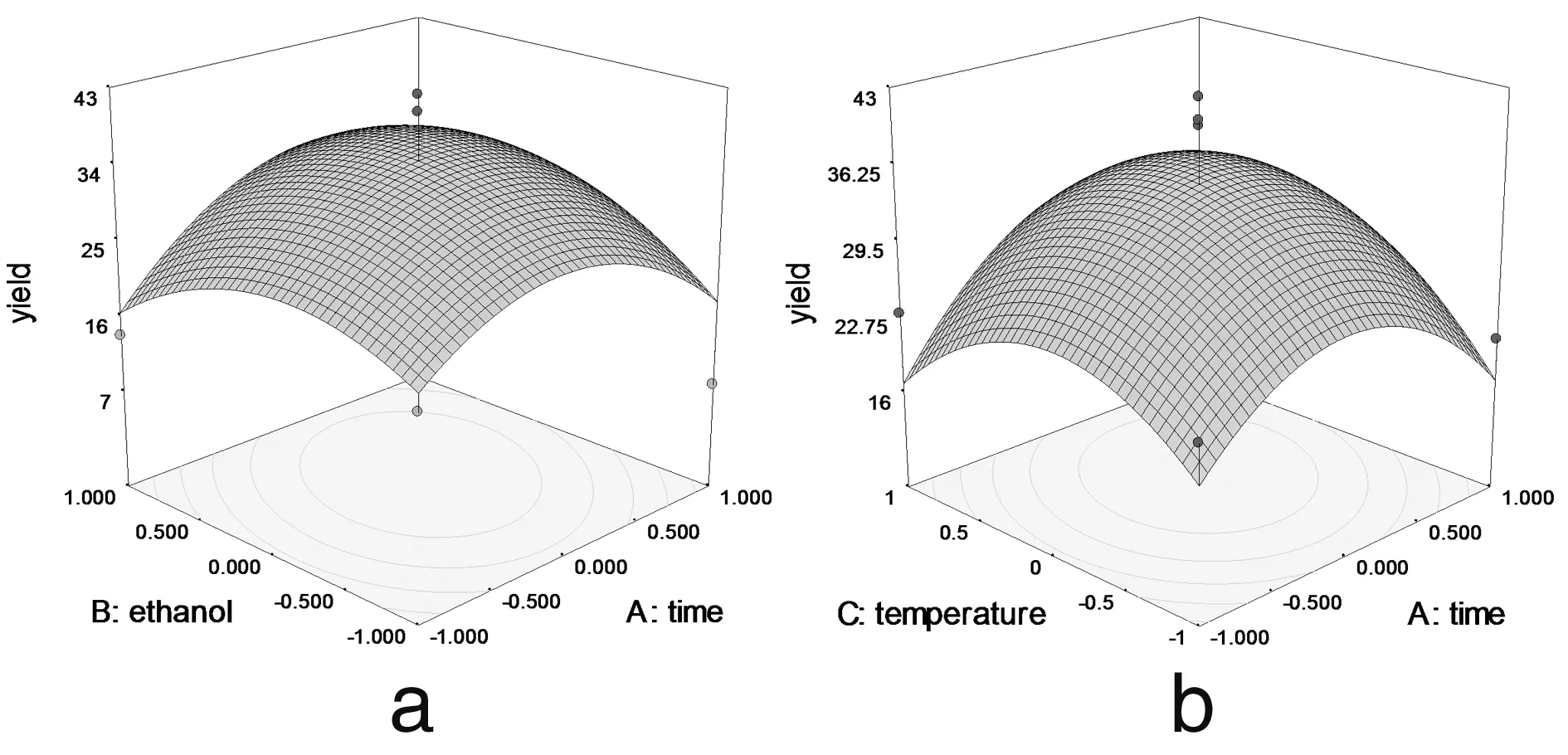
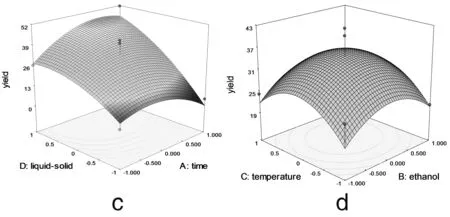
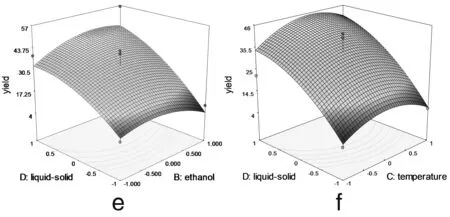
圖3 各兩因素交互作用對總黃酮提取率影響的響應面圖
由圖3可以看出料液比和提取時間 (3c)、乙醇濃度(3e)、提取溫度 (3f) 兩兩之間的交互作用非常顯著,表現為曲面較陡,等高線沿料液比方向變化較快,而沿其他因素方向變化較慢。在實驗水平下,料液比對提取率的影響比提取時間、提取溫度、乙醇濃度顯著[12]。圖3a顯示了提取時間和乙醇濃度對總黃酮提取率的影響。可以看出,隨著提取時間和乙醇濃度的同時增大,提取率呈先增大后降低的拋物線趨勢,其原因有可能與黃酮類物質的極性大小和穩定性有關[13]。但二者交互作用對提取率的影響不顯著。圖 3b 和3d與圖3a十分相似,等高線近似圓形,表明提取時間和提取溫度以及提取溫度和乙醇濃度交互作用對總黃酮提取率影響不顯著。
利用Design Expert 7.0.0軟件對回歸模型進行進一步的典型性分析,得到最優提取工藝條件為:提取時間35.2 min、乙醇濃度:58.05%、提取溫度:68.7℃、料液比1∶30,總黃酮提取率理論值為49.931%。
2.3 驗證實驗 為檢驗響應面分析法所得結果的可靠性,采用上述優化條件進行土茯苓總黃酮的提取實驗,考慮到實際情況,將修正后的最優提取條件定為:提取時間35min、乙醇濃度58%、提取溫度69℃、料液比1∶30,提取次數3次,共進行3次平行實驗,得到土茯苓總黃酮的平均提取率為49.003%,略低于理論值49.931%,其與理論預測值的相對誤差為1.89%,說明響應面法設計準確,模型可靠,不失為土茯苓總黃酮提取工藝優化的一種有效方法。
3 結論
本實驗在單因素實驗的基礎上,通過響應面法優化出土茯苓總黃酮提取工藝的最優條件為:提取時間35.2 min、乙醇濃度:58.05%、提取溫度:68.7℃、料液比1∶30,提取次數3次。根據實驗實際情況修正上述條件后,總黃酮提取率為49.003%,與理論值49.931%相差不大,相對誤差為1.89%,表明響應面分析法優化得到的參數條件準確可靠,可為土茯苓藥材的工業化大規模生產提供了實驗參考和依據。
[1]國家藥典委員會.中華人民共和國藥典﹒一部[S].北京: 中國醫藥科技出版, 2010: 43.
[2]劉虎岐, 高錦明, 邱明華, 等.菝葜屬的生物學和化學研究進展[J].天然產物研究與開發, 2001,13(1): 90-93.
[3]劉世旺, 徐艷霞, 王娟.菝葜與土茯苓黃酮類化合物的比較研究[J].中國野生植物資源, 2006, 25 (3): 44-46.
[4]陳文龍, 陳燕芬, 盧傳堅, 等.土茯苓總黃酮提取工藝的正交設計優化[J].時珍國醫國藥, 2013, 25(3): 544-546.
[5]劉志剛, 曾祥騰, 孫維峰, 等.正交實驗優化土茯苓黃酮類成分提取工藝研究[J].中華中醫藥學刊, 2010, 28 (3): 466-468.
[6]李琰, 范璐, 孫秀華.葛根提取工藝的考察[J].北京中醫藥大學學報, 2001, 24(4): 26-27.
[7]Gan C Y, Latiff A A.Optimisation of the solvent extraction of bioactive compounds from Parkia speciosapod using response surface methodology[J].Food Chemistry,2011,124(4):1 277-1 283.
[8]Hossain M B, Brunton N P, Patras A.et al.Optimization of ultrasound assisted extraction of antioxidant compounds from marjoram (Origanum majoranaL.) using response surface methodology[J].Ultrasonics Sonochemistry,2012,19(3),582-590.
[9]王晉黃, 池汝安, 陳少峰, 等.土茯苓中提取總黃酮的工藝研究[J].植物研究, 2006, 26(3): 370-373.
[10]Lai J X, Xin C, Zhao Y, et al.Optimization of ultrasonic assisted extraction of antioxidants from black soybean (Glycine maxvar) sprouts using response surface methodology [J].Molecules, 2013, 18 (1): 1 101-1 110.
[11]周玉, 孫曉佳, 孫瑩, 等.響應面法分析優化毛脈酸模多糖提取工藝[J].中醫藥學報, 2013, 41 (3): 48-52.
[12]夏道宗, 于新芬, 馬志杰.二次回歸通用旋轉設計優化土茯苓總黃酮的提取工藝[J].中華中醫藥學刊, 2009, 27(7): 1 460-1 463.
[13]Wang X S, Wu Q N, Wu Y F, et al.Response surface optimized ultrasonic-assisted extraction of flavonoids from sparganii rhizoma and evaluation of their in vitro antioxidant activities[J].Molecules, 2012, 17 (6): 6 769-6 783.

