密度對大樹蛙蝌蚪生長發育和存活率的影響
謝文華,陶雙倫,楊冬梅,梁 靜,李俊年
(吉首大學生物資源與環境科學, 吉首 416000)
密度對大樹蛙蝌蚪生長發育和存活率的影響
謝文華,陶雙倫,楊冬梅,梁 靜,李俊年*
(吉首大學生物資源與環境科學, 吉首 416000)
種群密度效應主要表現在影響和調節種群的死亡率、發育速率、繁殖率以及擴散、遷移等反應種群數量動態的重要參數。分析密度對大樹蛙蝌蚪生長發育和存活率的影響,有助于探究外界環境因子導致大樹蛙種群密度迅速下降的作用機制。設置了15、20、25 只/L和30 只/L 4個密度組,測量大樹蛙蝌蚪的尾長、體長、發育時間和存活率。結果表明,在15—30 只/L范圍內,密度升高顯著降低了大樹蛙蝌蚪尾長和體長的生長速率,減小其變態期的尾長和體長大小,其中與15 只/L相比,20、25 只/L和30 只/L 3組蝌蚪的尾長分別降低了11.6%、11.8%和13.9%,體長分別降低了11.1%、9.5%和12.9%;隨著密度的升高,大樹蛙蝌蚪發育至跗蹠部伸長期和前肢伸出期的所需時間顯著延長;大樹蛙蝌蚪生長后期的存活率隨密度升高顯著降低,但密度對蝌蚪生長早期的存活率影響不顯著。因此,密度升高可顯著減小大樹蛙蝌蚪的尾長和體長、延長發育時間和降低其生長后期的存活率,可能影響大樹蛙蝌蚪變態后的適合度。
密度;生長發育;存活率;大樹蛙;蝌蚪
兩棲類動物是動物資源的重要組成部分,其種群數量在全球范圍內持續銳減,甚至一些種類已經滅絕[1]。國內外學者對于引起兩棲類種群數量下降因素(如氣候變化、生境破壞和環境污染等)做了許多的研究[2- 8],但這些研究主要是定性分析,而很少從兩棲動物生長特征的變化來探討種群下降原因[9]。密度是影響蝌蚪生長發育的重要因素[10- 14]。高密度可導致林蛙(Ranasylvatica)蝌蚪[13]、虎紋蛙(Ranarugulosus)蝌蚪[15]和綠紋樹蛙(Litoriaaurea)蝌蚪[16]生長速率下降,變態個體減小和延長發育時間。而Semlitsh和Caldwell則研究發現高密度導致掘足蟾(Scaphiopusholbrooki)蝌蚪縮短發育時間[17],施林強等研究結果顯示高密度對澤陸蛙(Fejervaryalimnocharis)蝌蚪存活率和變態體重影響不顯著[18]。雖然有關密度對兩棲動物蝌蚪生長發育特征的研究已有諸多報道,但結論不一,因此對于密度對兩棲動物蝌蚪生長發育特征的影響尚需進一步深入。
大樹蛙(Rhacophorusdennysi)主要分布于我國四川、貴州、安徽、湖南等地山區溪流邊的森林內或稻田、水坑附近的灌木和草叢中[19],以昆蟲為食,繁殖季節成蛙選擇在水田、水塘或溪流平緩處上方的灌木或草叢上吐泡排卵,卵孵化成蝌蚪時,泡沫溶解蝌蚪掉入水中[20]。湘西是大樹蛙分布的主要區域之一,但近年來由于湘西大規模修建鄉村公路、旅游開發和建設農田水利設施等原因,致使森林面積迅速下降,大樹蛙種群數量急劇銳減,湖南省已將其列為地方重點保護動物。湘西為典型的喀斯特地區,森林覆蓋面積的減少將導致土壤涵養水能力下降。一旦降水減少,許多溪流斷流,水潭干枯,致使部分可供大樹蛙蝌蚪生長的水域面積縮減,引起蝌蚪在發育期內種群密度不同程度的升高。為了探究大樹蛙蝌蚪期種群密度的升高對蝌蚪生長發育及存活率的影響,本研究在實驗室內設置了4 個不同的培養密度,研究密度因子對大樹蛙蝌蚪尾長、體長、發育時間和存活率的影響,以揭示密度對大樹蛙生長發育和存活率的影響,為進一步研究樹蛙種群數量下降的機制提供參考依據。
1 材料與方法
1.1 實驗動物
實驗動物為孵化至第7 天的大樹蛙蝌蚪。大樹蛙成體(7雄,7雌)于2011年4月26日捕捉自湘西州吉首市躍進水庫區溪流邊的杉樹,參照《中國兩棲動物圖鑒》鑒定[19]。分別配對(1雌1雄)飼養在2 m (L) × 1 m (D) × 1.5 m (H)的培養池,陸水面積各占50%,水深30 cm,陸地區栽種茶樹和芋頭供大樹蛙休憩。每天18: 00給大樹蛙投喂面包蟲(Tenebriomolitor),每隔3d換1次水(pH值6.8),清理池中的排泄物。大樹蛙抱對吐泡排卵后,任其自然孵化,孵化后的蝌蚪移至實驗室飼養,室溫控制在(24±1) ℃。
1.2 飼料
參照商業蝌蚪飼料營養水平[21],采用黃豆粉、玉米粉、麩皮、熟雞蛋黃(自市場購買)、復合VB(湖北綠金子藥業有限責任公司)和鈣片(廣西梧州制藥股份有限公司)配置蝌蚪飼料,其100 g飼料的成分與營養水平如表1。
表1 大樹蛙蝌蚪飼料的組成及營養水平
Table 1 Feed Composition and trophic level of tadpoleRhacophorusdennysi
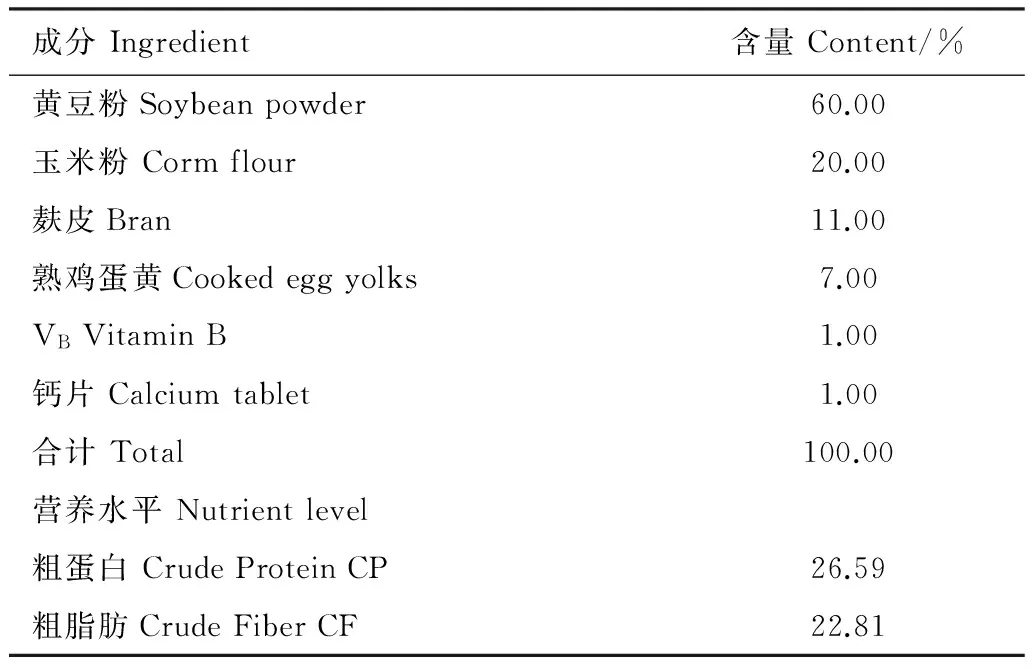
成分Ingredient含量Content/%黃豆粉Soybeanpowder60.00玉米粉Cormflour20.00麩皮Bran11.00熟雞蛋黃Cookedeggyolks7.00VBVitaminB1.00鈣片Calciumtablet1.00合計Total100.00營養水平Nutrientlevel粗蛋白CrudeProteinCP26.59粗脂肪CrudeFiberCF22.81
營養水平為計算值
1.3 實驗設計與飼養管理
雌雄配對的7對大樹蛙3對排卵,為了消除親代遺傳、母體效應等影響,實驗用的1080只蝌蚪均來自同一親代,蝌蚪培養密度設置為:15、20、25 只/L和30 只/L,培養盆(直徑×高 = 29.5 cm×9.0 cm)中水為2 L,水深約4.3 cm,每組設4個重復組和2個平行組(平行組用于補充實驗組死亡的蝌蚪數)。每天12:00換水,清洗培養盆。每天換水之后投食1次,從15 只/L到30 只/L組的投食量分別為0.3、0.4、0.5 g和0.6 g,25 d之后,各組的食物量增加1倍(飼料組成及營養水平見表1)。在室溫(24±1) ℃,水溫(20±0.2) ℃,光周期為12 L∶12 D,培養蝌蚪至變態成幼蛙。
1.4 蝌蚪生長發育及存活率參數測定
每天記錄蝌蚪的死亡數,移除死亡的個體,并從平行組中補充死亡的蝌蚪數。每隔6 d從每盆中隨機撈取5 只蝌蚪置于水深1 cm的培養皿(直徑×高 = 9.0 cm × 1.6 cm)中,進行拍照,采用ER Viewer 7.2軟件處理照片,測定蝌蚪的尾長(TL)和體長(SVL)。當蝌蚪進入變態期,每天對蝌蚪進行多次觀察并及時撈取出已進入變態期的蝌蚪(Stage 42)[22],待少量蝌蚪陸續進入變態時,停止測量蝌蚪形態參數。分別統計70%的蝌蚪發育至跗蹠部伸長期和前肢伸出期所需的時間[23]。繼續飼養至所有實驗個體均變成幼蛙時實驗結束。
1.5 統計分析
采用協方差分析檢驗(General Linear Model)不同密度組蝌蚪的尾長、體長的顯著性;體長與尾長的增長率采用反正弦轉換數值后,用單因素方差分析(One-way ANOVA)顯著性。采用單因素方差分析(One-way ANOVA)檢驗不同密度組蝌蚪發育時間的顯著性。采用卡平方(X2)檢驗不同密度組在不同測定點存活率的顯著性。所有統計分析在SPSS 13.0上進行,描述性統計值以平均值±標準誤差(Mean ± SE)表示。統計顯著水平為0.05。
2 結果
2.1 密度對大樹蛙蝌蚪生長的影響
密度升高可顯著減小蝌蚪變態期的尾長(F= 18.225,P= 0.0005)和體長(F= 11.010,P= 0.0004) (表2,表3),其中與15 只/L相比,20、25 只/L和30 只/L 3組蝌蚪的尾長分別減小了11.6%、11.8%和13.9%,體長分別減小了11.1%、9.5%和12.9%,但20、25 只/L和30 只/L 3組間蝌蚪變態期的尾長和體長無顯著性差異(TL:F= 3.492,P= 0.370; SVL:F= 0.822,P= 0.445)。
蝌蚪尾長和體長的生長速率隨密度的升高顯著降低(TL:F= 38.112,P= 0.0003; SVL:F= 21.432,P= 0.0003),但25 只/L與30 只/L組間的體長和尾長的生長速率無顯著性差異(TL:F= 3.171,P= 0.083; SVL:F= 1.220,P= 0.276)(圖1)。
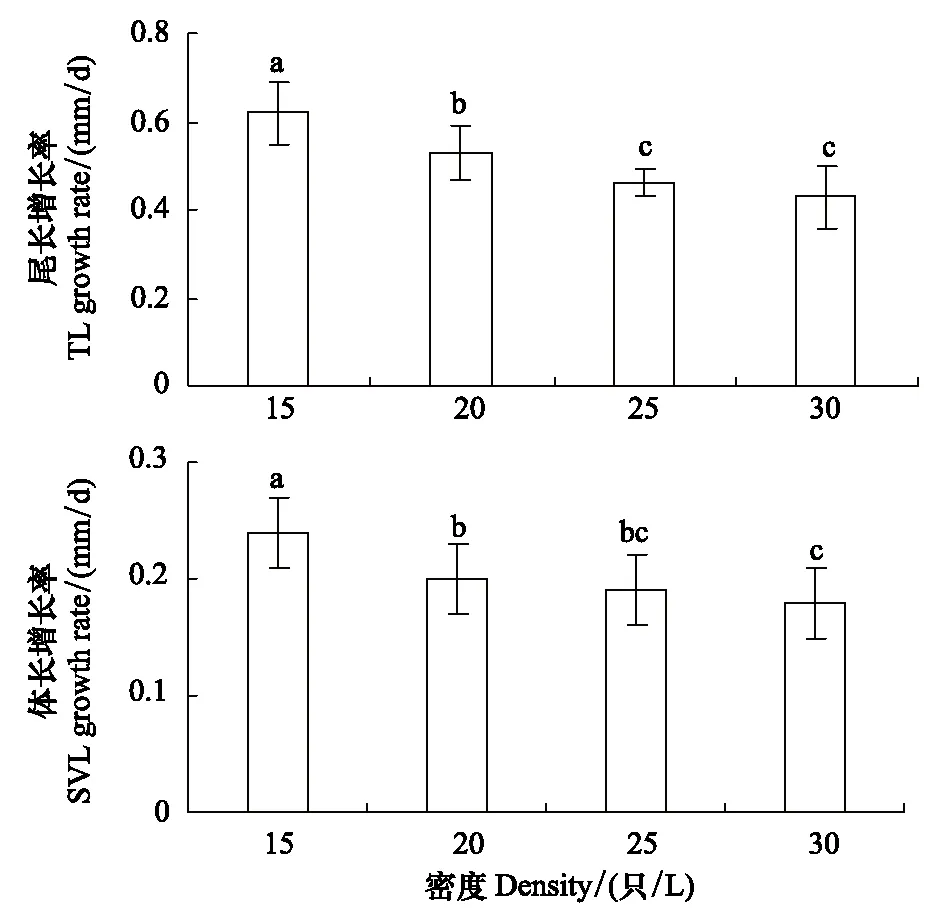
圖1 大樹蛙蝌蚪在不同培養密度中的生長速率Fig.1 Growth rate of tadpole Rhacophorus dennysi exposed to different culture density
2.2 密度對大樹蛙蝌蚪存活率的影響
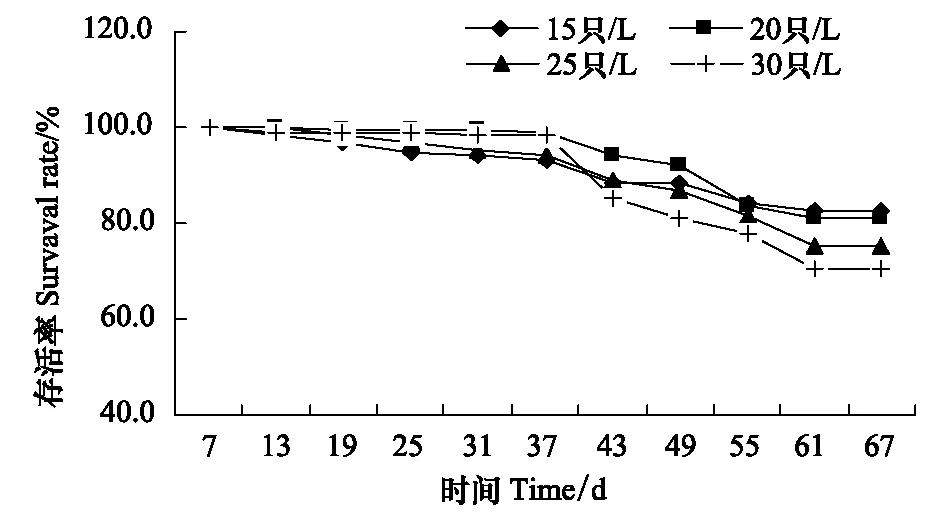
圖2 大樹蛙蝌蚪在不同培養密度中的存活率Fig.2 Survival rate of tadpole Rhacophorus dennysi exposed to different culture density
蝌蚪培養的前37 d內,密度對蝌蚪存活率的影響不顯著(X2= 4.034,P= 0.258),但從第37 天至第67 天實驗結束,密度的升高則顯著降低大樹蛙蝌蚪的存活率(X2= 2.479,P= 0.047)(圖2)。至67 d實驗結束,15、20、25 只/L和30 只/L的蝌蚪或幼蛙存活率分別為82.5%、81.3%、75.5%和70.4%,表明蝌蚪存活率隨密度的升高呈降低趨勢。
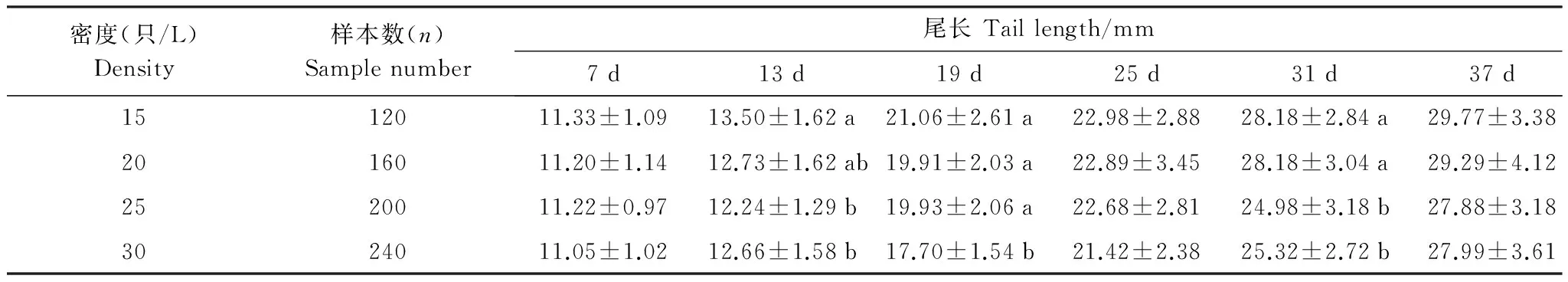
表2 大樹蛙蝌蚪在不同培養密度中尾長隨時間的變化
表中數據為平均值±標準差;a, b, c 表示同列不同上標差異顯著(P< 0.05)
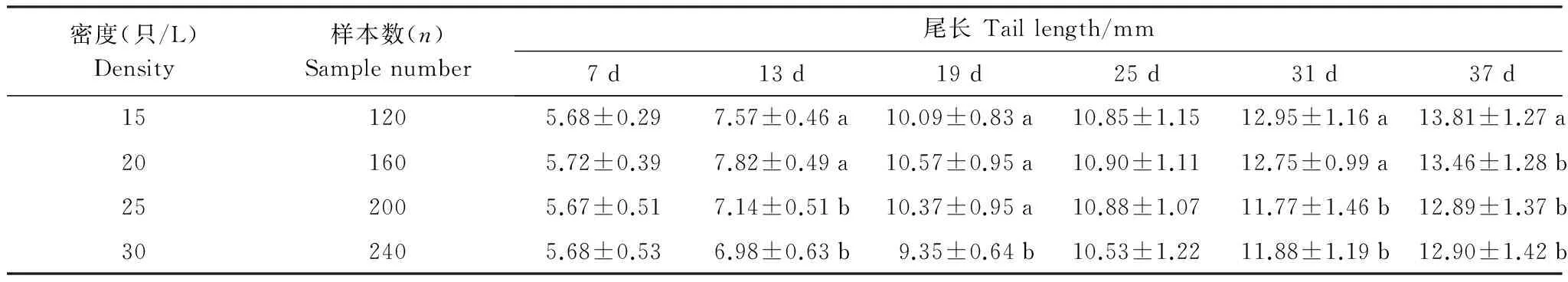
表3 大樹蛙蝌蚪在不同培養密度中體長隨時間的變化
2.3 密度對大樹蛙蝌蚪發育時間的影響
隨著密度的升高顯著延長蝌蚪發育至跗蹠部伸長期(F= 23.090,P= 0.0002)和前肢伸出期(F= 30.023,P= 0.0007)的所需時間(表4)。其中,30 只/L與15 只/L的蝌蚪發育時間相比,前者比后者蝌蚪發育至跗蹠部伸長期和前肢伸出期的時間分別延長6.7 d和6.2 d。
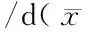
Table 4 Development time of tadpoleRhacophorusdennysiexposed to different culture density (mean±SE)

密度/(只/L)Density跗蹠部伸長期/(只/L)Metatarsalelongation前肢伸出期/(只/L)Forelimbprotrude1546.0±0.4a57.0±0.7a2048.0±0.6b60.2±0.8b2551.0±0.9c61.2±0.6b3052.7±0.6c63.2±0.8c
3 討論
生存空間一定時,種群密度的升高會減小蝌蚪的生存空間,導致種內競爭加劇,從而影響蝌蚪的生長發育及存活率[24- 25]。本研究結果表明,密度升高會顯著降低大樹蛙蝌蚪的生長速率,減小蝌蚪變態期的尾長和體長大小,但20、25 只/L和30 只/L 3組間的蝌蚪達到變態期的個體大小無顯著差異,卻會顯著延長蝌蚪變態所需時間。此與大多數的研究結論不同,即隨著密度的升高,綠紋樹蛙(Litoriaaurea)蝌蚪[16]、泡蟾(Physalaemuspustulosus)蝌蚪[26]的變態個體逐漸減小。
種內競爭加劇引起蝌蚪之間的物理性接觸增多,生存壓力升高,為了獲取足夠的食物和氧氣,蝌蚪的活動性增強,從而導致其生長速率降低[27]。Petranka發現豹蛙(Ranapipiens)蝌蚪在種內競爭加劇的情況下,生長快速、個體較大的蝌蚪會分泌抑制激素降低小個體蝌蚪的生長速率[28]。本研究發現25 只/L與30 只/L組內蝌蚪相對其他密度組的蝌蚪活動性更強,且隨著密度的升高,大樹蛙蝌蚪的生長速率顯著降低,研究結果與上述推論基本一致。此外,本研究發現大樹蛙蝌蚪生長后期的存活率隨著密度的增加顯著降低,可能是由于種內競爭加劇,引起生存空間的縮小和溶氧量的過度消耗從而導致了死亡率的增加。蝌蚪死亡率的增加,在一定程度上既可以緩解種內競爭,同時死亡的蝌蚪還可成為其他蝌蚪的食物[29]。Pfennig發現掘足蟾蝌蚪在生存環境變得惡劣的情況下,會從雜食性轉變成肉食性的蝌蚪,肉食性的蝌蚪與雜食性的蝌蚪相比,前者擁有更高的生長速率,能縮短進入陸生階段的變態發育時間,從而提高幼體的存活率[29],可能是掘足蟾蝌蚪對環境改變適應的一種生存對策。
蝌蚪的變態大小與變態時間影響其變態后的適合度[30- 31],而蝌蚪變態期個體大小除了跟本身遺傳基礎相關之外,主要與其生長速率和發育時間有關[17,32- 33]。Newman[33]研究發現,在適宜的環境中,掘足蟾蝌蚪的生長速率高,發育時間短,變態個體大。而Semlitsh研究表明,高密度會抑制掘足蟾蝌蚪的生長速率,誘導蝌蚪變態發育,縮短蝌蚪的發育時間,但會減小蝌蚪的變態個體[17]。本研究表明大樹蛙蝌蚪在20、25 只/L和30 只/L 3組密度處理條件下,大樹蛙蝌蚪的生長速率顯著降低,發育時間隨密度顯著延長,但實驗個體達到變態期時尾長和體長無顯著差異,此研究結果與施林強等[18]研究澤陸蛙的結果(高密度顯著降低澤陸蛙蝌蚪的生長速率,延遲發育時間,但不影響其變態個體大小)基本一致,分析其原因,可能是高密度對蝌蚪變態延遲的一種補償。但蝌蚪變態延遲有可能會持續影響大樹蛙蝌蚪變態后的適合度,因此,有必要進一步探究密度對大樹蛙變態后的生長發育及存活率。同時在以后的研究工作中,應設置更低密度并結合食物、溫度等因素對大樹蛙生長發育進行研究,有助于進一步闡述外界環境因素對大樹蛙蝌蚪生長發育的影響機制。
綜上所述,密度升高顯著降低大樹蛙蝌蚪的尾長和體長,延長大樹蛙蝌蚪發育時間,降低其存活率。在湘西城鄉建設、旅游開發等方面,應盡可能減少森林砍伐,減緩野生動物棲息地破碎化進程,對于保護兩棲類瀕危物種具有重要意義。
[1] Sih A, Bell A, Johnson J C. Behavioral syndromes: an ecological and evolutionary overview. Trends in Ecology & Evolution, 2004, 19(7): 372- 378.
[2] Wake D B. Declining amphibian populations. Science, 1991, 253(5022): 860- 860.
[3] Alford R A, Richards S J. Global amphibian declines: a problem in applied ecology. Annual Review of Ecology and Systematics, 1999, 30(1): 133- 165.
[4] Kiesecker J M, Blaustein A R, Belden L K. Complex causes of amphibian population declines. Nature, 2001, 410(6829): 681- 684.
[5] Biek R, Funk W C, Maxell B A, Mills L S. What is missing in amphibian decline research: insights from ecological sensitivity analysis. Conservation Biology, 2002, 16(3): 728- 734.
[6] Kats L B, Ferrer R P. Alien predators and amphibian declines: review of two decades of science and the transition to conservation. Diversity and Distributions, 2003, 9(2): 99- 110.
[7] Zhou Z, Xie F, Jiang J P, Zheng Z H. Research advances of amphibian declines. Chinese Journal of Applied & Environmental Biology, 2004, 10(1): 128- 132.
[8] Wu Z J, Li Y M. Causes and conservation strategies of amphibian population declination. Chinese Journal of Ecology, 2004, 23(1): 140- 146.
[9] Pan X F, Zhou W, Zhou Y W, Jiang G X. A summary of studies on amphibian population ecology in China. Zoological Research, 2002, 23(5): 426- 436.
[10] Wilbur H M. Density-dependent aspects of metamorphosis inAmbystomaandRanasylvatica. Ecology, 1976, 57(6): 1289- 1296.
[11] Wilbur H M. Density-dependent aspects of growth and metamorphosis inBufoamericanus. Ecology, 1977, 58(1): 196- 200.
[12] Wilbur H M. Interactions of food level and population density inRanasylvatica. Ecology, 1977, 58(1): 206- 209.
[13] Berven K A. The genetic basis of altitudinal variation in the Wood frogRanasylvaticaⅡ. An experimental analysis of larval development. Oecologia, 1982, 52(3): 360- 369.
[14] Morrison F C. Altitudinal Variation in the Life History of Anurans in Southeast Queensland [D]. Queensland: Griffith University, 2001.
[15] Dash M C, Hota A K. Density effects on the survival, growth rate, and metamorphosis ofRanatigrinatadpoles. Ecology, 1980, 61(5): 1025- 1028.
[16] Browne R K, Pomering M, Hamer A J. High density effects on the growth, development and survival ofLitoriaaureatadpoles. Aquaculture, 2003, 215(1- 4): 109- 121.
[17] Semlitsh R D, Caldwell J P. Effects of density of growth, metamorphosis, and survivorship in tadpoles ofScaphiopusholbrooki. Ecology, 1982, 63(4): 905- 911.
[18] Shi L Q, Mao F, Ma X M. The effects of density on growth, development and metamorphosis ofFejervaryalimnocharistadpoles. Journal of Hangzhou Normal University: Natural Science Edition, 2011, 10(5): 429- 434.
[19] Fei L, Ye C Y, Huang Y Z, Liu M Y. Atlas of Amphibians of China. Zhengzhou: Press of Science and Technology of He′nan, 1999: 276- 277.
[20] Shen Y H, Deng X J, Zhao A M. A study of the breeding ecology of theRhacophorusdennysi. Acta Ecologica Sinica, 1986, 6(2): 178- 185.
[21] Benitez-Mandujano M A, Flores-Nava A. Growth and metamorphosis ofRanacatesbeiana(Shaw) tadpoles fed live and supplementary feed, using tilapia,Oreochromisniloticus(L.), as a biofertilizer. Aquaculture Research, 1997, 28(7): 481- 488.
[22] Gosner K L. A Simplified table for staging anuran embryos and larvae with notes on identification. Herpetologica, 1960, 16(3): 183- 190.
[23] Hong Y Y, Zhang Y H. Toxicity effects of octylphenol on growth and development of tadpoles (Ranachensinensis). Asian Journal of Ecotoxicology, 2010, 5(3): 343- 350.
[24] Relyea R A. Competitor-induced plasticity in tadpoles: consequences, cues, and connections to predator-induced plasticity. Ecological Monographs, 2002, 72(4): 523- 540.
[25] Relyea R A, Hoverman J T. The impact of larval predators and competitors on the morphology and fitness of juvenile treefrogs. Oecologia, 2003, 134(4): 596- 604.
[26] Hailey A, Sookoo N, Hernandez E, Ramoo D. The influence of density and ration level on culturedPhysalaemuspustulosustadpoles, and the mitigation of a crowding effect by soil substrate. Applied Herpetology, 2007, 4(3): 261- 277.
[27] Crump M L. Energy accumulation and amphibian metamorphosis. Oecologia, 1981, 49(2): 167- 169.
[28] Petranka J W. Chemical interference competition in tadpoles: does it occur outside laboratory aquaria? Copeia, 1989, 1989(4): 921- 930.
[29] Pfennig D W. Polyphenism in spadefoot toad tadpoles as a logically adjusted evolutionarily stable strategy. Evolution, 1992, 46(5): 1408- 1420.
[30] Berven K A. Factors affecting population fluctuations in larval and adult stages of the wood frog (Ranasylvatica). Ecology, 1990, 71(4): 1599- 1608.
[31] Semlitsch R D, Scott D E, Pechmann J H K. Time and size at metamorphosis related to adult fitness inAmbystomatalpoideum. Ecology, 1988, 69(1): 184- 192.
[32] Newman R A. Adaptive plasticity in development ofScaphiopuscouchiitadpoles in desert ponds. Evolution, 1988, 42(4): 774- 783.
[33] Newman R A. Ecological constraints on amphibian metamorphosis: interactions of temperature and larval density with responses to changing food level. Oecologia, 1998, 115(1- 2): 9- 16.
參考文獻:
[7] 周洲, 謝鋒, 江建平, 鄭中華. 兩棲動物種群衰退研究進展. 應用與環境生物學報, 2004, 10(1): 128- 132.
[8] 武正軍, 李義明. 兩棲類種群數量下降原因及保護對策. 生態學雜志, 2004, 23(1): 140- 146.
[9] 潘曉賦, 周偉, 周用武, 江桂盛. 中國兩棲類種群生態研究概述. 動物學研究, 2002, 23(5): 426- 436.
[18] 施林強, 毛飛, 馬小梅. 密度對澤陸蛙蝌蚪生長發育和變態的影響. 杭州師范大學學報: 自然科學版, 2011, 10(5): 429- 434.
[19] 費梁, 葉昌媛, 黃永昭, 劉明玉. 中國兩棲動物圖鑒. 鄭州: 河南科學技術出版社, 1999: 276- 277.
[20] 沈猷慧, 鄧學健, 趙愛民. 大樹蛙繁殖生態的研究. 生態學報, 1986, 6(2): 178- 185.
[23] 洪燕燕, 張育輝. 辛基酚對中國林蛙蝌蚪生長發育的毒性效應. 生態毒理學報, 2010, 5(3): 343- 350.
The effect of rearing density on the development and survival ofRhacophorusdennysitadpoles
XIE Wenhua, TAO Shuanglun, YANG Dongmei, LIANG Jing, LI Junnian*
CollegeofBiologyandEnvironmentalSciences,JishouUniversity,Jishou416000,China
The population density of amphibians can greatly influence the dynamics of these populations by changing several key population parameters, such as mortality, development, reproductive rate, and dispersal and migration, especially in the larval stage. Meanwhile population density may change dramatically due to changes in the environment,, thus affecting the development and survival rate of the larval stage. Therefore, studying the impact of population density on larval growth and survival may help to understand the mechanism of rapid amphibian population declining caused by environmental factors. Nonetheless, the effect of population density on amphibian larvae is very poorly understood. In this study, we conducted laboratory simulation experiments to investigate the effect of rearing density on the development and survival ofRhacophorusdennysitadpoles. We measured the tail length, snout-vent length, development time, and survival rate ofRhacophorusdennysitadpoles at four rearing density levels (15, 20, 25 and 30 ind/L) and significant differences in tadpole performance were observed between density levels -tadpoles reared at higher densities were significantly smaller at metamorphosis, had longer larval development time and lower larval survival at later stage compared to those reared at the lowest density. Compared to tadpoles reared at the 15 level, tadpoles reared at 20, 25 and 30 density levels was 11.6%, 11.8% and 13.9% less in tail length, respectively, and 11.1%, 9.5% and 12.9% less in snout-vent length, respectively. In addition, increased rearing densities had also significantly prolonged the development time of tadpoles and lowered the survival rate at later stages, although they did not affect the early survival of the tadpoles.
Density; Development; Survival;Rhacophorusdennysi; Tadpole
湖南省科技計劃項目(201200613); 國家自然科學基金資助項目(30570285); 吉首大學校級重點項目(jdzd12008)
2013- 02- 13; 網絡出版日期:2014- 03- 17
10.5846/stxb201302130262
*通訊作者Corresponding author.E-mail: junnianl@163.com
謝文華,陶雙倫,楊冬梅,梁靜,李俊年.密度對大樹蛙蝌蚪生長發育和存活率的影響.生態學報,2014,34(22):6583- 6588.
Xie W H, Tao S L, Yang D M, Liang J, Li J N.The effect of rearing density on the development and survival ofRhacophorusdennysitadpoles.Acta Ecologica Sinica,2014,34(22):6583- 6588.

