植物晶體的形態結構、生物功能及形成機制研究進展
朱廣龍,馬 茵,韓 蕾,霍張麗,魏學智,*
(1. 山西師范大學生命科學學院, 臨汾 041000; 2. 華中農業大學植物科學技術學院, 武漢 430070)
植物晶體的形態結構、生物功能及形成機制研究進展
朱廣龍1,2,馬 茵1,韓 蕾1,霍張麗1,魏學智1,*
(1. 山西師范大學生命科學學院, 臨汾 041000; 2. 華中農業大學植物科學技術學院, 武漢 430070)
晶體是植物體內產生的一種具有特殊形態結構與生理功能的代謝物,其分布廣泛,已在500多種植物中發現有晶體的存在。晶體形態多樣,有針晶、柱晶、棱晶、砂晶、簇晶等;類型豐富,有草酸鈣晶體、鐘乳體、硅質體、硫酸鈣晶體及其它類型的晶體;功能特殊,具有鈣調節、植物保護和防御、重金屬解毒、離子平衡、緩解逆境脅迫及其它多種生物功能。晶體的形成涉及鈣離子的體外吸收和體內轉運,草酸的生物合成,以及鈣離子和草酸的耦合過程;晶體的生長發育涉及液泡、晶異細胞的調控及與其它細胞結構的相互協作。對晶體的研究進行綜述,以期為晶體的進一步研究提供基礎資料。
晶體;形態結構;生物功能;形成機制
顯微鏡的發明為微觀世界的探索和科學的發展起到非常重要的作用。Frey在1929年就發現植物體內有晶體的存在[1]。Foster 1956年將可以產生晶體并專事于這種功能的細胞稱作含晶異細胞(crystalidioblast),簡稱含晶細胞[2]。在不同植物和同種植物的不同組織中都可觀察到晶體,至今所觀察到的晶體大部分都聚積在特化的細胞——晶異細胞的液泡中[3]。植物的草酸鈣晶體被認為是首先通過光學顯微鏡觀察而被報道的晶體之一。自此之后在自然界陸續發現了各種草酸鈣晶體[3],如巖石、土壤以及所有五界生物(原核、原生、真菌、植物、動物界)中,尤其是在從海洋藻類[4]到陸地被子植物[5]都有草酸鈣晶體的發生。大部分的晶體都是由來自于環境中的鈣和生物體內合成的草酸形成的[3]。到目前為止, 已在500多種植物體內發現了草酸鈣的沉積, 其中90%的目屬于高等植物, 80%的目屬于被子植物, 50%的目屬于雙子葉植物[6- 26], 其主要存在于維管束植物中(圖1)[27]。晶體在植物體內如此廣泛的存在,必定有重要的生物學功能,有研究表明晶體的形成是植物體內正常的代謝過程[28],也有研究指出晶體在植物適應逆境中具有重要的作用[29- 35]。本文主要論述晶體的類型、生物學功能和產生的機制等,以期對晶體的功能和形成機理有進一步的認識,為晶體生物學的研究提供參考和基礎資料。
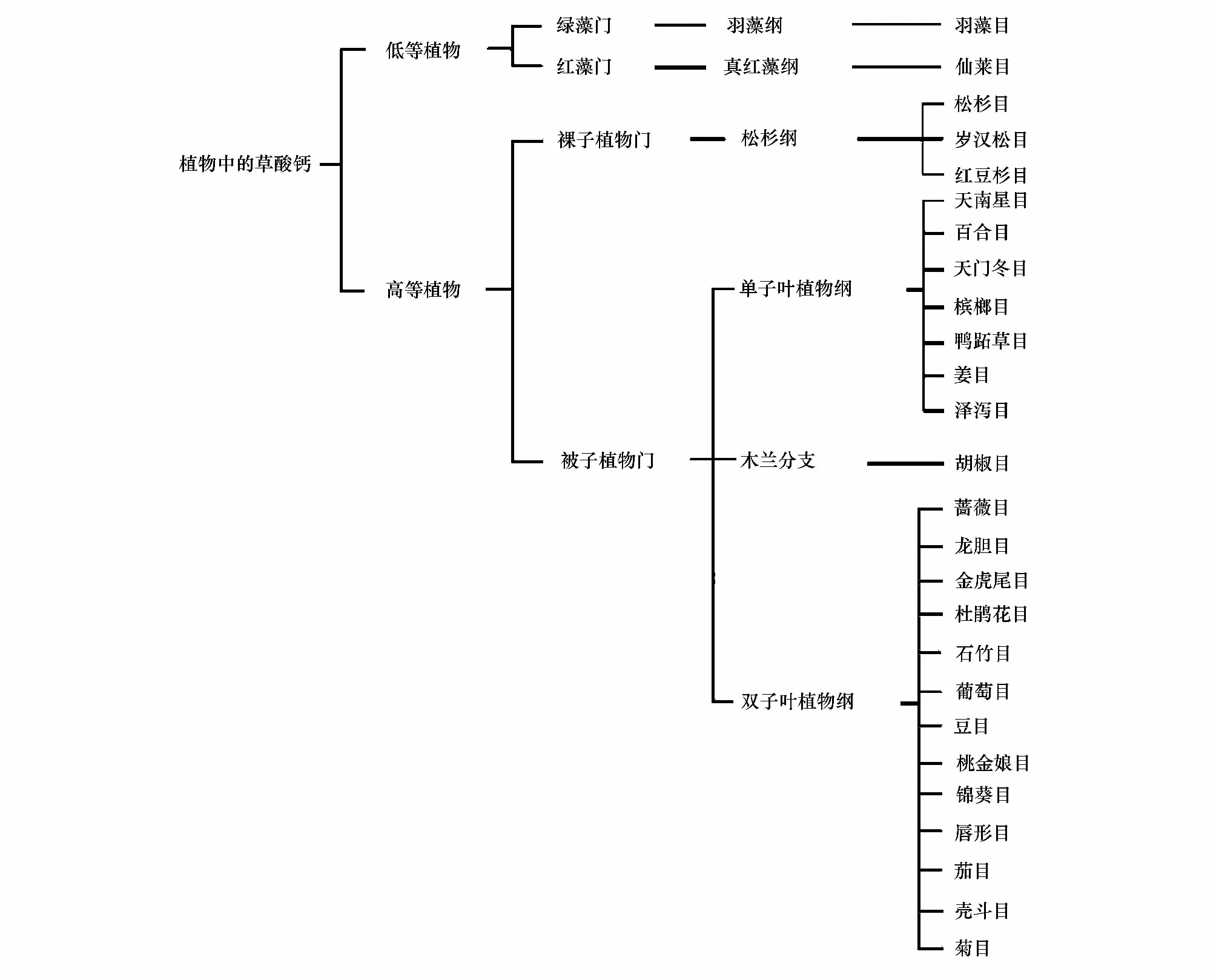
圖1 草酸鈣晶體在植物中的分布[27]Fig.1 The distribution of Calium oxalate crystal in plant[27]依據APGⅢ分類法
1 植物體晶體的類型和形態結構
自20世紀80年代以來, 隨著對生物大分子活性結構的深入了解,晶體學也逐漸成為研究的熱點, 這些研究促進了結構植物學的長足發展。在植物的根、莖、葉等器官中均研究發現有晶體的存在,植物的含晶結構中可以產生多種晶體, 這些晶體一般被認為是后含物。后含物是指細胞在生活過程中產生的各種代謝產物或無生命活性的物質。其中, 不少后含物在植物細胞中形成結晶, 在每種植物的生長發育過程中, 組織細胞所含的結晶類型、形狀及大小是比較穩定的, 但結晶體在不同科、屬的組織中,其形態、大小、分布等均有一定的差異[36]。
1.1 晶體的類型
1.1.1 草酸鈣晶體
含晶細胞中晶體的主要成分大多數是草酸鈣[29]。植物中的草酸鈣沉積較普遍,植物中有超過215個科的成員在組織中有草酸鈣晶體聚積,其中約54%為熱帶植物,3%為熱帶-亞熱帶植物,1%為亞熱帶植物,2%為亞熱帶-溫帶植物,18%為溫帶植物[30]。產生草酸的植物(包括很多農作物)可聚積3%—80%干重的草酸,植物中大概有90%的鈣可以在草酸鹽中發現[31- 32]。草酸鈣沉積的主要部位分布在植物的葉片、莖、種子、苞片、花藥、根等器官中的晶異細胞中[9,23,33], 另外還可形成在特定的組織或細胞類型中, 如通氣組織和石細胞[34]。
根據研究中常見的草酸鈣晶體的形態,可分為以下5類(圖2[26]和圖3[35]):(1)針晶,為細小針狀結晶, 常排列不規則而充塞于細飽中。少數聚集成球狀針晶叢或狹長延伸的針狀晶體束(圖2:e,h;圖3:e);(2)柱晶,一個有銳利末端的延伸的晶體,可能延伸成立方體、四方柱狀或棱柱狀,兩端平截或呈三角錐狀, 少數呈斜尖或分叉狀。在有些植物中柱晶的排列較有規律, 如白桐樹及淫羊霍, 柱晶多沿莖或葉的軸向分布,因而只有在縱切面才可見其全形[37](圖3:c,d); (3)棱(方)晶,形狀多樣,有類方形、角錐形、菱形、多面形或不規則塊狀, 多存在于薄壁組織中(圖2:a,b,c;圖3:a,b);(4) 砂晶,單個細胞中由很多微小的、單獨的晶體組成的結晶塊;(5)簇晶,為許多棱形或角錐形結晶聚集而成的晶簇, 小單晶的尖端突出在整個表面,簇晶的大小及棱角角度的大小等具有鑒別意義, 如刺五加與無梗五加粉末的區別[37](圖2:d;圖3:f)。晶體的其它形狀似乎是這些形態的變異或中間體[38]。草酸鈣晶體無器官、組織特異性,有時數種形態的晶體有可能在同一植物的同一或不同組織或器官中并存。植物

圖2 植物體內草酸鈣晶體的形態[26]Fig.2 The morphology of Calium oxalate in plant[26](a)香蕉葉柄中分離出的棱晶The prism isolated from petiole of Musa cavendishit;(b)大豆種皮中分離到的棱晶The prism isolated from coat of Soybean;(c)番茄葉片中分離到的假四面體棱晶The pseudotetrahedral fourlings crystals isolated from blade of Lycopersicon esculentum;(d)椒草葉片柵欄組織中的晶簇 The vug distributed in palisade tissue of Peperomia.;(e)美洲葡萄葉片中分離出的針晶束The raphid isolated from blade of Vitis labrusca.;(f)光學顯微鏡下晶異細胞內的針晶束(R)和與針晶束相連的有機質(M)The raphid linked with organic matter in crystal idioblast;(g)香蕉葉片中分離出的晶異細胞(細胞內包含針晶束)The crystal idioblast isolated from blade of Musa cavendishit;(h)晶異細胞內露出的針晶束(h) The raphids were emited from crystal idioblast

圖3 不同地區酸棗葉片分泌的晶體的形態[35]Fig.3 The morphology of crystal excreted from blades of Zizyphus jujube in different regions[35](a)不規則棱晶Irregular edge prism crystal;(b)正六棱體晶體Six-sided prism crystal;(c)正棱柱體晶體Regular edge prism;(d)長棱柱體晶體Long prismatic crystal;(e)針晶Raphid;(f)簇晶Vug
中的草酸鈣主要以2種水合狀態存在,即一水合物CaC2O4·H2O (水草酸鈣石)和多水合物CaC2O4·(2+x)H2O(草酸鈣石)[39]。兩者具有不同的結構,一水合物屬于單斜晶系而多水合物屬于四方晶系[30,39]。
1.1.2 鐘乳體
鐘乳體呈棒錘形、長圓球形或圓球形, 表面具有不規則層狀波紋及小瘤狀突起, 常具有纖維素柄而與細胞壁相連結,其主要成分是CaCO3。在植物體內,鐘乳體多存在于葉或莖的表皮細胞或毛茸基部的細胞腔內。少數植物如球花馬藍等的皮層、韌皮部及髓部也有沿莖軸向排列的鐘乳體[37]。
1.1.3 硅質體
硅質體的主要成分是SiO2。硅質體多為圓簇狀小團塊, 除氫氟酸外不溶于其它任何酸。其多存在于表皮細胞或薄壁組織中, 少數分布在纖維束周圍的細胞中而類似晶鞘纖維(如石解)或存在于種皮厚壁細胞腔內(如姜科)[37]。
1.1.4 硫酸鈣結晶
怪柳科植物無草酸鈣結晶,而具簇晶狀或棱晶狀石膏結晶, 這種晶體的主要成分為CaSO4,有的形成晶鞘纖維(如西河柳)。
1.1.5 其它類型的晶體
除上述常見的晶體外,還存在其它類型的晶體。這些晶體從化學結構組成上屬于有機物類晶體,主要有以下幾種:(1)菊糖,分子式(C6H10O5)n, 為吠喃果糖聚合物,球形或半球形結晶, 表面觀具放射狀線,主要分布在桔梗目(桔梗科、菊科)。(2)橙皮甙,分子式C28H34O15,為二氫黃酮甙,聚集成球簇狀、樹枝狀或羽毛狀淡黃色針狀結晶, 主要分布于蕓香科, 此外在冬青科、唇形科及菊科的某些屬中也有分布。(3)蛋白質擬晶體,為黃褐色或紅色,存在于復合糊粉粒中, 其外部有無定形蛋白質薄膜, 內含一個球晶體和一至數個擬晶體或僅含擬晶體。擬晶體并不是真正的晶體, 而是蛋白質結合了結晶和膠體的性質而形成的一種多角形或類方形的實體。(4)植酸,馬檳榔種子糊粉粒中的球晶體主要成分為植酸。另外在一些少數植物中還存在不常見的晶體,如荻藍葉肉細胞中含細小顆粒狀或片狀藍色靛藍結晶,肉豆蔻中析出的針簇狀或羽毛狀結晶。
2 晶體的功能
隨著科學技術的發展和研究的不斷深入,人們對植物體中晶體功能的認識不斷提高。最初人們認為草酸鈣晶體是植物體內新陳代謝的最終垃圾產物對生物體內有毒害作用[28]。然而后來的研究表明,晶體并不是植物體內代謝的垃圾產物,其在植物體內具有多種重要的功能[29- 35,39]。晶體是植物體內產生的一種具有特殊形態結構與生理功能的代謝物。晶體形態和大小的多態性及其時間和空間的分布特征,引發形成了許多有關植物內晶體功能的假說。其可能的功能涉及到鈣調節、離子平衡(如Na+、K+)、植物防御、組織支撐和植物硬度、解毒(如重金屬或草酸)、光的聚集和反射及植物逆境的適應等。
2.1 Ca調節功能生
Ca是一種重要的基本植物營養元素,植物對其需求形式是以離子形式表現出來的。大多數植物通過特殊的細胞器如內質網、液泡、葉綠體和線粒體的吸收來調節胞質Ca2+水平,或主動將Ca2+泵入質外體中[40]。作為胞質第二信使,Ca2+連接一定范圍內的外界刺激與生理反應。一般認為,含晶細胞的主要功能是一個局部鈣庫,可減少毗鄰細胞周圍質外體中Ca 濃度[41- 42]。外源Ca2+可誘導大量草酸鈣晶體的快速生成(在1 h之內),生成晶體的大小及數量隨著植物生長環境中Ca 濃度的變化而變化[41- 42]。Volk等研究認為針晶體的形成可能有雙重功效:一是Ca調節,二是植物防御;而晶簇(球形)的形成則只與Ca 調節有關。晶簇的形成是種動態過程,與Ca水平的波動相互響應:當Ca 水平高時,晶簇的大小和數量迅速增長;而當Ca受限制時,晶簇的大小和數量則減少。其分解出的Ca可便于植物利用[43],以此推測,晶體可能是Ca的臨時儲存單位。晶體隨Ca源這種結晶以及溶解的現象在很多植物中都有存[42,44- 45]。
2.2 植物保護和防御
晶體具有多種形態結構,這與其保護防御功能有關[46]。在瞪羚(Gazelladorcas)食草性的研究中觀察到,全能花屬植物Pancratiumsickenbergeri只有其葉片的尖端受到啃食,而葉片的尖端是整個葉片中唯一無針晶的部分[47]。Ruiz等2002年研究發現生長在放牧最多的地方的植物含有的晶體最多,而生長在放牧最少的地方的晶體積聚較少或沒有晶體;且剪下的或受損傷的植物葉片中草酸鈣的積聚并沒有增加,這表明,在這種情況下,晶體的形成是非誘導性的[46]。這樣看來,此研究中晶體的形成可能是一個進化的程序化過程,晶體的形成也可能是植物對取食壓力的響應[46]。某些植物的草酸鈣晶體有倒鉤和凹槽[34],被取食后晶體突出物會刺激食草動物的黏膜[47],凹槽釋放化學刺激物(如一類有毒的蛋白水解酶或葡糖苷)進入動物傷口[5],從而避免被取食傷害。由此看來,這些結構可能有防止被取食的威懾作用。
2.3 重金屬解毒
酸性土壤大約占全世界可耕地面積的40%, 酸性土壤中鋁的毒性是限制農作物產量的一個主要問題。微摩爾濃度的鋁就能抑制植物根的生長并影響植株體內營養物質和水分的平衡[48]。植物可合成有機酸(如檸檬酸、蘋果酸和/或草酸)與游離的重金屬離子結合為非活性態以增強其對重金屬的耐受[49]。有些植物用草酸(鹽)解除環境中有害金屬的毒性,如鉛、鋁、鍶和鎘等。此類作用于植物生長環境的金屬,通常將重金屬結合成草酸鹽晶體[50- 52]。
2.4 離子平衡
某些植物的有機酸影響離子吸收和離子平衡。草酸是許多植物的主要有機酸,可能在離子平衡中起特殊作用[53]。蕎麥中Ca的聚集可引發草酸增加;且高鉀水平下形成的草酸鹽較少[54]。晶體能螯合除去植物體內多余的草酸[38],因而,含晶細胞中草酸鹽晶體的形成可能有助于調控植物體內的離子平衡[19]。
2.5 緩解逆境脅迫
含晶細胞的廣泛存在暗示了含晶異細胞具有重要的生理功能。越來越多的實驗證據表明草酸鹽、草酸鹽氧化酶及其草酸被分解后的產物都參與植物正常的生理生化代謝及其抗逆反應[55]。含晶細胞多集中在沙生、旱生植物的葉和軸器官中,荒漠植物中的含晶細胞被認為是其抗旱結構特征之一, 推測它們可能與荒漠植物適應干旱和鹽堿環境有關[56- 58]。這些沙生、旱生植物中的含晶細胞有較高的滲透勢,吸水能力強,在外界環境水分狀況較好和導管中水分輸導良好時,它們可以吸收并貯存水分;當外界環境干旱時,導管中水分輸導受阻而不能正常供給植物體內各部分對水分的需求時,此種結構組織可為其周邊細胞提供一個較為濕潤的小環境,從而提高植物的抗旱性[56- 58]。從幾種荒漠植物的解剖結構可以看出, 晶體主要在柵欄組織、貯水組織和維管束中出現, 這符合形成晶體的相關離子(Ca2+)從土壤到根、莖、葉的運輸過程[19]。徐靜靜等對天津鹽漬化生境54種植物鈣晶體的研究表明,草酸鈣晶體在落葉喬、灌木抵御鹽分脅迫中發揮著重要作用[59]。
2.6 其它功能
遮蔭植物椒草屬(Peperomia)的葉片具厚而清晰的多層上皮層(即“窗口組織”),疊加在柵欄組織細胞上形成光合作用層。每個柵欄細胞中都具有含晶簇的液泡。晶簇是一個由中心向外各個方向輻射的小平面聚集而成的多面體球形(圖3:f)。據推測這種弱光適應性植物的晶體結構有助于將光平均分配給沿著邊緣壁排列和圍繞在液泡周圍的葉綠體中,也可能將多余的光反射回“窗口組織”,以驅散間歇光照時的間歇光[59]。
水生植物中,通常含有與通氣組織相關的草酸鈣晶體,有時晶體會伸入氣腔(air space)中,如天南星科(Aracea)和香蒲屬(Typha)的針晶體等[19]這類晶體可能與氣腔的形成有關[5]。
在許多藥用植物中,根據晶體的類型和結構特征,可以作為藥材鑒別的依據。藥材植物種類繁多,所含晶體的形狀、大小、數量、分布疏密、排列方式、所處位置等因植物而異, 這對不同藥材的原植物真偽、代用品的鑒別有重要意義。如人參中只有簇晶、其偽品華山參有砂晶;親緣關系極近的川黃柏和關黃柏的橫切面上, 維管束周圍都有方晶, 但關黃柏多于川黃柏, 便于區別;懷牛膝的薄壁細胞中含砂晶, 而川牛膝中的砂晶多聚積在細胞的角隅處;藥用大黃、掌葉大黃、唐古特大黃的根莖中所含的簇晶最大直徑分別為155、135、106 μm, 有利于三者的鑒定區別;茜草中的針晶長、軸多呈平行,甘草中的方晶長軸多呈縱向排列,葛根中的方晶長軸多呈橫向排列, 何首烏中的簇晶與大晶方晶共生, 桑寄生中的方晶存在于石細胞中[37]。
3 晶體的形成機制
植物體內草酸鈣晶體是內源合成的草酸和外源吸收的鈣離子共同反應的產物, 這一過程并不是簡單的化學沉淀過程, 而是受嚴格的遺傳調控[34]。草酸(C2H2O4)容易和鈣結合成難溶的草酸鈣, 當溶液處于過飽和態時就會形成晶體。由此可見,晶體的形成包括體內草酸的合成和體外鈣離子的轉運兩個過程。
3.1 草酸的合成
草酸是植物體內一種簡單的二元酸,其合成的部位主要是細胞質和液泡[60]。早期的研究證明植物有機酸(包括草酸)的產生與植物的光合作用和碳水化合物代謝有關。大量實驗表明草酸不是植物體光合作用的直接產物, 而是由光合作用的產物作為前體合成的[34]。草酸的生物合成主要包括以下途徑(圖4[55]): ①在光呼吸過程中, 1,5-二磷酸核酮糖被氧化形成乙醇酸, 乙醇酸再轉化為乙醛酸。②在乙醛酸途徑中, 異檸檬酸裂解形成乙醛酸。③在微生物體內主要通過草酰乙酸的裂解來合成草酸, 在非綠色植物中也可能利用此途徑合成。④ L-抗壞血酸可作為合成草酸的底物[61]。通過放射自顯影證明只有L-抗壞血酸可用于草酸鈣含晶異細胞的形成。但是在含晶異細胞中沒有發現乙醛酸氧化酶的存在, 所以由抗壞血酸轉變成草酸的途徑當時還不清楚(圖4)[55]。后來進一步的研究表明合成草酸的前體物質可能是抗壞血酸, 通過14C標記證實L-抗壞血酸用于合成草酸并最終形成草酸鈣晶體[62- 64]。抗壞血酸合成草酸在晶異細胞內完成, 合成反應受鈣水平的調控[65- 66]。
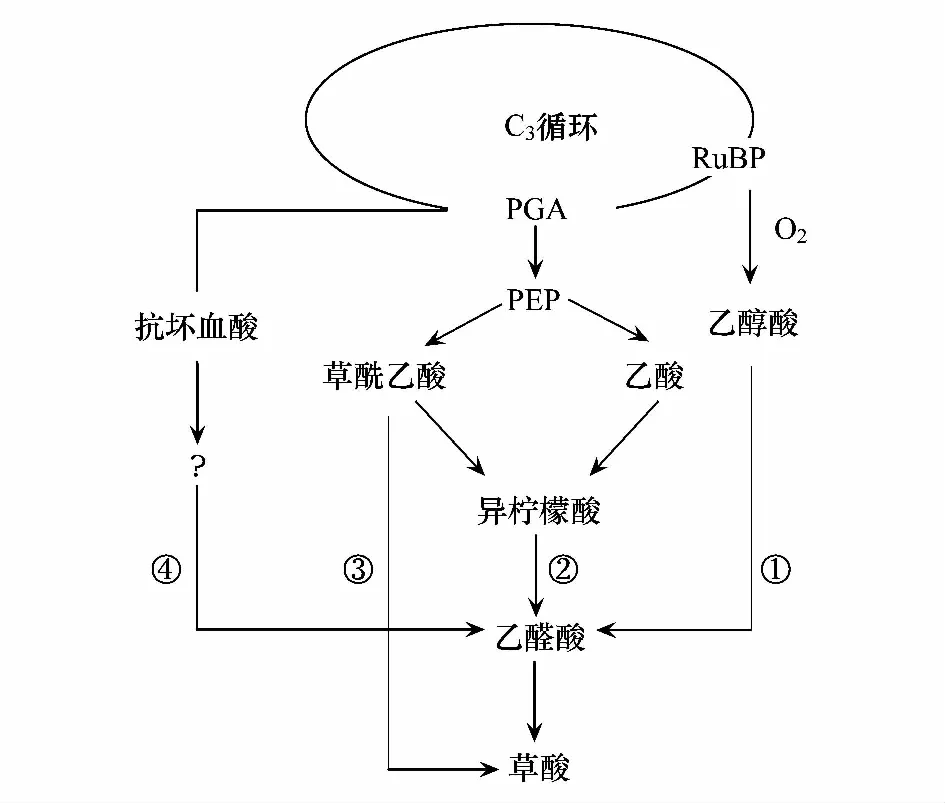
圖4 植物體內草酸鈣的合成途徑[55]Fig.4 Pathways for plant oxalate biosynthesis
3.2 鈣的轉運
植物根系與土壤中的離子吸附交換后通過質外體途徑和共質體途徑轉運。吸收的鈣離子通過鈣離子通道在Ca2+-ATP(三磷酸腺苷, adenosine triphosphate)酶和Ca2+/H+反向轉運子的參與下,通過跨越內皮層凱氏帶和木質部薄壁細胞組織進行運輸[67]。部分Ca2+可由離子通道流進內皮層細胞, 這部分鈣離子有兩種去向, 一種是通過共質體途徑到達木質部薄壁細胞組織, 需要Ca2+-ATP 酶驅動進入中柱質外體;另一種是由內皮層細胞運出, 沿內皮層內側的質外體途徑進入木質部導管, 并通過導管沉積在植物器官中[69]再隨質外體途徑由木質部流通到細胞間進行再次分配[68- 69]。胞內鈣離子濃度的增加為草酸鈣晶體的形成提供了充足的鈣源,而鈣濃度的變化對草酸鈣晶體的形態及水化狀態都具有影響[43]。
3.3 晶體的形成
晶異細胞是形成草酸鈣晶體的場所。晶異細胞的細胞質中含有大量的高爾基體、線粒體、內質網、特化質體及與液泡內晶體相連的獨特膜結構[34,69- 70](圖3a)。高爾基體和線粒體為細胞的快速增長提供能量, 而內質網與細胞內合成草酸鈣密切相關[69]。植物體內的鈣離子主要是通過質外體即木質部流進入葉肉細胞壁內, 然后通過細胞壁上的鈣通道或泵進入內質網[69], 最終由內質網輸送到液泡內。與此同時草酸(鹽)也向液泡內運輸, 它主要是在含晶異細胞的細胞質或者液泡合成[60], 但是合成的亞細胞位點不清楚。如果草酸鹽在細胞質合成,主要由液泡膜上的通道或者運輸工具轉入液泡內與鈣離子結合形成草酸鈣沉淀。如果草酸在液泡產生,其中草酸鹽的主要前體L-抗壞血酸可以在葉綠體內大量合成包括所有的細胞壁, 因此處于細胞壁上的由L-抗壞血酸合成的草酸鹽可以與鈣離子結合形成草酸鈣晶體。位于葉綠體內的L-抗壞血酸合成草酸鹽后可能通過細胞壁上的通道進入鄰近異細胞的細胞質, 參與草酸鈣晶體的形成, 其運輸的具體機制尚不清楚[71]。
晶體的形成是多個過程協調的結果。基質Ca2+增加后, 質外體Ca2+濃度也增加, 從而啟動異質細胞的分化, 細胞從抑制鈣積累模式轉為鈣吸收模式。鈣通道阻遏物可以抑制晶體的形成,用熒光標記的通道蛋白阻遏物使異質細胞帶上標記, 這就證明異質細胞利用鈣通道蛋白從質外體吸收Ca2+[69]。液泡積累Ca2+的同時, 草酸被運輸到液泡。液泡中的小室控制著晶體生長的速率、方向和形態, 非晶體基質也有調控作用。從晶體中分離出來的基質蛋白質可以促進晶體沉淀, 基質可能充當最初的成核物質, 決定晶體生長方向和形態[72]。
含晶細胞表現出的特征包括:一個增大的核、特化的質體、增多的內質網、高水平的rRNA及獨特的液泡成分(圖5:a)[38]。細胞核和核仁的擴大是含晶細胞發育過程中觀察到的最初變化之一,此時,胞質密集,且富含細胞器和小泡;與周圍細胞相比,質體變小并且幾乎無基粒(圖5:c)[38]。在含晶細胞發育過程中,發現一些與晶體腔相關的結構—微管,如在九節屬植物Psychotriapunctata的中心液泡中,發現有大量直徑在10—13nm的微管,通常平行于發育中的晶體腔存在[37]。作為細胞骨架元件的微管,可調節生長細胞的形態[73]。含晶細胞(如針晶體和柱狀晶)在晶體生長時會有所延長,因而研究者們推測微管可能作用于調節晶體和細胞的生長[3]。在晶體快速生長時期,對晶體和細胞生長的細致的調節是極為重要的。
晶異細胞中含有許多小囊泡(圖5:d箭頭所示), 這些小囊泡可能是通過融合方式調節腔膜形成的(圖5:d插圖箭頭所示)[70]。膜腔和包裹膜腔的基質分子能調控晶體的形成[28,43,70]:主要是通過調節鈣和草酸進入空腔的速率來控制晶體的生長速度和形貌[43]。從晶異細胞中分離出的基質蛋白含有大量的酸性氨基酸,具有較強的結合鈣的能力[74], 這將影響晶體成核、成核后的生長及最終的形貌。液泡調控晶體的形貌, 同時協調晶體生長和細胞增大。通常當晶異細胞膨脹到最大尺寸時, 晶體就會停止生長[34]。但對于晶體不同形貌的分化機制還有待進一步的研究。
綜上所述,晶體的合成和調控機制如圖6所示,植物吸收的鈣離子通過鈣通道和離子泵,完成跨膜轉運到達內質網,由內質網輸送到液泡中;與此同時細胞質和液泡特定部位合成的草酸也轉運到液泡中。鈣離子和草酸進入液泡后被轉運到晶異細胞的特定部位,在各細胞器的共同協調作用下形成晶體。晶異細胞的高爾基體和線粒體為晶細胞的快速增長提供能量,晶異細胞的微管和基質蛋白及液泡中的小室控制著晶體生長的速率、方向和形態;晶異細胞中的內質網和小囊泡主要通過調節鈣和草酸進入空腔的速率來控制晶體的生長速度和形貌。由此可見晶體合成及生長主要通過晶異細胞內部微管、基質蛋白和液泡的共同作用進行主調控,其次是通過小囊泡調節鈣離子和草酸的轉運速率來進行副調控。
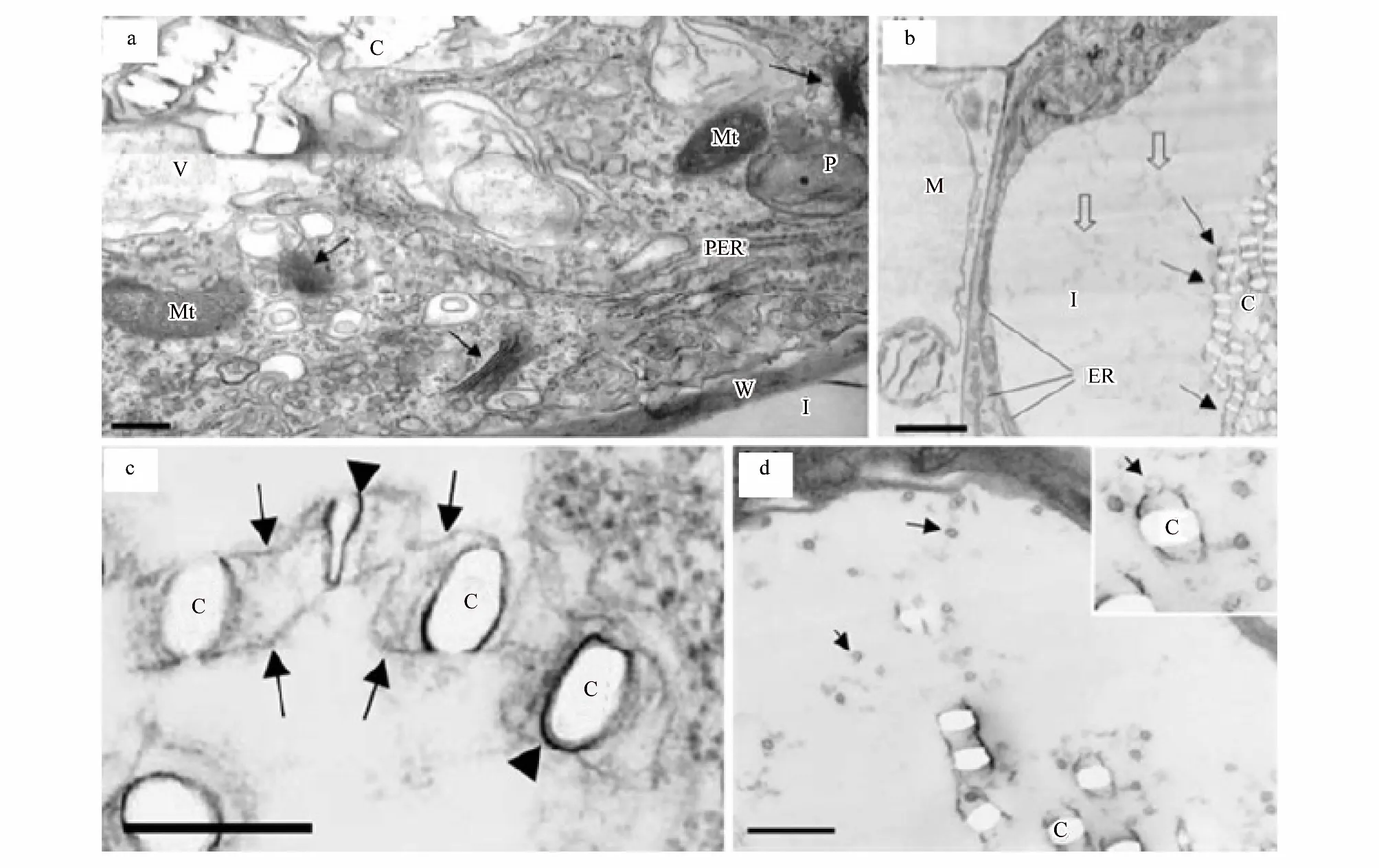
圖5 草酸鈣晶異細胞的透射電子顯微鏡圖[38]Fig.5 crystal idioblast of calcium oxalate was observed under transmission electron microscopy[38](a)晶體存在于晶異細胞的液泡中,晶異細胞的細胞質中含有大量的線粒體、質體、光面內質網、高爾基體(箭頭所示)和其它膜結構,標尺為1um;(b)晶異細胞及相鄰葉肉細胞的橫切面,在晶異細胞中晶體存在于液泡中并在膜的作用下排成縱列(箭頭所示),液泡中含有許多絮狀物質(空心箭頭所示),細胞質中含有豐富的內質網,標尺為2um;(c)一列正在形成的晶體,每個晶體的兩側都膜包裹(無尾箭頭所示),標尺為0.25um;(d)晶異細胞中含有許多小囊泡(箭頭所示),小囊泡與膜腔的一端融合,標尺為1um;圖(a)為大藻,其余為浮萍;M:葉肉;C:晶體;I:晶異細胞;Mt:線粒體;P:質體;V:液泡;W:細胞壁;PER:粗面內質網;ER:內質網(a)crystals exist invacuole of crystal idioblast which contains majority of Mt, P, ER, Golgi apparatus and others membrane structure, bar is 1 um; (b)the transection of crystal idioblast and its adjacent mesophyll cell,with the help of membranous, crystals align tandem(arrows show), vacuole contains numerous flocculent material(open arrows show),abundant ER distribute in cytoplasm, bar is 2 um; (c)the forming crystals and its two sides were pack by membrane(anury arrows show), bar is 0.25 um; (d)crystal idioblast contains a large amount of Capsule bubble,which were fusing with one side of membranous Cavity, bar is 1 um; the plant of(a)is Pistia stratiotes,and others is lesser duckweed; M: mesophyll; C: crystals; I: crystal idioblast; Mt: mitochondria; P: plastid; V: vacuole; W: cell wall; PER: rough endoplasmic reticulum; ER: endoplasmic reticulum
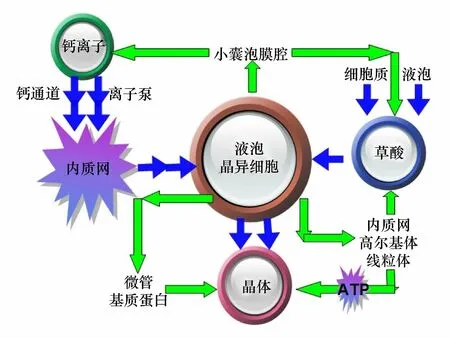
圖6 晶體的合成與調控Fig.6 The synthesis and regulation of crystal圖中藍色路線為晶體合成途徑,綠色路線為調控途徑
4 展望
對晶體的研究日益完善現已逐步形成一門學科,且與其它學科交叉發展,利用材料化學的方法可以模擬合成一些簡單的晶體用作納米材料。現有的研究對晶體的形態結構和基本功能闡述較清楚,但對晶體發育過程中一些精細的調控機制和合成的亞細胞位點仍需進一步的研究。掌握這些機制,就可以體外模擬合成和體內誘導生成晶體,這對晶體材料的開發利用具有重要的意義。
致謝:感謝華中農業大學植物科學技術學院彭少兵教授對本文寫作的幫助。
Reference:
[1] Frey A. Calciumoxalat-monohydrat und trihydrat// Linsbauer K, ed. Handbuch der Pflanzenanatomie (Vol. 3). Berlin: Gebruder Borntraeger, 1929: 82- 127.
[2] Foster A S. Plant idioblasts: remarkable examples of cell particles from photosynthetic tissue. Ⅱ. Oxidative decarboxylation of oxalic acid. Physiologia Plantarum, 1956, 7: 614- 624.
[3] Nakata P A. Advances in our understanding of calcium oxalate crystal formation and function in plants. Plant Science, 2003, 164(6): 901- 909.
[4] Friedmann E I, Roth W C, Turner J B, McEwen R S. Calcium oxalate crystals in the aragonite-producing green alga Penicillus and related genera. Science, 1972, 177(4052): 891- 893.
[5] Prychid C J, Rudall P J. Calcium oxalate crystals in monocotyledons: a review of their structure and systematics. Annals of Botany, 1999, 84(6): 725- 739.
[6] Nakata P A, McConn M M. Isolation ofMedicagotruncatulamutants defective in calcium oxalate crystal formation. Plant Physiology, 2000, 124(3): 1097- 1104.
[7] Lersten N R, Horner H T. Crystal macropatterns in leaves of Fagaceae and Nothofagaceae: A comparative study. Plant Systematics and Evolution, 2008, 271(3- 4): 239- 253.
[8] Hudgins J W, Krekling T, Franceschi V R. Distribution of calcium oxalate crystals in the secondary phloem of conifers: A constitutive defense mechanism? New Phytologist, 2003, 159(3): 677- 690.
[9] Cote G G. Diversity and distribution of idioblasts producing calcium oxalate crystals inDieffenbachiaseguine(Araceae). American Journal of Botany, 2009, 96(7): 1245- 1254.
[10] Bouropoulos N, Weiner S, Addadi L. Calcium oxalate crystals in tomato and tobacco plants: Morphology and in vitro interactions of crystal-associated macromolecules. Chemistry-A European Journal, 2001, 7(9): 1881- 1888.
[11] Pueschel C M, West J A. Cytoplasmic streaming of calcium oxalate crystals inCallipsygmawilsonis(Bryopsidales, Chlorophyta). Phycological Research, 2007, 55(4): 278- 285.
[12] Pueschel C M, West J A. Calcium oxalate crystals in the marine red algaSpyridiafilamentosa(Ceramiales; Rhodophyta). Phycologia, 2007, 46(5): 565- 571.
[13] Korth K L, Doege S J, Park S H, Goggin F L, Wang Q, Gomez S K, Liu G J, Jia L L, Nakata P A. Medicago truncatula mutants demonstrate the role of plant calcium oxalate crystals as an effective defense against chewing insects. Plant Physiology, 2006, 141(1): 188- 195.
[15] Osuji J O, Ndukwu B C. Probable functions and remobilisation of calcium oxalates in Musa L. African Journal of Biotechnology, 2005, 4(10): 1139- 1141.
[16] Katayama H, Fujibayashi Y, Nagaoka S, Sugimura Y. Cell wall sheath surrounding calcium oxalate crystals in mulberry idioblasts. Protoplasma, 2007, 231(3- 4): 245- 248.
[17] Demiray H. Calcium oxalate crystals of someCrataegus(Rosaceae) species growing in Aegean region. Biologia, 2007, 62(1): 46- 50.
[18] Coelhoa E G, Amaral A C F, Ferreirab J L P, Santos A G, Pinheiro M L B, de Silva J R A. Calcium oxalate crystals and methyl salicylate as toxic principles of the fresh leaves from Palicourea longiflora, an endemic species in the Amazonas state. Toxicon, 2007, 49(3): 407- 409.
[19] Yan Q D, Su P X, Chen H B, Zhang L H. Comparative analysis of the crystal cells located in photosynthesis organs among five kinds of C4 desert plant. Journal of Plant Ecology, 2008, 32(4): 873- 882.
[20] Park S H, Doege S J, Nakata P A, Korth K L.Medicagotruncatula-derived calcium oxalate crystals have a negative impact on chewing insect performance via their physical properties. Entomologia Experimentalis et Applicata, 2009, 131(2): 208- 215.
[21] Gonzalez J A Z, Costa M D, Silva I R, Neves J C L, de Barros N F, Borges A C. Accumulation of oxalic acid and calcium crystals in eucalypt ectomycorrhizas. I-Oxalic acid production and nutrient concentration in fine lateral roots colonized with ectomicorrhizal fungi. Revista Brasileira de Ciênc do Solo, 2009, 33(3): 541- 553.
[22] Lersten N R, Horner H T. Crystal diversity and macropatterns in leaves of Oleaceae. Plant Systematics and Evolution, 2009, 282(1- 2): 87- 102.
[23] Prywer J. Theoretical analysis of specific evolution of some faces of plant COM crystals. CrystEngComm, 2009, 11(1): 196- 202.
[24] ??lge?en H, Kaplan A, Büyükkartal H N. Calcium oxalate crystals in leaves ofQuercuscerrisL and Q Ilex L. Bangladesh Journal of Botany, 2009, 38(1): 103- 105.
[25] Meric C. Calcium oxalate crystals in some species of the tribe inuleae (asteraceae). Acta Biologica Cracoviensia Series Botanica, 2009, 51(1): 105- 110.
[26] Li X L, Zhang W J, Lu J W, Wang L J. Biological mineralization of calcium oxalate in the Plant. Chinese Science Bulletin, 2012, 57(26): 2443- 2455.
[27] Bremer B, Bremer K, Chase M W, Fay M F, Reveal J L, Soltis D E, Soltis P S, Stevens P F, The Angiosperm Phylogeny Group. An update of the angiosperm phylogeny group classification for the orders and families of flowering plants: APG III. Botanical Journal of the Linnean Society, 2009, 161(2): 105- 121.
[28] Webb M A, Cavaletto J M, Carpita N C, Lopez L E, Arnott H J. The intravacuolar organic matrix associated with calcium oxalate crystals in leaves ofVitis. The Plant Journal, 1995, 7(4): 633- 648.
[29] Finley D S. Patterns of calcium oxalate crystals in young tropical leaves: a possible role as an anti-herbivory defense. Revista de Biología Tropical, 1999, 47(1- 2): 27- 31.
[30] McNair J B. The interrelation between substances in plants: essential oils and resins, cyanogen and oxalate. American Journal of Botany, 1932, 19(3): 255- 271.
[31] Gallaher R N. The occurrence of calcium in plant tissue as crystals of calcium oxalate. Communications in Soil Science and Plant Analysis, 1975, 6(3): 315- 330.
[32] Libert B, Franceschi V R. Oxalate in crop plants. Journal of Agricultural and Food Chemistry, 1987, 35(6): 926- 938.
[33] Da Costa L M, Tronto J, Constantino V R L, Fonseca M K A, Oliveira A P, Da Costa M R. Extraction and concentration of biogenic calcium oxalate from plant leaves. Revista Brasileira de Ciênc do Solo, 2009, 33(3): 729- 733.
[34] Franceschi V R, Nakata P A. Calcium oxalate in plants: Formation and function. Annual Review of Plant Biology, 2005, 56(1): 41- 71.
[35] Zhu G L. The characteristics of physio-biochemical and features of morphological structure of Zizyphus jujuba Mill. response to grads drought stress [D]. Linfen: Shanxi Normal University, 2012.
[36] Sun R, Meng Z N, Pang Y, Zhou G L.the current study status of crystals in plant and utilization method.Shandong Forestry Science and Technonogy, 2004, (2): 35- 36.
[37] Xu Y M, Li J X, Wu Q N, Chen J L, Jiang X P. The types and distribution of crystals in the medicinal plants. The Journal of Chinese Medicine, 1989, 14(2): 69- 72.
[38] Franceschi V R, Horner H T. Calcium oxalate crystals in plants. The Botanical Review, 1980, 46(4): 361- 427.
[39] Frey-Wyssling W. Crystallography of the two hydrates of crystalline calcium oxalate in plants. American Journal of Botany, 1981, 68(1): 130- 141.
[40] Bush D S. Regulation of cytosolic calcium in plants. Plant Physiology, 1993, 103(1): 7- 13.
[41] Borchert R. Calcium acetate induces calcium uptake and formation of calcium-oxalate crystals in isolated leaflets ofGleditsiatriacanthosL.. Planta, 1986, 168(4): 571- 578.
[42] Franceschi V R. Calcium oxalate formation is a rapid and reversible process inLemnaminorL. Protoplasma, 1989, 148(2- 3): 130- 137.
[43] Volk G M, Lynch-Holm V J, Kostman T A, Goss L J, Franceschi V R. The role of druse and raphide calcium oxalate crystals in tissue calcium regulation inPistiastratiotesleaves. Plant Biology, 2002, 4(1): 34- 45.
[44] Tilton V R, Horner H T. Calcium oxalate raphide crystals and crystalliferous idioblasts in the carpels ofOrnithogalumcaudatum. Annals of Botany, 1980, 46(5): 533- 539.
[45] Ilarslan H, Palmer R G, Imsande J, Horner H T. Quantitative determination of calcium oxalate and oxalate in developing seeds of soybean (Leguminosae). American Journal of Botany, 1997, 84(8): 1042- 1046.
[46] Ruiz N, Ward D, Saltz S. Calcium oxalate crystals in leaves ofPancratiumsickenbergeri: constitutive or induced defence? Functional Ecology, 2002, 16(1): 99- 105.
[47] Ward D, Spiegel M, Saltz D. Gazelle herbivory and interpopulation differences in calcium oxalate content of leaves of a desert lily. Journal of Chemical Ecology, 1997, 23(2): 333- 346.
[48] Foy C D, Chaney R L, White M C. The physiology of metal toxicity in plants. Annual Review of Plant Physiology, 1978, 29(1): 511- 566.
[49] Ryan P R, Delhaize E, Jones D L. Function and mechanism of organic anion exudation from plant roots. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52(1): 527- 560.
[50] Ma J F, Ryan P R, Delhaize E. Aluminium tolerance in plants and the complexing role of organic acids. Trends in Plant Science, 2001, 6(6): 273- 278.
[51] Long X X, Yang X E, Ye Z Q. Metal ligand of super accumulation plant and application in phytoremediation. The Journal of Plant Physiology, 2003, 39(1): 71- 77.
[52] Li D H, Huang S M, He L Y, L W D. Organic acid secretion in plant roots and effect for reconciliation aluminum toxicity. The Journal of Plant Physiology, 2004, 40(4): 505- 510.
[53] Dijkshoorn W. Organic acids and their role in ion uptake// Butler G W, Bailey R W, eds. Chemistry and Biochemistry of Herbage. Volume 2. New York: Academic Press, 1973: 63- 187.
[54] Dunne T C. Plant buffer systems in relation to the absorption of bases by plants. Hilgardia, 1932, 7(3): 207- 234.
[55] Chen Z, Geng H C, Wang S S, Ding M L, Chen X J, Chen J Y. The formation, degradation and funtion of oxalic acid (salt) in plant. Molecular Plant Breeding, 2007, 5(S): 105- 110.
[56] Li Z L, Li R A.Anatomical observations of assimilating branches of nine xerophytes in Gansu. Chinese Bulletin of Botany, 1981, 23(3): 181- 185.
[57] Liu J Q.Xerophilous structures of desert plants in different ecological types. Journal of Plant Ecology, 1982, 6(4): 314- 319.
[58] Su P X, An Z L, Ma R J, Liu X M. H. Wreath structure and C4 photosynthetic characteristics of desert plants Ammodendron and Calligonum mongolicum. Chinese Journal of Plant Ecology, 2005, 29(1): 1- 7.
[59] Xu J J, Ci H C, He X D, Xue P P, Zhao X L, Guo J T, Gao Y B. The calcium crystals and calcium component characteristics of 54 plants in salinization habitat in Tianjin. Chinese Journal of Applied Ecology, 2012, 23(5): 1247- 1253.
[60] Kostman T A, Tarlyn N M, Loewus F A, Franceschi V R. Biosynthesis of L-ascorbic acid and conversion of carbons 1 and 2 of L-ascorbic acid to oxalic acid occurs within individual calcium oxalate crystal idioblasts. Plant Physiology, 2001, 125(2): 634- 640.
[61] Yu L, Jiang J Z, Zhang C, Jiang L R, Ye N H, Lu Y S, Yang G Z, Liu E, Peng C L, He Z G, Peng X X. Glyoxylate rather than ascorbate is an efficient precursor for oxalate biosynthesis in rice. Journal of Experimental Botany, 2010, 61(6): 1625- 1634.
[62] Keates S E, Tarlyn N M, Loewus F A, Franceschi V R. L-ascorbic acid and L-galactose are sources for oxalic acid and calcium oxalate inPistiastratiotes. Phytochemistry, 2000, 53(4): 433- 440.
[63] Horner H T, Kausch A P, Wagner B L. Ascorbic acid: A precursor of oxalate in crystal idioblasts of Yucca torreyi in liquid root culture. International Journal of Plant Sciences, 2000, 161(6): 861- 868.
[64] Kostman T A, Koscher J R. L-galactono-γ-lactone dehydrogenase is present in calcium oxalate crystal idioblasts of two plant species. Plant Physiology and Biochemistry, 2003, 41(3): 201- 206.
[65] Sakai W S, Jones R C. Raphides with barbs and grooves in Xanthosoma sagittifolium (Araceae). Science, 1972, 178(4058): 324- 325.
[66] Nakata P A, McConn M M. IsolatedMedicagotruncatulamutants with increased calcium oxalate crystal accumulation have decreased ascorbic acid levels. Plant Physiology and Biochemistry, 2007, 45(3- 4): 216- 220.
[67] Yang H Q, Jie Y L. Uptake and transport of calcium in plants. Journal of Plant Physiology and Molecular Biology, 2005, 31(3): 227- 234.
[68] White P J, Broadley M R. Calcium in plants. Annals of Botany, 2003, 92(4): 487- 511.
[69] Volk G M, Goss L J, Franceschi V R. Calcium channels are involved in calcium oxalate crystal formation in specialized cells ofPistiastratiotesL. Annals of Botany, 2004, 93(6): 741- 753.
[70] Mazen A M A, Zhang D Z, Franceschi V R. Calcium oxalate formation inLemnaminor: Physiological and ultrastructural aspects of high capacity calcium sequestration. New Phytologist, 2003, 161(2): 435- 448.
[71] Smironff N, Wheeler G L. Ascorbic acid in plant: biosynthesis and function. Critical Reviews in Biochemistry and Molecular Biology, 2000, 35(4): 291- 314.
[72] Tan Y. The formation and function of plant calcium oxalate crystal. Bulletin of Biology, 2007, 42(10): 20- 21.
[73] Zhai Z H, Wang X Z, Ding M X. Cell biology. Beijing:High Education Press, 2000: 280- 299.
[74] Li X X, Zhang D Z, Lynch-Holm V J, Okita T W, Franceschi V R. Isolation of a crystal matrix protein associated with calcium oxalate precipitation in vacuoles of specialized cells. Plant Physiology, 2003, 133(2): 549- 559.
[19] 嚴巧娣, 蘇培璽, 陳宏彬, 張嶺梅. 五種C4荒漠植物光合器官中含晶細胞的比較分析. 植物生態學報, 2008, 32(4): 873- 882.
[26] 李秀麗, 張文君, 魯劍巍, 王荔軍. 植物體內草酸鈣的生物礦化. 科學通報, 2012, 57(26): 2443- 2455.
[35] 朱廣龍. 酸棗生理生化特性及結構特征對梯度干旱的響應 [D]. 臨汾: 山西師范大學, 2012.
[36] 孫銳, 孟振農, 房用, 周光魯. 植物體內所含晶體的研究進展及其應用的思路. 山東林業科技, 2004, (2): 35- 36.
[37] 許益民, 李建新, 吳啟南, 陳建樓, 姜小平. 藥用植物中結晶物的類型及分布述要. 中國中藥雜志, 1989, 14(2): 69- 72.
[51] 龍新憲, 楊肖娥, 葉正錢. 超積累植物的金屬配位體及其在植物修復中的應用. 植物生理學通訊, 2003, 39(1): 71- 77.
[52] 李德華, 黃升謀, 賀立源, 劉武定. 植物根系有機酸的分泌和解鋁毒作用. 植物生理學通訊, 2004, 40(4): 505- 510.
[55] 陳崢, 耿華春, 王沙沙, 丁明麗, 陳新建, 陳軍營. 植物體內草酸(鹽)的形成、降解及其作用. 分子植物育種, 2007, 5(S): 105- 110.
[56] 李正理, 李榮敖. 我國甘肅九種旱生植物同化枝的解剖觀察. 植物學報, 1981, 23(3): 181- 185.
[57] 劉家瓊. 我國荒漠不同生態類型植物的旱生結構. 植物生態學與地植物學叢刊, 1982, 6(4): 314- 319.
[58] 蘇培璽, 安黎哲, 馬瑞君, 劉新民. 荒漠植物梭梭和沙拐棗的花環結構及C4光合特征. 植物生態學報, 2005, 29(1): 1- 7.
[59] 徐靜靜, 慈華聰, 何興東, 薛蘋蘋, 趙雪萊, 郭健潭, 高玉葆. 天津鹽漬化生境54種植物鈣晶體與鈣組分特征. 應用生態學報, 2012, 23(5): 1247- 1253.
[72] 譚云. 植物草酸鈣晶體的形成和功能. 生物學通報, 2007, 42(10): 20- 21.
[73] 翟中和, 王喜忠, 丁明孝. 細胞生物學. 北京: 高等教育出版社, 2000: 280- 299.
Current status of research on morphological structure, biological function and formation mechanism of plant crystals
ZHU Guanglong1,2, MA Yin1, HAN Lei1, HUO Zhangli1, WEI Xuezhi1,*
1CollegeofLifeScience,ShanxiNormalUniversity,Linfen041000,China2CollegeofPlantScienceandTechnology,HuazhongAgricultureUniversity,Wuhan430070,China
Plant crystals are one of the metabolin that have peculiar morphological structure and physiological function. They are widespreading and have been found in more than 500 floristics. Crystals have multiple shapes, such as raphid, column crystal, prism, sand crystal and cluster crystal and have multifarious types, including crystals of calcium oxalate, cystolith, silicon plastid, calcium sulfate crystal etc. They also have significant functions, for instance, calcium regulating, plant defense and protection, detoxifing heavy metal, ionic equilibrium, increasing stress tolerance and others biological functions. The synthesis of crystal is associated with calcium ion absorbed in vitro and transported in vivo, the biosynthesis of oxalate, and the coupling process of calcium ion and oxalate. The growth and development of crystal has close relationship with interaction among vacuole, idioblast regulation, and others eucaryotic cell structures. Previous studies have been summarized in this paper in order to identify the areas of further research.
crystal; morphological structure; biological function; formation mechanism
國家自然科學基金(30972396); 山西省自然科學基金項目資助(2009011041- 1)
2013- 02- 24; 網絡出版日期:2014- 03- 14
10.5846/stxb201302240293
*通訊作者Corresponding author.E-mail: wxz3288@163.com
朱廣龍,馬茵,韓蕾,霍張麗,魏學智.植物晶體的形態結構、生物功能及形成機制研究進展.生態學報,2014,34(22):6429- 6439.
Zhu G L, Ma Y, Han L, Huo Z L, Wei X Z.Current status of research on morphological structure, biological function and formation mechanism of plant crystals.Acta Ecologica Sinica,2014,34(22):6429- 6439.

