沉水植物莖葉微界面及其對水體氮循環影響研究進展
王文林,劉 波,韓睿明,范 婤,王國祥,*
(1. 南京師范大學地理科學學院,江蘇省環境演變與生態建設重點實驗室, 南京 210023;2. 環境保護部 南京環境科學研究所, 南京 210042; 3.南通大學地理科學學院, 南通 226007)
沉水植物莖葉微界面及其對水體氮循環影響研究進展
王文林1,2,劉 波1,3,韓睿明1,范 婤1,王國祥1,*
(1. 南京師范大學地理科學學院,江蘇省環境演變與生態建設重點實驗室, 南京 210023;2. 環境保護部 南京環境科學研究所, 南京 210042; 3.南通大學地理科學學院, 南通 226007)
沉水植物莖葉表面常富集了水中各類物質,包括有機質、泥沙、菌膠團、藻類、微生物等,形成厚度不等的附著層,形成特殊的莖葉微界面,其具有特殊的氧化-還原異質環境,并能為氮素循環細菌提供有機質,是水中氨化、反硝化及厭氧氨氧化等脫氮行為的重要基礎,因此,了解沉水植物莖葉微界面組分、微環境變化特征及其對氮循環的調控作用,對于正確認識和利用沉水植物的生態調控功能、改善水環境質量具有十分重要的意義。基于此,就沉水植物莖葉微界面物質組成、微環境特征及其對水體氮循環影響研究現狀進行了歸納總結,并對今后的研究方向進行了簡要展望。
沉水植物; 莖葉微界面; 物質組成;微環境特征;水體氮循環
地球表面與近地表存在著許多固、液和氣相之間的微界面[1],微界面存在相互分異又密切聯系的氧化-還原異質環境,其對土壤及水體氮素循環具有十分重要的影響[2- 3],就水生生態系統而言主要存在3個微界面[4]:水-沉積物、生物-沉積物(根際圈)、生物-水(如水生植物體表與水之間)。
水-沉積物微界面研究已經取得了長足進展,微界面內溶解氧(DO)、氧化還原電位(Eh)、酸堿度(pH)等剖面梯度變化的定量測定研究屢見報道[5-10]。研究表明,在水-沉積物界面,DO、Eh 及 pH 等因子時空變化較大,物質的遷移轉化過程活躍,尤其是反硝化作用十分劇烈[11- 12]。而生物-沉積物界面主要集中于根際圈研究,張福鎖等[13]指出根際概念最早系Hiltner于1904年提出,1989年Reddy[14]發現濕地植物根系附近的富氧-厭氧微環境控制了根-沉積物界面的硝化-反硝化過程,提出了根-沉積物界面的硝化-反硝化理論,并用同位素技術測定了水稻(Oryza.sativaL.)、梭魚草(PontederiacordataL.)、燈芯草(JuncuseffususLinn.)的根際氮遷移轉化過程,從而證實了這一理論,將根際研究從農作物拓展到濕地植物。由此影響氮素循環的濕地植物根際微界面環境也日益受到關注,已有研究結果表明根際微界面 DO、Eh 及 pH 值分布不僅受光照、光合作用強度[15- 16]等因素影響,存在明顯的晝夜時間序列差異;還受植物生長階段的影響,存在明顯的季節性時間分布差異[17- 18]。
生物-水微界面廣泛存在于水體中各種生物表面,而在淺水湖泊生態系統中,沉水植物與水的關系最為密切,占據著湖泊生態系統的關鍵界面,對湖泊生產力及生物地球化學循環具有重要的影響[19]。位于水面以下的沉水植物莖葉表面常富集了水中各類物質,包括有機質、泥沙、菌膠團、藻類、微生物等,形成厚度不等的附著層[20],形成了特殊的莖葉微界面[21]。莖葉微界面的出現不僅直接阻抑了植物莖葉與水之間的氣體交換[22],而且其內富集的有機質分解耗氧[23- 24]容易導致莖葉表面成為耗氧厭氧區域。一些研究已經證實,沉水植物莖葉表面 DO 和 pH 值等因子的時空分布差異比較明顯[25- 26],表明莖葉表面亦存在富氧-厭氧交替出現的氧化-還原微環境,同時還可為氮素循環細菌提供有機質[27- 29]。因此,了解沉水植物莖葉微界面環境變化特征及其對氮循環的調控作用,對于正確認識和利用沉水植物的生態調控功能、改善水環境質量具有十分重要的意義。基于此,本文就沉水植物莖葉微界面物質組成、微環境特征及其對水體氮循環影響研究現狀進行了歸納總結,并對今后的研究方向進行了展望。
1 沉水植物莖葉微界面物質組成
1.1 微界面物質組成特征
曲久輝等對天然水體中主要顆粒物及其界面特征進行了總結(表1)[4],而理論上沉水植物莖葉微界面均可能含有礦物質、金屬氫氧化物、腐殖質、纖維素、藻類、微生物、有機無機復合物等物質,它們在水體中的物理、化學和生物學特性往往是決定微界面體系特征的基本因素。
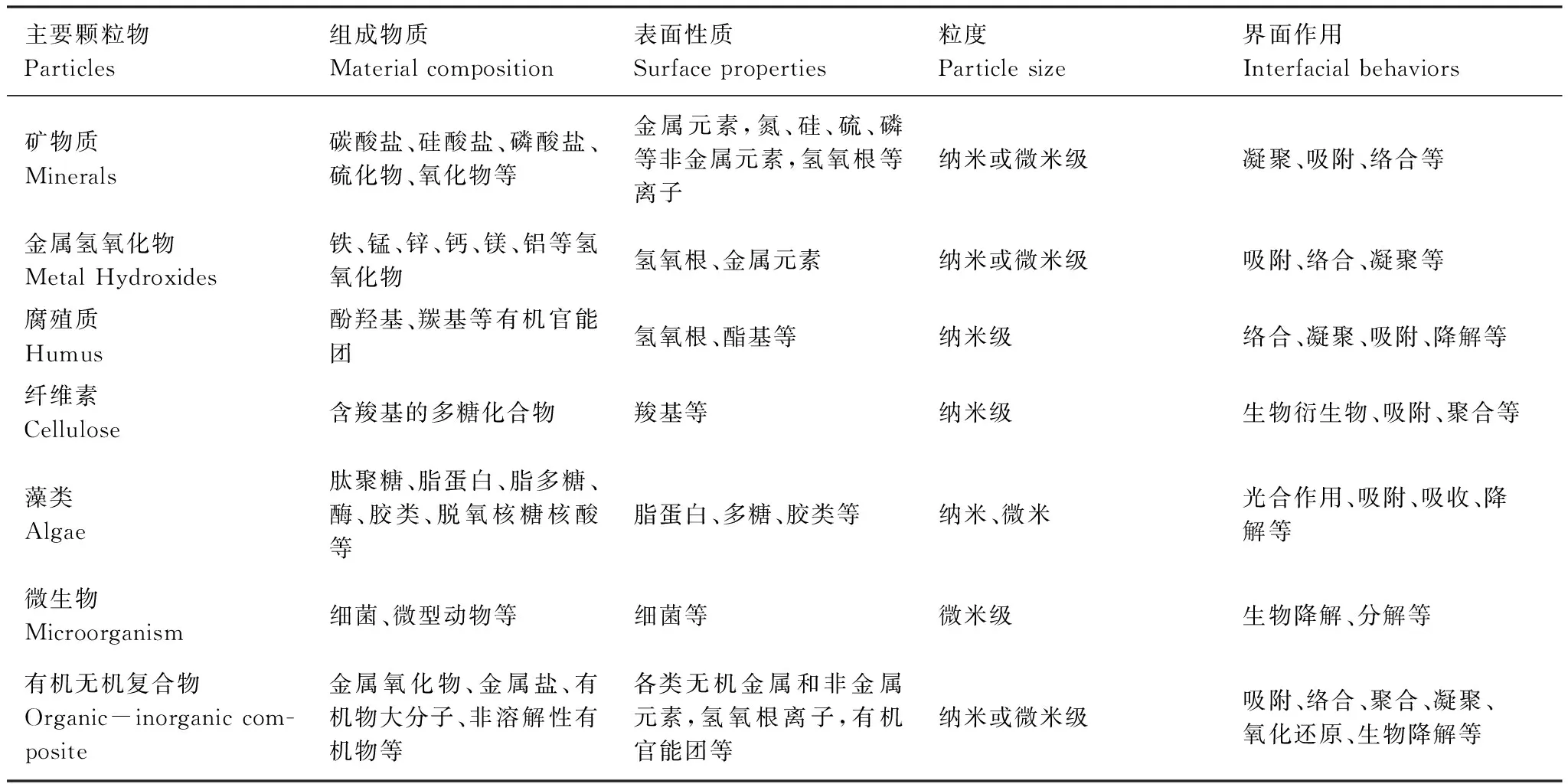
表1 天然水體中主要顆粒物及其界面特征
目前針對沉水植物莖葉附著藻類組成已有大量研究,但多從湖泊生態驅動機制的角度出發,集中于附著藻類組成及生物量等受沉水植物種類[30- 31]、生長階段[32- 34]、水體營養鹽負荷[35- 36]等因素影響方面。由文輝等[31]發現富營養化水體中附著藻類的生物量大小表現為黑藻 (Hydrillaverticillata) > 金魚藻 (CeratophyllumdemersumL.) > 菹草 (Potamogetoncrispus) > 苦草 (Vallisnerianatans) > 馬來眼子菜 (Potamogetonmalaianus);蘇勝齊等[34]對菹草表面附植生物群落動態變化的研究發現,附生藻類的密度和生物量在菹草不同生長時期表現為:衰亡期 > 幼苗期 > 成熟期 > 生長期,并且不同葉齡沉水植物上附生藻類的群集時間也有長短之差,此外,沉水植物莖的不同部位附著藻類的分布也不同[33]。但是,也有學者認為附著藻類的組成與沉水植物關系不大,主要受水體環境制約[37- 38],在營養狀態顯著不同的湖泊中,附生藻類的物種數呈減少趨勢而種群密度呈增大趨勢[39]。
沉水植物莖葉表面同樣也是微生物棲息的良好生境[40],沉水植物莖葉著生微生物也日益受到關注。K?rner[41]用最大計數法分析了沉水植物表面和底泥表面硝化細菌和反硝化細菌差異,發現沉水植物表面硝化細菌數量大于底泥,而反硝化細菌則相反。Coci等[42]運用聚合酶鏈式反應(Polymerase chain reaction,PCR)技術對沉水植物表面、底泥表面和水面浮游植物表面的氨氧化細菌數量和活性進行了對比分析,發現沉水植物表面的氨氧化細菌無論在數量和活性上與其他兩個載體上的無明顯差異,并發現只有水力停留時間、總氮和總磷與氨氧化細菌潛在活性相關。此外,沉水植物附著菌類也存在時空分布差異。研究表明,葉片的附著菌類密度要小于莖部和葉柄處[43],同一葉片的不同部位菌群密度差異顯著[44]、葉片越老菌群密度越大[44],不同植物之間差異明顯[43- 44]。
綜上,現有沉水植物莖葉微界面物質組分研究多集中于生物組分(著生藻類、微生物)特征,鮮見針對非生物組分特征的相關報道。
1.2 微界面形態結構及物質交互作用
沉水植物微界面的形態結構直接影響光照的傳輸、氣體的交換及物質的輸移。光通過附著層到達植物莖葉表面時會發生衰減,附著層越厚越復雜光衰減越多;光的衰減在一定條件下會限制沉水植物的光合作用速率,進而影響附著物微界面內的氧的時空分布,最終對植物生長和水-植物間的物質遷移與轉化產生重要影響[45- 47];如厚度加大會增加水與植物表面間物質的傳輸距離和物質傳遞的阻力[25,48],研究證實沉水植物葉表附著層會阻抑游離態氧氣(O2)、二氧化碳(CO2)和可溶性有機碳(DOC)等物質從水相向植物表面的遷移[48- 49],但其阻抑機制尚不清楚,這均源于缺乏對微界面形態結構的認識,而現有研究更多的浮于表象,如有學者觀察到[50],富營養和貧營養湖泊中的附生藻類群落不僅組成結構有所差異,外部形態結構也顯著不同,富營養湖泊通常有相對厚但松散附著、不穩定的附著層,而貧營養湖泊的附著層則相對緊湊而且穩定。Jones等[26]通過附著層內 DO 和 pH 產生波動的范圍來表征其厚度,發現受植物莖葉表面附著物組成、植物種類、生長階段等的影響,厚度從200 μm (大葉藻(Zosteramarina))至2300 μm (宣藻(Scytosiphonlomentaria))不等[25- 26]。
此外,由于微界面中存在多種性質和尺寸的顆粒物,其物理、化學或生物學等特性不同,因而也存在復雜的相互間的交互作用,其中不同性質顆粒物之間的碰撞、聚集、沉積、分解是最基本的交互作用過程[4, 51]。這一過程不僅依賴于顆粒物的大小、密度、緊密程度和強度等物理特性,而且與其表面化學性質有關[52]。目前尚未見有針對沉水植物莖葉微界面物質交互作用的相關報道。
2 沉水植物莖葉微界面環境特征
由于沉水植物莖葉微界面厚度往往不足幾毫米[25- 26],其內部環境因子定量測定比較困難,隨著微電極技術的發展,原位測定沉水植物莖葉微界面環境因子的微時空分布,真實反映莖葉微界面環境特征成為可能。已有沉水植物莖葉微界面環境因子研究主要針對 DO 和 pH 等。
2.1 微界面DO分布特征
沉水植物葉表面的溶解氧存在顯著的時空分布特征。Sand-Jensen等[25]運用微電極技術對菹草、車前草(Littorellauniflora)、大葉藻、宣藻4種沉水植物葉表微界面 DO 變化進行了測定,發現越接近植物葉表 DO 濃度越高,且隨著光照強度增強而升高,葉表微界面 DO 的空間分布差異明顯;在白天,植物表面產生富氧環境,而夜間即使水體 DO 達到飽狀態,葉表附著層內也會出現高度厭氧的環境,故葉表微界面存在晝夜交替的富氧-厭氧環境;研究還發現菹草葉表 DO 對光照響應速率還存在季節性差異,8月份快于6月份。另外,在相同的光照強度變化范圍內,不同宿主植物微界面內 DO 變化幅度不同,菹草快于車前草,光合能力強的宿主植物變化幅度大,說明不同沉水植物葉表微界面 DO 變化程度受宿主植物自身的光合特性影響較大,可能是導致不同沉水植物分布區域水體 DO 的時空異質性的重要原因。在后續研究中,Sand-Jensen等[22]發現在微界面內光合作用強度有兩個峰值,一個在微界面頂部,主要受附著藻類影響,一個出現在葉表,主要受葉片光合作用影響。
現有研究對附著生物與沉水植物形成的微界面中 DO 變化及機理做了一定的探討,認為微界面內 DO 的變化主要是附著生物與宿主植物的光合作用共同決定的,微界面內物質的傳輸方式和速率與上覆水體的差異是形成 DO 特殊剖面的主要原因,但是附著層內的著生藻類和沉水植物的光合與呼吸作用對微界面氧變化的貢獻還難于甄別。且上述研究都集中在水質相對較好的水體中,認為附著生物大部分是自養生物[25- 26],光合作用產生的O2多數被呼吸作用消耗,而在富營養化水體中氮、磷等營養物質豐富,有機質含量也較高,那么在沉水植物表面的附著生物量也會較高,有機質等耗氧物質會出現富集[29],耗氧物質的富集勢必對微界面的 DO 變化產生影響,必將重塑 DO 的剖面分布規律和時間變化規律。目前關于富營養化水體中沉水植物莖葉微界面的 DO 研究還未見報道。
2.2 微界面pH值分布特征
沉水植物莖葉微界面內pH要高于周圍水體的 pH 值[25- 26]。Sand-Jensen等[25]發現沉水植物莖葉微界面的 pH 值要高于周圍水體的 pH 值,差值隨附著層厚度增大而增加。Eaton[26]將人造葉片與伊樂藻(Elodeanuttallii)在實驗室共同培養,利用微電極技術研究分析了人造葉片附著層的 pH 值空間分布,發現自微界面外側向內至葉表 pH 值逐漸升高,在葉表處達到最高,且附著層越厚,pH 值增加越多,但是,他們并未實際測定沉水植物伊樂藻葉表微界面 pH 值的變化。根據模擬實驗結果,認為附著生物光合作用及附著層對游離態 CO2的阻抑是導致 pH 值垂直分布差異的主要原因。此外,Jones等[26]還發現近葉表處 pH 值有所下降,但對下降的原因并沒有做深入研究。現有研究僅對沉水植物莖葉微界面內 pH 值的空間分別作了簡要探討,尚未有針對pH的時間變化報道。
3 沉水植物莖葉微界面對氮循環的調控作用
在水中氮素負荷不斷加劇的背景下,關于水生植物對氮調控的研究,學者們更關心水生植物對水體氮的去除效果。一般認為水生植物的吸收作用、加速顆粒物質沉降作用及被人為收割是水生植物除氮的主要途徑[53- 55]。Weisner等[28]發現沉水植被莖葉附著層具有增強水體反硝化速率的作用,后有研究還發現在營養物質豐富的水體中,有沉水植物區域的硝化強度要比無沉水植物的區域高10倍,沉水植物莖葉莖葉附著層的反硝化作用與沉積物的反硝化作用相當[53,56],K?rner[41]發現沉水植物表面有大量的硝化和反硝化細菌富集。沉水植物莖葉附著層形成的微界面硝化-反硝化作用作為水體中重要的自然脫氮機制逐漸引起學者的關注。
一般認為沉水植物與漂浮植物和挺水植物相比,其莖葉微界面為附著生物提供了更大的棲息地,同時沉水植被的分泌物和殘體為微生物提供了必要的有機物質[28,57],微界面的光合-呼吸作用為硝化-反硝化細菌創造了富氧-缺氧條件[28,58]。目前關于沉水植物莖葉附著層氮素調控研究主要圍繞在光照、水流、植物生長階段等因素下硝化-反硝化速率方面。研究發現光合作用產生的 O2是反硝化反應的一個重要抑制因素[42],但有利于硝化反應。Eriksson[56]發現光照條件下 O2和硝酸根離子凈富余,在黑暗條件下凈消耗,說明光照條件下硝化強度明顯高于黑暗條件,而反硝化只在呼吸作用明顯的黑暗條件才出現。但是S?rensen等[59]發現在白天微界面內的反硝化也在進行,只是速率比夜間低2—3倍。在流動水體中,附著層內反硝化反應僅在低DO濃度時發生,而在靜水條件下即使周圍水體中DO達到飽和狀態反硝化反應也能進行[57],主要是因為沉水植物及附著生物層呼吸作用耗氧較多造成表面缺氧導致。Palijan[60]等將不同枝齡金魚藻放在同一水體壞境中培養,發現成熟枝段表面的凈硝化活性有了明顯增強,認為成熟枝段附著生物層生物量較大是促使硝化速率增大的主要原因,由此可以推斷沉水植物的不同生長階段由于自身生理特點和附著生物的差異,會導致微界面對氮的調控能力差異。
上述研究從尺度上看,多基于沉水植物個體或群落水平,鮮見微界面水平研究;從表征指標來看,只是通過周圍水體環境中的無機氮的變化來反應植被對氮素調控的結果,尚未涉及到直接反映界面過程內氮形態的變化;從調控機制研究來看,缺乏微界面內微環境指標(DO、pH、Eh 等)的同步測定,只是通過水體的背景環境指標間接表征。因此,上述研究難以揭示沉水植物莖葉微界面的富氧-厭氧微環境對水體氮循環的調控機制。
4 研究展望
在富營養化水體中,沉水植物莖、葉表面的微界面是水中氨化、反硝化及厭氧氨氧化等脫氮行為機制的重要基礎,這可能是在一些沉水植物茂盛的水體中,水質長期處于清澈優質狀態,且沉水植物衰亡期并未出現明顯的“二次污染”現象的重要原因之一[61]。沉水植物莖葉微界面組分復雜,目前研究多側重于生物組分的特征描述,對各組分特別是非生物物質的作用,尤其是對莖葉微界面環境的影響缺乏系統深入研究。沉水植物微界面對水體氮循環的調控,尤其是反硝化脫氮作用是富營養化水體生態修復的重要生物化學過程[41]。目前的研究對于沉水植物微界面對水體氮循環調控結果有了初步的認識,認為沉水植物的微界面的存在可以促進水體的硝化-反硝化作用,在一定條件下反硝化速率可觀。但是,并沒有從微界面組成特征及其內部環境因子的角度深入揭示氮素形態遷移與轉化的機制。
因此,開展針對沉水植物莖葉微界面組分特征、環境因子特征及氮形態轉化主要過程的研究,可深入揭示沉水植物對富營養化水體氮素循環的調控機制,為富營養化水體氮素污染治理提供科學支撐。此外,針對污染物在環境微界面的轉移轉化機制與控制原理的研究,不僅要解決系統性問題,還必須解決方法學問題、過程認識問題和技術發展問題[4]。
(1)沉水植物莖葉微界面物質組成、結構特征及時空變化規律
重點發展基于原位取樣的質譜技術,深入探索不同生長階段沉水植物莖葉微界面物質組成及物質間化學反應動力學、反應速率、物質轉化通道、物料平衡等問題,通過發展微界面形貌原位連續觀測的顯微技術,實現對沉水植物莖葉微界面過程中顯微形貌變化的直接觀察,揭示微界面附著層物質的時空變化規律及相互作用機制。
(2)沉水植物莖葉微界面主要環境因子及其富氧-厭氧微生境的時空變化特征
重點發展基于原位測定的微電極技術,測定典型沉水植物莖、葉微界面 DO、pH 值、Eh 等環境因子,分析微界面主要環境因子的時空變化特征,探討沉水植物光合作用及呼吸作用強度及組織結構對莖、葉微界面主要環境因子的生理周期影響規律,揭示沉水植物莖葉微界面主要環境因子的影響機制。
(3)沉水植物莖葉微界面對富營養化水體氮素循環的調控機制
重點發展微量原位取樣技術、微電極技術、同位素示蹤技術等,測定不同沉水植物、不同生長階段的沉水植物莖葉微界面銨態氮、硝酸鹽氮、亞硝酸鹽氮、氧化亞氮等指標,研究微界面組成、結構及主要環境因子變化對氨化、硝化及反硝化作用的影響,探討微界面氨化、硝化及反硝化作用的時空分布特點及驅動機制,揭示沉水植物微界面對水體氮循環的影響及調控機制。
[1] Brown G E J, Foster A L, Ostergren J D. Mineral surfaces and bioavailability of heavy metals: A molecular-scale perspective. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(7): 3388- 3395.
[2] Fan C X, Wang C X. Environmental Geochemistry and Eutrophication of Lakes in the Middle and Lower Reaches of Yangtze River. Beijing: Science Press, 2007.
[3] Wu F C, Jin X C, Zhang R Y, Liao H Q, Wang S R, Jiang X, Wang L Y, Guo J Y, Li W, Zhao X L. Effects and significance of organic nitrogen and phosphorous in the lake aquatic environment. Journal Lake Science, 2010, 22(1): 1- 7.
[4] Qu J H, He H, Liu H J. Typical environmental micro-interfaces and its effect on environmental behaviors of pollutants. Acta Scientiae Circumstantiae, 2009, 29(1): 2- 10.
[5] Cai W J, Reimers C E. The development of pH and pCO2microelectrodes for studying the carbonate chemistry of pore waters near the sediment-water interface. Limnology and Oceanography, 1993, 38(8): 762- 773.
[6] David A, Steven E, Clare R. Dissolution of calcite in deep-sea sediments: pH and O2microelectrode results. Geochimica et Cosmochimica Acta, 1989, 53(11): 2831- 2845.
[7] Gundersen J K, J?rgensen B B. Microstructure of diffusive boundary layers and the oxygen uptake of the sea floor. Nature, 1990, 345(6276): 604- 607.
[8] J?rgensen B B, Marais D J D. The diffusive boundary layer of sediments: oxygen microgradients over a microbial mat. Limnology and Oceanography, 1990, 35(6): 1343- 1355.
[9] Lansard B, Rabouille C, Massias D. Variability in benthic oxygen fluxes during the winter-spring transition in coastal sediments: an estimation by in situ micro-electrodes and laboratory mini-electrodes. Oceanologica Acta, 2003, 26(3): 269- 279.
[10] Rasmussen H, J?rgensen B B. Microelectrode studies of seasonal oxygen uptake in a coastal sediment: role of molecular diffusion. Marine Ecology Progress Series, 1992, 81(3): 289- 303.
[11] Gardner W S, McCarthy M J. Nitrogen dynamics at the sediment-water interface in shallow, sub-tropical Florida Bay: why denitrification efficiency may decrease with increased eutrophication. Biogeochemistry, 2009, 95(2- 3): 185- 198.
[12] Strauss E A, Richardson W B, Cavanaugh J C, Bartsch L A, Kreiling R M, Standorf A J. Variability and regulation of denitrification in an Upper Mississippi River backwater. Journal of the North American Benthological Society, 2006, 25(3): 596- 606.
[13] Zhang F S, Shen J B, Feng G. Rhizosphere Ecology: Processes & Management. Beijing: China Agricultural University Press, 2009: 10- 11.
[14] Reddy K R, Patrick W H, Lindau J A C W. Nitrification-denitrification at the plant Root-sediment interface in wetlands. Limnology and Oceanography, 1989, 34(6): 1004- 1013.
[15] Waters I, Armstrong W, Thompson C J, Setter T L, Adkins S, Gibbs J, Greenway H. Diurnal changes in radial oxygen loss and ethanol metabolism in roots of submerged and non-submerged rice seedlings. New Phytologist, 1989, 113(4): 439- 451.
[16] Connell E L, Colmer T D, Walker D I. Radial oxygen loss from intact roots ofHalophilaovalisas a function of distance behind the root tip and shoot illumination. Aquatic Botany, 1999, 63(3- 4): 219- 228.
[17] Caffrey J M, Kemp W M. Seasonal and spatial patterns of oxygen production, respiration and root-rhizome release inPotamogetonperfoliatusL. andZosteramarinaL.. Aquatic Botany, 1991, 40(2): 109- 128.
[18] Inoue T M, Tsuchiya T. Interspecific differences in radial oxygen loss from the roots of threeTyphaspecies. Limnology, 2008, 9(3): 207- 211.
[19] Carpenter S R, Lodge D M. Effects of submersed macrophytes on ecosystem processes. Aquatic Botany, 1986, 26: 341- 370.
[20] Vis C, Hudon C, Carignan R. Influence of the vertical structure of macrophyte stands on epiphyte community metabolism. Canadian Journal of Fisheries and Aquatic Sciences, 2006, 63(5): 1014- 1026.
[21] Stevens C L, Hurd C L. Boundary-layers around bladed aquatic macrophytes. Hydrobiologia, 1997, 346(1): 119- 128.
[22] Sand-Jensen K, Revsbech N P. Photosynthesis and light adaptation in epiphyte-macrophyte associations measured by oxygen microelectrodes. Limnology and Oceanography, 1987, 32(2): 452- 457.
[23] McCormick P V, O′Dell M B, Shuford R B E, Backusa J G, Kennedyb W C. Periphyton responses to experimental phosphorus enrichment in a subtropical wetland. Aquatic Botany, 2001, 71(2): 119- 139.
[24] Pietro K C, Chimney M J, Steinman A D. Phosphorus removal by the Ceratophyllum/periphyton complex in a south Florida (USA) freshwater marsh. Ecological Engineering, 2006, 27(4): 290- 300.
[25] Sand-Jensen K, Revsbech N P, Barker J?rgensen B. Microprofiles of oxygen in epiphyte communities on submerged macrophytes. Marine Biology, 1985, 89(1): 55- 62.
[26] Jones J I, Eaton J W, Hardwick K. The influence of periphyton on boundary layer conditions: a pH microelectrode investigation. Aquatic Botany, 2000, 67(3): 191- 206.
[27] Liboriussen L, Jeppesen E. Structure, biomass, production and depth distribution of periphyton on artificial substratum in shallow lakes with contrasting nutrient concentrations. Freshwater Biology, 2006, 51(1): 95- 109.
[28] Weisner S E B, Eriksson P G, Granéli W, Leonardson L. Influence of macrophytes on nitrate removal in wetlands. Ambio, 1994, 23(6): 363- 366.
[29] Qin B Q, Song Y Z, Gao G. The function of periphyton during the transition between algal and macrophytic types in shallow eutrophic lake. Science in China Ser. C Life Sciences, 2006, 36(3): 283- 288.
[30] Pip E, Robinson G. A comparison of algal periphyton composition on eleven species of submerged macrophytes. Hydrobiological Bulletin, 1984, 18(2): 109- 118.
[31] You W H. The species composition and quantitative features of the periphytic algae communities in Dianshan Lake. Environmental Science, 1999, 20(5): 59- 62.
[32] Br?nmark C. Interactions between epiphytes, macrophytes and freshwater snails: A review. Journal of Molluscan Studies, 1989, 55(2): 299- 311.
[33] Morin J O N, Kimball K D. Relationship of macrophyte-mediated changes in the water column to periphyton composition and abundance. Freshwater Biology, 1983, 13(5): 403- 414.
[34] Su S Q, Shen A L, Yao W Z. Species composition and quantitative features of perphytic algae communities onPotamogetoncrispus. Journal of Southwest Agricultural University, 2002, 24(3): 255- 258.
[35] Chen C, Yin D, Yu B, Zhu H. Effect of epiphytic algae on photosynthetic function ofPotamogetoncrispus. Journal of Freshwater Ecology, 2007, 22(3): 411- 420.
[36] Lin H J, Dai X X, Shao K T, Su H M, Lo W T, Hsieh H L, Fang L S, Hung J J. Trophic structure and functioning in a eutrophic and poorly flushed lagoon in southwestern Taiwan. Marine Environmental Research, 2006, 62(1): 61- 82.
[37] Blindow I. The composition and density of epiphyton on several species of submerged macrophytes: The neutral substrate hypothesis tested. Aquatic Botany, 1987, 29(2): 157- 168.
[38] Cejudo-Figueiras C,lvarez-Blanco I, Bécares E, Saúl B. Epiphytic diatoms and water quality in shallow lakes: the neutral substrate hypothesis revisited. Marine and Freshwater Research, 2010, 61(12): 1457- 1467.
[39] Yuan X F, Shi Y H, Wang X R. Temporal and spatial distributions of periphytic algae in Taihu Lake. Journal of Agro-Environment Science, 2006, 25(4): 1035- 1040.
[40] Coci M, Bodelier P L E, Laanbroek H J. Epiphyton as a niche for ammonia-oxidizing bacteria: detailed comparison with benthic and pelagic compartments in shallow freshwater lakes. Applied and Environmental Microbiology, 2008, 74(7): 1963- 1971.
[41] K?rner S. Nitrifying and denitrifying bacteria in epiphytic communities of submerged macrophytes in a treated sewage channel. Acta Hydrochimica et Hydrobiologica, 1999, 27(1): 27- 31.
[42] Coci M, Nicol G W, Pilloni G N, Schmid M, Kamst-van Agterveld M P, Bodelier P L E, Laanbroek H J. Quantitative assessment of ammonia-oxidizing bacterial communities in the epiphyton of submerged macrophytes in shallow lakes. Applied and Environmental Microbiology, 2010, 76(6): 1813- 1821.
[43] Rimes C A, Goulder R. Temporal variation in density of epiphytic bacteria on submerged vegetation in a calcareous stream. Letters in Applied Microbiology, 1986, 3(1): 17- 21.
[44] Baker J H, Orr D R. Distribution of epiphytic bacteria on freshwater plants. Journal of Ecology, 1986, 74(1): 155- 165
[45] Black M A, Maberly S C, Spence D H N. Resistances to carbon dioxide fixation in four submerged freshwater macrophytes. New Phytologist, 1981, 89(4): 557- 568.
[46] Madsen T V, Sand-Jensen K. Photosynthetic carbon assimilation in aquatic macrophytes. Aquatic Botany, 1991, 41(1- 3): 5- 40.
[47] Smith F A, Walker N A. Photosynthesis by aquatic plants: effects of unstirred layers in relation to assimilation of CO2and HCO3-and to isotopic descrimination. New Phytologist, 1980, 86(3): 245- 259.
[48] Sand-Jensen K, Borg D, Jeppesen E. Biomass and oxygen dynamics of the epiphyte community in a Danish lowland stream. Freshwater Biology, 1989, 22(3): 431- 443.
[49] Demarty M, Prairie Y T. In situ dissolved organic carbon (DOC) release by submerged macrophyte-epiphyte communities in southern Quebec lakes. Canadian Journal of Fisheries and Aquatic Sciences, 2009, 66(9): 1522- 1531.
[50] Raeder U, Ruzicka J, Goos C. Characterization of the light attenuation by periphyton in lakes of different trophic state. Limnologica-Ecology and Management of Inland Waters, 2010, 40(1): 40- 46.
[51] Tang H X. Environmental nano-pollutants (ENP) and their micro-interfacial processes on the aquatic particles. Acta Scientiae Circumstantiae, 2003, 23(2): l46- 155.
[52] Liang L, Morgan J J. Chemical aspects of iron oxide coagulation in water, laboratory studies and implications for natural systems. Aquatic Sciences, 1990, 52(1): 32- 55.
[53] Eriksson P G, Weisner S E B. Nitrogen removal in a wastewater reservoir: the importance of denitrification by epiphytic biofilms on submersed vegetation. Journal of Environmental Quality, 1997, 26(3): 905- 910.
[54] Kreiling R, Richardson W B, Cavanaugh J C, Bartsch L A. Summer nitrate uptake and denitrification in an upper Mississippi River backwater lake: the role of rooted aquatic vegetation. Biogeochemistry, 2011, 104(1- 3): 309- 324.
[55] McKellar H N, Tufford D L, Alford M C, Saroprayogi P, Kelley B J, Morris J T. Tidal nitrogen exchanges across a freshwater wetland succession gradient in the upper Cooper River, South Carolina. Estuaries and Coasts, 2007, 30(6): 989- 1006.
[56] Eriksson G P, Weisner S E B. An experimental study on effects of submersed macrophytes on nitrification and denitrification in ammonium-rich aquatic systems. Limnology and Oceanography, 1999, 44(8): 1993- 1999.
[57] Eriksson P. Interaction effects of flow velocity and oxygen metabolism on nitrification and denitrification in biofilms on submersed macrophytes. Biogeochemistry, 2001, 55(1): 29- 44.
[58] Toet S, Huibers L H F A, Van Logtestijn R S P, Verhoeven J T A. Denitrification in the periphyton associated with plant shoots and in the sediment of a wetland system supplied with sewage treatment plant effluent. Hydrobiologia, 2003, 501(1- 3): 29- 44.
[59] S?rensen J, J?rgensen T, Brandt S. Denitrification in stream epilithon: Seasonal variation in Gelbk and Rabis Bk, Denmark. FEMS Microbiology Letters, 1988, 53(6): 345- 353.
[60] Palijan G, Fuks D, Vidakovic J. Spatial and temporal distribution of net nitrite and nitrate production on submersed macrophyteCeratophyllumDemersumL.. Fresenius Environmental Bulletin, 2009, 18(1): 64- 69.
[61] Ge X G, Wang G X, Li Z G. Effects ofEichhorniacrassipesremains on the organic pollution in urban riverway. Journal of Anhui Agricultural Sciences, 2010, 38(10): 5287- 5288, 5291- 5291.
參考文獻:
[2] 范成新, 王春霞. 長江中下游湖泊環境地球化學與富營養化. 北京: 科學出版社, 2007.
[3] 吳豐昌, 金相燦, 張潤宇, 廖海清, 王圣瑞, 姜霞, 王立英, 郭建陽, 黎文, 趙曉麗. 論有機氮磷在湖泊水環境中的作用和重要性. 湖泊科學, 2010, 22(1): 1- 7.
[4] 曲久輝, 賀泓, 劉會娟. 典型環境微界面及其對污染物環境行為的影響. 環境科學學報, 2009, 29(1): 2- 10.
[13] 張福鎖, 申建波, 馮固. 根際生態學——過程與調控. 北京: 中國農業大學出版社, 2009: 10- 11.
[29] 秦伯強, 宋玉芝, 高光. 附著生物在淺水富營養化湖泊藻-草型生態系統轉化過程中的作用. 中國科學C輯: 生命科學, 2006, 36(3): 283- 288.
[31] 由文輝. 淀山湖著生藻類群落結構與數量特征. 環境科學, 1999, 20(5): 59- 62.
[34] 蘇勝齊, 沈盎綠, 姚維志. 菹草著生藻類的群落結構與數量特征初步研究. 西南農業大學學報, 2002, 24(3): 255- 258.
[39] 袁信芳, 施華宏, 王曉蓉. 太湖著生藻類的時空分布特征. 農業環境科學學報, 2006, 25(4): 1035- 1040.
[51] 湯鴻霄. 環境納米污染物與微界面水質過程. 環境科學學報, 2003, 23(2): 146- 155.
[61] 葛緒廣, 王國祥, 李振國. 鳳眼蓮殘體對城市河道有機物污染的影響. 安徽農業科學, 2010, 38(10): 5287- 5288, 5291- 5291.
Research advancements and perspectives on leaf and stem micro-interfaces in submerged macrophytes and its effect on water nitrogen cycling
WANG Wenlin1,2, LIU Bo1,3, HAN Ruiming1, FAN Zhou1, WANG Guoxiang1,*
1JiangsuKeyLaboratoryofEnvironmentalChangeandEcologicalConstruction,CollegeofGeographicalScience,NanjingNormalUniversity,Nanjing210023,China2NanjingInstituteofEnvironmentalSciences,MinistryofEnvironmentalProtection,Nanjing210042,China3CollegeofGeographicalScience,NantongUniversity,Nantong226007,China
Various kinds of substances in water, including organic matter, silt, zoogloea, algae, microorganisms etc., often cumulate on the leaf and stem surface in submerged macrophytes. A micro-interface is therefore established which varies in its composition, structure and thickness according to the actual environmental properties. It induces specific heterogeneous oxidation-reduction condition and provides organic material for nitrogen-cycle bacteria thus plays an important role in micro-interfacial processes such as ammonification, denitrification and anammox. The composition of this micro-interface, its responses to micro-environmental changes and functions in regulating nitrogen cycling constitute the fundamental horizon for better understanding the feature of submerged macrophytes in water management and ecological regulation. The present paper summarizes the research advancements on leaf and stem micro-interface in submerged macrophytes and its effect on water nitrogen cycling. The substance composition and micro-environmental property of the micro-interface are identified and reviewed respectively. Perspectives on future research are raised.
Because of the compositional complexity in the leaf and stem micro-interface, recent studies have been mainly focused on the characterization of biotic components for example alga and microbe in submerged macrophytes. Much less information is available concerning the function of a certain component, especially that of the abiotic matters and that their effects on the micro-environmental properties in this micro-interface.
Thanks to the development of microelectrode technique, in situ measurement of micro-environmental factors in the leaf and stem micro-interface and their spatial and temporal changes becomes feasible recently. However, current studies are much centered on the non-eutrophicated freshwater in which the major proportional periphyton is considered as autotrophic and the photosynthesis-sourced oxygen is to be consumed by respiration processes. The actual condition in eutrophicated waters is characterized by the abundance of oxygen-depleting substances and their accumulation on the leaf and stem surface of submerged macrophytes greatly changes the environmental properties in the micro-interface. Reports on the fluctuation of such micro-environmental properties in eutrophicated waters are still largely missing.
The modulation of aquatic nitrogen cycling, specifically the denitrification by microbes in the micro-interface of submerged macrophytes, is the key biogeochemical process in ecological remediation of eutrophicated waters with high level of nitrogen nutrition. It has been proven that the existence of periphytic layers on the leaf and stem of submerge macrophytes could facilitate the aquatic nitrification-denitrification processes. The denitrification efficiency is apparently intensive in certain conditions. Nevertheless, these studies are mainly upon individual submerged plant or at the level of community as maximum, and in most cases estimating the nitrogen modulation according to the overall level of aquatic inorganic nitrogen, rather than the actual substance composition and inner environmental factors of the micro-interface that directly alter the nitrogen transportation and transformation.
To further elucidate the secrets of leaf and stem micro-interface, studies are needed on the spatial and temporal variations in substance composition, structural characteristics and oxic-anoxic micro-inhabitants. The modulation mechanism of this micro-interface on the biogeochemical cycling of nitrogen in eutrophicated waters are fundamentally required.
submerged macrophyte; leaf and stem micro-interface; substantial composition; micro-environmental property; water nitrogen cycling
國家自然科學基金 (41173078); 科技部國際合作重大項目 (2010DFB33960); 環保公益性行業科研專項 (201309035); 國家水體污染控制與治理科技重大專項 (2012ZX07506-007, 2014ZX0710- 012)
2013- 08- 15;
2014- 06- 06
10.5846/stxb201308152085
*通訊作者Corresponding author.E-mail: wangguoxiang@njnu.edu.cn
王文林,劉波,韓睿明,范婤,王國祥.沉水植物莖葉微界面及其對水體氮循環影響研究進展.生態學報,2014,34(22):6409- 6416.
Wang W L, Liu B, Han R M, Fan Z, Wang G X.Research advancements and perspectives on leaf and stem micro-interfaces in submerged macrophytes and its effect on water nitrogen cycling.Acta Ecologica Sinica,2014,34(22):6409- 6416.

