微波輻射下污泥殘渣催化甲烷裂解制氫
劉樹剛,鄧文義,蘇亞欣,沈恒根
(東華大學環境科學與工程學院,上海 201620)
能源與環境問題是人類社會未來可持續發展所面臨的主要問題。隨著不可再生化石能源的進一步枯竭以及使用對環境造成的嚴重污染,尋求高效、清潔無污染的新能源已經成為當今世界的主題。近年來,氫能作為一種理想的新型能源日益受到人們的關注。傳統的制氫方法主要有CH4重整和CH4部分氧化兩種,但由于產物中含有大量不易分離的CO 而限制了H2的進一步使用,如氫燃料電池中CO 的濃度要求在10μL/L 以內。
CH4直接裂解作為一種具有工藝簡單、產物容易分離等優點的工藝而受到了廣泛研究。CH4裂解產物為C 和H2,可以達到產出高純H2的目的。甲烷性質穩定,通過向反應中加入催化劑可以降低反應所需活化能,提高反應效率。研究指出,過渡金屬(Ni、Co、Fe 等)以及過渡金屬合金對CH4裂解有著顯著的催化作用[1-3]。目前,在CH4催化裂解制氫的研究中,Ni 作為一種高效低廉的催化劑而得到廣泛應用。近年來,炭材料作為一種價格低廉、催化性能良好的催化劑而日益受到重視[4-6]。炭催化劑的選擇主要傾向于工業活性炭、炭黑以及煤半焦等。此外,生物質焦由于其多孔結構以及灰分中含堿金屬而具有一定的催化活性,且能原位再生,成為一種頗具潛力的炭催化劑[7]。
傳統的加熱方式由于受到熱量傳遞的限制,導致床層溫度分布不均勻,影響到CH4的轉化率[8]。近年來,微波加熱作為一種新型的催化CH4裂解的加熱方式得到了廣泛研究[9-11]。微波加熱與傳統的加熱方式相比主要具有以下優點:①加熱均勻;②加熱速率快;③有選擇性加熱,等等。另外,微波加熱條件下可能產生“微等離子體”或“熱點效應”,增強加熱效果。
本研究在微波加熱條件下,以污泥熱解殘渣為催化劑,系統考察了影響CH4裂解的幾種因素,主要包括微波功率、氣氛條件、粒徑以及CH4濃度的影響;并對污泥殘渣的表面性質,包括比表面積、孔徑分布以及平均孔徑的變化進行了測定,并對反應前后污泥殘渣表面進行了掃描電鏡分析;在實驗結果的基礎上,對所探究影響CH4裂解的因素進行了分析和討論。
1 實驗部分
1.1 污泥殘渣的制備與分析
污泥殘渣是由取自上海某污水處理場的機械脫水污泥經熱解30min 得到。熱解條件如下:將電阻爐預熱至800℃,熱解前用N2以100mL/min 的流量吹掃石英反應器5min,將系統內空氣排出;然后將盛有污泥的石英反應器緩緩推入爐內并使污泥在N2氣氛下進行熱解。污泥經熱解后的殘渣經研磨、篩分置于干燥皿中備用。新鮮污泥殘渣的數據分析見表1 和表2。

表1 污泥殘渣C、H、N 元素分析 單位:%

表2 污泥殘渣金屬元素分析 單位:mg/g
1.2 實驗裝置
實驗采用連續流動石英質固定床反應器,實驗系統如圖1 所示。微波加熱系統由美的微波爐改裝而成,該微波爐額定功率為800W,有10 個可調功率(10%~100%可調),微波頻率為2.45GHz。測溫儀器選用美國STL200-A314 型紅外測溫儀。樣品制備以及空白實驗加熱裝置選用上海意豐SK2-1-10 型電阻爐,電阻爐額定功率為6. 3kW,采用智能溫控系統,0~1200℃可調。反應器是內徑為28mm,長度為450mm 的石英管。氣體樣品采用上海天美GC7900 氣相色譜儀檢測,檢測器類型為TCD 熱導檢測器,色譜柱為填充柱,型號為TDX-01,規格為2m(L)×3mm(OD)×2mm(ID),高純N2為載氣,載氣流量30mL/min,進樣量1mL;檢測器溫度120℃,檢測電流50mA,進樣口溫度120℃,柱溫50℃。
1.3 實驗方案
在進行不同氣氛升溫實驗時,系統首先使用CH4、N2或者H2(60mL/min)對裝置進行空吹3min以掃除裝置內的雜質氣體,然后在給定工況下進行升溫實驗。在進行CH4裂解實驗時,污泥殘渣質量均為12g,CH4流量均設定為60mL/min。首先系統使用N2(60mL/min)空吹3min,然后在N2氛圍內升溫,至裝置溫度相對穩定后置換為CH4或混合氣體(高純N2為稀釋氣體)。反應過程中每隔一定時間對尾氣進行收集并快速進行離線分析。實驗結果以CH4轉化率為評價指標,CH4轉化率通過分析出口CH4及H2的體積分數計算得出,計算公式如 式(1)。
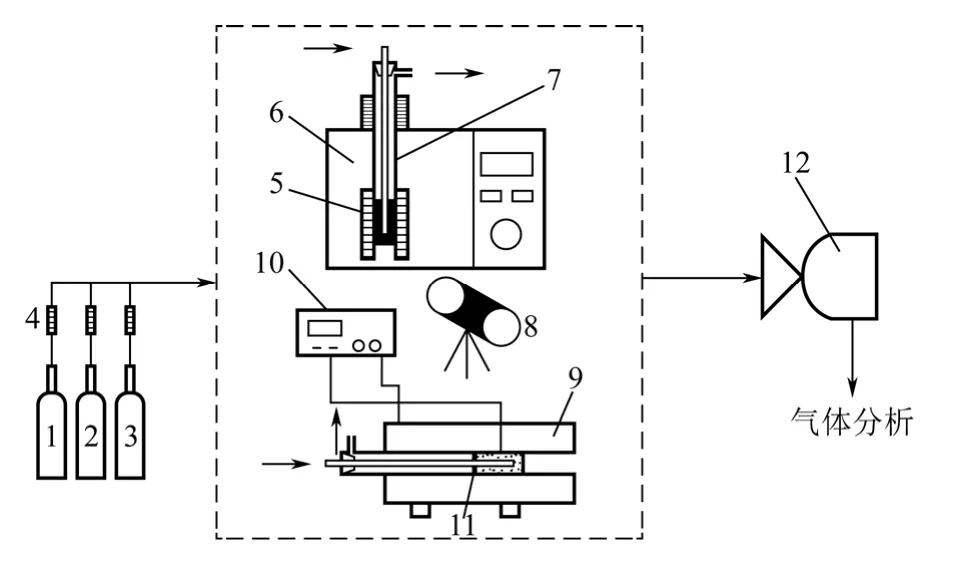
圖1 實驗裝置示意圖
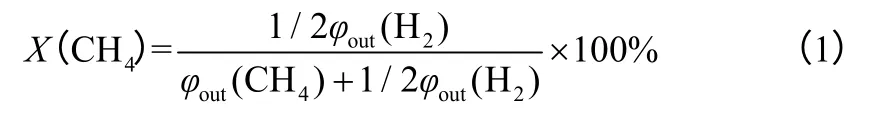
式中,X(CH4)為CH4轉化率;φout(CH4)為在反應系統出口混合氣體中CH4體積分數;φout(H2)為在反應出口混合氣體中H2體積分數。
1.4 活性炭表面特征分析
反應前后污泥殘渣的比表面積和孔結構采用TRISTARⅡ3020 型比表面積儀對樣品的比表面積和孔徑分析儀進行測定,吸附質為液氮(77K)。樣品測定前在200℃抽真空8h 以上,以排除內部水分和雜質氣體。總的比表面積通過BET 方程線性回歸確定,總的孔容由BJH 模型確定,由BJH 脫附模型進行孔徑分布確定。反應前后活性炭的表面結構由Quanta-250 型掃描電子顯微鏡直接觀察。
2 結果與討論
2.1 空白實驗
為了解CH4在無催化劑條件下的裂解反應情況,采用電阻爐進行了不同溫度下CH4裂解的空白實驗。反應溫度分別為785℃、900℃及950℃,CH4流量60mL/min,結果如圖2 所示。由圖2 可知,在沒有催化劑的條件下,CH4的轉化率維持在很低的水平。在900℃以下,CH4的轉化率幾乎可以忽略不計;當溫度高于900℃時,CH4轉化率開始增大,950℃時對應的CH4轉化率約為4%。
作為對比,考察了電阻爐內污泥殘渣對CH4裂解的催化效果。反應溫度分別為785℃、850℃及950℃,CH4流量為60mL/min,實驗結果如圖3 所示。由圖3 可以看出,CH4轉化率隨溫度的升高而升高,在3 種反應溫度下,CH4轉化率分別為14.7%、35.9%和83.8%。與空白實驗對比可知,污泥殘渣具有良好的催化作用。
2.2 微波功率的影響
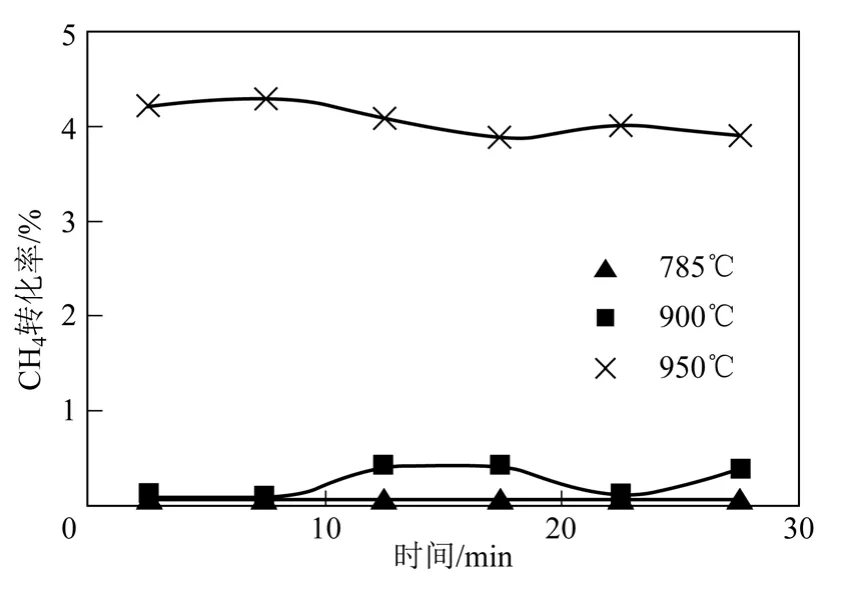
圖2 無催化劑條件下CH4 裂解空白實驗
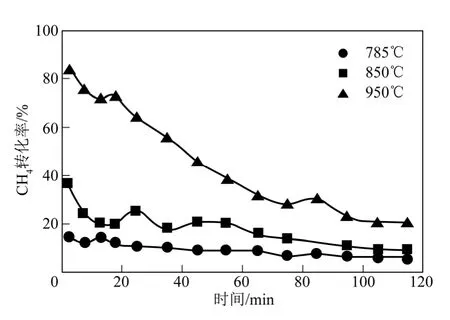
圖3 電阻爐內污泥殘渣催化CH4 裂解實驗
CH4裂解正向反應為吸熱反應,溫度是影響反 應進程的重要因素,在微波熱解實驗系統中,不同的溫度可以通過改變微波功率得以實現。因此,本實驗考察了CH4轉化率隨微波功率的變化趨勢,實驗中污泥殘渣的質量均為12g,CH4流量均為60mL/min,結果如圖4 所示。由圖4 可知,增大微波功率可以有效提高CH4的轉化率,微波功率分別為320W 和560W 時,CH4的轉化率分別為74.5%和84.7%。由圖4 還可以看出,反應初始階段,兩種功率下反應系統床層平均溫度分別為821℃和871℃。但隨著反應的進行,反應溫度顯示出明顯的降低趨勢,反應后期床層平均溫度分別降低至675℃和738℃。分析產生這種現象的原因與微波場中的“熱點效應”有關:微波場中氣體放電等離子體的形成與放電氣體的性質有著緊密聯系,在本次實驗中,CH4/H2體積比隨著反應的進行逐步升高,這可能會導致產生的放電等離子體數量的降低,從而導致床層平均溫度的降低的原因。圖5 為微波功率分別為320W 和560W,不通CH4,且N2為30mL/min系統出口氣體組分分析。由圖5 可知,兩種工況下,出口氣體中CH4體積分數幾乎可以忽略不計,H2體積分數均在4%以下,并隨時間的增加呈現出減小趨勢。這小部分H2來自污泥殘渣中的殘留H 元素,因此實測的CH4轉化率將略高于CH4的真實轉化率。

圖4 微波功率對CH4 轉化率的影響
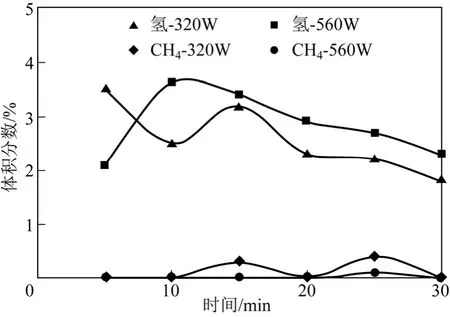
圖5 無CH4 條件下污泥殘渣空白實驗
2.3 氣氛的影響
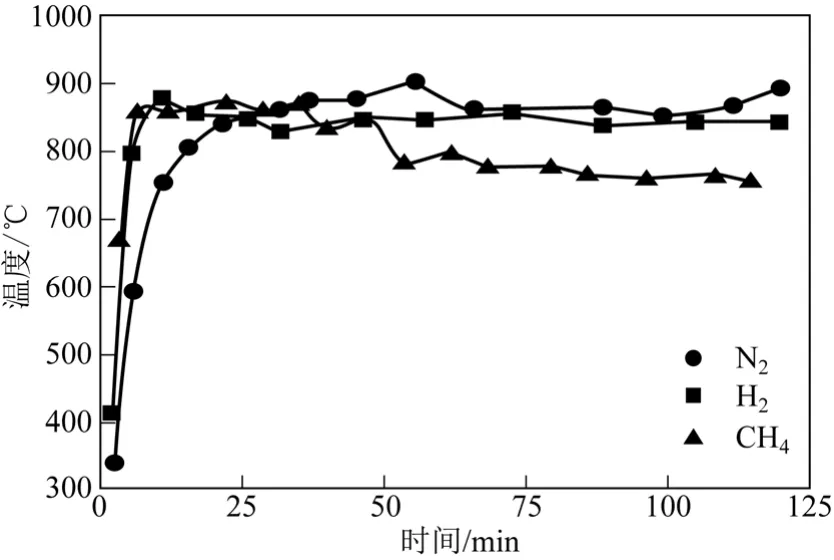
圖6 不同氣氛條件下污泥殘渣溫度
為了進一步探究微波加熱條件下,不同氣氛條件對CH4催化裂解過程中溫度的影響。基于微波氣體放電特性,對污泥殘渣在微波功率為320W、氣體流量為60mL/min 的N2、H2和CH4氛圍內分別進行了升溫特性實驗,結果如圖6 所示。由圖6 可知,不同氣氛條件下,污泥殘渣呈現出不同的微波升溫特性。加熱30min 后,N2和H2中污泥殘渣的溫度均能夠保持在比較穩定的水平,其床層平均溫度分 別為869℃和843℃。污泥殘渣在CH4氣氛中的溫度最低,并隨加熱時間有逐漸下降的趨勢,最終穩定在760℃左右。產生這種現象的主要原因是[12]:微波輻射下,部分氣體分子中的電子會被激發脫離形成宏觀顯電中性,包含電子、離子和中性粒子的等離子氣體,等離子體放電伴隨著極強的熱輻射和熱傳導,導致床層的平均溫度升高;同時這種特性與工作氣體的性質有關,N2和H2在微波誘導下更加容易被電離,內部產生等離子體的數量多于CH4氣氛中,導致前兩者床層溫度較高。
2.4 粒徑的影響
粒度影響反應物在催化劑內部的擴散情況,是影響催化劑活性的一個重要因素。圖7 給出了在微波功率為320W、CH4流量為60mL/min 條件下,3種不同粒度污泥殘渣的升溫曲線。由圖7 可知,粒徑對微波加熱效果影響顯著,粒徑越小,污泥殘渣在微波場中的加熱效果則越好,這可能是由于微波加熱條件下,減小粒徑有利于增加催化劑內部放電等離子體的數量所致[6]。從圖7 還可以發現,當粒徑為<0.4mm 或2.5~5mm 時,污泥殘渣溫度升高后都維持在穩定的水平,沒有出現先升高后逐漸降低的現象。
由于不同粒徑條件下的催化劑溫度差異明顯,導致不同粒徑催化劑作用下的CH4轉化率也有顯著不同,其結果如圖8 所示。由圖8 可知,CH4初始轉化率和催化劑溫度密切相關,當向反應器中通入CH4時,粒徑0.4~1mm 催化劑和粒徑<0.4mm 催化劑溫度相近,分別為814℃和793℃,CH4初始轉化率也非常相近;當催化劑粒徑2.5~5mm 時,通入CH4時刻的催化劑溫度為608℃,因而CH4初始轉化率也明顯低于其他兩種工況。對比0.4~1mm 粒徑工況和<0.4mm 粒徑工況可以發現,由于0.4~1mm 粒徑的催化劑在溫度升至最大值后逐漸降低,因此該工況下CH4轉化率的下降速度明顯快于催化劑粒徑<0.1mm 的工況。粒徑除了對微波加熱產生影響外,還可能在其他方面對CH4轉化率產生影響,主要體現在以下兩方面:一方面,隨著催化劑粒徑增大,催化劑比表面積減小,導致CH4轉化率降低;另一方面,隨著催化劑粒徑增大,增加了CH4從顆粒表面到內部的擴散阻力[13]。此外,減小粒徑還可以緩解積炭對催化劑表面孔隙的堵塞,從而使催化劑具有更加良好的催化性能[14]。但是,從實驗結果中催化劑溫度和CH4轉化率之間的密切關系可以看出,在粒徑所產生的影響當中,粒徑變化所導致的催化劑溫度的變化占據了主導作用。

圖7 不同粒徑對溫度的影響
2.5 進口甲烷濃度的影響
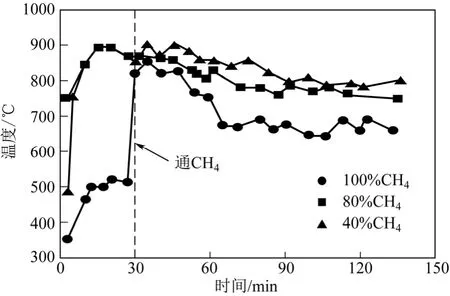
圖9 不同濃度對溫度的影響
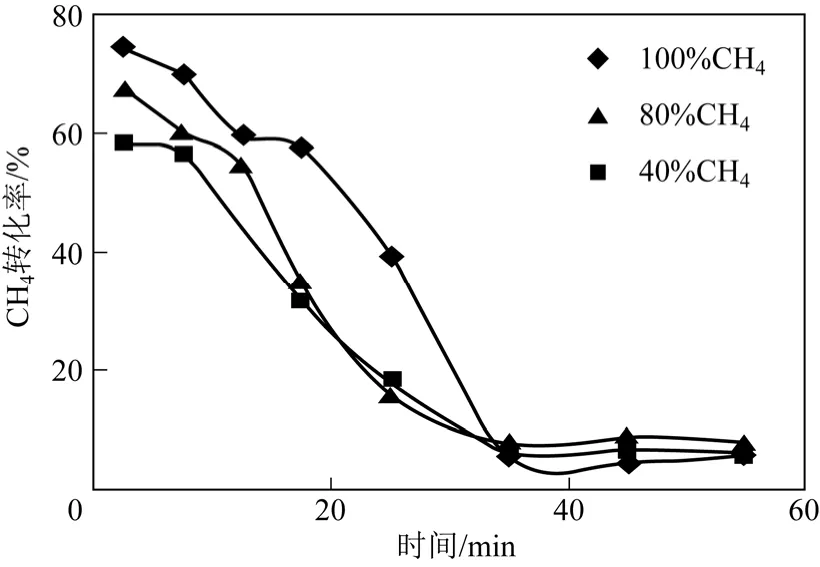
圖10 不同濃度對CH4 轉化率的影響
圖9 為進口CH4濃度分別為100%、80%和40%條件下污泥殘渣的升溫曲線。由圖9 可知,與純CH4工況相比,N2的引入能夠起到顯著提高反應溫度的效果,N2比例越大,效果越明顯。同時還可知,混合氣對反應過程中溫度的下降趨勢具有良好的抑制作用,反應末期,3 種工況下的床層溫度分別為660℃、741℃和802℃,表明N2的引入可以促進微波場內氣體放電等離子體的產生。CH4轉化率與反應 溫度密切相關,圖10 為不同進口CH4濃度對CH4轉化率的影響。由圖可知,CH4轉化率隨N2/CH4比例的增大而減小,3 種工況下CH4初期轉化率分別為74.5%、67.7%和48.2%。這與溫度的變化趨勢不一致,分析主要原因有以下兩個方面:一方面,反應過程中不同工況的CH4流量保持不變,通過改變N2流量來改變進口CH4濃度,因此CH4濃度越小,則CH4在反應器內的停留時間越短,從而導致CH4轉化率降低;另一方面,CH4濃度越高,單位氣體內所含CH4量增大,從化學平衡的角度分析,增大反應物的濃度可以促使反應向右移動,從而提高CH4轉化率。
2.6 反應前后污泥殘渣表面性質的變化
分別對新鮮樣品和反應后的樣品進行掃描電鏡、比表面積和孔結構分析測試,結果如圖11 和表3 所示。由表3 可以看出,經CH4裂解反應后,污泥殘渣的比表面積有所降低,分別由反應前的40.623m2/g 降低至反應后的32.346m2/g。其微孔體積反應前后基本保持不變,但平均孔徑有所增大,由反應前的86.796nm 增至反應后的86.972nm。由此可以推斷,污泥殘渣催化甲烷裂解過程中失活的原因可能與比表面積的降低有關。由圖11 可以看出,反應后的污泥殘渣表面有大量積炭的產生的同時還伴隨著熔融球狀物體的生成,可能與微波場中氣體放電等離子體所產生的瞬間局部高溫有關(即“熱點效應”)。同時由圖11 還可以發現,熔融球狀物產生數量隨粒徑的減小而增大,這也進一步說明污泥殘渣內部等離子體的產生與粒徑之間有直接關聯,減小粒徑有利于反應過程中氣體放電等離子體的形成。
3 結 論


圖11 污泥殘渣反應前后電鏡掃描測試
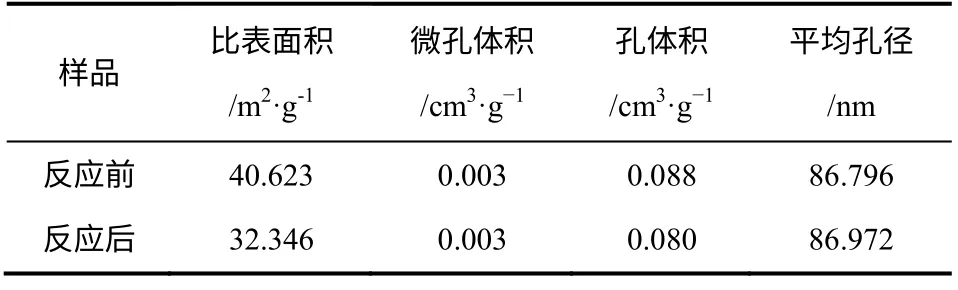
表3 反應前后污泥殘渣表面性質的變化
微波加熱條件下,微波功率、氣氛條件、粒徑 以及CH4濃度對污泥殘渣催化甲烷裂解過程具有明顯的影響,得出以下結論。
(1)CH4裂解的正向反應為吸熱反應,微波功率增大,反應溫度升高,促進了甲烷裂解反應的正向進行。
(2)由于不同氣體在微波場中的放電特性存在差異,污泥殘渣在N2、H2以及CH4呈現出不同的溫度特性,其中污泥殘渣在N2和H2中的溫度較高,在CH4氣氛中的溫度最低。
(3)減小粒徑可以促進污泥殘渣內部氣體放電等離子體的生成,提高反應溫度,從而進一步促進甲烷裂解反應的正向進行。
(4)CH4初始濃度對CH4轉化率有明顯影響,CH4濃度越高,則CH4轉化率越大。
(5)微波裂解反應后污泥殘渣比表面積有所 降低,孔徑有所增大,這是由于甲烷裂解反應產生的積炭覆蓋在活性炭表面所致,說明污泥殘渣在催化甲烷裂解過程中活性降低的原因可能與表面積炭的覆蓋有關。
[1] Rmakova M A,Ermakov D Y. Ni/SiO2and Fe/SiO2catalysts for production of hydrogen and filamentous carbon via methane decomposition[J]. Catalysis Today,2002,77(3):225-235.
[2] Italiano G,Delia A,Espro C,et al. Methane decomposition over Co thin layer supported catalysts to produce hydrogen for fuel cell[J]. International Journal of Hydrogen Energy,2010,35(20):11568-11575.
[3] Reshetenko T V,Avdeeva L B,Ushakov V A,et al. Coprecipitated iron-containing catalysts (Fe-Al2O3,Fe-Co-Al2O3,Fe-Ni-Al2O3) for methane decomposition at moderate temperatures. Part II. Evolution of the catalysts in reaction[J]. Applied Catalysis A:General,2004,270(1-2):87-99.
[4] Nazim Z Muradov. CO2-free production of hydrogen by catalytic pyrolysis of hydrocarbon fuel[J]. Energy & Fuels,1998,12(1):41-48.
[5] Nazim Muradov. Hydrogen via methane decomposition : An application for decarbonization of fossil fuels[J]. International Journal of Hydrogen Energy,2001,26(11):1165-1175.
[6] Kim M H,Lee E K,Jun J H,et al. Hydrogen production by catalytic decomposition of methane over activated carbons:Kinetic study[J]. International Journal of Hydrogen Energy,2004,29(2):187-193.
[7] 彭軍霞,趙增立,潘守聚,等. 生物質焦催化裂解萘和苯酚的實驗[J]. 農業機械學報,2010,41(5):76-81.
[8] Perry W L,Datye A K,Prinja A K,et al. Microwave heating of endothermic catalytic reactions:reforming of methanol[J]. AIChE Journal,2002,48(4):820-831.
[9] Cooney D O,Xi Z. Production of hydrogen from methane and methane/team in a microwave irradiated char-loaded reactor[J]. Fuel Science & Technology International,1996,14(8):1111-1141.
[10] Domínguez A,Fidalgo B,Fernández Y,et al. Microwave-assisted catalytic decomposition of methane over activated carbon for CO2-free hydrogen production[J]. International Journal of Hydrogen Energy,2007,32(18):4792-4799.
[11] 李龍之,宋占龍,李中慶,等. 微波輻照下活性炭催化CO2重整CH4制備合成氣[J]. 煤炭學報,2012,37(4):669-673.
[12] 徐學基,諸定昌. 氣體放電物理[M]. 上海:復旦大學出版社,1996.
[13] Horikoshi S , Osawa A , Sakamoto S , et al. Control of microwave-generated hot spots. Part V. Mechanisms of hot-spot generation and aggregation of catalyst in a microwave-assisted reaction in toluene catalyzed by Pd-loaded AC particulates[J]. Applied Catalysis A:General,2013,460:52-60.
[14] 李延兵. 炭體系下二氧化碳重整甲烷試驗研究及數值模擬[D]. 南京:東南大學,2008.

