晚期糖基化終產物通過mTORC1/uPAR途徑促進足細胞移動*
談曉凡, 陳源漢, 俞春萍, 賴宇雄, 張 麗, 趙星辰, 張 鴻, 林 婷, 李銳釗, 史 偉△
(1南方醫科大學研究生學院,廣東 廣州 510515;2廣東省人民醫院腎內科,廣東省醫學科學院,廣東 廣州 510080)
晚期糖基化終產物通過mTORC1/uPAR途徑促進足細胞移動*
談曉凡1, 2, 陳源漢2, 俞春萍2, 賴宇雄2, 張 麗2, 趙星辰1, 2, 張 鴻2, 林 婷2, 李銳釗2, 史 偉2△
(1南方醫科大學研究生學院,廣東 廣州 510515;2廣東省人民醫院腎內科,廣東省醫學科學院,廣東 廣州 510080)
目的: 足細胞哺乳動物雷帕霉素靶蛋白復合體1(mTORC1)活化是糖尿病腎病的重要發病機制。我們前期在db/db小鼠中觀察到調控足細胞活動度的尿激酶型纖溶酶原激活物受體(uPAR)表達增加。本研究旨在研究晚期糖基化處理的牛血清白蛋白(AGE-BSA)對mTORC1、uPAR和足細胞活動度的影響并初步探索其可能的分子聯系。方法: 體外培養小鼠腎小球足細胞,MTT法和免疫熒光分析各刺激物及干預劑對足細胞存活率及細胞骨架的影響。Western blotting檢測正常對照組、對照BSA組及AGE-BSA處理組mTORC1的活性及uPAR的表達水平,劃痕實驗檢測足細胞的活動度。進一步采用雷帕霉素抑制AGE-BSA組mTORC1的活性,觀察uPAR和細胞活動性的改變。結果: 在預設濃度及干預時間下各刺激物及干預劑對細胞存活率及細胞骨架無明顯影響。AGE-BSA 可上調足細胞mTORC1的活性和uPAR的水平,并促進足細胞移動。雷帕霉素能抑制AGE-BSA引起的uPAR表達水平的上調和細胞活動性的增強。結論: AGE-BSA 可能通過mTORC1/uPAR途徑導致足細胞移動性增強。
足細胞; 細胞移動性; 晚期糖基化終產物; 哺乳動物雷帕霉素靶蛋白復合體1; 受體, 尿激酶型纖溶酶原激活物
糖尿病腎病是發達國家導致終末期腎病最常見的原因,中國近年的發病率也逐漸增加[1]。足細胞損傷是糖尿病腎病的重要致病原因,近年受到研究者的重視[2-3]。晚期糖基化終產物(advanced glycosylation end products,AGEs)是高濃度葡萄糖或其它還原性的單糖與蛋白質、脂質、核酸等在無酶參與的條件下形成的穩定共價合成物,是糖尿病的重要致病物質,其中以糖基化白蛋白的研究最多[4-5]。糖基化牛血清白蛋白(AGE-BSA)能通過AGE受體介導足細胞凋亡[6]。近年發現,在亞致死損傷條件下,足細胞活動性增加也是其致病的一個重要機制[7]。但是,AGEs對足細胞活動性的影響及詳細的分子機制尚不完全清楚。
哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一種絲氨酸/蘇氨酸激酶,新近發現它是一個引起糖尿病腎病的重要致病分子[8-9]。哺乳動物雷帕霉素靶蛋白復合體1(mammalian target of rapamycin complex 1, mTORC1)在介導細胞生長和增殖方面發揮重要作用[10]。糖尿病腎病小鼠模型中足細胞內mTORC1活性顯著增強;小鼠足細胞特異性高表達mTORC1可出現糖尿病腎病樣的腎小球損傷[8-9]。最近發現mTORC1 在調節細胞的移動性方面發揮著重要作用[11-12]。本研究旨在明確AGEs能否通過mTORC1途徑影響足細胞活動性,并探索AGEs通過mTORC1活性增強引起足細胞損傷的新機制。
材 料 和 方 法
1 主要儀器和試劑
二氧化碳培養箱(Thermo);SW-CJ-D1F型潔凈工作臺(蘇州安泰空氣技術有限公司);倒置相差顯微鏡、熒光顯微鏡和激光共聚焦顯微鏡(OLYMPUS);酶標儀(Molecular Devices);Mini-PROTEAN?3電泳系統(Bio-Rad)。
RPMI-1640(Corning);胎牛血清(FBS)、0.25%胰酶(Gibco);鼠尾膠原Ⅰ型(BD);γ干擾素(ProSpec);雷帕霉素、BSA和 D-葡萄糖(Sigma);P70S6K抗體、p-P70S6K抗體、驢抗羊Alexa Fluor 488抗體(Cell Signaling);尿激酶型纖溶酶原激活物受體(urokinase-type plasminogen activator receptor, uPAR)抗體和synaptopodin 抗體(Santa Cruz);GAPDH抗體(GOOD HERE);防熒光淬滅劑(Beyotime);MTT試劑盒(KeyGEN)。
2 AGE-BSA的制備
將40 g/L BSA與90 g/L葡萄糖溶于0.2 mol/L PBS,在無菌條件下37 ℃避光孵育90 d。孵育結束后用10倍體積的0.01 mol/L PBS充分透析以替換0.2 mol/L PBS及去除未結合的剩余葡萄糖;為了更充分地去除未結合葡萄糖,使用50 kD大小的超濾管過濾除去葡糖糖而截留濃縮AGE-BSA。濃縮的AGE-BSA使用0.01 mol/L PBS稀釋并使用0.22 μm濾器過濾除菌,新制備的AGE-BSA采用BCA法測定其濃度。對照BSA(control BSA, co-BSA)不加高滲葡萄糖,其余處理同AGE-BSA制備。
3 足細胞的培養和實驗分組
條件永生化足細胞系由美國J. Resier教授(Rush University Medical Center, Chicago, IL, USA)惠贈。細胞復蘇后用含10% FBS的RPMI-1640和(20~100)×103U/L重組小鼠γ干擾素在5% CO2、33 ℃環境下誘導傳代增殖。然后轉入5% CO2、37 ℃培養箱,用不含重組小鼠γ干擾素的RPMI-1640加5% FBS在包被有Ⅰ型鼠尾膠原的培養皿中誘導分化。經8~12 d的培養誘導,足細胞進入分化階段并最終分化成熟,細胞分化成熟后用足細胞特異性骨架蛋白synaptopodin染色陽性確定足細胞已分化成熟。本實驗所有足細胞實驗均在分化成熟后進行。
根據實驗設計,分化成熟足細胞將分為(1)正常對照組(control):未加任何干預;(2)co-BSA對照組:co-BSA(100 mg/L)干預24 h;(3)AGE-BSA組:AGE-BSA(100 mg/L)干預24 h;(4)雷帕霉素組:10 nmol/L雷帕霉素干預24 h;(5)AGE-BSA+雷帕霉素組:AGE-BSA(100 mg/L)+10 nmol/L雷帕霉素干預24 h。
4 主要實驗方法
4.1 MTT實驗檢測足細胞存活率 分化成熟的足細胞按100 μL/well(約5 000個細胞)接種到96孔板中,5% CO2、37 ℃孵育過夜。按照實驗分組加入刺激物及干預劑,在培養箱內孵育24 h,加入50 μL MTT孵育4 h后,吸棄上清液,每孔加入150 μL二甲基亞砜(DMSO),室溫振蕩10 min用全自動酶標儀讀取550 nm處吸光度(A)。細胞存活率(%)=檢測孔的A值/對照孔的A值×100%。
4.2 免疫熒光激光共聚焦檢測 將足細胞接種至預先用Ⅰ型鼠尾膠原包被的6孔板(含蓋玻片)中,37 ℃分化成熟。按實驗要求給予相關干預,干預結束后采用4%多聚甲醛固定15 min,之后PBS洗3次,每次5 min。5%牛血清白蛋白封閉1 h,PBS洗3次,每次5 min。I抗羊抗小鼠多克隆synaptopodin抗體(1∶80)4 ℃孵育過夜,PBS洗3次,每次5 min。之后操作均在避光環境下進行。熒光Ⅱ抗驢抗羊Alexa Fluor 488(1∶250)室溫孵育1 h,PBS洗3次,每次15 min。加DAPI(1∶1 000)孵育5 min染核,PBS洗3次,每次10 min。采用抗熒光淬滅劑封片,激光掃描共聚焦顯微鏡下觀察,所用圖片均在400倍油鏡下拍攝。
4.3 劃痕實驗檢測足細胞移動性 將已分化成熟的足細胞按每孔1×108/L數量接種到6孔板,5% CO2、37 ℃孵育過夜。用1 mL無菌槍頭末端刮除每孔蓋玻片上的細胞,PBS輕輕洗滌1次后換上新鮮培養基,同時按實驗分組進行處理24 h。處理結束后去上層培養液,PBS輕輕洗滌1次,4%多聚甲醛室溫固定10 min,PBS洗3次,0.5% Triton X-100透化10 min,PBS洗3次。DAPI染色5 min顯示細胞核,避光PBS洗3次后防熒光淬滅劑封片,置于熒光顯微鏡下觀察,取同樣大小方形視野計數并照像。
4.4 Western blotting檢測 實驗處理結束后用預冷的PBS洗3遍,加入含蛋白酶抑制劑的細胞裂解液在冰上裂解10 min,收獲細胞總蛋白并定量。變性10 min后,取30~50 μg蛋白上樣到10.5%分離膠進行電泳分離,然后以220 mA恒流濕轉到PVDF膜上,5%脫脂奶粉室溫封閉1 h,與待測目的蛋白的特異性抗體4 ℃孵育過夜,用相應Ⅱ抗室溫孵育1 h后,使用ECL化學發光劑進行曝光。GAPDH作為內參照,圖像分析系統掃描并定量分析膠片條帶的灰度值,以目的條帶與相應GAPDH的灰度值之比表示相關含量。每組實驗重復3次。
5 統計學處理
數據以均數±標準差(mean±SD)表示,用統計軟件SPSS 13.0進行統計學分析,組間比較用單因素方差分析(One-way ANOVA),采用LSD檢驗進行兩組間比較。以P<0.05為差異有統計學意義。
結 果
1 各刺激物及干預劑對足細胞細胞活性及細胞骨架的影響
如圖1A所示,co-BSA、AGE-BSA及雷帕霉素干預24 h后MTT實驗結果顯示足細胞的存活率分別為(108.67±18.58)%、(107.50±14.86)%和(98.67±10.26)%,與對照組相比均沒有顯著差異(P>0.05)。相同干預下,足細胞骨架同樣未見明顯改變,見圖1B。由此可見,本實驗設計可有效避免刺激物濃度過高產生的細胞毒性對實驗結果的影響。
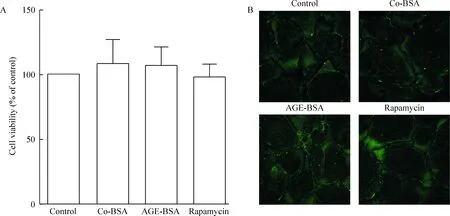
Figure 1.The effects of various stimuli and intervention agents on cell viability and cytoskeleton. A: the viability of podocytes treated with co-BSA (100 mg/L), AGE-BSA (100 mg/L) or rapamycin (10 nmol/L) for 24 h compared with control; B: representative confocal images of the cytoskeleton of the podocytes with different treatments (×400). Synaptopodin (green) was used to mark the cytoskeleton of the podocytes. Mean±SD.n=3.
圖1 各刺激物及干預劑對足細胞活力及骨架的影響
2 AGE-BSA促進足細胞移動
與control和co-BSA組比較,AGE-BSA組能明顯增強足細胞的移動度,見圖2。
3 AGE-BSA上調細胞移動性關鍵調控分子uPAR
uPAR在介導足細胞移動性增強及足細胞損傷中有著重要作用[7]。本實驗發現,與control和co-BSA組相比,AGE-BSA組的uPAR蛋白表達水平明顯升高,見圖3。
4 AGE-BSA上調足細胞mTORC1的活性
mTORC1促進下游靶分子P70S6K的磷酸化,檢測P70S6K的磷酸化形式即p-P70S6K的水平可反映mTORC1活性。與control和co-BSA組相比,AGE-BSA組 p-P70S6K明顯升高,表明AGE-BSA 可上調足細胞mTORC1活性水平,見圖4。
5 AGE-BSA促進足細胞移動依賴mTORC1
雷帕霉素能降低AGE-BSA組足細胞的移動度和uPAR水平,見圖5、6。
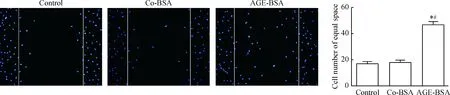
Figure 2.The effects of AGE-BSA on the motility of podocytes (DAPI staining,×100). Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA.
圖2 AGE-BSA對足細胞運動的影響
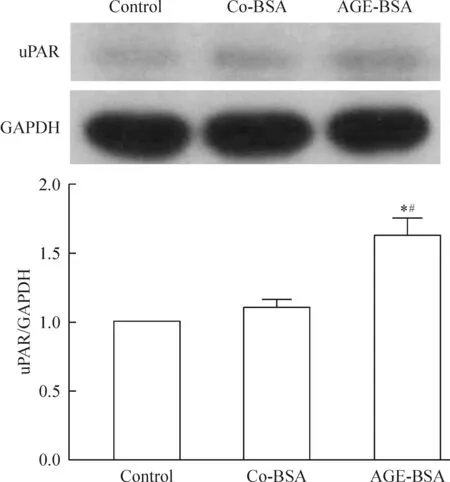
Figure 3.The effects of AGE-BSA on the expression level of uPAR. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA.
圖3 AGE-BSA對uPAR表達水平的影響
討 論
蛋白尿是糖尿病腎病的一個獨立的危險因素,蛋白尿水平和持續時間是糖尿病腎病進展程度的一個重要臨床指標。緩解蛋白尿水平的進展是腎病科臨床醫師治療糖尿病腎病的重要策略。然而,目前仍缺乏針對糖尿病腎病的理想降蛋白尿藥物,且糖尿病腎病相關蛋白尿的發病機制也不明確。因此,深入研究糖尿病腎病的致病機制并尋找到相關特異靶點是當前的極為緊迫的任務。大量研究提示足細胞損傷在介導糖尿病腎病蛋白尿中有著重要意義[2]。
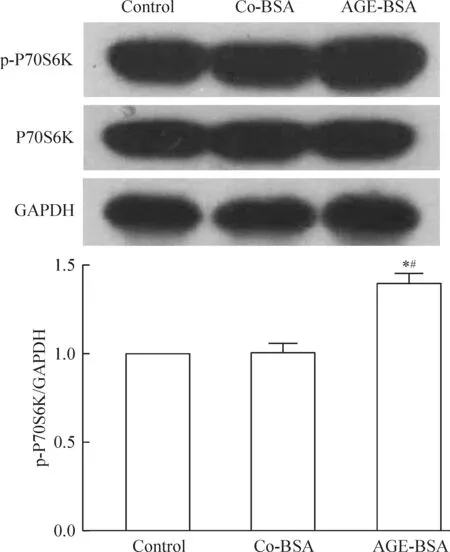
Figure 4.The effects of AGE-BSA on the activity of mTORC1. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA.
圖4 AGE-BSA對mTORC1下游分子P70S6K磷酸化的影響
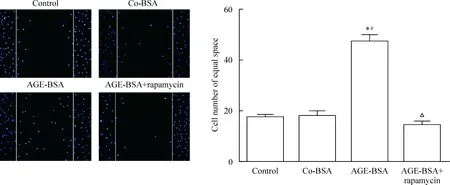
Figure 5.Rapamycin inhibited the increase in podoctye migration induced by AGE-BSA treatment (DAPI staining,×100). Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA;△P<0.05vsAGE-BSA.
圖5 雷帕霉素抑制AGE-BSA導致的足細胞移動性增強
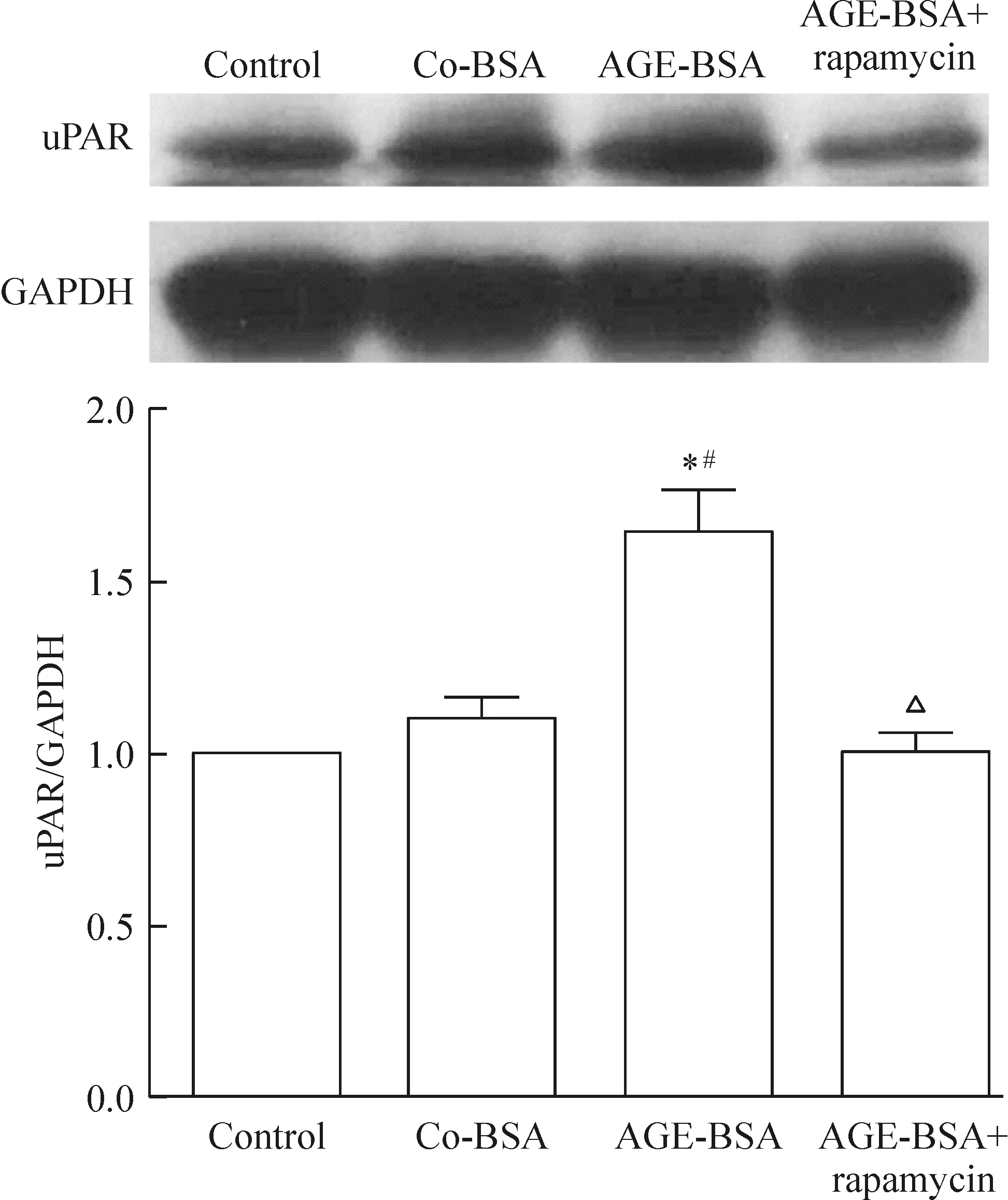
Figure 6.Rapamycin down-regulated the expression level of uPAR in the podocytes treated with AGE-BSA. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsco-BSA;△P<0.05vsAGE-BSA.
圖6 雷帕霉素下調AGE-BSA導致的足細胞uPAR表達水平增強
足細胞是特異分化的終末期細胞,位于腎小球基底膜外側。正常足細胞具有一定程度的活動性以適應毛細血管袢跨壁壓不同程度的變化。然而,足細胞活動性的增強卻是足細胞的一個重要損傷因素,在體內會引起足細胞足突的融合甚至足細胞丟失導致蛋白尿,在體外表現為足細胞移動性的增強同足突融合有著相似的機理[13]。抑制損傷足細胞的活動度是公認的保護足細胞抑制蛋白尿的關鍵之一。
足細胞是通過整合素錨定在基底膜上,生理情況下足細胞表達高黏附性的β1整合素,以維持低水平的活動性以適應毛細血管袢跨壁壓變化。在病理條件下低黏附性的β3整合素活化,足細胞的活動性增強,可引起腎小球通透性增加,導致蛋白尿,甚至引起足細胞丟失[13-14]。uPAR為一種糖基化磷脂酰肌醇錨定蛋白,能與整合素形成復合物并調控整合素,參與炎癥、腫瘤侵襲和轉移[15]。足細胞uPAR過度上調可活化β3整合素,導致細胞移動度增加,從而介導蛋白尿發生[7, 16]。我們最近在db/db糖尿病腎病小鼠中發現uPAR上調可能參與了糖尿病腎病的發生[17]。既往多數研究采用高水平葡萄糖作為研究處理因素。目前認為AGEs是糖尿病腎病的重要致病因子。本實驗首次觀察到AGE-BSA能上調uPAR并引起足細胞活動性增加,提示該途徑可能是導致糖尿病條件下引起腎臟損傷的一個重要途徑。
mTORC1是mTOR兩種復合物中的一種,其活性可被雷帕霉素特異性抑制,主要參與細胞的生長和增殖,最新研究顯示mTORC1可通過mTORC1-S6K1/4E-BP1信號通路調控RhoA、cdc42和Rac1等細胞骨架相關分子的表達及活性而參與調控細胞的移動性[11-12]。足細胞mTORC1在人和小鼠糖尿病腎病中發揮重要作用[8]。本研究中我們觀察到AGE-BSA能促進足細胞mTORC1活化,提示糖尿病可能通過提高AGEs水平引起足細胞mTORC1活化而進一步引起腎損害。為更加深入地研究AGE-BSA介導足細胞移動性的增強與mTORC1及uPAR間的關系,本實驗采用mTORC1的特異性抑制劑雷帕霉素來探討mTORC1與足細胞移動性及uPAR的聯系。我們在AGE-BSA干預的基礎上給予雷帕霉素,結果顯示用雷帕霉素抑制mTORC1后,經AGE-BSA刺激的足細胞的uPAR表達水平和細胞活動性都恢復到對照水平,表明AGE-BSA促進足細胞移動依賴mTORC1/uPAR途徑。
本文結果提示AGE-BSA能通過mTORC1/uPAR途徑促進足細胞移動,這可能是AGEs參與糖尿病腎病的一個潛在致病機制。這些初步結果值得進一步在動物實驗中驗證。
[1] Liu ZH. Nephrology in China[J]. Nat Rev Nephrol, 2013, 9(9):523-528.
[2] Rask-Madsen C, King GL. Diabetes: Podocytes lose their footing[J]. Nature, 2010, 468(7320):42-44.
[3] Reidy K, Kang HM, Hostetter T, et al. Molecular mechanisms of diabetic kidney disease[J]. J Clin Invest, 2014, 124(6):2333-2340.
[4] Wendt T, Tanji N, Guo J, et al. Glucose, glycation, and RAGE: implications for amplification of cellular dysfunction in diabetic nephropathy[J]. J Am Soc Nephrol, 2003, 14(5):1383-1395.
[5] 胡鵬飛,賴東武,何 紅. 自噬在晚期糖基化終產物誘導的內皮細胞凋亡中的作用[J]. 中國病理生理雜志, 2012, 28(6):1006-1011.
[6] Zhou LL, Cao W, Xie C, et al. The receptor of advanced glycation end products plays a central role in advanced oxidation protein products-induced podocyte apoptosis[J]. Kidney Int, 2012, 82(7):759-770.
[7] Wei C, Moller CC, Altintas MM, et al. Modification of kidney barrier function by the urokinase receptor[J]. Nat Med, 2008, 14(1):55-63.
[8] Godel M, Hartleben B, Herbach N, et al. Role of mTOR in podocyte function and diabetic nephropathy in humans and mice[J]. J Clin Invest, 2011, 121(6):2197-2209.
[9] Inoki K, Mori H, Wang J, et al. mTORC1 activation in podocytes is a critical step in the development of diabetic nephropathy in mice[J]. J Clin Invest, 2011, 121(6):2181-2196.
[10]Wullschleger S, Loewith R, Hall MN. TOR signaling in growth and metabolism[J]. Cell, 2006, 124(3):471-484.
[11]Liu L, Luo Y, Chen L, et al. Rapamycin inhibits cytoskeleton reorganization and cell motility by suppressing RhoA expression and activity[J]. J Biol Chem, 2010, 285(49):38362-38373.
[12]Liu L, Li F, Cardelli JA, et al. Rapamycin inhibits cell motility by suppression of mTOR-mediated S6K1 and 4E-BP1 pathways[J]. Oncogene, 2006, 25(53):7029-7040.
[13]Reiser J, Oh J, Shirato I, et al. Podocyte migration du-ring nephrotic syndrome requires a coordinated interplay between cathepsin L and α3integrin[J]. J Biol Chem, 2004, 279(33):34827-34832.
[14]Zhang B, Xie S, Shi W, et al. Amiloride off-target effect inhibits podocyte urokinase receptor expression and reduces proteinuria[J]. Nephrol Dial Transplant, 2012, 27(5):1746-1755.
[15]Blasi F, Carmeliet P. uPAR: a versatile signalling orchestrator[J]. Nat Rev Mol Cell Biol, 2002, 3(12):932-943.
[16]Zhang B, Shi W, Ma J, et al. The calcineurin-NFAT pathway allows for urokinase receptor-mediated beta3 integrin signaling to cause podocyte injury[J]. J Mol Med (Berl), 2012, 90(12):1407-1420.
[17]Zhang L, Li R, Shi W, et al. NFAT2 inhibitor ameliorates diabetic nephropathy and podocyte injury indb/dbmice[J]. Br J Pharmacol, 2013, 170(2):426-439.
Advanced glycosylation end products promote migration of podocytes through mTORC1/uPAR pathway
TAN Xiao-fan1, 2, CHEN Yuan-han2, YU Chun-ping2, LAI Yu-xiong2, ZHANG Li2, ZHAO Xing-chen1, 2, ZHANG Hong2, LIN Ting2, LI Rui-zhao2, SHI Wei2
(1GraduateSchool,SouthernMedicalUniversity,Guangzhou510515,China;2DepartmentofNephrology,GuangdongGeneralHospital,GuangdongAcademyofMedicalSciences,Guangzhou510080,China.E-mail:weishi_gz@126.com)
AIM: To investigate the influence of advanced glycosylation end products-modified bovine serum albumin (AGE-BSA) on mammalian target of rapamycin complex 1 (mTORC1), urokinase-type plasminogen activator receptor (uPAR), and cell mobility in the podocytes, and to further explore the probable relationship. METHODS: The conditionally immortalized mouse podocyte cell line was culturedinvitro. MTT assay and immunofluorescence were used to analyze the cell viability and cytoskeleton of the podocytes treated with the stimuli and intervention agents. The activity of mTORC1 and the expression level of uPAR in normal podocytes and podocytes treated with control BSA or AGE-BSA were detected by Western blotting. The migration ability of the podocytes was determined by would-healing assay. Rapamycin was added to inhibit the activity of mTORC1 along with the addition of AGE-BSA to observe the changes of uPAR and the motility of podocytes. RESULTS: No significant difference of the cell viability or cytoskeleton in the podocytes treated with the stimuli and intervention agents was observed. AGE-BSA up-regulated the activity of mTORC1 and the expression of uPAR, and induced the high mobility of the podocytes. Rapamycin obviously reduced the high expression level of uPAR and the increase in the migration ability of podocytes caused by AGE-BSA treatment. CONCLUSION: AGE-BSA might cause the high migration of podocytes through the mTORC1/uPAR signaling pathway.
Podocytes; Cell mobility; Advanced glycosylation end products; Mammalian target of rapamycin complex 1; Receptors, urokinase-type plasminogen activator
1000- 4718(2014)12- 2232- 06
2014- 07- 09
2014- 10- 13
國家自然科學基金資助項目(No. 81270784);國家臨床重點專科建設項目
R363
A
10.3969/j.issn.1000- 4718.2014.12.020
△通訊作者 Tel: 020-83850849; E-mail: weishi_gz@126.com

