不同食用菌品種產漆酶規律的研究*
孫淑靜,郭艷艷,吳曉華,單書凱,李念靜,翁彩紅,張燎原,胡開輝
(福建農林大學生命科學學院,福建 福州 350002)
不同食用菌品種產漆酶規律的研究*
孫淑靜,郭艷艷,吳曉華,單書凱,李念靜,翁彩紅,張燎原,胡開輝**
(福建農林大學生命科學學院,福建 福州 350002)
本研究對6種食用菌在液體和栽培料培養時產漆酶能力和產酶規律進行了比較分析。實驗結果表明,在液體培養條件下,鳳尾菇、秀珍菇和雞腿菇均在第6天左右達到酶活性峰值,金針菇酶活性持續增加,在第10天達到峰值。在栽培料培養條件下,鳳尾菇、秀珍菇和雞腿菇均在大試管中長至一半時達到酶活性峰值,金針菇酶活性持續增加,在原基形成時達到峰值。在2種培養條件下,生長速度較快的鳳尾菇、秀珍菇、金針菇fl98、雞腿菇漆酶活性均較高,而生長速度慢的白玉HM03和滑菇漆酶活性較低,漆酶產生規律相同,產漆酶能力較強的菌種菌絲生長較快,產酶高峰多出現較早,而產漆酶能力較弱的菌種菌絲生長較慢。以上結果說明食用菌中漆酶在菌絲生長速度上起著重要的作用,可為以后食用菌提高其生長速度、定向育種提供重要的參考。
食用菌;生長速度;漆酶
漆酶(Laccase)是1種含銅的多酚氧化酶,屬藍色多銅氧化酶家族[1],能夠催化酚類、羧酸、生物色素、芳胺類、甾體類激素、金屬有機化合物等物質生成醌類化合物、羰基化合物和水[2]。近幾年的研究表明,漆酶在紙漿的生物漂白[3,4]、新型傳感器的研制和生物檢測[5,6]、環境污染物的降解[7,8]、生物燃料電池的陰極反應[9]、食品飲料中酚類物質的去除[10]等領域具有潛在的應用價值。研究還發現很多食用菌菌體中富含漆酶, 它有利于呼吸過程中電子傳遞的正常運行,呼吸過程正常運轉,為菌體的生命活動提供充足的可利用的能量,從而加速菌體的生長發育[11]。此外,在菌絲體生長發育過程中,漆酶在分解木質素的同時還會產生酚類或醌類化合物,而酚類或醌類物質是有毒物質,是1種很好的殺蟲劑,能夠抑制雜菌的生長,從而防止雜菌進一步污染,并影響菇類菌體的生長發育[12]。由此可見,漆酶參與真菌體內的許多生物化學反應,具有重要的生理功能[13],影響著真菌的發育及形態的發生[14]。但食用菌在不同條件下菌絲產漆酶規律的相關性研究甚少。針對目前有些珍貴食用菌生產周期長、生產成本高的實際情況,如何縮短食用菌生產周期及提高抗雜菌能力、降低成本,成為目前食用菌育種亟待解決的關鍵問題之一。本實驗通過測定不同條件下不同食用菌菌絲生長速度、漆酶酶活及產酶規律,分析其相關性,從而為食用菌根據漆酶定向選育高產性能的新品種提供理論依據。
1 材料與方法
1.1 材料
1.1.1 供試菌株
鳳尾菇(Pleurotussajor-caju)、金針菇fl98(Flammulinavelutipes)、秀珍菇(Pleurotusgeesteranus)、雞腿菇(Coprinuscomatus)、滑菇(Pholiotanamek)、白玉HM03(Hypsizigusmarmoreus),均為實驗室保藏菌種。
1.1.2 供試培養基
PDA綜合培養基:馬鈴薯200 g、葡萄糖20 g、蛋白胨10 g、KH2PO43 g、MgSO41.5 g、VB10.01 g、瓊脂20 g,加水至 1 000 mL,pH自然;液體加富培養基:馬鈴薯200 g、葡萄糖20 g、酵母粉3 g、蛋白胨3 g、KH2PO41 g、MgSO40.5 g、VB10.1 g,加水至 1 000 mL,pH自然;生產培養基:棉籽殼71%、麥麩23%、石灰1%、玉米粉5%,含水量60%~65%。
1.2 方法
1.2.1 菌株生長速度測定試驗
將鳳尾菇、金針菇fl98、秀珍菇、雞腿菇、滑菇、白玉HM03六種菌株分別接種于PDA培養基,每個菌株做3個重復,24℃恒溫培養箱中培養10 d,每隔1 d測其菌絲生長直徑。
根據生產培養基配方,將栽培料裝入21 mm×180 mm試管中,每個菌種裝料10管,121℃高壓滅菌2 h,冷卻后以5%的比例接入原種,一定時間后測其菌絲生長速度。
1.2.2 粗酶液的提取
(1)液體加富培養基中酶液的提取
將待測菌株接入含有50 mL液體加富培養基的三角瓶中,每瓶6片(直徑2 cm),每個菌株做3個重復,110 r·min-1,24℃恒溫振蕩培養10 d,每隔1 d提取1次發酵液,經紗布過濾,離心后取其上清液,即為粗酶液,4℃冰箱保存備用[15-17]。
(2) 生產培養基中酶液的提取
分4個階段取樣:菌絲生長過程(平均取5次)、菌絲滿袋、原基形成、幼菇形成。每1次取樣分別取若干栽培料打碎、混勻,四分法取3 g加30 mL蒸餾水,24℃浸提4 h,過濾后離心,取其上清液即為粗酶液,4℃冰箱保存備用[18]。
1.2.3 漆酶酶活性測定
以ABTS為底物,3 mL反應體系中含有醋酸-醋酸鈉緩沖液(pH 5.0)2.7 mL、粗酶液0.1 mL和1 mmol·L-1的ABTS 0.2 mL,25℃水浴5 min,測其在420 nm處反應開始前3 min內吸光值的增加。將粗酶液在沸水中煮沸15 min作為對照。定義每分鐘使吸光值增加0.1所需的酶量為1個酶活力單位(U)[19,20]。
2 結果與分析
2.1 不同菌株生長速度測定
不同菌株菌絲生長速度情況見表1和圖1。
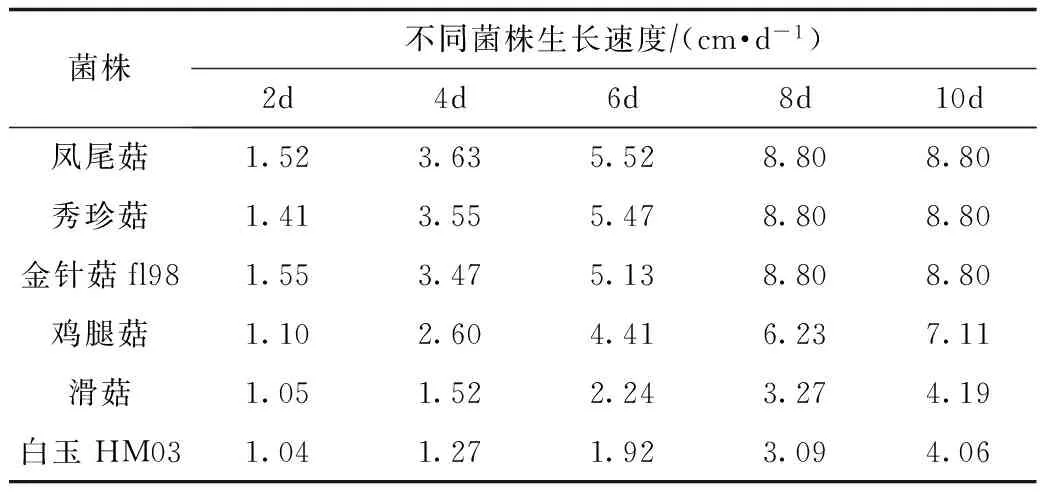
表1 不同菌株在PDA平板上的生長速度比較
由表1可知,不同菌株在PDA平板上生長速度差異較大。鳳尾菇、秀珍菇、金針菇fl98生長速度較快,8 d長滿平皿(平皿直徑8.8 cm);而雞腿菇生長速度較慢,13 d長滿平皿;滑菇和白玉HM03生長速度最慢,長滿平板需20 d左右。

由圖1可見,在栽培料中鳳尾菇、秀珍菇生長速度最快,金針菇fl98次之,雞腿菇較慢,滑菇和白玉HM03最慢,與PDA平板上的結果基本一致。
2.2 不同菌株在液體培養基中漆酶變化規律
不同菌株在液體培養基中漆酶酶活變化見圖2。
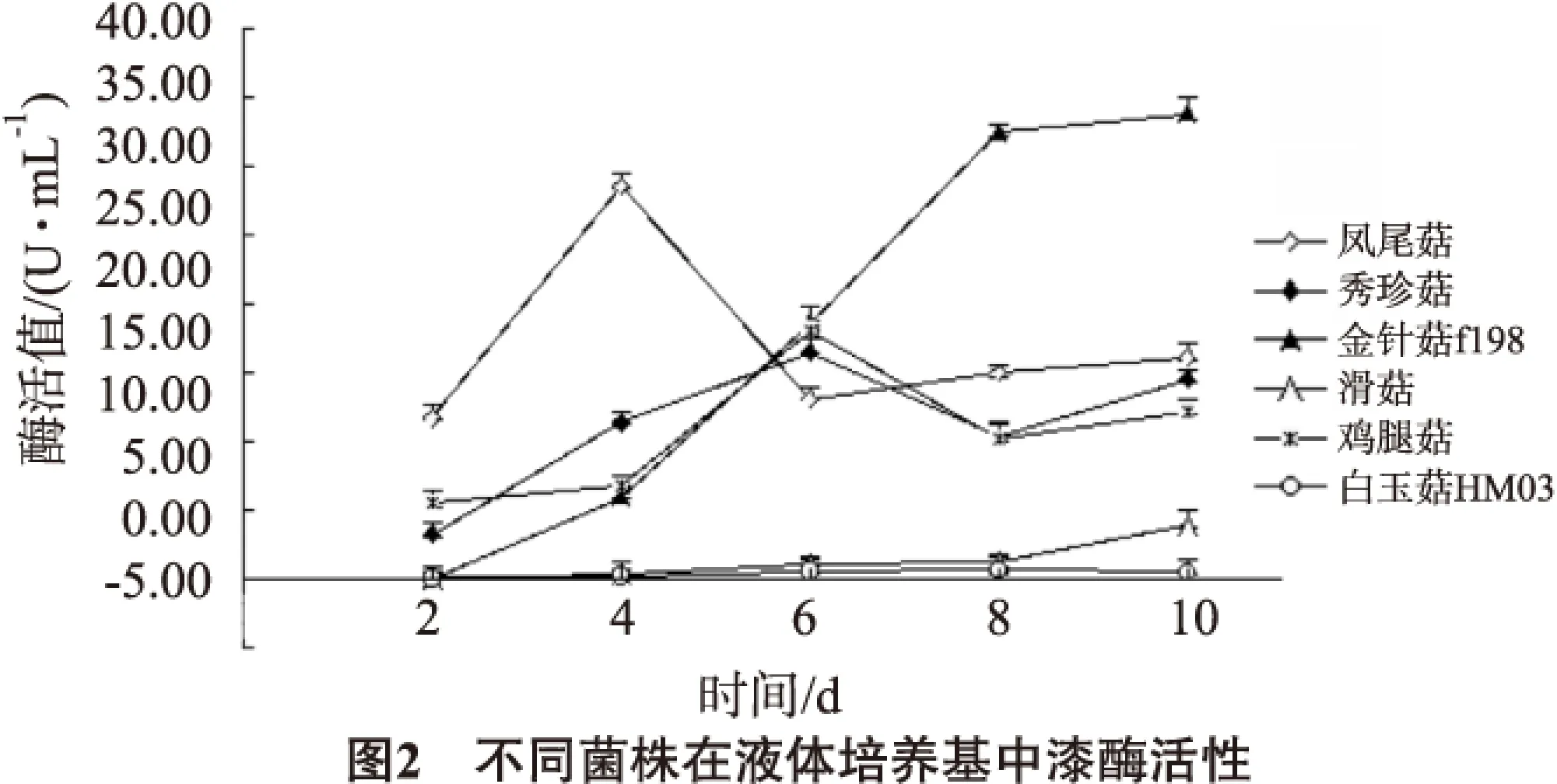
由圖2可知,鳳尾菇在生長過程中酶活性一直很高,在第4天達到酶活性的峰值;秀珍菇和雞腿菇酶活性也較高,在第6天達到峰值。鳳尾菇、秀珍菇和雞腿菇的產酶規律都是生長前期酶活性較低,隨著培養時間增加,酶活性逐漸達到峰值,接著降低,在生長后期又略有增加。滑菇、白玉HM03前期酶活較低,后期略有增加。金針菇fl98漆酶活性持續增加,在生長后期達到酶活性的峰值。相關文獻表明,漆酶參與菌體的呼吸作用,為菌體的生命活動提供更多的可利用的能量,從而加速菇類的生長發育過程[11]。本試驗選取6種不同生長速度的菌種對其進行液體培養,在生長過程中測其漆酶活性,以探討漆酶活性與菌絲生長速度的關系。
2.3 不同菌株在栽培料中漆酶變化規律
不同菌株在栽培料中漆酶酶活變化見圖3。
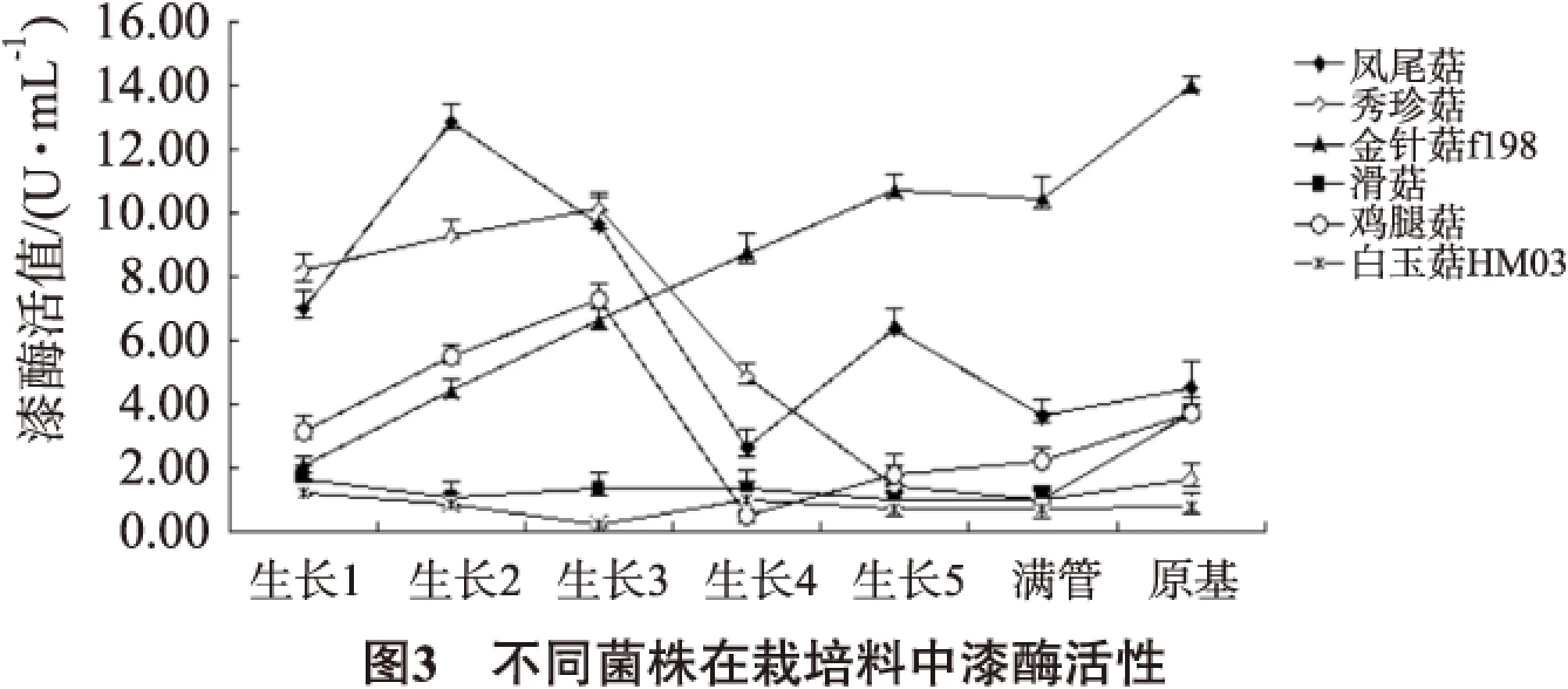
金針菇生長過程中酶活性持續增加,在原基形成時達到峰值,且酶活性高于鳳尾菇;鳳尾菇漆酶活性很高,且在其生長前期酶活性達到峰值,之后持續降低,在生長后期略有增高;秀珍菇酶活性也較高,在菌絲生長至半管時達到酶活性峰值,之后一直下降,后期亦略有增加;雞腿菇酶活性略低于鳳尾菇和秀珍菇,在菌絲生長至半管時也達到酶活性峰值,在形成原基時酶活性也較高;滑菇酶活性相對較低,生長前期酶活性也較低,在原基形成時酶活性最高;白玉HM03生長過程中酶活性一直較低。
3 小結與討論
在液體培養基中,金針菇的漆酶酶活性持續增加,在第10天達到峰值;栽培料中,金針菇在菌絲生長階段,漆酶活性也較高,這一規律與相關報道結論一致[21,22]。栽培料中,鳳尾菇、秀珍菇、雞腿菇的漆酶活性均隨栽培時間的延長由高逐漸降低,這與金頂側耳(Pleurotuscitrinopileatus)[23]、巴西蘑菇(Agaricusblazei)[24]等食用菌的情況相似;液體培養時,鳳尾菇、秀珍菇的漆酶活性較高,雞腿菇的漆酶活性也相對較高,這與其生長速度的測定結果相一致。結合不同菌種的生長速度和酶活性的測定結果,可以得到,生長速度較快的金針菇 fl98、鳳尾菇和秀珍菇,其漆酶酶活性亦較高;生長速度中等的雞腿菇,其酶活性相對較高;而生長速度比較慢的滑菇、白玉 HM03,幾乎沒有酶活性。以上結果說明食用菌中漆酶在菌絲生長速度方面起著重要的作用,可為以后食用菌提高其生長速度、定向育種提供重要的參考。
[1]鈔亞鵬,錢世鈞. 真菌漆酶及其應用[J].生物工程進展,2001,21(5):23-27.
[2]吳晴. 白腐真菌及其漆酶的應用研究[J].安徽科技, 2010(3):47-48.
[3]Nurdan KP, Merih S, Azmi T.Laccase production by trametes versicolor and application to denim washing[J].Process Biochemistry, 2005, 40(5): 1673-1678.
[4]Sigoillot C, Record E, Belle V, et al.Natural and recombinant fungal laccases for paper pulp bleaching[J].Appl Microbiol Biotechnol, 2004, 64(3): 346-352.
[5]Gomes SASS, Nogueira JMF, Rebelo MJF. An amperometric biosensor for polyphenolic compounds in red wine[J].Biosensors and Bioelectronics, 2004, 20(6): 1211-1216.
[6]Fabio V, Antonio C, Santa R, et al. A high sensitivity amperometric biosensor using a monomolecular layer of laccase as biorecognition element[J]. Biosensors and Bioelectronics, 2004, 20(2): 315-321.
[7]Atef J, Francisco G, Michel JP, et al. Role ofPycnoporuscoccineuslaccase in the degradation of aromatic compounds in olive oil mill wastewater[J]. Enzyme and Microbial Technology, 2005, 36(4): 478-486.
[8]Rigas F, Dritsa V, Marchant R, et al. Biodegradation of lindane byPleurotusostreatusvia central composite design[J]. Environment International, 2005, 31(2): 191-196.
[9]Katz E, Filanovsky B, Willner I. A biofuel cell based on two immiscible solvents and glucose oxidase and microper oxidase monolayer functionlized electrodes[J]. New J Chem, 1999(23): 481-487.
[10]Servili M, De Stefano G, Piacquadio P, et al. A novel method for removing phenols from grape must[J]. Am J Enol Viticulture, 2000(51): 357-361.
[11]Turner EM, Wright M, Ward T, et al. Production of ethylene and other volatiles and changes in cellulase and laccase activities during the life cycle of the cultivated mushroom,Agaricusbisporus[J]. Gen Microbiol, 1975, 91(1): 167-176.
[12]Bollag JM, Shuttleworth KL, Anderson DH. Laccase-mediated detoxification of phenolic compounds[J]. Appl Environ Microbiol, 1988, 54(12): 3086-3091.
[13]Bourbonnais R, Paice MG. Oxidation of nonphenolic substrates: An expanded role for laccase in lignin biodegradation[J]. Febs Letters, 1990, 267(1): 99-102.
[14]Leatham G, Slahanman M A. Studies on the laccase ofLentinusedodes: specificity, localization and association with the development of fruiting bodies[J]. Gen Microbiol, 1981, 125(1): 147-157.
[15]蘭瑞芳,林少琴,林玉滿,等. 杏鮑菇漆酶的生物學特性[J]. 食用菌學報,2002,9(2):14-16.
[16]俞苓,劉民勝,陳有容. 杏鮑菇液體培養中胞外酶活性變化[J]. 食用菌,2003(1):7-9.
[17]王宜磊, 畢紅衛. 多孔菌漆酶性質研究[J]. 淄博學院學報:自然科學與工程版,2002,4(4): 12-14.
[18]劉朝貴, 邵坤, 聶和平,等. 不同培養料對雞腿菇胞外酶活性影響的研究[J]. 西南師范大學學報:自然科學版,2008,33(1):40-42.
[19]朱海瀟,黃桂英,胡開輝,等. 鳳尾菇漆酶性質及應用的研究[J]. 福建農業報,2008,23(1):48-52.
[20]堵國成, 趙政, 陳堅. 真菌漆酶的活性測定及其在織物染料生物脫色中的應用[J]. 江南大學學報, 2003,2(1): 83-90.
[21]劉蘋, 唐志紅, 李夢玉, 等. 金針菇漆酶活性測定的最佳反應條件及液體培養胞外酶的研究[J]. 食品科技, 2012, 37(6):35-36.
[22]馮偉林, 蔡為明, 金群力,等. 金針菇生長發育期間相關胞外酶的活性變化研究[J]. 浙江農業學報, 2012, 24(3): 430-433.
[23]李娟, 倪新江, 樊守金, 等. 金頂側耳不同生長期幾種胞外酶活性變化[J]. 吉林農業大學學報, 2006,28(6):24-26.
[24]楊立紅,倪新江,黃清榮. 栽培基質對巴西蘑菇胞外酶活性的影響[J]. 吉林農業大學學報,2004,26(3):284-286.
Study on the Production Rules of Laccase of Different Edible Fungi
SUN Shu-jing, GUO Yan-yan, WU Xiao-hua, SHAN Shu-kai,LI Nian-jing, WENG Cai-hong, ZHANG Liao-yuan, HU Kai-hui
(College of Life Sciences, Fujian Agriculture and Forestry University, FuzhouFujian350002)
The capacities and production rules of laccase by six different types of edible fungi were analyzed and compared in two media. The results showed the laccase activities ofPleurotussajor-caju,PleurotusgeesteranusandCoprinuscomatusreached peak at 6th day in liquid medium. The laccase activity ofFlammulinavelutipesincreased continuously and reached the peak at 10th day. The laccase activities ofPleurotussajor-caju,PleurotusgeesteranusandCoprinuscomatusreached the peak when the mycelia grew up the half part of big test tube in cultivation material. The laccase activity ofFlammulinavelutipesincreased continuously and reached the peak at the period of anlage formed. Under two culture conditions,Pleurotussajorcaju,Pleurotusgeesteranus,FlammulinavelutipesandCoprinuscomatushad high laccase activities with short growth cycle, whileHypsizigusmarmoreusandPholiotanamekhad little laccase activity with long growth cycle. The production rules of laccase were same under two culture conditions, the strains with high production capacity of laccase grew fast and produced laccase at early stage of growth cycle, and the strains with weak production capacity of laccase grew slowly. The fruiting test results indicated that the laccase played an important role in mycelial growth of the edible fungi, and it can provide important reference for growth rate and directional breeding.
Edible fungi; Growth rate; Laccase
*項目來源:福建省發改委農業五新工程項目“珍稀食用菌真姬菇新品種閩真1號工廠化栽培技術熟化與中試研究”,項目編號:閩發改委投資[2012]931號;福建省教育廳項目“雙重靶向性篩選食用菌新品種體系的建立”,項目編號:JA11079;福建省發改委生物產業技術專項“福建省生物產業技術專項:真姬菇品種改良與農業可再生資源適應性研究及示范”,項目編號:2011878;福建省高校產學合作科技重大項目“真姬菇(閩真2號)菌包成熟度多尺度生化參數指標”,項目編號:2013N5101。
孫淑靜(1978-),女,副教授,主要從事食用真菌學研究。E-mail:shjsun2004@126.com
**通信作者: 胡開輝,男,教授。E-mail:hukh62@sohu.com
2014-03-25
S646.9
A
1003-8310(2014)03-0038-03

