合浦珠母貝貝殼珍珠層EDTA可溶性基質蛋白對無定形碳酸鈣穩定性的影響
林慧娟,方 東,向 量,謝莉萍,王洪鐘,張貴友,麻彩萍,張榮慶
(清華大學 生命科學學院,北京 100084)
生物礦化是指生物體通過生物有機物質調控無機礦物,在其體內特定部位有序沉積的過程[1]。常見的生物礦物,如牙齒、骨骼、貝殼等可以強化組織、支撐結構與保護生物體;此外,趨磁細菌體內的磁小體還具有磁力感應和導航的功能[1-2]。生物體通過生物有機質調控生物礦化過程,使生物礦物具有與其多種功能相適應的晶型與晶貌。
作為典型的碳酸鈣生物礦物,珍珠具有機械性能優良、結構精細、形成環境溫和、生物相容性好等天然礦物和人工合成礦物所不具備的優勢。因此,其形成機理一直被生物學家、材料學家等所關注。由于珍珠和貝殼珍珠層均由文石組成,且其晶貌、物質組成相近,對貝殼文石層形成機理的研究是珍珠形成機理研究的重要組成部分。天然碳酸鈣礦物相比,貝殼最大的特點是其中含有5%左右的有機大分子[1-2]。因此,對其生物礦化分子機理的研究主要集中在這些有機基質(organic matrix),尤其是基質蛋白(matrix protein)對晶體生長的調控作用上。研究表明,基質蛋白參與了貝殼有機框架形成[3]、誘導碳酸鈣結晶并控制晶體形狀[4]與類型[5]、調控貝殼礦化過程[6-7]等幾乎整個貝殼形成過程。貝殼一般由棱柱層和珍珠層組成,通常認為,棱柱層來源的生物大分子促進方解石的形成而珍珠層來源的生物大分子與文石的形成密切相關[6-11]。因此,貝殼珍珠層來源生物大分子對珍珠的形成具有重要的意義。無定形碳酸鈣(amorphous calcium carbonate,ACC)是碳酸鈣晶體中溶解度最高、最不穩定的結晶形式。早在20世紀初,人們就在生物體內發現了 ACC[12],但是其分布的有限性和不穩定性阻礙了人們對其的研究。研究表明,ACC可以被視為由 Ca2+和形成穩定碳酸鈣晶體過程中的中間形[13],生物體通過精密調控ACC的穩定性來控制其晶型轉化過程以及礦化產物的晶型與晶貌。2007年Ma 等[19]在合浦珠母貝間液中發現ACC結合蛋白以來,對ACC晶型轉化及其分子調控機制的研究成為了生物礦化領域的研究熱點。常溫常壓下,ACC在體外水溶液中很快發生晶型轉化形成穩定晶型。轉化過程的迅速性是造成研究ACC晶型轉化過程具有難度的主要原因。因此,對ACC晶型轉化過程中穩定性及其機理的研究,不僅有助于闡明生物體如何調控 ACC的穩定性,也有助于對ACC的晶型轉化進行體外研究。生物體內還存在一些穩定的ACC。對其研究表明,其大多含有Mg2+[20]。體外研究表明,人工合成的ACC可以分別被間液[21]和Mg2+[19]穩定。
雖然珍珠層基質蛋白對于生物礦化具有重要作用,但目前的研究集中在其在無機離子形成穩定晶體過程中的整體作用[6,22-25],對于其在 ACC晶型轉化階段中的作用涉及較少。但鑒于ACC的穩定及晶型轉化在生物礦化中的重要性,不難推測,基質蛋白對ACC的穩定及晶型轉化具有重要作用,且這種作用很有可能伴隨著ACC中Mg2+含量的變化。因此,本研究通過研究合浦珠母貝貝殼珍珠層 EDTA可溶性基質蛋白(ESM),對 ACC晶型轉化過程中是否具有穩定ACC的作用,及在此過程中晶體鎂鈣比的變化,初步探討了貝殼珍珠層基質蛋白對ACC穩定及晶型轉化的作用及其可能的機制,為闡明生物礦化機制及體外合成珍珠提供參考。
1 材料與方法
1.1 材料
1.1.1 實驗材料
合浦珠母貝采自廣西北海市珍珠總公司珍珠養殖場。
1.1.2 試劑
CaCl2·2H2O購于 Sigma公司;其余化學試劑均為國產分析純。
1.2 方法
1.2.1 ACC的制備
以去離子水為溶劑分別制備A溶液(20 mmol/L碳酸鈉,0.2 mol/L氫氧化鈉)和B溶液(20 mmol/L氯化鈣),并于4℃冷卻6 h以上。將等體積A溶液與B溶液于 4℃混合,并迅速混勻后進行抽濾以除去水分,將反應所得沉淀用丙酮沖洗3次,無水乙醇沖洗3次后,真空晾干24 h。
1.2.2 合浦珠母貝貝殼珍珠層EDTA可溶性基質蛋白的提取
取新鮮珍珠貝殼,用2 mol/LNaOH處理3 d后將棱柱層用機械方法刮除。將珍珠層研磨至粉末狀,取10 g溶解于 50 mL 0.5 mol/L EDTA(pH8.0)中,于4℃用力攪拌4 d,離心。將蛋白溶液用2 μm濾膜過濾后于3 kD超濾管中3 900 g,4℃離心濃縮并將溶劑替換為Tris-Cl(pH8.0)。采用BCA法對蛋白濃度進行檢測。
1.2.3 ACC體外轉化
中的方法[26]并進行了細微調整。將ACC加入到二甘醇(Diethylene glycol,DEG)中(3.95 mg/mL)。將 1.6mLTris-Cl、MgCl2(1 mmol/L)以及20 μ g/mL貝殼珍珠層EDTA可溶性基質蛋白分別加入到 1.24 mLDEG中形成反應溶液。將0.76 mLACC-DEG混合溶液加入到反應溶液中,取不同轉化時間的 ACC離心并用乙醇多次分散去除DEG后進行FTIR檢測。為了觀察貝殼珍珠層EDTA可溶性基質蛋白在反應液中有 Mg2+存在時對 ACC轉化的影響,先將 1.36 mLMgCl2(1mmol/L)加入到0.94 mLDEG中,再加入0.76 mLACC-DEG混合溶液,1 h后加入貝殼珍珠層EDTA可溶性基質蛋白(20 μg/mL),同樣取不同轉化時間的ACC做FTIR檢測。上述溶液濃度均為反應體系中的終濃度,MgCl2及蛋白均溶解于Tris-Cl溶液(pH8.0)中。反應在室溫環境下進行。
1.2.4 傅立葉變換紅外色譜(FTIR)檢測
將1.2.3中的ACC樣品與KBr混合研磨均勻壓片,測定紅外光譜。FTIR紅外光譜儀系美國 Thermofisher公司的Nicolet 6700傅立葉紅外光譜儀,掃描波數為4 000~400 cm–1,掃描32次。
1.2.5 X射線衍射(XRD)光譜檢測
將1.2.1中的ACC樣品進行XRD檢測。測試參數: 步距 2(°/min),2θ角范圍 10°~120°。X 射線衍射儀系日本理學公司的D/max 2500立式X射線衍射儀,儀器參數: 40 kV,200 mA,Cu-Kα輻射。
1.2.6 掃描電鏡(SEM)及能譜(EDS)檢測
將 1.2.3干燥的 ACC樣品噴碳鍍膜后利用SEM-EDS聯用儀進行SEM及EDS檢測,掃描電鏡系美國 FEI公司的 QUANTA200F,儀器參數: 加速電壓15 kV。
2 結果與分析
2.1 體外制備ACC的性質鑒定

圖1 ACC的X射線衍射圖譜Fig.1 XRD pattern of ACC
對制備產物進行 XRD 檢測(圖 1)發現,圖譜中只有 20°~40°(2θ)和 40°~50°(2θ)之間分別檢測到一個寬闊的衍射峰,并沒有檢測到方解石、文石等結晶態碳酸鈣的任何特征衍射峰,表明在制備過程中 ACC沒有發生晶型轉化。掃描電鏡結果(圖 2)顯示,制備產物為均勻球狀顆粒,沒有檢測到體外結晶的方解石晶體的正方體或文石晶體的針簇狀形貌,表明ACC保持了其無定形狀態。
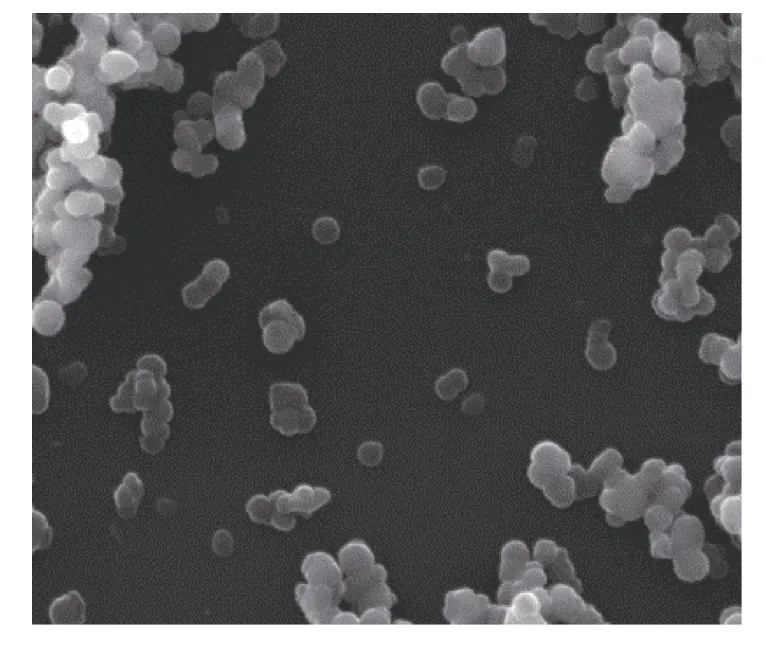
圖2 掃描電子顯微鏡下ACC的形貌Fig.2 SEM image of ACC
2.2 珍珠層EDTA可溶性基質蛋白對ACC穩定性及晶型轉化的影響
取1.2.3中ACC晶型轉化體外反應體系中不同反應時間的碳酸鈣樣品分別進行FTIR檢測。結果表明,在轉化體系不含有 Mg2+的情況下,ACC在水溶液中反應5 min后的樣品便在712 cm–1檢測到典型的方解石吸收峰,表明水溶液中ACC迅速轉化為方解石(圖3)。在Tris-Cl緩沖溶液中ACC轉化較在水溶液中緩慢,但仍在10 min內發生了轉化形成方解石(圖4A)。加入 20 μg/mL珍珠層 ESM后 ACC的轉化速率明顯減慢,在1 h后才發生轉化形成方解石(圖4B)。結果表明,珍珠層ESM具有穩定ACC的作用,穩定時間大于1 h。
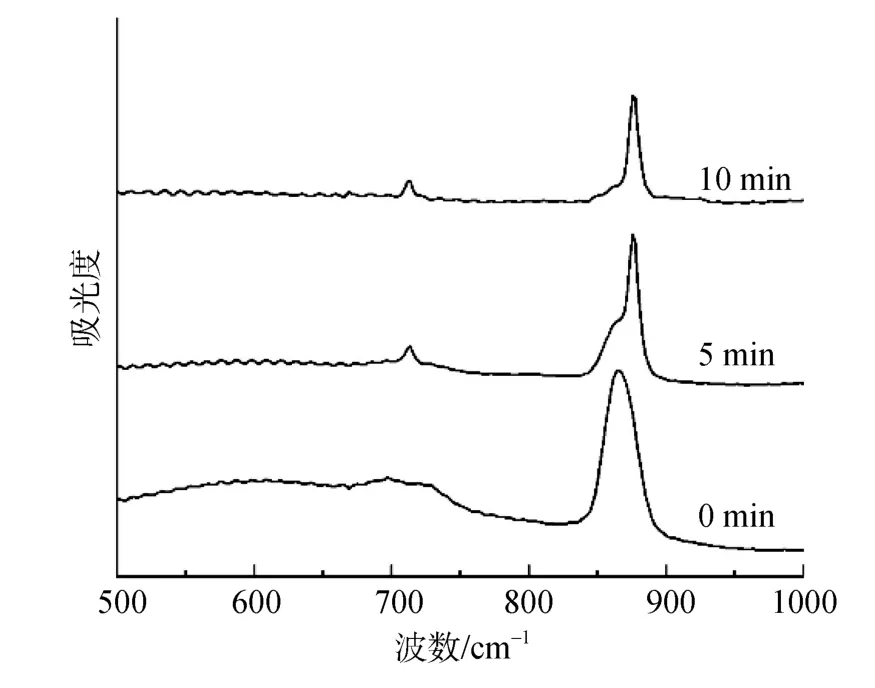
圖3 水溶液中ACC的轉化速率Fig.3 FT-IR spectra of ACC in water at different time intervals
在ACC晶型轉化體外反應體系中含有1 mmol/L Mg2+的情況下,未加入珍珠層 ESM 時,Mg2+并沒有明顯的穩定ACC的作用,ACC在30 min之內便發生轉化形成方解石(圖3C),表明1 mmol/L的Mg2+對于ACC的穩定作用不及20 μg/mL的珍珠層ESM。但在反應體系中加入20 μg/mL珍珠層ESM后,ACC的轉化明顯受到抑制,在轉化體系中反應23 h后仍穩定存在而不發生轉化(圖3D)。結果表明,Mg2+和珍珠層ESM對于ACC的穩定具有協同作用。Mg2+和珍珠層ESM對于ACC的穩定時間分別小于30 min和3 h,但體系中同時存在Mg2+和珍珠層ESM時,ACC的穩定時間可長達24 h以上。
在ACC晶型轉化體外反應體系中含有5 mmol/L Mg2+的情況下,未加入珍珠層ESM時,ACC的穩定時間不及3 d(圖3E),ACC在3 d內發生轉化形成方解石。但加入珍珠層ESM后,ACC可被Mg2+和珍珠層ESM的協同作用穩定長達4 d以上(圖3F)。
2.3 珍珠層 EDTA可溶性基質蛋白對晶體鎂鈣比的影響
取1.2.3中ACC晶型轉化體外反應體系中不同反應時間的碳酸鈣樣品分別進行能譜檢測,結果表明(表1),在含有1mmol/L Mg2+且未加入珍珠層ESM的轉化體系中,ACC未發生轉化時,ACC中鎂離子相對于鈣離子的含量為2.2%±1.5%,而ACC轉化成方解石后這一數值達到8.4%±0.7%,增加了282%,說明在未加入珍珠層 ESM 時,隨著時間的推移,Mg2+參與ACC轉化為方解石的過程并最終摻入方解石晶體中,使得晶體中 Mg2+含量明顯增加。但在加入珍珠層ESM后,ACC發生轉化前,ACC中鎂離子含量為 1.3%±0.9%,ACC轉化成方解石后這一數值為3.6%±0.4%,雖然鎂離子含量增加了 177%,但明顯小于未加入珍珠層 ESM 的情況。由此可見,珍珠層ESM 可以抑制 ACC晶型轉化形成方解石的過程中Mg2+的參與,減少最終形成的方解石中Mg2+的含量。
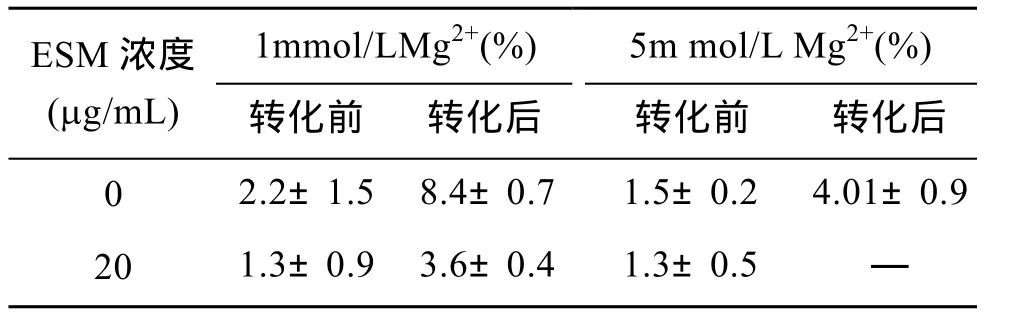
表1 不同濃度 Mg2+存在的條件下轉化前后 ACC中Mg2+/Ca2+(%)的變化Tab.1 Changes of Mg2+/Ca2+(%)in ACC before/after ACC transformation in the systems of different concentrations of Mg2+
2.4 珍珠層 EDTA可溶性基質蛋白對晶體形貌的影響
取1.2.3中加入1 mmol/LMg2+的ACC晶型轉化體外反應體系中不同反應時間的碳酸鈣樣品進行SEM檢測,結果表明,未加入珍珠層ESM時,ACC轉化形成的方解石有兩種晶貌。一種呈棒槌型多層片狀晶貌,另一種則類似體外結晶的典型正方體方解石堆疊而成的晶貌。而加入珍珠層ESM后,ACC晶型轉化后形成的方解石晶貌則具有明顯的不規則性,晶貌趨向于球狀,且沒有明顯的分層結構。說明珍珠層ESM可能具有調節ACC中離子的排列的作用,從而調節ACC轉化產物的晶貌。
3 討論
研究表明,生物體中方解石和文石均由暫態ACC轉化而來[14-15]。同時,生物體內的穩定ACC作為機械強化劑和鈣離子和碳酸根離子的暫時貯存位點,在生物礦化中也起著重要作用[16-18]。生物體中存在穩定性不同的ACC表明,生物體必定通過某種機制調節 ACC的穩定性,從而使暫態 ACC得以在合適的條件下結晶,而穩定 ACC得以保持其穩定狀態。因此,研究生物體調節 ACC穩定性的機制,對闡明生物礦化過程以及解釋生物礦化產物具有優良材料學特性的原因具有重要意義。另一方面,通過一些手段提高ACC的穩定性并探究其穩定機理,不僅有助于在體外研究ACC的晶型轉化過程,更有助于闡明生物體調節ACC穩定性的機制,從而進一步解釋生物礦化的機制。同時,提高ACC的穩定性也有助于今后對體外模擬珍珠形成的過程進行準確控制。研究表明,向溶液中添加某些成分,如鎂離子[27],磷酸根離子[28],乙二醇[29]等都可以可逆地穩定ACC。這些添加劑可能通過吸附在初生晶核上從而抑制碳酸鈣沉淀。也有研究表明,在含有鎂的情況下,從藻類Corallina提取的大分子可以穩定ACC[30],說明向溶液中添加兩種以上成分也可以有效穩定ACC。這與本研究中,相較于不含有Mg2+的情況,在含有Mg2+的溶液中珍珠層ESM對ACC的穩定作用顯著增強一致。
生物礦物的形成環境復雜多變,因此其中或多或少會含有一些雜質成分。但由于固相的溶解度以及雜質離子豐度的限制,這些雜質成分的含量非常少,對生物礦物性質的影響也較小。但Mg元素對碳酸鈣生物礦物的影響卻受到了廣泛關注。生物礦化過程中Mg2+整合進方解石晶格會使得方解石的溶解度升高[31-32],而溶解度升高往往伴隨著穩定性的降低;Mg元素對文石的溶解度的影響則較小,因此,在高Mg/Ca比的結晶溶液中則傾向于沉積文石。研究表明,生物來源的方解石中Mg含量受到嚴格的調控[33-34]。也有體外研究表明,貝殼棱柱層ESM可顯著降低方解石Mg含量,但貝殼珍珠層ESM卻對方解石中 Mg含量沒有顯著影響[35]。這可能是由于上述研究中方解石體外結晶過程由飽和離子溶液為開端,因此,貝殼 ESM 的作用體現了由無機離子轉化為穩定晶體的過程中的整體作用,對于ESM在ACC轉化為穩定晶型階段的作用并沒有進行詳細探討。由于 ACC的晶型轉化是珍珠生物礦化的關鍵步驟,因此本研究主要探討了珍珠層ESM在ACC晶型轉化過程中對于Mg2+含量的調節作用。結果表明,ACC晶型轉化過程中珍珠層ESM可以顯著降低方解石中Mg2+的含量。而珍珠層 ESM 在 Mg2+存在時可以顯著提高ACC的穩定性。因此,貝殼珍珠層ESM可能通過抑制Mg2+結合到ACC,調節晶體中鎂含量來穩定ACC。同時SEM結果表明,珍珠層ESM可以調節ACC轉化形成的方解石的晶貌,使ACC以不同于典型方解石正方體晶貌的形式結晶。這表明,生物體可能通過珍珠層ESM來塑造ACC的晶貌,從而使其結構與功能相適應。
參考文獻:
[1]Simkiss K,Wilbur K M.Biomineralization: Cell biology and Mineral Deposition[M].New York:Academic Press,1989.
[2]Lowenstam H A,Weiner S.On Biomineralization[M].New York: Oxford University Press,1989.
[3]Hare P E.Amino Acids in proteins from aragonite and calcite in shells of Mytiluscalifornianus[J].Science,1963,139(355): 216.
[4]Weiner S,Traub W,Parker S B.Macromolecules in mollusc shells and their functions in Biomineralization[J].Philosophical Transactions of the Royal Society of London.Series B,Biological Sciences,1984,304(1121): 425-433.
[5]Falini G,Albeck S,Weiner S,et al.Control of aragonite or calcite polymorphism by mollusk shell macromolecules[J].Science,1996,271(5245): 67-69.
[6]Miyamoto H,Miyashita T,Okushima M,et al.A carbonic anhydrase from the nacreous layer in oyster pearls[J].Proceedings of the National Academy of Sciences of the United State of America,1996,93(18):9657-9660.
[7]Kong Y W,Jing G,Yan Z G,et al.Cloning and characterization of prisilkin-39,a novel matrixprotein serving a dual role in the prismatic layer formation from the oyster pinctadafucata[J].Journal of Biological Chemistry,2009,284(16): 10841-10854.
[8]Takeuchi T,Sarashina I,Iijima M,et al.In vitro regulation of CaCO3crystal polymorphism by the highly acidic molluscan shell protein aspein[J].Febs Letters,2008,582(5): 591-596.
[9]Kono M,Hayashi N,Samata T.Molecular mechanism of the nacreous layer formation in pinctada maxima[J].Biochemical and Biophysical Research Communications,2000,269(1): 213-218.
[10]Yan Z G,Jing G,Gong N P,et al.N40,a novel nonacidic matrix protein from pearl oyster nacre,facilitates nucleation of aragonite in vitro[J].Biomacromolecules,2007,8(11): 3597-3601.
[11]Feng Q L,Pu G,Pei Y,et al.Polymorph and morphology of calcium carbonate crystals induced by proteins extracted from mollusk shell[J].Journal of Crystal Growth,2000,216(1-4): 459-465.
[12]Prenant M.The types of calcium mineral in living beings and the problem of their determination[J].Biological Reviews and Biological Proceedings of the Cambridge Philosophical Society,1927,2(4): 365-393.
[13]Ogino T,Suzuki T,Sawada K.The formation and transformation mechanism of calcium-carbonate in water[J].Geochimica et Cosmochimica Acta,1987,51(10): 2757-2767.
[14]Beniash E,Aizenberg J,Addadi L,et al.Amorphous calcium carbonate transforms into calcite during sea urchin larval spicule growth[J].Proceedings of the Royal Society B-Biological Sciences,1997,264(1380):461-465.
[15]Weiss I M,Tuross N,Addadi L,et al.Mollusc larval shell formation: Amorphous calcium carbonate is a precursor phase for aragonite[J].Journal of Experimental Zoology,2002,293(5): 478-491.
[16]Aizenberg J,Weiner S,Addadi L.Coexistence of amorphous and crystalline calcium carbonate in skeletal tissues[J].Connective Tissue Research,2003,441: 20-25.
[17]Aizenberg J,Lambert G,Weiner S,et al.Factors involved in the formation of amorphous and crystalline calcium carbonate: A study of an ascidian skeleton[J].Journal of the American Chemical Society,2002,124(1): 32-39.
[18]Aizenberg J,Lambert G,Addadi L,et al.Stabilization of amorphous calcium carbonate by specialized macromolecules in biological and synthetic precipitates[J].Advanced Materials,1996,8(3): 222.
[19]Ma Z J,Huang J,Sun J,et al.A novel extrapallial fluid protein controls the morphology of nacre lamellae in the pearl oyster,Pinctada fucata[J].Journal of Biological Chemistry,2007,282(32): 23253-23263.
[20]Addadi L,Raz S,Weiner S.Taking advantage of disorder: Amorphous calcium carbonate and its roles in biomineralization[J].Advanced Materials,2003,15(12):959-970.
[21]Raz S,Hamilton P C,Wilt F H,et al.The transient phase of amorphous calcium carbonate in sea urchin larval spicules: The involvement of proteins and magnesium ions in its formation and stabilization[J].Advanced Functional Materials,2003,13(6): 480-486.
[22]Samata T,Hayashi N,Kono M,et al.A new matrix protein family related to the nacreous layer formation of Pinctada fucata[J].Febs Letters,1999,462(1-2):225-229.
[23]Suzuki M,Saruwatari K,Kogure T,et al.An acidic matrix protein,pif,is a key macromolecule for nacre formation[J].Science.2009,325(5946): 1388-1390.
[24]Yano M,Nagai K,Morimoto K,et al.A novel nacre protein N19 in the pearl oyster Pinctada fucata[J].Biochemical and Biophysical Research Communications,2007,362(1): 158-163.
[25]Zhang C,Li S,Ma Z J,et al.A novel matrix protein p10 from the nacre of pearl oyster (Pinctada fucata)and its effects on both CaCO3crystal formation and mineralogenic cells[J].Marine Biotechnology,2006,8(6): 624-633.
[26]Tao J H,Zhou D M,Zhang Z S,et al.Magnesium-aspartate-based crystallization switch inspired from shell molt of crustacean[J].Proceedings of the National Academy of Sciences of the United States of America,2009,106(52): 22096-22101.
[27]Reddy M M,Nancollas G H.Crystallization of calcium carbonate: IV.theeffect of magnesium,strontium and sulfate-ions[J].Journal of Crystal Growth.1976,35(1):33-38.
[28]Clarkson J R,Price T J,Adams C J.Role of metastable phases in the spontaneous precipitation of calcium carbonate[J].Journal of the Chemical Society-Faraday Transactions,1992,88(2): 243-249.
[29]Kjellin P,Holmberg K,Nyden M.A new method for the study of calcium carbonate growth on steel surfaces[J].Colloids and Surfaces A-Physicochemical and Engineering Aspects,2001,194(1-3): 49-55.
[30]Raz S,Weiner S,Addadi L.Formation of high-magnesian calcites via an amorphous precursor phase: Possible biological implications[J].Advanced Materials,2000,12(1): 38.
[31]van Enckevort W,van den Berg A.Impurity blocking of crystal growth: a Monte Carlo study[J].Journal of Crystal Growth,1998,183(3): 441-455.
[32]Voronkov V V,Rashkovich L N.Influence of a mobile adsorbed impurity on the motion of steps[J].Soviet Physics-Crystallography,1992,37(3): 289-295.
[33]Mucci A.Influence of temperature on the composition of magnesium calcite overgrowths precipitated from seawater[J].Geochimica et Cosmochimica Acta,1987,51(7): 1977-1984.
[34]Blackmon P D,Todd R.Mineralogy of some foraminifera as related to their classification and ecology[J].Journal of Paleontology,1959,33(1): 1-15.
[35]朱方捷.合浦珠母貝貝殼基質大分子對含鎂方解石鎂含量的調控[D].北京: 清華大學,2010.

