連續降溫對大菱鲆成魚代謝機能的影響
紀利芹,蔣克勇,韓龍江,袁坤山,邱楚雯, 王寶杰,劉 梅,王 雷,溫海深
(1.中國海洋大學 水產學院,山東 青島 266003;2.中國科學院 海洋研究所 海洋生態養殖技術國家地方聯合工程實驗室,山東 青島 266071;3.青島科技大學 化學與分子工程學院,山東 青島 266061)
魚類是變溫動物,水溫的變化必然會改變其新陳代謝,進而影響其生長、發育,并使之產生相應的生理變化甚至病理反應,水溫也是影響魚類養殖生產中的關鍵因素之一[1-3]。
大菱鲆(Scophthalmus maximus),屬于鰈形目(Pleuronectiformes),鲆科(Bothidae),原主要產自于大西洋東側沿岸,是較名貴的冷水性經濟魚類。自1992年被引進中國后,因其生長較快、耐低溫、繁殖較快兼有膠質豐富、風味獨特、市場價格高等優良特性,現已成為中國北方地區為數不多的養殖較為廣泛的重要經濟魚類之一。目前,大菱鲆的養殖區域分布在以山東半島、遼東半島以及天津為主的北方沿海地區[4-7],隨著大菱鲆養殖規模的擴大,市場影響力的提高,南方及內地市場越來越得到養殖戶和商家的關注,所以如何保證其在長途運輸過程中的品質成為急需解決的技術難題。
目前,生態冰溫保活運輸技術已成為魚類保活運輸研究的新方向,即利用魚的生態冰溫,采用控溫方式,使其處于半休眠或完全休眠狀態,從而降低新陳代謝,減少機械損傷,有效延長存活時間,達到長距離、大批量保活運輸的目的。而且該方法無需用水,節能環保,并且水產品品質能夠得到更好的保持,應用前景廣闊[8-9]。
血液是動物體內循環系統中的重要組織,具有運輸營養和代謝廢物、機體免疫等功能[10]。由Selye[11]的應激理論可知,在低溫脅迫下,魚體內生理變化一定會在血液指標中體現,因此血液指標能靈敏地反應魚體的生理、病理變化,可作為動物的營養水平、健康狀況及外界環境變化的生物指標[10,12-16]。魚類以糖原、脂肪和蛋白質作為主要貯能物質,外界環境變化時,魚體最先分解糖原提供能量,且主要以分解肝糖原為主。氧氣不足時肌肉通過糖酵解途徑產生乳酸,因此肝糖原和肌肉中乳酸值的變化能從側面反映體內的能量變化。作者初步研究了連續降溫對大菱鲆成魚肝臟、肌肉及血清代謝等指標的影響,試圖了解大菱鲆的冷應激耐受性,并為大菱鲆的無水保活技術提供理論依據。
1 材料與方法
1.1 實驗材料
實驗用大菱鲆購自山東青島市南山水產品批發市場,個體初始體質量為(400±46)g,暫養于實驗室控溫循環水過濾系統,暫養期間控制水溫為(18.0±1)℃,溶氧為6 mg/L以上,pH約為7~8,鹽度為31,暫養2 d后,選取規格一致的成魚30尾進行實驗。
1.2 實驗設計
通過設計的降溫循環水裝置實現逐漸變溫,大菱鲆的采樣溫度點分別為: 18℃、13℃、8℃、5℃、3℃和1℃,水溫降溫速率設置為: ≤5℃/h (10℃以上)、≤2℃/h (10~1℃)。實驗開始前取樣測定一次指標作為起始對照;降溫開始后,待溫度降到設定的溫度點處立刻進行取樣,每個溫度點處取樣6尾。
1.3 樣品采集
開始降溫后在 13℃、8℃、5℃、3℃和 1℃處立刻進行隨機取樣,每個溫度點處取6尾平行。取出后立刻放入質量濃度為 200 mg/L的MS-222溶液中做快速深度麻醉,配置MS-222溶液所用水的溫度與取樣時的溫度一致,尾靜脈采血,用 1mL注射器于魚尾柄動脈采血5 mL以上,血液不加抗凝劑,在4℃冰箱靜置5 h后,用離心機4℃、12 000 r/min、離心20 min制備血清,血清移入–80℃保存。采血后解剖,取出肝臟、肌肉等組織用液氮速凍后置于–80℃冰箱保存備用。
1.4 血清生化指標的分析
制備好的血清采用全自動生化分析儀測定部分生化指標(邁瑞 BS-180),測定項目包括: 總蛋白、白蛋白、高密度脂蛋白膽固醇、低密度脂蛋白膽固醇、總膽紅素、尿素、總膽固醇、甘油三酯和血糖。
1.5 肝糖原、肌肉乳酸含量的測定
肝糖原、肌肉乳酸含量的測定分別使用南京建成生物工程研究所的肝糖原試劑盒(A043)和乳酸試劑盒(A019-2),其中肝臟與肌肉樣品按照試劑盒說明書進行制備、處理。
1.6 數據處理
數據采用 Spss17.0統計軟件包中的單因素方差分析(ANOVA)和 Duncan氏多重范圍比較進行分析,P<0.05表示有顯著差異,所有結果均以平均值±標準差表示。
2 結果與分析
2.1 連續降溫對魚體血清蛋白濃度的影響
由圖1可知,在連續降溫過程中,血清中總蛋白和白蛋白的濃度變化趨勢整體一致: 均隨溫度降低而升高,總蛋白在 8℃時濃度達到最高(52.33±9.61)g/L,溫度降到 1℃時,濃度下降到初始水平附近。13℃實驗組總蛋白濃度顯著低于3℃實驗組濃度(P<0.05),其余各組之間無顯著差異(P>0.05)。
血清白蛋白在3℃時濃度達到最高值為(30.67±5.32)g/L,1℃時濃度也下降到初始濃度附近,與總蛋白在1℃時濃度變化相似,且1℃時的白蛋白濃度顯著低于 3℃時的濃度(P<0.05),其余各組之間沒有顯著差異(P>0.05)。
2.2 連續降溫對魚體血糖和肝糖原的影響
由圖2A可知,大菱鲆血糖濃度隨溫度的降低呈現先降低后升高再降低的趨勢,在 13℃時降到最低水平(0.85±0.22)mmol/L,在 3℃時含量達到最高(1.85±0.14)mmol/L,當溫度降到 1℃時血糖含量又降到初始水平,且8℃、5℃、3℃實驗組濃度顯著高于其余實驗組(P<0.05)。
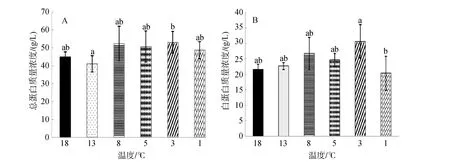
圖1 連續降溫對大菱鲆血液總蛋白及白蛋白質量濃度的影響Fig.1 Effects of continuous cooling on mass concentrations of serum total protein and serum albumin in Scophthalmus maximus
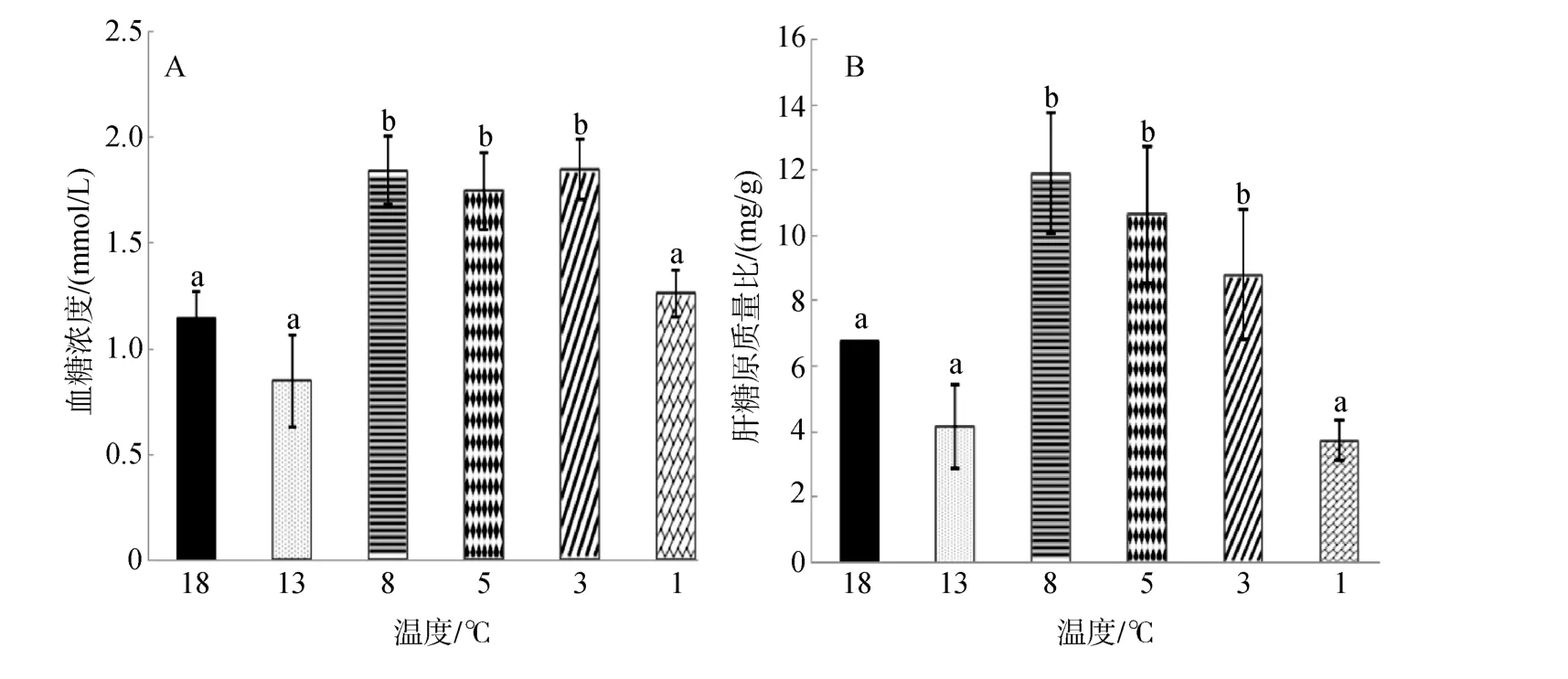
圖2 連續降溫對大菱鲆血液血糖濃度和肝糖原質量分數的影響Fig.2 Effects of continuous cooling on concentrations of serum glucose and contents of liver glycogen in Scophthalmus maximus
由圖2B可知,肝糖原含量與血糖濃度變化趨勢一致,隨溫度降低呈現先降低后升高再降低的趨勢,在 8℃時濃度最高為(11.92±1.84)mg/g,最后當溫度降到1℃時回到初始水平,且 8℃、5℃、3℃實驗組濃度顯著高于其余實驗組(P<0.05)。
2.3 連續降溫對魚體脂類的影響
由圖3A可知,大菱鲆總膽固醇濃度隨溫度降低整體呈現升高趨勢,8℃時濃度低于初始水平,其余各組濃度均高于初始水平,3℃時濃度最高為(8.02±1.05)mmol/L,顯著高于初始水平(P<0.05),其余各實驗組之間無顯著性差異(P>0.05)。
由圖3B可知,甘油三酯濃度隨溫度降低呈現先升高后降低趨勢,各實驗組的濃度均高于初始水平,且各實驗組之間無顯著差異(P>0.05)。
由圖4A可知,高密度脂蛋白膽固醇的濃度開始時隨溫度下降而升高,當溫度降到 5℃時,濃度達到最高(5.74±0.42)mmol/L,溫度再降低時,高密度脂蛋白濃度隨之降低,但都高于18℃時的初始濃度。5℃實驗組的高密度脂蛋白濃度和 18℃實驗組之間存在顯著差異(P<0.05),其余各組之間沒有顯著差異(P>0.05)。
由圖4B可知,低密度脂蛋白膽固醇的濃度隨溫度降低整體呈現先升高后降低再升高的趨勢,當溫度降到 5℃時,濃度達到最低值(4.50±1.62)mmol/L,繼續降低至 3℃時,濃度達到最高值(6.72±2.42)mmol/L,各實驗組之間無顯著性差異(P>0.05)。
2.4 連續降溫對大菱鲆代謝產物的影響
由圖5A可知,隨溫度降低尿素濃度先降低后升高再降低,在8℃時濃度達最高值(3.34±0.03)mmol/L,在1℃時降到最低值(0.58±0.03)mmol/L,且1℃時的濃度值顯著低于 8℃時(P<0.05),其余各組之間沒有顯著差異(P>0.05)。
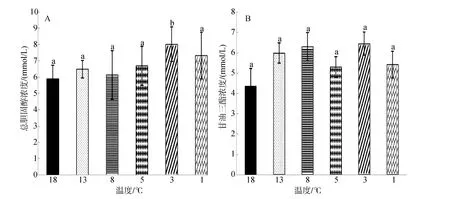
圖3 連續降溫對大菱鲆血清總膽固醇濃度和甘油三酯濃度的影響Fig.3 Effects of continuous cooling on concentrations of serum total cholesterol and serum triglyceride in Scophthalmus maximus
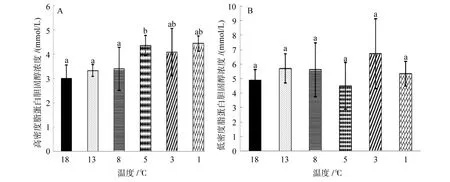
圖4 連續降溫對大菱鲆血清高密度脂蛋白膽固醇濃度和低密度脂蛋白膽固醇濃度的影響Fig.4 Effects of continuous cooling on concentrations of serum high density lipoprotein cholesterol and low density lipoprotein cholesterol in Scophthalmus maximus
由圖 5B可知,乳酸含量隨溫度降低呈現升高趨勢,降到 5℃時達到最高值為(0.615±0.11)mmol/g,18℃時濃度達到最低值為(0.523±0.087)mmol/g,18℃組與 5℃組之間存在顯著差異(P<0.05),其余各實驗組之間沒有顯著性差異。
3 討論
3.1 連續降溫對大菱鲆血清蛋白質含量的影響
血清中的總蛋白主要包括白蛋白和球蛋白,白蛋白主要由肝臟合成,有維持血漿滲透壓、參與機體免疫、運輸、營養等功能,球蛋白由淋巴細胞轉化成的漿細胞分泌形成,在機體的特異性免疫中發揮重要作用[17-19]。本實驗中,溫度降到 8℃以下時,總蛋白和白蛋白隨溫度降低均有逐漸升高的趨勢,可能是隨著溫度降低,大菱鲆受到冷刺激處于應激狀態,肝臟開始合成應激蛋白,而到1℃時白蛋白濃度又降低,可能是此時的溫度已超過了大菱鲆的耐受范圍,肝臟開始受損,各種代謝酶的活性受到抑制。這與常玉梅等[17-20]的觀點一致。
3.2 連續降溫對魚體血糖和肝糖原的影響
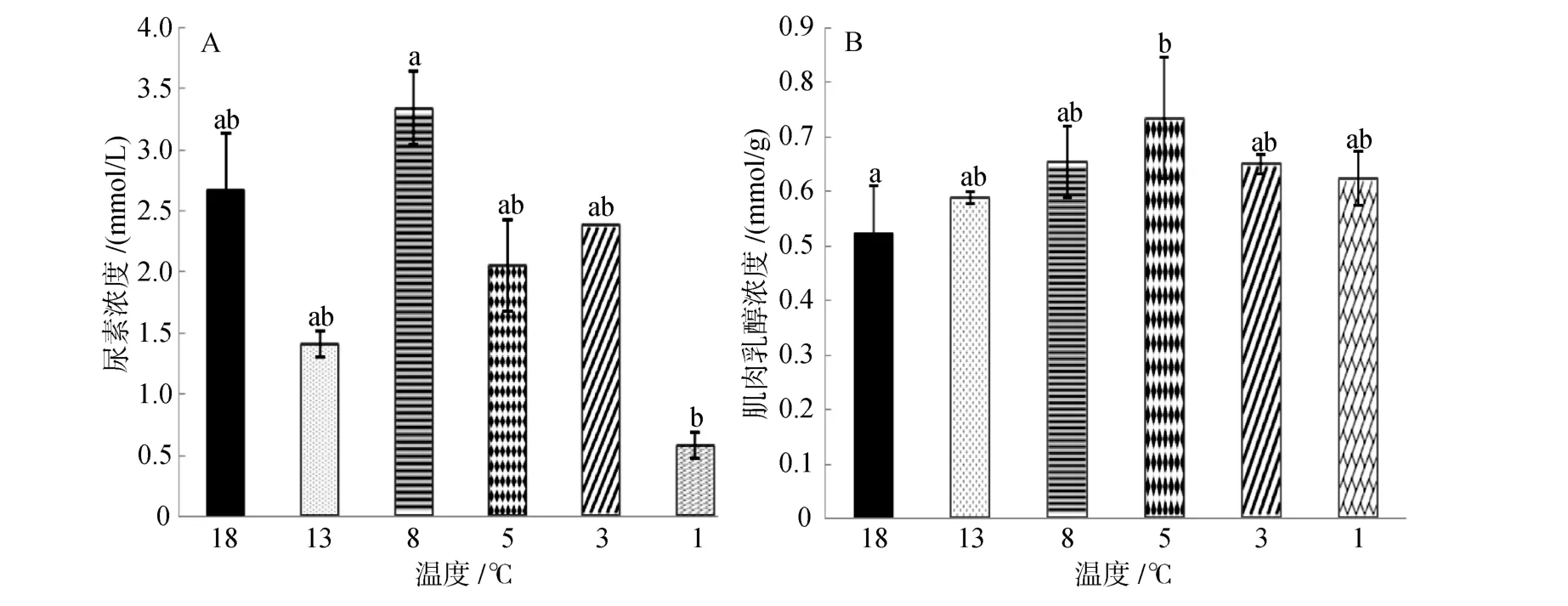
圖5 連續降溫對大菱鲆血清尿素濃度和肌肉乳酸濃度的影響Fig.5 Effects of continuous cooling on concentrations of serum urea and lactic acid of muscle in Scophthalmus maximus
血糖是機體的主要供能物質,正常情況下,其在血液中的含量在一定范圍內保持相對穩定。一些研究發現,應激狀態下,魚體的血糖含量明顯升高,產生高血糖癥[21-25],當環境溫度下降早期,生物體內的適應性變化以血糖代謝增加為主,即體內的糖元轉化為葡萄糖量增加,產生熱量以增強御寒功能,機體在代謝產熱過程中,血糖大量消耗,機體和臟器組織的抗寒能力下降[17,26]。隨著低溫脅迫的加強或脅迫時間的延長,機體將大量的葡萄糖分解成三磷酸腺苷(ATP)提供能量,又使葡萄糖濃度下降。本實驗中葡萄糖的變化規律與此規律相符,在 8~3℃實驗組的血清葡萄糖濃度顯著高于其余實驗組,說明在3℃之前大菱鲆處于應激狀態,溫度降低血糖含量升高以增強魚體的抗脅迫能力,當溫度繼續降低到 3℃以下,大菱鲆機體葡萄糖代謝酶活性降低,使葡萄糖產生量減少且大部分血糖被分解生成 ATP,消耗量增加,使血糖總量減少,而 1℃實驗組與對照組無顯著差異。
肝糖原含量的變化與血清葡萄糖含量變化趨勢一致,原因可能是: 血清葡萄糖濃度的升高意味著需要更多的糖原分解提供葡萄糖,而魚體內血清葡萄糖一般是由肝糖原分解提供[21,27],所以為滿足血清葡萄糖含量的增加,肝臟也增加了肝糖原的合成量。
3.3 連續降溫對魚體脂類的影響
血液高密度脂蛋白膽固醇和低密度脂蛋白膽固醇分別是高、低密度脂蛋白中結合的膽固醇,能相應反映高、低密度脂蛋白的多少。血液中總膽固醇的含量應該是高、低密度脂蛋白綜合作用的結果,高密度脂蛋白的合成和分泌在肝臟和腸內進行,本實驗中,隨溫度降到 5℃時,高密度脂蛋白含量顯著升高而使更多的血液膽固醇被轉運至肝臟,從而使3℃時的血漿膽固醇含量降低,但是低密度脂蛋白含量升高則會將更多的膽固醇和甘油三酯轉運到血液中,二者綜合作用使得血清總膽固醇含量升高[26,28]。
低密度脂蛋白能將甘油三酯運送至血液,所以低密度脂蛋白的含量會對血清中甘油三酯的含量產生影響,這一關系表現為甘油三酯與低密度脂蛋白隨溫度降低變化趨勢一致。
甘油三酯是植物和動物細胞貯脂的主要形式,溫度急劇下降會減弱魚體細胞膜的脂流動性和彈性而使膜損壞或通透性增加,因此細胞膜的脂組成和結構會影響細胞的抗寒性[12,17]。魚類的脂肪酸代謝對體溫降低的適應很敏感,通過積累磷脂中長鏈不飽和脂肪酸的含量,使膜在低溫脅迫時仍保持穩定性和流動性[29-33],從而提高自身的抗寒能力。本研究通過連續降溫實驗發現,與常溫的對照組相比,降溫組的甘油三酯的含量都有增加但無顯著性差異,這說明連續降溫對魚體細胞膜沒有實質性的損害。
3.4 連續降溫對代謝產物的影響
尿素是蛋白質和氨基酸在代謝過程中脫去氨基,由氨基代謝生成[17,34],此過程在肝臟中進行。本實驗中,除 8℃組外,其余各組與對照組相比含量都有所降低,可能與溫度降低導致體內蛋白質的代謝速率降低,尿素產量減少有關。大菱鲆的溫度耐受范圍大約在 20~8℃,8℃是尿素濃度變化的一個轉折點,一定程度上說明8℃是大菱鲆適溫范圍的下限。
氧氣不足情況下,肌肉通過糖酵解途徑產生乳酸并且迅速提供能量。血液流速緩慢、氧氣攝入量不足以及劇烈的運動都會導致體內乳酸含量升高[21,35]。劉偉東[36]研究發現,大菱鲆在低溫保活過程中隨時間的延長,呼吸頻率迅速降低,鰓的煽動幅度也隨保活時間逐漸減弱,呼吸頻率降低使氧氣的吸入量減少,部分組織器官出現無氧代謝使乳酸生成量增多,并且低溫時,魚體內的新陳代謝逐漸降為較低水平,乳酸的代謝受阻,乳酸生成量的增多和排出量的減少都將導致肌肉中乳酸含量的增多[37],這與本實驗研究結果一致。
4 小結
綜合分析實驗中大菱鲆機體代謝指標變化趨勢發現: 當溫度在 18~8℃范圍時,為抵御溫度降低,大菱鲆體內相應代謝開始發生改變以抵消低溫對魚體產生的不利影響,此時,由于溫度范圍在大菱鲆的耐受范圍之內,大菱鲆通過調節自身的代謝能夠維持內環境的相對穩定,因而在此溫度范圍內并未出現應激反應;當溫度降到8~3℃時,此溫度范圍已超過大菱鲆的正常生活溫度,內環境的穩定受到一定的影響,體內開始出現應激反應,某些指標濃度相對于初始降溫有顯著性差異;當溫度繼續低到 1℃時,各指標濃度基本處于較低狀態,說明在此低溫度區間內,大菱鲆體內各種代謝反應的酶活力降到極低程度,體內的應激反應和各種代謝反應基本處于停滯狀態,說明 3~1℃溫度區間與大菱鲆的生態冰溫點比較接近,在此溫度區間大菱鲆代謝程度極低,接近于半休眠或休眠狀態,可以在此溫度區間附近進一步進行無水保活的探索,在保證大菱鲆無水運輸可行性的基礎上優化經濟成本。
肌肉中乳酸含量過高會影響魚體口感,這是冰溫運輸中產生的負面影響,在以后的研究和實踐過程中應引起注意。
低溫無水保活運輸還有很多有待深入研究的工作: 篩選機體內較靈敏的代謝指標來反映低溫運輸過程中魚體內的代謝狀況,探索大菱鲆的降溫生理極限及其在無水低溫運輸過程中的耐受時間,同時無水低溫運輸過程中產生的負面影響也是不可忽視,值得深入探索的。
[1]劉波,王美垚,謝駿,等.低溫應激對吉富羅非魚血清生化指標及肝臟 HSP70基因表達的影響[J].生態學報,2011,31(17): 4866-4873.
[2]王輝,強俊,王海貞,等.溫度與鹽度對吉富品系尼羅羅非魚幼魚能量代謝的聯合效應[J].中國水產科學,2012,19(1): 51-61.
[3]強俊,徐跑,何杰,等.溫度與鹽度對吉富品系尼羅羅非魚仔魚生長與存活的聯合影響[J].中國水產科學,2011,18(6): 1300-1308.
[4]雷霽霖,馬愛軍,陳超,等.大菱鲆(Scophthalmus maximus)養殖現狀與可持續發展[R].中國工程科學,2005,7(5): 30-34.
[5]米娜莎,王棟.大菱鲆產業現狀及發展趨勢分析[J].海洋科學,2011,35(6): 96-99.
[6]雷霽霖,馬愛軍.大菱鲆(Scophthalmus maximus L.)胚胎及仔稚幼魚胚胎發育的研究[J].海洋與湖沼,2003,34(l): 9-19.
[7]雷霽霖.大菱鲆養殖技術(修訂版)[M].上海: 上海科學技術出版社,2005.
[8]殷邦忠,滕瑜.不同保活方法對菲律賓蛤仔保活效果的研究[J].海洋水產研究,1996,17(l): 76-81.
[9]劉淇,殷邦忠.牙鲆無水保活技術[J].中國水產科學,1996,2: 101-104.
[10]林浩然.魚類生理學(2版)[M].北京: 高等教育出版社,2002: 57-67.
[11]Selye H.Stress and the general adaptation syndrome [J].British Medical Journal,1950,17(1): 1383-1392.
[12]冀德偉,李明云,王天柱,等.不同低溫脅迫時間對大黃魚血清生化指標的影響[J].水產科學,2009,28(1): 1-4.
[13]周玉,郭文場,楊振國,等.魚類血液指標研究進展[J].上海水產大學學報,2001,10(2): 163-165.
[14]史增奎.重金屬離子對魚類血液指標影響的研究[J].漁業經濟研究,2006,6: 45-48.
[15]SunY,Zhang B,Guo X W,et al.Effects of temperature on energybudget of Sparus macrocephalus[J].Actaecologica Sinica,2001,21(2): 186-190.
[16]Procarione L S,Barry T P,Malison J A.Effects of high reaing densities and loading rates on the growth and stress responses of juvenile rainbow trout[J].Aquaculture,1999,61: 91-96.
[17]常玉梅,曹鼎臣,孫效文,等.低溫脅迫對鯉血清生化指標的影響[J].水產學雜志,2006,19(2): 71-75.
[18]林浩然.魚類生理學[M].廣州: 廣東高等教育出版社,1999.
[19]王鏡巖,朱圣庚,徐長法.生物化學(3版)[M].北京:高等教育出版社,2002.
[20]吳垠,張峰,桂遠明,等.幾種養殖魚類越冬生理生化指標的變化Ⅲ—血清蛋白組分[J].大連水產學院學報,1995,10(4): 19-26.
[21]彭士明,施兆鴻,李杰,等.運輸脅迫對銀鯧血清皮質醇、血糖、組織中糖元及乳酸含量的影響[J]. 水產學報,2011,35(6): 831-837.
[22]Ubokawa K,Watanabe T,Yoshioka M,et al.Effects of acute stress on plasma cortisol,sex steroid hormone and glucose levels in male and female sockeye salmon during the breeding season[J]. Aquaculture,1999,172: 335-349.
[23]Iversen M,Finstad B,Mckinley R S,et al.Stress responses in Atlantic salmon(Salmon salar L.)smolts during commercial well boat transports and effects on survival after transfer to sea[J].Aquaculture,2005,243:373-382.
[24]Urbinati E C, Deabreu J S,Dasilvacamargo A C,et al.Loading and transport stress of juvenile matrinxa(Brycon cephalus,Characidate)at various densities [J].Aquaculture,2004,229: 389-400.
[25]Wedemeyer G A.Physiological response of juvenile coho salmon(Oncorhynchus kisutch)and rainbow trout(Salmo gairdneri)to handling and crowding stress in intensive fish culture[J].Fisheries Board of Canada,1976,33 : 2699-2702.
[26]洪磊,張秀梅.環 境脅迫對許氏平 鲉和花鱸血糖、血沉降的影響[J].中國水產科學,2005,7(4): 414-418.
[27]Axelrod J,Reisine T D.Stress hormones: their interaction and regulation[J].Science,1984,224: 452-459.
[28]孫學亮,邢克智,陳成勛,等.急性溫度脅迫對半滑舌鰨血液指標的影響[J].水產科學,2010,29(7):387-392.
[29]張羽航,鮑時翔,王延平,等.脂肪酸脫飽和的應用進展[J].生物工程進展,2001,21(2): 41-49.
[30]Dey I,Buda C,Wiik T,et al.Molecular and structural composition of phospolipids membrances in livers of marine and freshwater fish in relation to temperature[J].National Acad Sciences,1993,90(16): 7498-7502.
[31]Hazel J R.Effects of temperature on the structure and metabolism of cell membranes in fish[J].Am Physiological Soc ,1984,246(4pt2): 460-470.
[32]Buda C,Dey I,Balogh N,et al.Structural order of membranes and composition of phospholipids in fish brain cells during thermal acclimation[J].Proc Natl Acad Sci USA,1994,9(17): 8234-8238.
[33]支兵杰,劉偉,王立波,等.水溫對懷頭鲇血液學指標的影響[J].水產學雜志,2008,21(2): 64-70.
[34]馮廣朋,莊平,章龍珍,等.溫度對中華鱘幼魚血液生化指標的影響[J].生態學雜志,2010,29(10):1973-1978.
[35]Iversen M,Finstad B,Mckinley R S,et al.Stress responses in Atlantic salmon(Salmo salar L.)smolts during commercial well boat transportions and effects on survival after transfer to sea[J].Aquaculture,2005,243: 373-382.
[36]劉偉東,薛長湖,殷邦忠,等.低溫下大菱鲆有水和無水保活過程中生理生化變化的研究[J].漁業科學進展,2009,30(5): 69-74.
[37]劉淇,殷邦忠,姚健,等.牙鲆在低溫無水保活過程中的生化變化[J].水產學報,1999,23(3): 296-299.

