萌動(dòng)小麥生化指標(biāo)及Mixolab糊化特性的變化
李興軍 姜 平 路子顯
(國(guó)家糧食局科學(xué)研究院,北京 100037)
小麥?zhǔn)斋@前穗上發(fā)芽,在我國(guó)長(zhǎng)江流域的山谷小麥產(chǎn)區(qū)、東北春小麥產(chǎn)區(qū)及華北、西北的冬小麥產(chǎn)區(qū),時(shí)有發(fā)生。不正常年份,我國(guó)小麥的穗發(fā)芽,面積能夠達(dá)到2 471萬(wàn)hm2,占我國(guó)小麥種植面積的83%[1]。有研究表明, 90 g小麥中如果有一粒小麥嚴(yán)重發(fā)芽,就嚴(yán)重地影響測(cè)定樣品的降落數(shù)值和糊化值[2]。因此建立快速有效的芽麥檢測(cè)方法,選育抗穗發(fā)芽的小麥品種,是糧食工作者的重要目標(biāo)之一。閆長(zhǎng)生等[3]采用收獲時(shí)種子發(fā)芽率和面粉降落數(shù)值法于2000~2002年評(píng)價(jià)了我國(guó)小麥主產(chǎn)區(qū)1950年以來(lái)主要推廣的781個(gè)品種(系)的穗發(fā)芽抗性,發(fā)現(xiàn)穗發(fā)芽抗性20世紀(jì)90年代育成的品種與80年代的相近,但是明顯弱于50~70年代育成的品種。一個(gè)重要原因是進(jìn)入80年代,出粉率高的白麥品種受到偏愛(ài),白麥抗穗發(fā)芽能力不如紅麥。從白粒小麥品種或特殊種質(zhì)資源選育抗穗發(fā)芽品種進(jìn)展緩慢,于是利用基因工程技術(shù)反義導(dǎo)入α-淀粉酶活性的調(diào)控基因來(lái)加快抗穗發(fā)芽育種[4-6]。
Fox等[7]指出優(yōu)質(zhì)小麥面粉包含有α-淀粉酶、β-淀粉酶、蛋白酶等多種酶。其中的大多酶在不發(fā)芽、含水率低的完整粒小麥中活性很低,加入水時(shí)才能被活化,然而他們對(duì)面粉、面包及其他加工品的功能和營(yíng)養(yǎng)屬性起重要影響。小麥萌動(dòng)(發(fā)芽)時(shí),蛋白酶活性增加了17倍[8],而蛋白質(zhì)及游離氨基酸含量報(bào)道較少。本試驗(yàn)分析了萌動(dòng)小麥游離氨基酸、總蛋白質(zhì)及水溶性糖類(lèi)的含量、面團(tuán)Mixolab糊化特性的變化,以期對(duì)我國(guó)芽麥檢測(cè)及小麥營(yíng)養(yǎng)品質(zhì)的評(píng)價(jià)提供參考。
1 材料與方法
1.1 試驗(yàn)樣品及準(zhǔn)備
采用的小麥樣品如表1。芽麥制備方法如下:100粒小麥在培養(yǎng)皿打濕的濾紙上于25 ℃萌動(dòng)48 h,然后60 ℃烘干,40目粉碎,4 ℃保存。大量小麥樣品在潮濕的雙層紗布上萌動(dòng),供Mixolab 面團(tuán)糊化特性測(cè)定。

表1 采用的小麥樣品
注:發(fā)芽率在20 ℃測(cè)定;LSD test,P=0.05,同一列相同字母表示品種之間差異不顯著。
1.2 儀器設(shè)備
肖邦Mixolab混合實(shí)驗(yàn)儀、肖邦SD matic儀:特雷首邦(北京)貿(mào)易有限公司。
1.3 試劑
含內(nèi)切和外切酶活的蛋白酶來(lái)自Bacillusamy-loliquefaciens,僅含內(nèi)切活性的蛋白酶來(lái)自Aspergillus melleus:Sigma公司。
1.4 樣品制備
小麥樣品粉碎(40目篩)后,稱(chēng)取1.0 g面粉于50 mL塑料離心管中,加入15 mL己烷,充分渦旋,蓋上蓋子。常溫下振蕩3 h,在4 ℃ 4 000 r/min離心10 min,取沉淀并在通風(fēng)櫥將己烷揮發(fā)掉。然后在沉淀中加入15 mL無(wú)氨蒸餾水,研磨,在室溫下提取5 min, 在4 ℃ 4 000 r/min離心10 min,上清液即為提取液。
1.5 游離氨基酸含量測(cè)定
按照文獻(xiàn)[9]方法。吸取0.50 mL樣品提取液于10 mL帶塞刻度試管中,依次加入無(wú)氨蒸餾水0.25 mL、乙酸-乙酸鈉緩沖液0.5 mL、3% 茚三酮0.5 mL, 混勻,蓋上塞子。置沸水浴中12 min,冷卻,立即于每管中加入95%乙醇5 mL,塞好塞子,劇烈渦旋試管,促進(jìn)加熱時(shí)形成的紅色產(chǎn)物被空氣中的氧所氧化而褪色。最終溶液顯示藍(lán)紫色,于570 nm波長(zhǎng)下測(cè)其吸光值。以亮氨酸作標(biāo)準(zhǔn)曲線(xiàn),游離氨基酸含量單位是μg氨基態(tài)氮/g 干重(dw)。
1.6 還原糖和總糖含量測(cè)定
采用3,5-二硝基水楊酸(DNS)方法[10]。800 μL提取液加入4.4 mmol/L DNS反應(yīng)液600 μL,混勻,沸水浴5 min。冷卻至室溫,加入蒸餾水定容至10 mL,測(cè)定D540。以葡萄糖作標(biāo)準(zhǔn)曲線(xiàn)。總糖含量采用苯酚-硫酸方法[11]。0.5 mL提取液加入5% 苯酚水溶液0.5 mL,混勻,再加入濃硫酸3 mL,混勻,冷卻后測(cè)定D490。
1.7 蛋白酶和內(nèi)切蛋白酶水解
含有內(nèi)切和外切活性的Bacillusamyloliquefaciens蛋白酶,酶解條件是50 mg樣品中加入2 mL 50 mmol/L Tris-HCl緩沖液pH 7.5、酶活0.106 U,37 ℃酶解3 h。Aspergillusmelleus內(nèi)切蛋白酶酶解條件是50 mg樣品加入2 mL 50 mmol/L Tris-HCl緩沖液pH 7.5、酶活0.120 U,37 ℃酶解3 h。酶解產(chǎn)物測(cè)定游離氨基酸含量。
1.8 破損淀粉含量測(cè)定
破損淀粉含量采用肖邦公司SD matic儀器測(cè)定。取1 g小麥粉樣品放到儀器樣品小斗中,在反應(yīng)杯中加入1滴95%乙醇、3 g硼酸、3 g碘化鉀和120 mL水。儀器會(huì)自動(dòng)把反應(yīng)杯中的溫度上升到35 ℃,然后面粉自動(dòng)落入反應(yīng)杯中。根據(jù)溶液中殘留碘的濃度,儀器自動(dòng)計(jì)算出小麥粉中損傷淀粉的含量,以UCD單位表示。最終的小麥粉破損淀粉考慮含水率、蛋白質(zhì)含量的影響,以UCDC單位表示。蛋白含量測(cè)定采用全自動(dòng)氮元素快速分析儀。
1.9 Mixolab面團(tuán)糊化特性測(cè)定
小麥粉糊化特性采用Mixolab混合實(shí)驗(yàn)儀分析,進(jìn)行恒量加水試驗(yàn)。水分基數(shù)14%濕基;參數(shù)按照Rosell等[12]方法,包括目標(biāo)扭矩(1.1±0.5)Nm,轉(zhuǎn)速80 r/min,面團(tuán)重量75 g,和面初始溫度30 ℃,水箱溫度30 ℃,水合作用55%,第1階段30 ℃恒溫8 min,第2階段從30 ℃升溫到90 ℃共15 min,第3階段90 ℃恒溫保持7 min,第4階段從90 ℃降溫至50 ℃ 10 min,第5階段50 ℃恒溫5 min,試驗(yàn)總時(shí)間45 min。
1.10 數(shù)據(jù)分析
數(shù)據(jù)統(tǒng)計(jì)與處理采用Excel軟件,差異顯著性分析采用單因素方差分析,P<0.05為差異顯著。
2 結(jié)果分析
2.1 萌動(dòng)小麥中游離氨基酸和糖類(lèi)含量變化
從表2~表4看出,6個(gè)小麥品種萌動(dòng)后,游離氨基酸總量均顯著增加。除了順義9843,其他5個(gè)品種的水溶性還原糖含量在萌動(dòng)后也顯著增加。對(duì)6個(gè)小麥品種,萌動(dòng)前后水溶性總糖含量差異不顯著。
注:LSD test,P=0.05,同一列相同字母表示品種之間差異不顯著,下同。
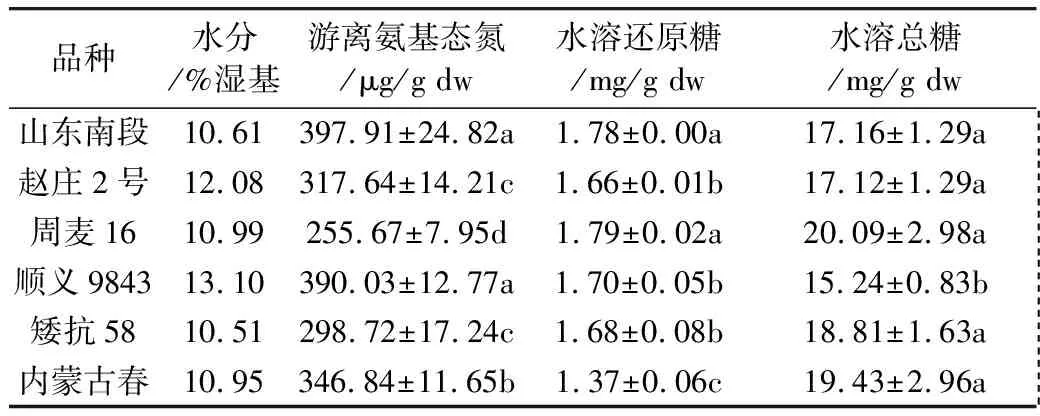
表3 萌動(dòng)小麥游離氨基酸及糖類(lèi)含量
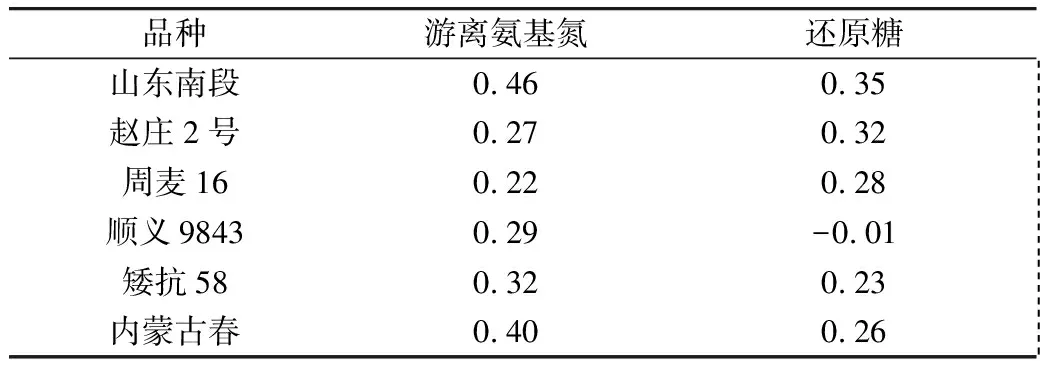
表4 萌動(dòng)小麥游離氨基酸和還原糖增加的倍數(shù)
2.2 小麥萌動(dòng)后外源蛋白酶對(duì)面粉蛋白的降解作用
為了探討萌動(dòng)小麥對(duì)外源蛋白酶降解的敏感程度,采用微生物蛋白酶處理萌動(dòng)小麥面粉。從表5~表6看出,小麥萌動(dòng)后,加入Bacillusamyloliquefaciens蛋白酶(含內(nèi)切和外切酶),產(chǎn)生大量游離氨基酸,但是小麥品種之間、萌動(dòng)前后之間游離氨基酸總量差異不顯著。加入Aspergillusmelleus蛋白酶(僅含內(nèi)切酶),酶解產(chǎn)生的游離氨基酸數(shù)量約是加入Bacillusamyloliquefaciens蛋白酶酶解產(chǎn)物的0.14~0.23倍;與未萌動(dòng)小麥比較,除了趙莊2號(hào),萌動(dòng)的其他5個(gè)小麥品種被內(nèi)切蛋白酶酶解產(chǎn)生的游離氨基酸含量顯著增加。

表5 蛋白酶(內(nèi)切+外切)降解萌動(dòng)小麥粉產(chǎn)生游離氨基酸的量/μg氨基氮/g dw
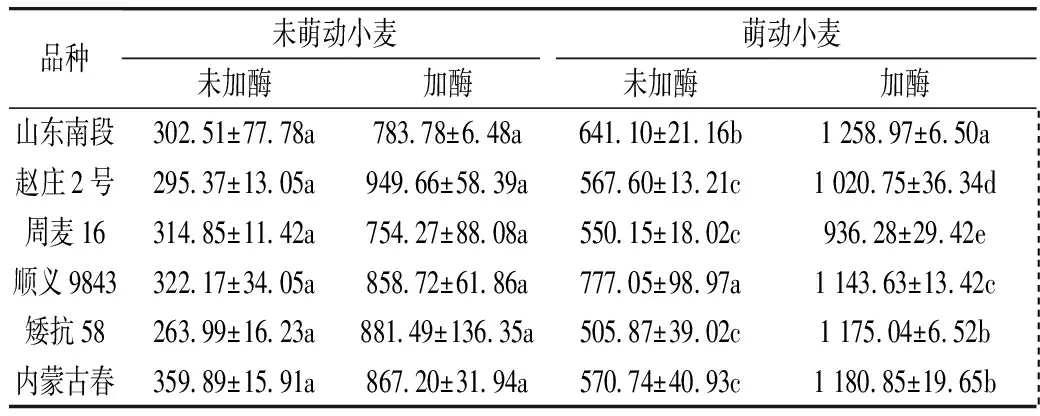
表6 內(nèi)切蛋白酶酶解萌動(dòng)小麥粉產(chǎn)生游離氨基酸的量/μg氨基氮/g dw
2.3小麥萌動(dòng)后蛋白質(zhì)、破損淀粉含量及Mixolab糊化特性的變化
就小麥萌動(dòng)對(duì)蛋白質(zhì)的影響,從表7看出,萌動(dòng)小麥蛋白含量(%干基)增大。小麥粉中淀粉粒的破損率與小麥硬度及研磨劇烈度有關(guān),在同樣粉碎條件下,2個(gè)硬麥品種周麥16、山東南段破損淀粉含量各是15.07、18.90 UCDC,萌動(dòng)后稍增加;2個(gè)軟麥品種順義9843、趙莊2號(hào)破損淀粉含量各是18.54、20.67 UCDC,萌動(dòng)后顯著減少。說(shuō)明小麥籽粒萌動(dòng)48 h對(duì)蛋白質(zhì)合成的影響較淀粉晶體結(jié)構(gòu)的影響明顯。
Mixolab曲線(xiàn)能夠提供小麥粉的吸水率、面團(tuán)蛋白質(zhì)結(jié)構(gòu)網(wǎng)絡(luò)及淀粉糊化信息。從圖1a~圖1b及表8看出,和面恒量加水率對(duì)4個(gè)品種萌動(dòng)小麥?zhǔn)?1.6%~64.0%,與對(duì)未萌動(dòng)小麥的63.6%~65.4%相似。C1是30 ℃ 面團(tuán)達(dá)到最大扭矩所需的時(shí)間(面團(tuán)形成時(shí)間),萌動(dòng)小麥<未萌動(dòng)小麥。4個(gè)品種萌動(dòng)小麥C1稠度峰值(1.09~1.11 Nm)類(lèi)似未萌動(dòng)小麥的C1稠度峰值(1.09~1.15 Nm);和面峰值帶寬對(duì)4個(gè)品種萌動(dòng)小麥?zhǔn)?.05~0.10 Nm,對(duì)未萌動(dòng)小麥品種是0.06~0.09 Nm;面團(tuán)穩(wěn)定時(shí)間是面粉團(tuán)在最大扭矩保持的時(shí)間,對(duì)4個(gè)品種萌動(dòng)小麥?zhǔn)?.87~3.78 min,對(duì)未萌動(dòng)小麥?zhǔn)?.03~5.63 min。

表7 小麥粉大量樣品的蛋白質(zhì)及破損淀粉含量

圖1 未萌動(dòng)小麥與萌動(dòng)小麥恒量加水Mixolab面團(tuán)糊化特性曲線(xiàn)

表8 Mixolab測(cè)定的面團(tuán)糊化特性
注:樣品編號(hào)同表7。
C2稠度谷值為機(jī)械和熱約束引起的蛋白質(zhì)網(wǎng)絡(luò)弱化度,高C2稠度谷值表示強(qiáng)烈的蛋白質(zhì)網(wǎng)絡(luò)。最初階段過(guò)度混合期間面團(tuán)穩(wěn)定性及抗變形能力萌動(dòng)小麥<未萌動(dòng)小麥。蛋白網(wǎng)絡(luò)弱化度(C1-C2)萌動(dòng)小麥>未萌動(dòng)小麥。
高C3淀粉糊化峰值,表示凝膠形成能力萌動(dòng)小麥<未萌動(dòng)小麥。C4淀粉糊化黏度谷值、C5淀粉回生終點(diǎn)值均是萌動(dòng)小麥<未萌動(dòng)小麥。有趣的是,與其他小麥品種比較,萌動(dòng)的順義9843(樣品編號(hào)8)小麥淀粉糊化谷值較大,C3-C4表示的內(nèi)源淀粉酶活性(淀粉衰減值)極低,與該品種小麥萌動(dòng)后還原糖含量不增加相一致。
3 討論
穗發(fā)芽鑒定方法有測(cè)定淀粉降解酶的濁度法、二硝基水楊酸(DNS)法、底物染色法及ELISA法、降落數(shù)值法,測(cè)定黏度參數(shù)的快速黏度分析儀和布氏黏培儀[13],檢測(cè)脂肪酶的熒光法[14],以及Donelson等[15]提出的預(yù)凝膠化淀粉處理的α-淀粉酶活法。降落數(shù)值法、快速黏度分析儀和布氏黏培儀都是通過(guò)控溫(92~100 ℃)使小麥面粉-水懸浮液達(dá)到凝膠狀態(tài),再利用內(nèi)源淀粉水解酶使這種凝膠態(tài)轉(zhuǎn)變?yōu)槿苣z態(tài),測(cè)定懸浮液的黏度下降。Mixolab能夠定性面團(tuán)在混合和溫度雙重限制條件下的理化特性,Dapcevic等[16]發(fā)現(xiàn)Mixolab測(cè)定值與傳統(tǒng)經(jīng)驗(yàn)式流變學(xué)設(shè)備粉質(zhì)儀和糊化儀的測(cè)定值具有顯著的相關(guān)性。Mixolab儀分析的是面團(tuán)蛋白網(wǎng)絡(luò)弱化程度和淀粉糊化特性[17]。本研究顯示,萌動(dòng)小麥淀粉糊化峰值和谷值均減小,淀粉回生終點(diǎn)值降低。另外,與其他小麥品種比較,萌動(dòng)的順義9843小麥淀粉衰減值(C3-C4)表示的內(nèi)源淀粉酶活性是極低的。這個(gè)結(jié)果與該小麥品種萌動(dòng)時(shí)DNS法測(cè)定的還原糖含量不增加相一致。這說(shuō)明采用DNS法檢測(cè)芽麥還原糖增多,不是芽麥檢測(cè)的可靠指標(biāo)。
許多學(xué)者認(rèn)為,小麥籽粒發(fā)生穗發(fā)芽過(guò)程中,蛋白水解酶對(duì)于小麥品質(zhì)的不利影響不及α-淀粉酶[13]。他們的理由是,蛋白水解酶是一個(gè)復(fù)雜的體系,依據(jù)底物分類(lèi)為內(nèi)肽酶、羧肽酶、氨肽酶及其他肽酶,目前還沒(méi)有確切的證據(jù)來(lái)判斷蛋白水解酶對(duì)小麥品質(zhì)影響的精確程度[13]。本研究則首次表明,小麥萌動(dòng)后,內(nèi)源蛋白酶解產(chǎn)生顯著量的游離氨基酸,而且快速定氮儀顯示蛋白含量增大,Mixolab儀顯示蛋白質(zhì)網(wǎng)絡(luò)弱化程度(C1-C2)加大,即說(shuō)明小麥萌動(dòng)過(guò)程蛋白質(zhì)合成和降解同時(shí)存在,游離氨基酸積累。
小麥本身蛋白酶對(duì)面團(tuán)形成的調(diào)控作用已經(jīng)爭(zhēng)議了多年,多數(shù)人認(rèn)為他們對(duì)面粉蛋白的物理化學(xué)變化起微小作用[18],可能在于面粉蛋白酶的最佳pH值是4,在較高pH值時(shí)酶快速失活,而且 pH、鹽、氧化劑、機(jī)械力對(duì)小麥蛋白質(zhì)結(jié)構(gòu)具有顯著的影響。在小麥萌動(dòng)(發(fā)芽)時(shí),蛋白酶活性增加了17倍,以血紅素為底物測(cè)定外切蛋白酶活性,他對(duì)發(fā)芽變化貢獻(xiàn)很小;以偶氮酪蛋白為底物測(cè)定內(nèi)切蛋白酶活性,他貢獻(xiàn)發(fā)芽狀況下的大部分蛋白酶活性[19]。本研究中,萌動(dòng)小麥蛋白質(zhì)結(jié)構(gòu)網(wǎng)絡(luò)弱化程度加大,內(nèi)切蛋白酶容易進(jìn)攻小麥貯藏蛋白,產(chǎn)生大量游離氨基酸,用于合成淀粉代謝的蛋白酶類(lèi)。
4 結(jié)論
萌動(dòng)小麥面粉蛋白質(zhì)結(jié)構(gòu)網(wǎng)絡(luò)弱化程度加大,游離氨基酸總量顯著增加,以及淀粉糊化峰值和谷值降低,可以作為芽麥及其面粉質(zhì)量評(píng)價(jià)的參考依據(jù)。
[1]Xiao S H, Zhang X Y, Yan C S, et al. Germplasm improvement for preharvest sprouting resistance in Chinese white-grained wheat: An overview of the current strategy [J]. Euphytica, 2002, 126: 35-38
[2]Jensen S A, Law D P. A rapid method for the detection of sprouting in populations of wheat kernels [J]. Cereal Chemistry, 1983, 60(5):406-407
[3]閆長(zhǎng)生,張海萍,海林,等. 中國(guó)小麥品種穗發(fā)芽抗性差異的研究[J].作物學(xué)報(bào), 2006, 32(4): 580-587
[4]任江萍,尹君,牛烘斌,等. 反義trxs基因?qū)D(zhuǎn)基因小麥種子內(nèi)源trxh基因表達(dá)的影響[J].植物生理與分子生物學(xué)學(xué)報(bào), 2007, 33(4):325-332
[5]楊燕,張春利,陳新民,等. 穗發(fā)芽率和發(fā)芽指數(shù)及STS標(biāo)記Vp1B3在小麥抗穗發(fā)芽基因型鑒定中的應(yīng)用[J].麥類(lèi)作物學(xué)報(bào), 2007, 27(4): 577-582
[6]蘭秀錦,鄭有良,任曉波,等. RSP抗穗發(fā)芽基因育種利用研究初報(bào)[J].植物遺傳資源學(xué)報(bào), 2005, 6(2):204-209
[7]Fox P F, Morrissey P A. Exogenous enzymes in food processing [M]//Vitale L, Simeon V. Industrial and Clinical Enzymology. New York: Pergamon Press, 1981:39-48
[8]Preston K R, Dexter J E, Kruger J E. Relationship of exoproteolytic and endoproteolytic activity storage protein hydrolysis in germinating durum and hard red spring wheat [J]. Cereal Chemistry, 1978, 55: 877-888
[9]李興軍,姜平,陸暉. 小麥及加工品中游離氨基酸總量測(cè)定[J]. 糧食科技與經(jīng)濟(jì), 2013, 38(1)35-36
[10]西北農(nóng)業(yè)大學(xué)主編.基礎(chǔ)生物化學(xué)實(shí)驗(yàn)指導(dǎo)[M].西安:陜西科學(xué)技術(shù)出版社,1986, 51-53
[11]Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry,1956, 28: 350-356
[12]Rosell C M, Collar C, Haros M. Assessment of hydrocolloid effects on the thermo-mechanical properties of wheat using the Mixolab [J]. Food Hydrocolloids, 2007, 21: 452-462
[13]肖世和,閆長(zhǎng)生,張海萍,等. 小麥穗發(fā)芽研究[M]. 北京:中國(guó)農(nóng)業(yè)科學(xué)技術(shù)出版社,2004
[14]李興軍. 芽麥快速檢測(cè)的幾種方法[C]//中國(guó)糧油學(xué)會(huì)糧油質(zhì)檢研究分會(huì)編、糧油標(biāo)準(zhǔn)質(zhì)量管理與檢驗(yàn). 第一屆中國(guó)糧油標(biāo)準(zhǔn)質(zhì)量年會(huì)優(yōu)秀論文匯編.北京:中國(guó)標(biāo)準(zhǔn)出版社,2010: 24-27
[15]Donelson J R, Gaines C S, Donelson T S, et al. Detection of wheat preharvest sprouting using a pregelatinized starch substrate and centrifugation[J]. Cereal Chemistry, 2001, 78(3):282-285
[16]Dapcevic T, Hadnadev M, Polic M. Evaluation of the possibility to replace conventional rheological wheat flour quality control instruments with the new measurement tool-Mixolab [J]. Agriculturae Conspectus Scientificus, 2009, 74(3):169-174
[17]Torbica A, Hadnadev M, Dapcevic T. Rheological, textural and sensory properties of gluten-free bread formulations based on rice and buckwheat flour [J]. Food Hydrocolloids, 2009, 74(3):169-174
[18]McDonald C E. Proteolytic enzymes of wheat and their relation to baking quality [J]. Bakers Digest, 1969, 43(4):26-30, 32
[19]Preston K R. Note on separation and partial purification of wheat proteases by affinity chromatography [J]. Cereal Chemistry, 1978, 55: 793-798.

