經皮動脈藥盒植入術在治療腹部腫瘤的臨床應用現狀
李明武,武文彬,殷占新,韓國宏
·綜述General review·
經皮動脈藥盒植入術在治療腹部腫瘤的臨床應用現狀
李明武,武文彬,殷占新,韓國宏
自1981年動脈藥盒系統(PCS)首次應用于外科領域以后,PCS被廣泛應用于介入放射學領域。經皮動脈藥盒植入灌注化療兼具創傷小,無需全身麻醉等優點。已有10項隨機對照研究證實了經皮動脈藥盒植入灌注化療結腸癌肝轉移,療效明顯優于系統靜脈化療,而應用于晚期膽道腫瘤、胰腺癌、肝癌的治療僅在一些Ⅰ/Ⅱ臨床試驗和回顧性隊列研究中報道。本文闡述經皮動脈藥盒植入術治療腹部腫瘤的適應證、臨床應用、并發癥以助臨床實踐。
經皮動脈藥盒系統植入術;腹部腫瘤;臨床現狀
經皮動脈藥盒系統(port-catheter system,PCS)植入術是指在影像設備(X線,超聲)引導下經皮穿刺股動脈或左鎖骨下動脈,然后在導絲的導引下將導管遠端插到靶血管附近,再將導管近端與藥盒相連,埋置于下腹壁和左前胸壁而行持續性動脈灌注化療的方法。本文著重對PCS植入術治療腹部腫瘤的臨床應用現狀做一綜述。
1 PCS治療適應證
根據現有文獻的循證醫學證據我們將PCS的適應證分為3類。Ⅰ類適應證是指經前瞻性隨機對照研究已經證實,在一定范圍內有明確療效,如結腸癌肝轉移;Ⅱ類適應證是回顧性隊列研究結果支持在臨床上廣泛應用的,但是缺乏隨機對照研究證實的,如原發性肝癌晚期;Ⅲ類是指病例系列報道或者學者推薦可行PCS,如進展期膽管癌、膽囊癌伴肝轉移,胰腺癌肝轉移。
2 PCS植入入路的選擇
藥盒植入可分為經股動脈途徑和經左鎖骨下動脈途徑[1]。經左鎖骨下動脈入路,埋置藥盒后對患者的生活影響較小、護理方便,而且導管順應血流方向,不易移位,但是穿刺左鎖骨下動脈時稍復雜,需要積累相應經驗。經股動脈入路,技術操作相對簡單、避免形成氣胸、動脈相對較淺、穿刺難度較小,而且無潛在影響大腦供血引起腦栓塞的風險。經左鎖骨下動脈植入的PCS導管在主動脈內過于冗長增加患者腦卒中風險[2]。目前無經左鎖骨下動脈入路和股動脈入路對比研究的結果。從治療腹部腫瘤的角度考慮,動脈藥盒的植入途徑以股動脈入路、將藥盒埋植在髂窩處為佳。
3 PCS臨床應用現狀
3.1 結腸癌肝轉移
自20世紀90年代以來已有10項隨機對照試驗證實了PCS化療結腸癌肝轉移的確切療效。Kemeny等[3]報道了PCS化療對比系統靜脈化療治療結腸癌肝轉移的隨機對照試驗結果:動脈藥盒納入68例患者,系統靜脈化療納入67例患者;化療方案是氟尿嘧啶和四氫葉酸。結果顯示兩組中位生存期各為24.4和20個月(P=0.003);客觀反應率各為47%和24%(P=0.012),三級以上藥物不良反應PCS顯著少于系統靜脈化療。Bertino等[4]肯定了PCS灌注化療在結腸癌肝轉移的地位及作用,同時指出期望新藥的開發通過PCS的給藥方式能夠使結腸癌肝轉移患者臨床獲益更多。盡管隨后的Mocellin等[5]薈萃分析納入10個PCS動脈灌注療法與系統靜脈化療的隨機對照試驗1 277例結腸癌肝轉移的患者得出:PCS灌注化療具較好的腫瘤反應率(RR=2.26,95%CI:1.80~2.84,P<0.000 1)。這個薈萃分析的結果引起了很多學者關注,指出PCS動脈灌注化療應該與系統靜脈化療聯合應用會使結腸癌肝轉移患者更多獲益。近來,Arai等[6]用PCS聯合系統靜脈化療治療25例的多中心1/2期試驗:腫瘤的客觀反應率和中位生存期為72%和49.8個月(95%CI,27.5~78.1),三級以上不良反應僅為15%。因此在結腸癌肝轉移的患者中PCS動脈灌注化療值得肯定和推薦。
3.2 原發性肝癌晚期
晚期肝癌是指伴有門靜脈侵犯,淋巴結或遠處轉移的原發性肝癌。當前對于晚期肝癌總體療效仍然不令人滿意[7]。目前在一線治療失敗之后的晚期肝癌患者,還沒有值得推薦的二線治療方案。Shao等[8]對23例原發性肝癌索拉非尼治療失敗后行PCS動脈灌注化療順鉑、5-氟尿嘧啶的初步試驗結果:48%(11例)患者伴有門靜脈侵犯,83%(19例)患者肝功能Child A級,客觀部分反應率(PR)為26.1%(6例),中位至疾病進展時間為4.4個月,中位生存期為7.5個月,作者認為此方案可作為晚期原發性癌初次治療失敗后的二線方案。Poggi等[9]用西妥西單抗、順鉑和5氟尿嘧啶PCS動脈灌注治療索拉非尼治療失敗的12例晚期肝癌,部分反應率為41.6%,腫瘤控制率為83.3%,僅2例在治療期間出現進展。Oh等[10]用5-氟尿嘧啶、順鉑經PCS動脈灌注治療54例晚期肝癌的結果:腫瘤反應率為22.2%(12例),其中位生存期Child A/Child B為8.7和3.7個月;三級以上化療藥物不良反應為90%。由于Child B/C的患者較短的生存期,較多的化療藥物不良反應,PCS動脈灌注化療應該謹慎對待。另外當肝功能惡化(轉氨酶大于正常值的5倍)或者受基礎疾病限制不能行TACE時,PCS動脈灌注化療是一種可選擇的策略[11]。國內陳世晞等[12]用p53基因藥盒灌注晚期肝癌的病例對照研究結果顯示:治療組的平均生存期為238.1 d,對照組為:80.7 d,并且治療組術后的生活質量(卡氏評分)較術前有顯著差異(P<0.05)。因此對于一線藥物治療失敗和不能耐受TACE的晚期肝癌患者,PCS動脈灌注化療是備選策略。
3.3 進展期膽道系統腫瘤
膽系腫瘤(biliary tract cancer,BTC)是一種起源于膽管皮的惡性腫瘤。目前手術切除仍是惟一可能治愈的手段。大多數患者在發病時已為晚期或已發生遠處轉移,無法根治性切除腫瘤。
在早期階段,一些學者在晚期膽道腫瘤的PCS動脈灌注化療就進行了一些探索。Tanaka等[13]對11例肝內膽管癌行PCS動脈灌注5-氟尿嘧啶,阿霉素,絲裂霉素C的初步臨床試驗結果:總腫瘤反應率達到64%(7例),中位生存期為26個月。Shitara等[14]對20例肝內膽管癌患者行PCS動脈灌注絲裂霉素C加緩釋微球的初步臨床試驗:總腫瘤反應率50%(10例),至疾病進展時間為8.3個月,中位生存期為14.1個月。
2010年Valle等[15]報道了關于吉西他濱聯合順鉑與單用吉西他濱治療晚期膽道腫瘤隨機對照試驗結果:中位生存期各為11.3個月和8.1個月。當吉西他濱、順鉑在系統靜脈化療顯示出優越的結果之后,Inaba等[16]用吉西他濱動脈灌注化療治療不可切除性肝內膽管癌的Ⅰ/Ⅱ期試驗(JIVROSG-0301),此研究中Ⅰ期入組16例患者,Ⅱ期入組13例患者,在Ⅰ期試驗中,患者未能耐受大劑量(1 000 mg/m2)。在Ⅱ期患者中,9例患者的吉西他濱的劑量加到大劑量(1 000 mg/m2);但是總的客觀反應率僅7.7%,而三級不良反應:神經毒性反應(20%),肝功能惡化(20%),惡心嘔吐(8%)。此方案過低的腫瘤反應率,經藥盒動脈灌注沒有比系統靜脈化療具有優勢。Sinn等[17]動脈灌注奧沙利鉑、亞葉酸鈉、氟尿嘧啶治療晚期膽道腫瘤的Ⅱ期試驗,總體的腫瘤反應率:16%,腫瘤控制率可達65%,中位無疾病進展時間為6.5個月,中位生存期為13.5個月,而僅有輕微的毒性反應。微侵襲性的PCS顯示良好腫瘤控制率和較低的毒性反應。
綜上所述,對于晚期膽道腫瘤,當前指南推薦以吉西他濱、順鉑為基礎的一線系統靜脈化療方案并不適合于PCS動脈灌注化療,而以氟尿嘧啶為基礎的聯合化療方案可能更適合于PCS動脈灌注治療晚期膽道腫瘤,但是需要進一步大樣本臨床試驗數據來支持。
3.4 晚期胰腺癌及肝轉移
胰腺癌是預后非常差的一類腫瘤,其5年生存率低于5%。目前針對于晚期胰腺癌肝轉移的PCS動脈灌注化療僅有一些小樣本的實驗性研究和個案報道證實其可行性和安全性。陳世晞等[18]報道的經動脈藥盒輸注吉西他濱治療37例晚期胰腺結果:腫瘤的部分緩解率為5.4%,疾病控制率為43%;治療組對比對照組痛疼緩解率(27.2%比4.8%,P= 0.002),中位生存期(6.25比4.41個月,P<0.01)。Doh等[19]報道1例胰腺癌術后肝內多發轉移患者,吉西他濱系統靜脈化療聯合PCS動脈灌注氟尿嘧啶,26周期后,肝內腫塊完全消失,患者生存34個月。Tajima等[20]對胰腺癌術后肝轉移的5例患者行PCS灌注吉西他濱和氟尿嘧啶,客觀反應2例,5例均獲腫瘤控制。PCS由于提高了局部血藥濃度,保證了其高效性,降低了全身不良反應。鑒于PCS對晚期胰腺癌肝轉移只得益于小樣本臨床研究的結果,PCS動脈灌注的療效需進一步確定。
4 并發癥及防治
PCS的并發癥可分為操作相關并發癥和化療藥物并發癥(表1)。PCS操作相關并發癥包括血腫、氣胸、導管移位、肝動脈栓塞、藥物滲漏、層流及反流,藥盒周圍皮膚感染、傷口愈合延遲、腦卒中等。其中PCS術后最主要的并發癥是導管移位和肝動脈栓塞。關守海等[21]報道348例經左鎖骨下動脈藥盒系統植入術的患者中,導管移位率為7.1%,靶血管與腹主動脈間的頭向夾角偏小和其相關。在縫合切口前應再次透視觀察留置管頭的位置是否滿意,預留較長的留置管于靶動脈內;靶動脈過短時,可將留置的管頭端置于其開口上方的主動脈內[22]。植入導管的直徑和放置的靶血管直徑相近顯著增加肝動脈栓塞的發生率,常規抗凝療法能降低血管栓塞事件的發生。對于患者消瘦明顯,腹股溝處皮下脂肪偏少者易出現切開愈合不良伴感染,PCS宜以左鎖骨下動脈穿刺入路為佳[23]。
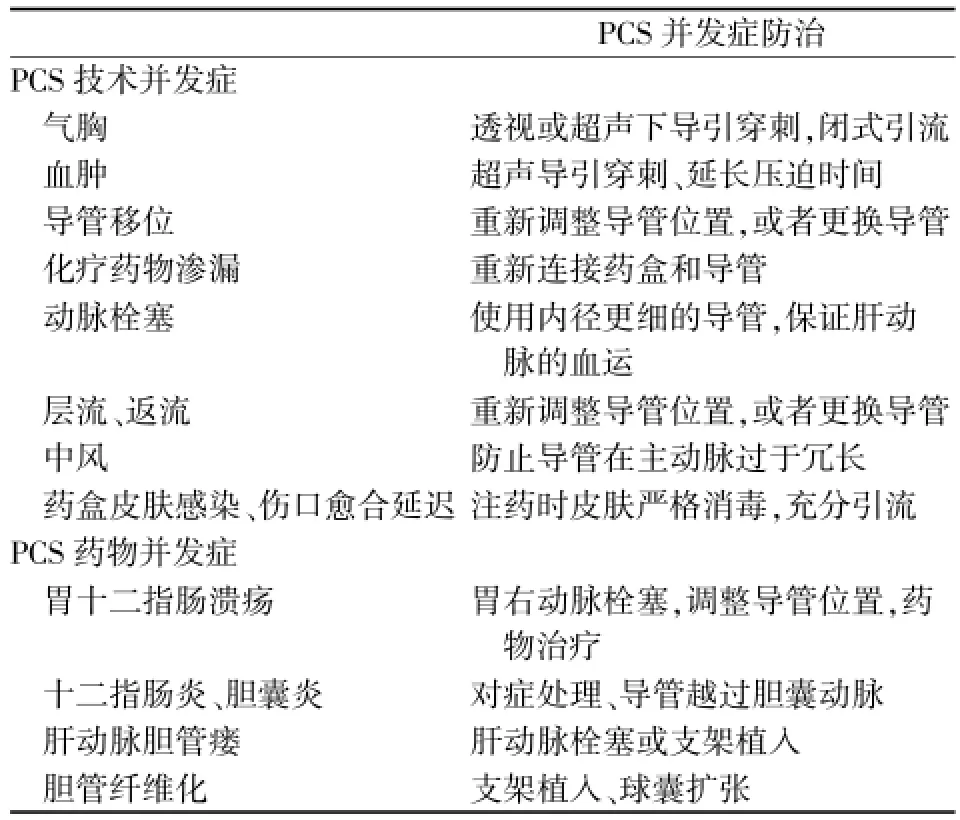
表1 PCS并發癥及其防治
PCS術后的藥物并發癥主要包括胃十二指腸潰瘍,十二指腸炎、膽囊炎、肝動脈膽管瘺、膽管纖維化。行胃右動脈栓塞是防止胃十二指腸潰瘍的有效方法[24]。Ito等[25]報道結腸直腸癌肝轉移PCS術后的少見并發癥膽管硬化的發生率5.5%,主要位于膽總管;其發生的概率和化療藥物的劑量呈正相關,可行支架植入或球囊擴張修正。Venturini等[26]報道的204例PCS術后的患者中,有2例發生肝動脈膽管瘺,及時行肝動脈栓塞得以修正。
當前,經皮PCS動脈灌注化療結腸癌肝轉移的有效性和安全性已經被大量隨機對照研究充分證實;在晚期原發性肝癌一線藥物-索拉非尼治療失敗的患者PCS動脈灌注療法仍是值得備選的方案;然而,更適合的PCS動脈灌注的化療方案仍需進一步的研究來確認。晚期胰腺癌的PCS治療由于較低腫瘤反應率仍然處于初步探索階段。
[1]Tanaka T,Arai Y,Inaba Y,etal.Radiologicplacementof sidehole catheter with tipfixation for hepatic arterial infusion chemotherapy[J].JVasc Interv Radiol,2003,14:63-68.
[2]Hirota T,Yamagami T,Tanaka O,etal.Catheter redundancy in the aortic arch increases the risk of stroke in left subclavian arterialport-catheter systems[J].JVasc Interv Radiol,2005,16:471-476.
[3]Kemeny NE,Niedzwiecki D,Hollis DR,et al.Hepatic arterial infusion versus systemic therapy for hepatic metastases from colorectal Cancer:a randomized trial of efficacy,quality of Life,and molecularmarkers(CALGB 9481)[J].JClin Oncol,2006,24:1395-1403.
[4]Bertino JR.Implantablepumpfor long-term chemotherapy administration via the hepatic artery:has it fulfilled itspromise?[J].JClin Oncol,2008,26:4528-4529.
[5]Mocellin S,Pilati P,Lise M,et al.Meta-analysis of hepatic arterial infusion for unresectable liver metastases from colorectal Cancer:the end of an era?[J].JClin Oncol,2007,25:5649-5654.
[6]Arai Y,Ohtsu A,Sato Y,et al.PhaseⅠ/Ⅱstudy of radiologic hepatic arterial infusion of fluorouracilplus systemic irinotecan for unresectable hepatic metastases from colorectal Cancer:Japan Clinical Oncology GroupTrial 0208-DI[J].JVasc Interv Radiol,2012,23:1261-1267.
[7]Shao YY,Lin ZZ,Hsu C,et al.Early alpha-fetoprotein responsepredicts treatment efficacy of antiangiogenic systemic therapy inpatients with advanced hepatocellular carcinoma[J].Cancer,2010,116:4590-4596.
[8]Shao YY,Liang PC,Wu YM,et al.Apilot study of hepatic arterial infusion of chemotherapy forpatients with advanced hepatocellular carcinoma who have failed anti-angiogenic therapy[J].Liver Int,2013,33:1413-1419.
[9]Poggi G,Montagna B,Melchiorre F,et al.Hepatic intra-arterial cetuximab in combination with 5-fluorouracil and cisplatin as salvage treatment for sorafenib-refractory hepatocellular carcinoma[J].Anticancer Res,2011,31:3927-3933.
[10]Oh MJ,Lee HJ,Lee SH.Efficacy and safety of hepatic arterial infusion chemotherapy for advanced hepatocellular carcinoma as first-line therapy[J].Clin Mol Hepatol,2013,19:288-299.
[11]Nagano H.Treatment of advanced hepatocellular carcinoma:intraarterial infusion chemotherapy combined with interferon[J]. Oncology,2010,78:142-147.
[12]陳世晞,陳駿,徐衛東,等.動脈灌注p53基因治療晚期肝癌的初步臨床應用[J].介入放射學雜志,2007,16:127-129.
[13]Tanaka N,Yamakado K,Nakatsuka A,et al.Arterial chemoinfusion therapy through an implantedport system forpatients with unresectable intrahepatic cholangiocarcinomainitial experience[J].Eur JRadiol,2002,41:42-48.
[14]Shitara K,Ikami I,Munakata M,etal.Hepatic arterial infusion of mitomycin C with degradable starch microspheres for unresectable intrahepatic cholangiocarcinoma[J].Clin Oncol(R Coll Radiol),2008,20:241-246.
[15]Valle J,Wasan H,Palmer DH,et al.Cisplatinplus gemcitabine versus gemcitabine for biliary tract Cancer[J].N Engl JMed,2010,362:1273-1281.
[16]Inaba Y,Arai Y,Yamaura H,et al.PhaseⅠ/Ⅱstudy of hepatic arterial infusion chemotherapy with gemcitabine inpatients with unresectable intrahepatic cholangiocarcinoma(JIVROSG-0301)[J].Am JClin Oncol,2011,34:58-62.
[17]Sinn M,Nicolaou A,Gebauer B,et al.Hepatic arterial infusion with oxaliplatin and 5-FU/folinic acid for advanced biliary tract Cancer:aphaseⅡstudy[J].Dig Dis Sci,2013,58:2399-2405.
[18]陳世晞,徐衛東,尹國文,等.經動脈藥盒輸注吉西他濱治療37例晚期胰腺癌[J].中國癌癥雜志,2002,12:413-415.
[19]Doh J,Sho M,Tanaka T,et al.A case ofpostoperativemultiple liver metastases ofpancreatic cancer successfully treated by combination chemotherapy with weekly high-dose 5-FU hepatic arterial infusionplus systemic infusion of gemcitabine[J].Gan To Kagaku Ryoho[J].2009,36:2087-2089.
[20]Tajima H,Ohta T,Kitagawa H,et al.Pilot study of hepatic arterial infusion chemotherapy with gemcitabine and 5-fluorouracil forpatients withpostoperative liver metastases frompancreatic Cancer[J].ExpTher Med,2011,2:265-269.
[21]關守海,陳勇,姜在波,等.經皮左鎖骨下動脈導管藥盒系統置入術后留置管移位的原因及處理[J].介入放射學雜志,1999:31-33.
[22]陳勇,李彥豪,單鴻,等.經皮左鎖骨下動脈導管藥盒系統植入術的并發癥及其處理[J].中華放射學雜志,1997:30-32.
[23]姜建威,程潔敏,李新勝,等.介入性導管藥盒系統廢用的原因及預防措施[J].介入放射學雜志,2002,11:127-128.
[24]Inaba Y,Arai Y,Matsueda K,et al.Right gastric artery embolization toprevent acute gastric mucosal lesions inpatients undergoing repeat hepatic arterial infusion chemotherapy[J].J Vasc Interv Radiol,2001,12:957-963.
[25]Ito K,Ito H,Kemeny NE,et al.Biliary sclerosis after hepatic arterial infusionpumpchemotherapy forpatients with colorectal Cancer liver metastasis:incidence,clinical features,and risk factors[J].Ann Surg Oncol,2012,19:1609-1617.
[26]Venturini M,Angeli E,Salvioni M,et al.Complication afterpercutaneous transaxillary implatation of a catheter for intraarterial chemotherapy of liver tumors:clinical relevance and management in 204patients[J].AJR,2004,182:1417-1426.
Percutaneous im plantation of port-catheter system for the treatment of abdom inal neoplasms:present situation in clinical practice
LIMing-wu,WUWen-bin,YIN Zhan-xin,HAN Guo-hong.Department of Interventional Radiology,Xijing Hospital of Digestive Diseases,the Fourth Military Medical University,Xi' an,Shaanxi Province 710032,China
HAN Guo-hong,E-mail:guohh@fmmu.edu.cn
Since intra-arterial chemotherapy with the helpof implantation ofport-catheter system(PCS)was first used in the surgical field in 1981,PCS has been widely employed in the field of interventional radiology.Intra-arterial chemotherapy by implantation of PCS has some certain advantages such as minimal invasion,no need of general anesthesia,etc.Ten randomized clinic trails have been already reported,which indicate that intra-arterial chemotherapy with PCS is obviously superior to systemic chemotherapy in treating hepatic metastasis form colorectal cancer.As for the treatment of advanced biliary tract cancer,pancreatic carcinoma and hepatocellular carcinoma,the relevant reports can be found only in severalphaseⅠ/Ⅱclinical trials or in some retrospective cohort studies.Thispaper aims to make a comprehensive review about the indications,clinical applications and complications of PCS in treating abdominal tumors in order to improve the clinicalpractice.(JIntervent Radiol,2014,23:739-742)
percutaneous implantation ofport-catheter system;abdom inal neoplasm;current clinical situation
R735
A
1008-794X(2014)-08-0739-04
2013-12-24)
(本文編輯:俞瑞綱)
10.3969/j.issn.1008-794X.2014.08.022
710032西安第四軍醫大學西京消化病醫院介入科
韓國宏E-mail:guohh@fmmu.edu.cn