低氮低熱量腸外營養對食管癌術后營養狀態、血糖和并發癥的影響
翟春波 李偉 胡德宏
國內外大量的研究表明,在重癥感染、手術等應激狀態的早期給予低氮低熱量腸外營養不會造成血漿總蛋白、白蛋白、血清前蛋白等指標的明顯降低,但是卻能降低術后感染并發癥、降低血糖、降低藥物費用及減少手術后住院日,因此不少學者認為術后早期或是嚴重感染等應激狀態的急性期應選擇低氮低熱量腸外營養[1-5]。然而這些報道對食管癌切除術后影響的研究較少,雖然謝春玲、夏曉明等[6-7]進行的回顧性研究初步顯示食管癌術后患者應用低氮低熱量腸外營養對控制血糖、減少術后并發癥等方面有積極意義,但仍需前瞻性的隨機對照研究來進一步驗證。為此本研究采用前瞻性隨機對照的方法來探討低氮低熱量腸外營養對食管癌術后營養狀態、血糖和術后并發癥的影響。
1 資料與方法
1.1 一般資料 2012年1月-2013年12月,共有60例符合標準的食管癌患者入組,按照1:1的比例隨機分為低氮低熱量組(研究組)和傳統氮熱量組(對照組),每組30例。其中研究組男27例,女3例,年齡42~65歲;對照組男28例,女2例,年齡45~63歲,兩組患者年齡、性別比較差異無統計學意義。研究方案經濰坊市人民醫院倫理委員會審核批準,所有受試者均簽署知情同意書。
1.2 納入和排除標準 納入標準:(1)因食管、賁門癌行食管癌根治術并需禁飲食1周以上的患者;(2)腫瘤分期T≤T4且腫瘤未侵及周圍臟器;(3)患者年齡在18~65歲之間。排除標準:(1)根據NRS2002評分標準,BMI<18.5 kg/m2且一般情況差,或1個月內體重丟失>5%(或3個月體重下降15%),或者前1周食物攝入比正常需要量低75%~100%;(2)有輸液禁忌證或對營養劑、藥物過敏;(3)有較嚴重的心臟基礎疾患;(4)有支氣管哮喘病史;(5)有糖尿病且需要藥物治療者;(6)有嚴重的肝腎功能異常;(7)術中出現嚴重并發癥者。
1.2 治療方案 所有患者均采用全麻、雙腔氣管插管、左側開胸,都接受了食管腫瘤切除并食管-胃胸內吻合術,術后前5 d均采用全腸外營養支持治療,研究組按熱量 20 kCal/(kg·d),氮 0.1 g/(kg·d)給予,對照組按熱量35 kCal/(kg·d),氮0.2 g/(kg·d)給予,5 d后無吻合口瘺表現的患者開始進食,懷疑有吻合口瘺的患者放置鼻腸管行腸內營養。腸外營養均由本院靜脈配置科統一配成3 L袋,所有患者經由中心靜脈給藥(PICC方法)。
1.3 監測指標 術后觀察并記錄患者心律失常、肺部感染、刀口感染及吻合口瘺等并發癥的發生率。術前1 d、術后第3、6天測定血漿總蛋白、白蛋白、前白蛋白,術前和術后第1、3、6天查動脈血氣測PaO2、PaCO2、乳酸濃度等指標,并在輸注腸外營養開始后3 h測末梢血糖。
1.4 統計學處理 應用SPSS 17.0軟件對數據進行統計分析,計量資料用(s)表示,采用t檢驗;計數資料采用 字2檢驗;P<0.05為差異有統計學意義。
2 結果
所有患者均順利完成手術,術中未出現嚴重并發癥,無退出病例。
2.1 手術前后蛋白濃度變化 術前1 d兩組患者總蛋白、白蛋白及前白蛋白濃度比較差異無統計學意義;術后第3天和術后第6天兩組各蛋白指標均較術前有所降低,但兩組比較差異均無統計學意義。見表1。
表1 兩組手術前后蛋白濃度變化(s)
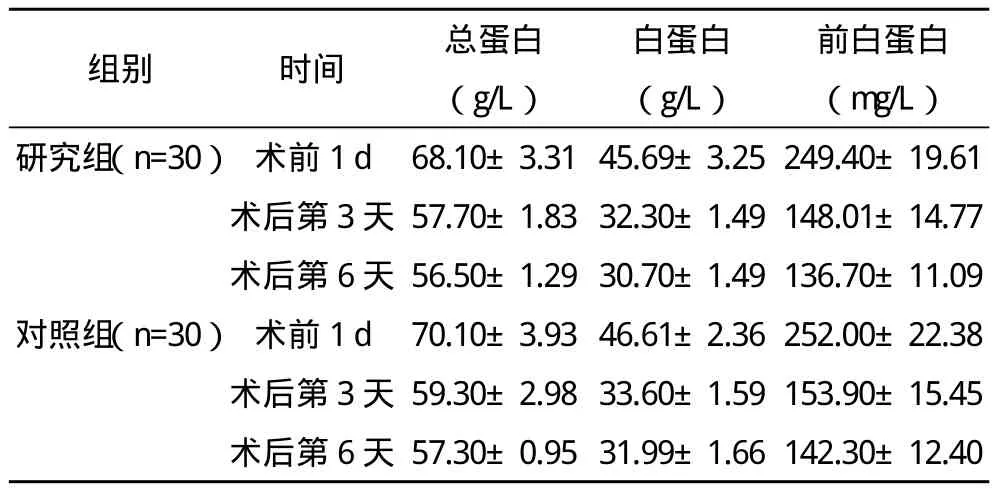
表1 兩組手術前后蛋白濃度變化(s)
前白蛋白(mg/L)研究組(n=30)術前1 d 68.10±3.31 45.69±3.25 249.40±19.61術后第3天 57.70±1.83 32.30±1.49 148.01±14.77術后第6天 56.50±1.29 30.70±1.49 136.70±11.09對照組(n=30)術前1 d 70.10±3.93 46.61±2.36 252.00±22.38術后第3天 59.30±2.98 33.60±1.59 153.90±15.45術后第6天 57.30±0.95 31.99±1.66 142.30±12.40組別 時間 總蛋白(g/L)白蛋白(g/L)
2.2 手術前后血氣指標變化 手術前兩組患者PaO2、PaCO2和乳酸指標比較差異無統計學意義,兩組患者手術后第1、3、6天PaO2均較術前有不同程度的降低,且兩組間比較差異有統計學意義(P<0.05)。兩組患者手術后第1、3、6天PaCO2和乳酸指標均較術前有不同程度的升高,且兩組間比較差異有統計學意義(P<0.05)。見表 2。
表2 兩組手術前后血氣指標變化(s)
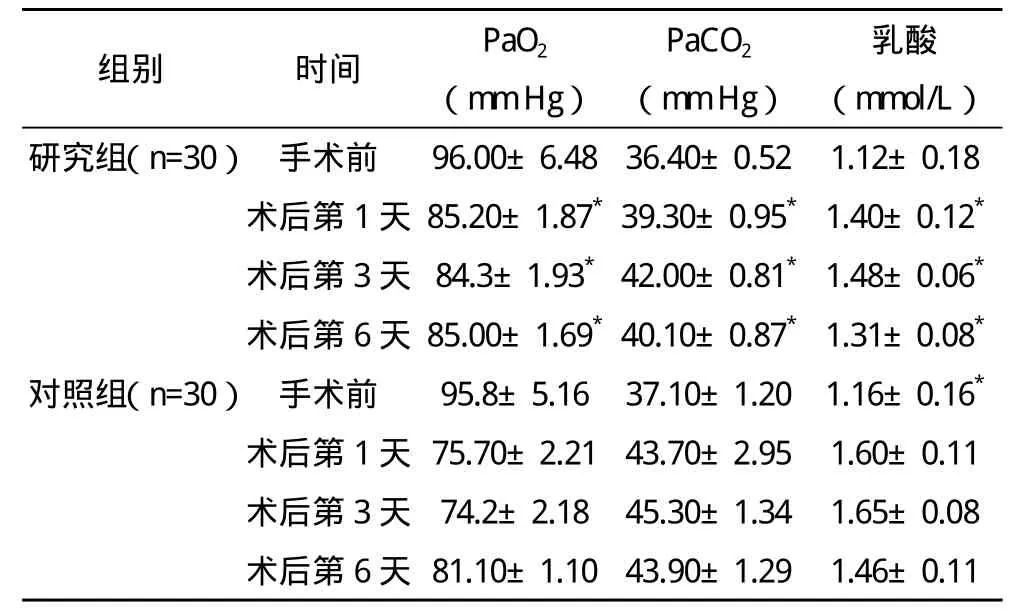
表2 兩組手術前后血氣指標變化(s)
*與對照組相應時間點比較,P<0.01
研究組(n=30)手術前 96.00±6.48 36.40±0.52 1.12±0.18術后第1天 85.20±1.87*39.30±0.95*1.40±0.12*術后第3天 84.3±1.93*42.00±0.81*1.48±0.06*術后第6天 85.00±1.69*40.10±0.87*1.31±0.08*對照組(n=30)手術前 95.8±5.16 37.10±1.20 1.16±0.16*術后第1天 75.70±2.21 43.70±2.95 1.60±0.11術后第3天 74.2±2.18 45.30±1.34 1.65±0.08術后第6天 81.10±1.10 43.90±1.29 1.46±0.11
2.3 兩組手術前后末梢血糖的變化 術前兩組末梢血糖差異無統計學意義,術后第1、3、6天的末梢血糖兩組比較差異有統計學意義(P<0.05)。見表3。
表3 兩組手術前后末梢血糖的變化(s)mmol/L

表3 兩組手術前后末梢血糖的變化(s)mmol/L
研究組(n=30)5.62±0.33 7.31±0.38 6.76±0.29 5.81±0.22對照組(n=30)5.74±0.23 8.31±0.37 7.92±0.18 6.40±0.14 P值 0.335 0.000 0.000 0.000
2.4 兩組術后并發癥發生率比較 兩組術后心律失常、肺部感染、刀口感染和吻合口瘺的發生率比較差異無統計學意義,但是對照組較研究組術后并發癥發生率有增多趨勢;對照組較研究組術后總的并發癥發生率高,差異有統計學意義(P<0.05)。見表4。

表4 兩組術后并發癥發生率比較 例(%)
3 討論
國內外大量的研究表明手術或創傷等應激狀態的早期,機體系統性炎癥反應和內環境紊亂導致機體高分解代謝,此時,一方面蛋白質分解增加,糖原異生加速,血糖濃度升高;另一方面機體對葡萄糖利用率降低,此時補充過多的葡萄糖只會增加機體的應激水平和基礎代謝率。應激狀態的早期補充過多的熱量和蛋白質非但不能逆轉高分解代謝,反而加重了機體的負擔,造成更嚴重的全身炎癥反應和更高的感染率[8-9]。Jiang等[10]的研究顯示低氮低熱量營養能夠更好地控制血糖、減少感染發生率和縮短住院日,因此近年來越來越多的專家提倡在應激狀態下應限制熱量和蛋白質的供給。
在手術或創傷的早期,蛋白質分解代謝明顯增加,合成減少,呈負氮平衡。Lu等[11]的研究顯示胃腸道癌手術后低氮低熱量營養組和傳統氮熱量營養組的白蛋白、總蛋白和前蛋白濃度均低于術前,但是兩組間比較差異無統計學意義。于健春等[12]的研究顯示胃腸道癌術后低氮低熱量腸外營養結合生長激素、生長抑素及胰島素等藥物能更好地提高機體免疫功能和促進蛋白質合成。本組研究結果顯示在食管癌術后早期兩組各蛋白水平均呈降低趨勢,對照組雖然補充了更多的熱量和蛋白質,但是并未使蛋白水平明顯升高,提示在食管癌術后早期也是負氮平衡狀態,這一狀態并不因增加氮、熱量的供給而改變。
機體在手術、創傷等應激狀態下可以出現急性一過性的血糖增高現象,稱為應激性高血糖,與免疫-神經-內分泌軸、下丘腦-垂體-腎上腺軸、下丘腦-垂體-甲狀腺軸等神經內分泌條件相關[13],可以造成患者病情惡化、感染、各種并發癥以及多器官功能不全等并發癥[14]。本組研究顯示食管癌術后對照組的血糖水平明顯高于研究組,因此兩組術后心律失常、肺部感染、刀口感染和吻合口瘺的發生率雖然差異無統計學意義,但是對照組術后并發癥發生率有增多趨勢,而且對照組總并發癥發生率要顯著高于研究組。2009年5 月, 美國臨床內分泌協會和美國糖尿病協會聯合提出了適當控制住院患者高血糖水平的新指南[15],對于危重患者的建議:對于持續性高血糖的治療,閾值不應高于10.0 mmo l/L(180 mg/dl),就應開始胰島素治療;對于已開始胰島素治療的多數危重患者, 建議血糖控制在7.8~10.0 mmol/L(140~180 mg/dl)。
食管癌切除術由于需要單肺通氣及術中對肺的牽拉,術后容易出現肺損傷,超過氧化能力、過量輸注葡萄糖可以增加二氧化碳的產生速率[13],進一步加重肺的負擔,導致乳酸增加、氧分壓降低,甚至呼吸功能不全,而呼吸功能障礙又易誘發心律失常等并發癥。低熱量腸外營養可以使血糖保持在較低的水平,有利于減少二氧化碳的產生,從而減少心肺不良事件的發生。
總之,與傳統氮熱量腸外營養相比,低氮低熱量并未造成食管癌術后營養狀態的明顯降低,但卻有利于控制術后的血糖水平、減少體內二氧化碳的蓄積,從而降低乳酸和二氧化碳分壓,減少肺損傷;雖然低氮低熱量組在降低術后心律失常、肺部感染、刀口感染及吻合口瘺等方面未顯示出明顯優勢,但仍然顯示出降低的傾向。當然,本研究尚存在一些不足,如樣本量偏小,術后單類并發癥的例數較少,不能完全體現兩組差異的變化,在以后的研究中可以通過加大樣本量、延長研究時間來進一步驗證兩者的差異。
[1]吳肇漢. 努力提高我國臨床營養的整體水平[J].中華胃腸外科雜志,2012,15(5):426-428.
[2]吳肇漢.感染患者的營養支持[J].中華普通外科學文獻(電子版),2009,3(5):419-421.
[3]吳道宏,昊本儼. 低熱量營養支持用于高齡老年患者的可行性[J].中華臨床營養雜志,2010,18(1):9-11.
[4]Katcher H I, Legro R S, Kunselman A R, et al. The effects of a whole grain-enriched hypocaloric diet on cardiovascular desease risk factors in men and women with metabolic syndrome[J]. Am J Clin-Nutr, 2008,87(1):79-90.
[5]潘斌,鄭少波,劉春曉,等.低氮低熱量腸外營養對根治性全膀胱切除患者術后恢復的影響[J].廣東醫學,2011,32(16):2092-2094.
[6]謝春玲,邢志嵩,黃貝玉,等. 不同氮量低熱量腸外營養對食管癌術后患者臨床結局的影響[J].齊齊哈爾醫學院學報,2011,32(14):2229-2230.
[7]夏曉明,施仁忠,張亞峰.高齡食管癌合并糖尿病術后早期腸內營養與血糖控制[J].中華臨床醫師雜志(電子版),2011,5(18):5514-5516.
[8]朱明煒,韋軍民. 低氮低熱量營養支持在外科患者的應用[J]. 中國醫刊,2008,43(10):16-19.
[9]陳煥年,王榮朝,王勍,等.低氮低熱量腸外營養對胃癌術后病人免疫功能的影響[J].腸外與腸內營養,2011,18(2):88-90.
[10]Jiang H, Sun M W, Brook H, et al. Efficacy of hypocaloric parenteral nutrition for surgicalpatients: A systematic review and metaanalysis[J]. Clinical Nutrition, 2011,30(12):730-737.
[11]Lu C Y, Chuang H Y, Yu F J, et al. Hypocaloric peripheral parenteral nutrition with lipid emulsion in postoperative gastrointestinal cancer patients[J]. World J Gastrointest Oncol, 2010 , 2(1): 51-55.
[12]于健春. 危重患者高血糖的控制[J]. 中華普通外科學文獻:電子版, 2009, 3(5): 425-426.
[13]郭延召,許樟榮. 應激性高血糖的臨床研究進展[J].中華老年多器官疾病雜志,2011,10(4):293-296.
[14]Charles Vega, Laurie Barclay. New guidelines address treatment of hospitalizd patients with high blood glucose levels[J]. Endocr Pract,2009, 15(12):1-15.
[15]Liu Q, Liu Z, Chen H,et al. Treatment with growth hormone,somatostatin, and insulin incombination with hypocaloric parenteral nutrition in gastrointestinal cancer patients aftersurgery[J]. Nutrition,2011, 27(6):633-640.

