兩種PCV2抗體ELISA檢測試劑盒檢測效果比較
邢 剛,邱小伙,阮系真,金玉蘭
(浙江大學農業部動物病毒學重點實驗室,浙江杭州310058)
2000年,郎洪武等(2000)[1]曾對北京、河北、山東、天津、江西等省市不同階段豬群血清學調查發現PCV2(豬圓環病毒2 型)抗體陽性率高達42%,表明PCV2 在國內豬群中流行已很普遍;周繼勇等(2004)[2]利用IFA 方法對浙江省內2000-2002年間的2039 份血清樣本進行檢測,發現浙江省內豬群中普遍存在PCV2 感染;隨后的PCV2 流行病學調查表明:國內豬群的PCV2 感染已較普遍;不同地區不同生長階段豬群的PCV2 抗體陽性率變化較大(10%~90%);公豬、母豬及育肥豬的抗體陽性率明顯高于仔豬,血清學調查及臨床癥狀表明在過去10年中,PCV2 已給中國的養豬業帶來了嚴重影響[3]。
ELISA 檢測技術由于其獨特的優點已被廣泛應用于豬群病原微生物抗體監測。本研究比較了國內市售兩種PCV2 抗體ELISA 檢測試劑盒的檢測效果,以期為豬群PCV2 抗體水平監測選擇合適的試劑盒提供參考。
1 材料與方法
1.1 試驗材料 PCV2 ZJ/C 株由本實驗室分離并保存,IFA 測定其TCID50為10-7.0/0.1 mL,PK-15 細胞Dulac 株由本實驗室保存,MEM 培養基購自Invitrogen 公司(California,USA),脫脂奶粉購自上海某乳業股份有限公司,新生牛血清購自杭州某生物工程材料研究所,FITC 標記的羊抗豬IgG 購自KPL 公司(Maryland,USA)。
ELISA 檢測試劑盒分別購自國內兩家不同研發公司。分別命名為ZJ-ELISA、HB-ELISA。兩種試劑盒均在有效期內。
1.2 試驗方法
1.2.1 IFA 檢測 對44 份臨床血清進行間接免疫熒光方法(IFA)檢測。
具體步驟:PCV2 ZJ/C 株按1%比例接入傳代后的PK15 細胞懸液中,在37℃,含5%CO2的培養箱中培養至細胞長成單層;棄培養液,細胞用預冷的丙酮:甲醇(1∶1)混合液在-20℃下滲透和固定30 min,移去固定液并自然干燥后,每孔加入100 μL 5%脫脂奶,37℃下封閉45 min;棄封閉液,并用PBS洗滌3 次后,加入100 μL 分別用PBS 稀釋100 倍和20 倍的待檢豬血清,37℃下,孵育60 min,用PBS 清洗5 次后加入1 ∶400 倍稀釋的FITC 標記羊抗豬IgG,37℃下避光溫育30 min;PBS 洗滌5 次后,吸水紙上拍干,加入100 μL PBS,在倒置熒光顯微鏡下觀察結果。
結果判定,樣品作100 倍稀釋時有特異性熒光者為陽性;樣品在20 倍稀釋時無特異熒光者為陰性;樣品在100 倍稀釋時無特異熒光者,而在20 倍稀釋時有特異熒光者為弱陽性[4]。
1.2.2 ELISA 檢測血清 利用兩種試劑盒分別檢測44 份臨床血清,并判定其結果。
檢測方法按試劑盒使用說明進行,具體步驟如下。
ZJ-ELISA 試劑盒檢測方法:血清利用試劑盒自帶稀釋液稀釋400 倍后,加樣(100 μL/孔),37℃孵育30 min,洗滌5 次后,加酶標二抗,37℃孵育30 min 后再洗滌,加底物液,室溫避光顯色10 min,加終止液終止反應,用酶標儀于450 nm 波長測定OD值并計算S/P 值,反應設陽性,弱陽性,陰性對照。當S/P 值大于等于0.25 時,樣品為陽性;小于等于0.16 時,則判定為陰性。
HB-ELISA 試劑盒檢測方法:血清利用試劑盒自帶稀釋液稀釋40 倍后,加樣(100 μL /孔),37℃孵育30 min 后,洗滌5 次,加酶標二抗,37℃孵育30 min,再洗滌,加底物液,室溫避光顯色10 min,加終止液終止反應,用酶標儀于630 nm 波長測定OD值,反應設陽性,陰性對照。當OD 值大于0.42 時判為陽性;小于0.38 時,則判為陰性。
1.2.3 檢測數據處理
S/P 值計算公式如下。
S/P 值= (樣本平均值- 陰性對照平均值)/(陽性對照平均值-陰性對照平均值)。
臨界值=陽性對照孔平均OD 值×0.25。
ELISA 檢測方法與IFA 檢測方法的陽性符合率、陰性符合率和總符合率計算公式如下。
陽性符合率=兩種方法同時定性為陽性的血清份數/IFA 總陽性數。
陰性符合率=兩種方法同時定性為陰性的血清份數/IFA 總陰性數。
總符合率=兩種方法同時定性為為陽性或陰性樣本數之和/檢測總數。
配對卡方檢驗及Kappa 檢驗(一致性檢驗)利用SPSS 軟件進行[5]。
2 結果與分析
2.1 符合率比較 詳見表1~表3。
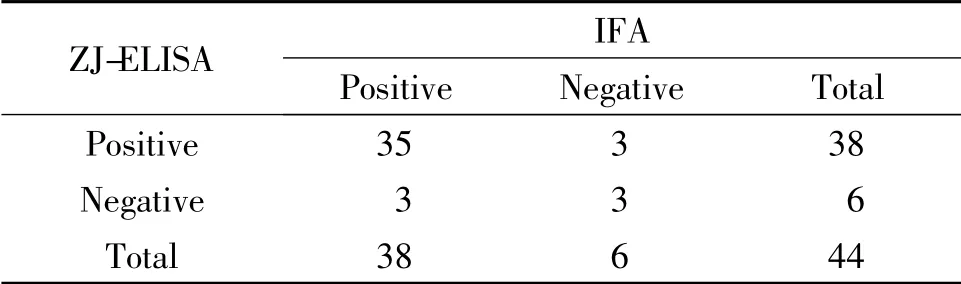
表1 ZJ-ELISA 與IFA 對44 份臨床血清結果的比較
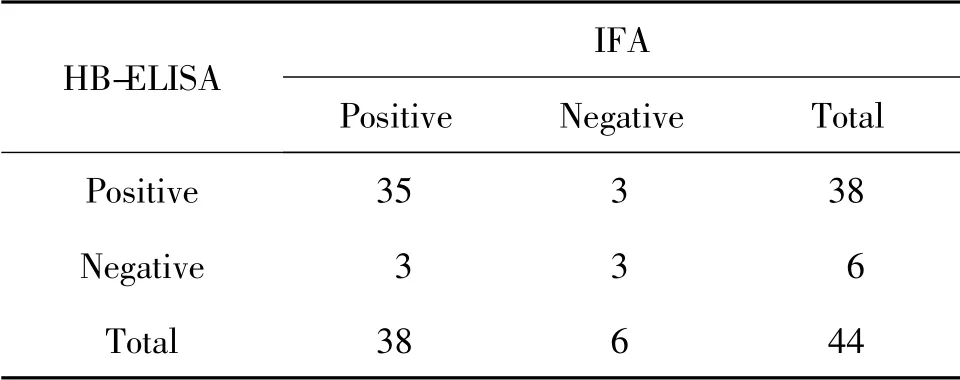
表2 HB-ELISA 與IFA 對44 份臨床血清結果的比較
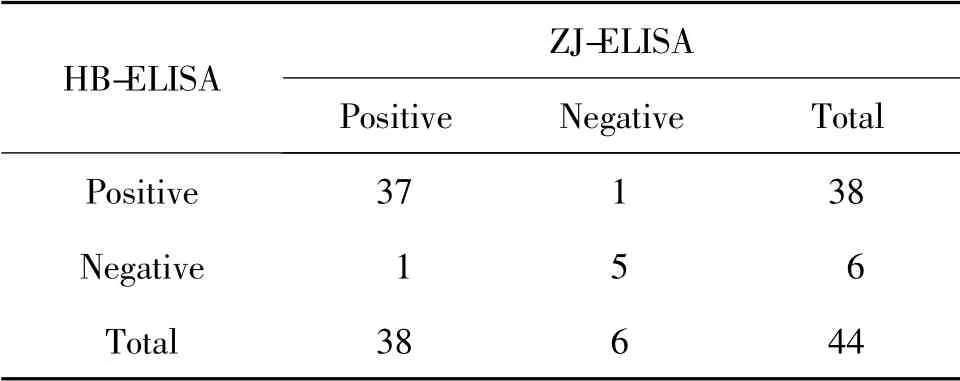
表3 HB-ELISA 與ZJ-ELISA 對44 份臨床血清結果的比較
由表可見,對44 份血清檢測后發現,IFA 陽性檢出率為86.37%(38/44),陰性檢出率為13.63%(6/44);ZJ-ELISA 檢測試劑盒陽性檢出率為86.37%(38/44),陰性檢出率為13.63% (6/44);HB-ELISA 檢測試劑盒陽性檢出率為86.37%(38/44),陰性檢出率為13.63%(6/44)。
ZJ-ELISA 檢測試劑盒和HB-ELISA 檢測試劑盒與IFA 檢測方法的陽性符合率均為92.11%(35/38),陰性符合率均為50%(3/6),總符合率均為86.36%(38/44)(表1,表2)。
ZJ-ELISA 檢測試劑盒和HB-ELISA 檢測試劑盒間的陽性符合率為97.37%(37/38),陰性符合率為83.33%(5/6),總符合率均為95.45% (42/44)(表3)。
2.2 配對卡方檢驗及Kappa 檢驗 兩種PCV2 抗體檢測試劑盒與IFA 檢測結果間的差異及兩種試劑盒檢測結果間的差異利用配對卡方檢驗方法(McNemar test)進行檢驗。其結果如下。
ZJ-ELISA 檢測試劑盒和HB-ELISA 檢測試劑盒與IFA 檢測結果McNemar test 的P 值均為1,大于0.05,表明這幾種方法的檢測結果間差異不顯著。ZJ-ELISA 檢測試劑盒和HB-ELISA 檢測試劑盒檢測結果McNemar test 的P 值同樣為1,大于0.05,表明這兩種試劑盒的檢測結果差異不顯著。
兩種PCV2 抗體檢測試劑盒與IFA 檢測結果的一致性及兩種試劑盒檢測結果間的一致性利用Kappa 檢驗方法進行檢驗。其結果如下。
ZJ-ELISA 檢測試劑盒和HB-ELISA 檢測試劑盒與IFA 檢測方法的檢測結果Kappa 值均為0.421,大于0.4,表明ELISA 檢測方法與IFA 檢測方法所得檢測結果一致性一般。
上述兩種ELISA 檢測試劑盒的檢測結果,Kappa 值均為0.807,大于0.75,表明這兩種試劑盒檢測結果一致性較好。
3 小結與討論
PCV2 為目前豬群中廣泛流行的一種病原微生物,給全世界養豬業帶來了巨大的經濟損失[6]。由PCV2 ORF2 編碼的病毒衣殼蛋白(Cap 蛋白)是PCV2 的主要抗原,該蛋白大小為27.8 kDa,具有PCV2 特異性的抗原表位[7]。
有研究認為Cap 蛋白與斷奶仔豬多系統衰竭綜合征(PMWS)的發生有關,流行病學調查表明PCV2的致病性與Cap 蛋白存在有關[8]。
目前防治PCV2 感染主要通過接種疫苗。目前市場所售豬圓環病毒疫苗主要有勃林格殷格翰公司和先靈葆雅公司基于桿狀病毒真核表達系統研制的PCV2 Cap 蛋白亞單位疫苗、法國梅里亞公司研制的PCV2 全病毒滅活苗、美國富道公司開發的PCV1/2嵌合病毒滅活疫苗等。
國產豬圓環病毒疫苗則有豬圓環病毒滅活疫苗LG 株,SH 株和ZJ/C 株,這些疫苗接種豬群后能誘導豬體產生針對PCV2 的中和抗體,且主要針對Cap蛋白。
臨床檢測該抗體水平的主要途徑是通過相關ELISA 檢測試劑盒。
本研究比較了國內不同生產廠家生產的兩種PCV2 抗體ELISA 檢測試劑盒。試劑盒均以PCV2 Cap 蛋白作為包被抗原,ELISA 檢測試劑盒均為間接法。
研究以IFA 檢測方法首先檢測了44 份臨床豬血清,并判定其陰陽性,然后利用這兩種試劑盒,按照試劑盒說明書操作,分別檢測了上述44 份血清樣品。
檢測結果表明,這兩種試劑盒與IFA 檢測方法相比,陽性檢出率均為86.37%(38/44),陰性檢出率均為13.63%(6/44),具有較高的符合率。
配對卡方檢驗及Kappa 檢驗表明PCV2 抗體檢測試劑盒與IFA 檢測結果差異不顯著,一致性較好;兩個試劑盒間的檢測結果差異不顯著且一致性非常好,陽性符合率為97.37%(37/38),陰性符合率為83.33%(5/6),總符合率為95.45%。
綜上所述,國內市售試劑盒能很好用于對豬群進行PCV2 抗體監測。
[1]郎洪武,張廣川,吳發權,等.斷奶豬多系統衰弱綜合征血清抗體檢測[J].中國獸醫科技,2000,30:3-5.
[2]周繼勇,陳慶新,葉菊秀,等.豬圓環病毒2 型感染的血清學分析[J].中國獸醫學報,2004,24:1-3.
[3]GE X N,WANG F,GUO X,et al.Porcine circovirus type 2 and its associated diseases in China [J].Virus Res,2012,164:100-6.
[4]陳慶新,商紹彬,葉菊秀,等.杭州地區豬II 型圓環病毒抗體的血清學調查[J].中國獸醫科技,2003,33:26-28.
[5]唐潔,唐啟義,程家安.病蟲發生程度預報質量評估方法[J].昆蟲知識,2006,43:410-413.
[6]MADSON D M,OPRIESSNIG T.Effect of porcine circovirus type 2 (PCV2) infection on reproduction:disease,vertical transmission,diagnostics and vaccination[J].Anim Health Res Rev,2011,12:47-65.
[7]MAHE D P,BLANCHARD C,TRUONG C,et al.Differential recognition of ORF2 protein from type 1 and type 2 porcine circoviruses and identification of immunorelevant epitopes[J].J Gen Virol,2000,81:1815-24.
[8]CHO H.S,KIM T J,LEE J I,et al.Park:Serodiagnostic comparison of enzyme-linked immunosorbent assay and surface plasmon resonance for the detection of antibody to porcine circovirus type 2 [J].Can J Vet Res,2006,70:263-8.

