溫度和CO2濃度升高下轉Bt水稻種植對土壤活性碳氮和線蟲群落的短期影響
陳 婧,陳法軍,劉滿強,*,馮 運,黨志浩,李輝信,胡 鋒
(1.南京農業大學資源與環境科學學院土壤生態實驗室,南京 210095;2.南京農業大學植物保護學院,南京 210095)
全球范圍內的CO2濃度([CO2])和溫度升高對農業生態系統產生日益嚴重的影響[1]。作物生長及其化學組成對[CO2]升高的反應非常敏感[2],大量研究表明了[CO2]升高導致作物對碳的吸收和同化增加,刺激植物根系生長和淀積物,從而提高土壤活性有機質的數量,并進一步激發土壤食物網結構和功能的改變[3,5]。土壤可溶性有機物作為土壤生態系統中最活躍的有機質組分,是土壤微生物可利用的主要物質和能量來源[6];相對于土壤有機質對溫室氣體和溫度升高的響應更為敏感[5],土壤可溶性碳氮已成為氣候變化下土壤生態系統響應的預警指標[8]。土壤生物作為土壤生態功能的關鍵驅動者,其群落結構的變化在農業生態系統服務功能中占據重要的地位[9]。大氣[CO2]和溫度升高不僅影響土壤活性碳氮及土壤微生物性質,而且進一步影響土壤食物網的結構和復雜性[10]。例如,線蟲作為土壤食物網的重要組成部分,營養類群多樣,能夠靈敏反映環境變化下土壤生態系統的綜合狀況[11]。前人研究表明了線蟲群落分析有助于了解全球氣候變化下土壤食物網結構和功能的變化[12]。
水稻在農業生產中占據重要地位,蟲害造成的水稻產量損失每年卻高達一千萬噸以上[6]。轉Bt水稻的種植能夠為降低水稻蟲害損失提供一種有效手段[13],但轉Bt水稻有可能對土壤理化性質和生物群落產生不利影響,進而對土壤生態系統的功能服務帶來一定風險[14-15]。因此,加強轉Bt作物對土壤生態系統的生態風險監測是其商業化推廣的迫切需要。有關轉Bt水稻對土壤可溶性碳氮及土壤線蟲群落的評價研究逐漸增多[13-14],但對于全球氣候變化條件下種植轉Bt水稻對土壤生態系統的影響仍未見報道。因此,開展溫度和[CO2]升高后轉Bt水稻種植對土壤活性碳氮和線蟲群落的影響研究,將有助于科學評價種植轉Bt水稻在未來氣候變化條件下對土壤生態系統的潛在生態風險。
1 材料與方法
1.1 試驗材料
供試土壤采自山東省德州市寧津縣(37.64°N,116.8°E),該地區之前主要種植棉花、玉米等旱地作物,土壤類型為蒙淤砂白土,系統分類屬于潮土亞類潮砂土土屬,耕作層(0—20 cm)土壤pH值體積分數為8.5,土壤有機碳(高溫外熱重鉻酸鉀氧化法)、全氮(開氏消煮法)、堿解氮(堿解擴散法)、速效磷(鉬藍比色法)和速效鉀(火焰光度計法)含量分別為 6.6 g/kg、0.4 g/kg、7.9 g/kg、14.4 mg/kg 和 96 mg/kg。土壤基本性質的分析方法參見文獻[16]。土壤取樣深度0—20 cm,鮮土采集后剔除大中型土壤動物及根茬等。采用Φ24 cm×h32 cm的塑料盆缽,每盆放置土壤10 kg,水稻盆栽直播。出苗后每盆定植12株水稻。播種前底肥施入量為N(尿素)30 kg/hm2、(NH4)2HPO415 kg/hm2、KCl 15 kg/hm2。水稻生長期間的水分管理同大田,保持間歇性淹水狀態。
1.2 試驗方法
1.2.1 OTC氣室管理與試驗設計
試驗地點位于在山東省德州市寧津縣(37.64°N,116.8°E)氣候變化與生物多樣性和控害減排(聯合)創新研究基地。開頂式氣室(OTC)由CO2氣源、CO2濃度控制系統和開頂式氣室3部分組成。由紅外 CO2測控儀 (Ventostat 8102,Telfaire Company,USA)自動監測和控制氣室內CO2濃度。氣室框架為鐵結構,正八邊形,高2.56 m,每邊長為1.61 m,相當于直徑4.20 m的柱體結構,整個氣室體積約為21 m3。測控儀的控制參數:CO2濃度測定范圍為0—10000 μL/L,控制范圍為0—2000 μL/L;測控儀分辨率為 1 μL/L,反應時間 <60 s,年度漂移 ≤ 10 μL·L-1[17]。通過氣室底部設施換氣扇的個數多少控制溫度。
本研究采用裂區(Split-plot)試驗設計,以[CO2]和溫度作為主區因子,以水稻品種作為裂區因子。主區中設置OTC氣室內的[CO2]和溫度各兩個水平:正常濃度(實際測定值為 Ambient(382±6.6)μL/L)和高濃度(Elevated(657±10.7)μL/L)CO2;正常溫度為(年平均溫度測定值25.57±3.27℃)和較高溫度(26.14±3.32℃)。每天6:00—20:00通入CO2以模擬環境[CO2]升高和氣候變暖的氣候變化環境,即正常溫度(AT)和正常[CO2](AC)處理、正常溫度(AT)和高[CO2](EC)處理、高溫(ET)和正常[CO2](AC)處理以及高溫(ET)和高[CO2](EC)處理,每個處理分別設3個重復,共計12個OTC氣室。每一個OTC氣室(面積17.6 m2)內種植的不同品種水稻盆缽為裂區。供試兩個品種的水稻種植在塑料盆缽內,放置在不同處理的OTC氣室內,每個氣室內各品種重復3次。試驗進行的時間為一個完整的水稻生長季節,2009年9月種植,2010年11月采樣。在試驗期內,同一OTC氣室內的各盆缽隨機排列,定期更換位置。
轉Bt水稻選擇華恢1號(HH1;轉Cry1Ab/Ac基因抗蟲恢復系)及相應的非轉 Bt親本明恢 63(MH63)。HH1由MH63為受體,通過基因槍介導的遺傳轉化方法將目的基因Cry1Ab/Ac轉入受體細胞后所得的轉基因株系TT51-1而來,該品系能專一且有效地控制水稻二化螟、三化螟和稻縱卷葉螟等靶標型鱗翅目害蟲的發生。清水浸種12 h后用過氧化氫消毒20 min,再用清水沖洗干凈,置于35℃陰處催芽,待露出胚根后以20株每盆的密度在盆栽容器中播種,最終每盆定株12株。采集土壤時進行破壞性采樣,由于根系幾乎分布于整個土體,因此盆缽內所有土壤均可視為根際土,采樣時棄去靠近盆栽容器內壁的土壤,以減少邊際影響。
1.2.2 土壤活性碳氮分析
土壤微生物生物量采用氯仿熏蒸-硫酸鉀溶液浸提法[16],具體步驟為:稱取相當于 10 g干土(105℃下24 h)的待測土樣,加入1 mL氯仿攪勻,于25℃黑暗條件下密閉培養24 h,然后抽盡土壤殘留氯仿,用0.5 moL/L K2SO4溶液浸提,體積分數為1∶4。280 r/min振蕩30 min,定量濾紙過濾。熏蒸培養的同時,稱取等量土樣按照上述方法振蕩浸提得對照濾液。吸取10 mL濾液,用K2Cr2O4容量法測定溶液中的有機碳含量。另取15 mL濾液,用半微量開氏法測定氮含量。熏蒸土樣與未熏蒸土樣的有機碳氮差值分別除以轉換系數(KC0.38、KN0.54),計算土壤微生物生物量碳和氮的含量。
可溶性有機碳氮的測定采用蒸餾水浸提法,具體步驟為:稱取相當于10 g干土的土壤樣品,去離子水浸提,體積分數為1∶5,200 r/min振蕩1 h,在 8000 g下離心10 min,上清液過孔徑0.45 μm的醋酸纖維素濾膜,濾液碳氮含量的測定同微生物生物量碳氮測定方法。
土壤無機氮采用2 moL/L KCl溶液浸提[16],體積分數為1∶5,振蕩30 min后用定量濾紙過濾,流動分析儀(Bran Luebbe,德國)測定濾液中的銨態氮和硝態氮含量。
1.2.3 線蟲群落分析
采用蔗糖浮選離心法分離線蟲[11]。線蟲在立體顯微鏡下計數,在生物顯微鏡下鑒定到屬,并劃分不同營養類群(植食性線蟲、食細菌線蟲、食真菌線蟲和捕/雜食線蟲)和生活史c-p值[15]。線蟲群落生態指數的計算:(1)線蟲通道指數(NCR)為食細菌和食微(食細菌+食真菌)線蟲數量之比。(2)富集指數(EI)主要用于評估食物網對可利用資源的響應。根據線蟲功能團分別計算富集指數EI:EI=100×e/(e+b);其中,e代表食物網中的富集成分,主要指食細菌線蟲中c-p值為1和食真菌線蟲中c-p值為2的類群,b代表食物網中的基礎成分,主要指食細菌線蟲c-p值為2和食真菌線蟲中c-p值為2的這兩個類群[19]。
1.2.3 數據統計分析
數據分析采用 SPSS16.0軟件,分析前利用Kolmogorov-Smirnov和Levene法檢驗數據的正態分布及方差齊性,并在必要時利用對數轉換和反正弦平方根轉換以滿足中數據的正態分布假設。利用一般線性模型(General linear models,GLM)進行方差分析,以[CO2]和溫度作為主區因子,以水稻品種作為裂區因子,各因子均為2水平。對于每個氣室內的各水稻品種而言,數據取3個盆缽的平均值進行統計分析,以避免假重復問題。[CO2]、溫度和水稻品種組合處理的均值顯著性差異采用LSD方法進行檢驗(P<0.05)。
2 結果分析
2.1 土壤活性碳氮
溫度和[CO2]升高對土壤可溶性碳(DOC)無顯著影響,但轉Bt水稻種植顯著降低了DOC含量,并且受到溫度和[CO2]的交互影響(表1,圖1A)。溫度和[CO2]升高顯著影響轉Bt水稻土壤可溶性氮(DON)和硝態氮(-N)含量(P<0.05,表 1)。不論轉Bt水稻品種,溫度和[CO2]升高都顯著降低了DON(P<0.05,圖 1)。正常溫度和[CO2]條件下,轉基因水稻(HH1)對DON產生顯著影響;但在僅升高溫度或[CO2]條件下,轉Bt水稻顯著降低了DON(P<0.05,圖1)。土壤硝態氮含量與DON的變化趨勢大體相反,但差異程度減少(圖1)。所有處理中土壤銨態氮含量在 3.4—4.2 mg/kg范圍,溫度、[CO2]和水稻品種對其均無顯著性影響(數據未列出)。
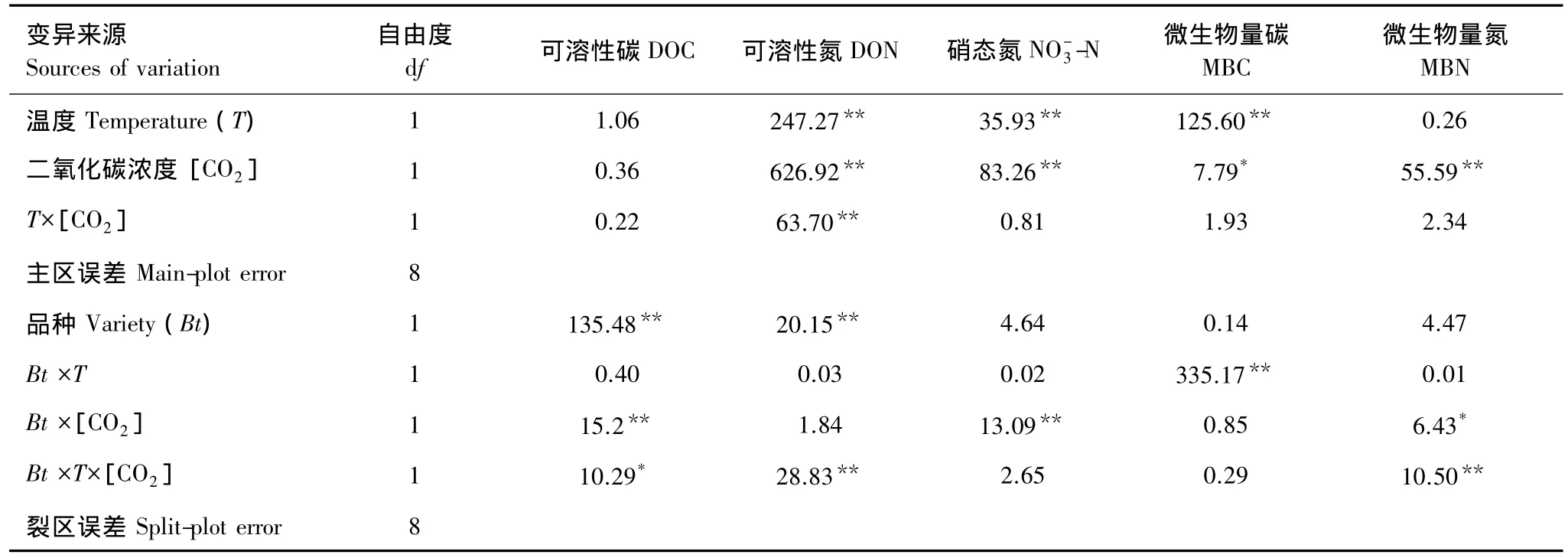
表1 溫度、[CO2]和轉基因水稻品種對土壤可溶性碳(DOC)、可溶性氮(DON)、硝態氮(NO-3-N)、微生物量碳(MBC)和微生物量氮(MBN)影響的方差分析結果(F值和顯著水平)Table 1 ANOVAs results(F values and Probability level)on the effects of temperature(T),[CO2]and transgenic Bt treatment on soil dissolved organic C(DOC),dissolved organic N(DON),NO-3-N,microbial biomass C(MBC)and microbial biomass N(MBN)
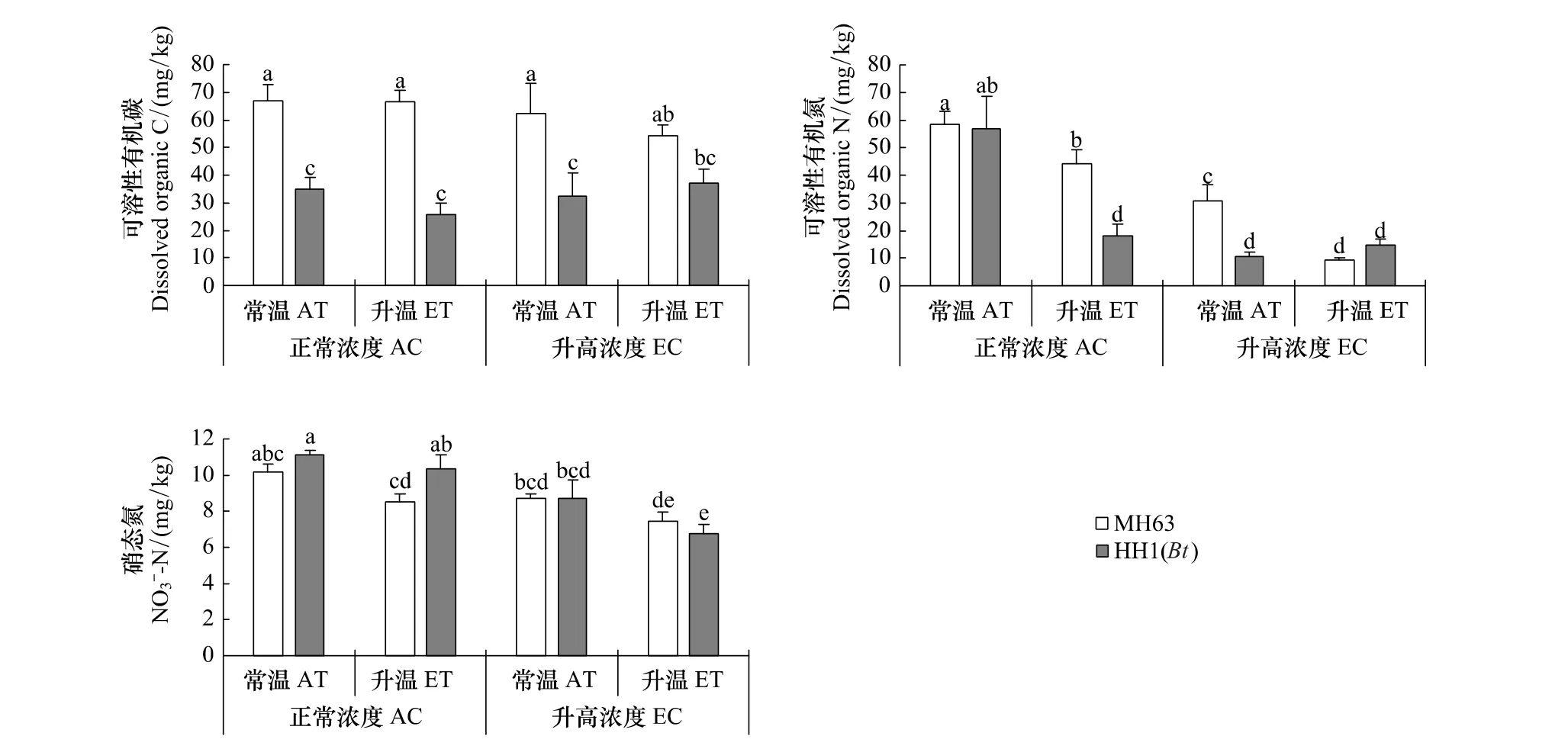
圖1 非轉Bt(MH63)和轉Bt(HH1)水稻在常溫(AT)、升溫(ET)及正常CO2濃度(AC)和升高CO2濃度(EC)條件下對土壤可溶性碳氮和硝態氮(平均值±標準差)的影響Fig.1 Effects of non-Bt(MH63)and transgenic Bt(HH1)rice varieties on soil dissolved organic carbon and nitrogen and nitrate nitrogen(Mean±SD)under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
2.2 土壤微生物量碳氮
溫度、[CO2]和轉 Bt水稻對土壤微生物量碳(MBC)和氮(MBN)有不同程度的影響(表1)。升溫和[CO2]增高顯著影響MBC和MBN,并且分別與水稻品種之間存在顯著交互作用(P<0.05,表1)。在正常溫度和[CO2]條件下,HH1種植后MBC顯著低于MH63(圖2)。不論[CO2]升高與否,升溫后MH63種植下的MBC顯著降低,但在HH1下顯著增加(P<0.05),從而導致升溫條件下HH1的MBC顯著高于 MH63(P<0.05,圖 2)。不論升溫與否,[CO2]升高均增加MBN,且與轉基因水稻有顯著交互作用(表1)。在正常[CO2]下,轉Bt水稻對MBN沒有影響,而在[CO2]升高條件下,常溫下HH1的MBN顯著高于MH63(圖2)。
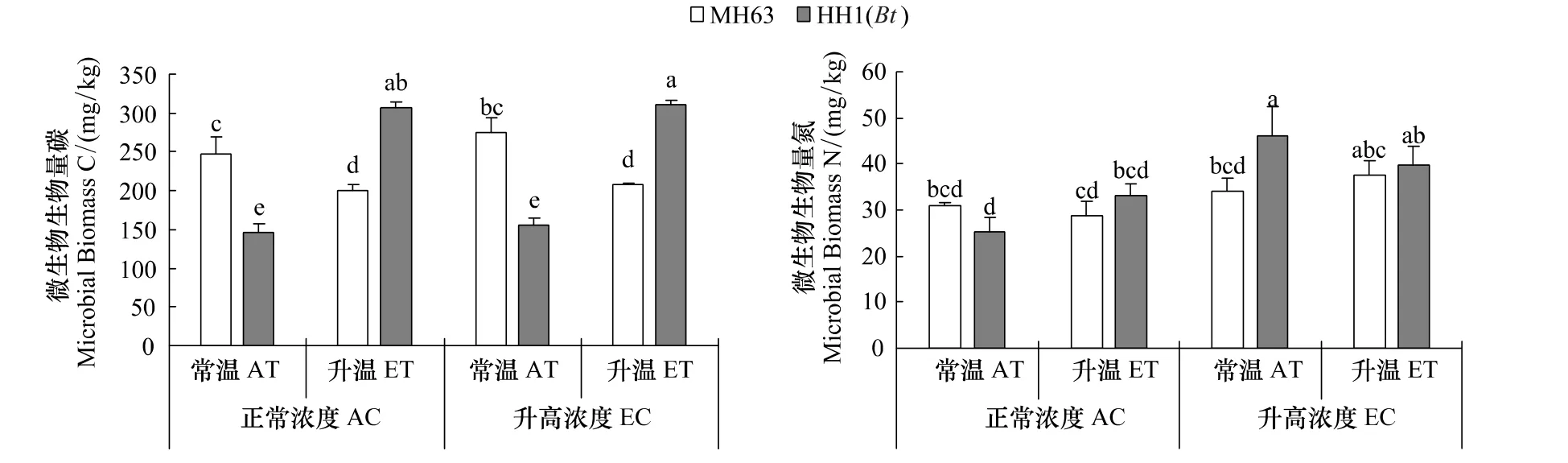
圖2 非轉Bt(MH63)和轉Bt(HH1)水稻在常溫(AT)、升溫(ET)及正常CO2濃度(AC)和升高(EC)條件下對土壤微生物生物量碳和氮(平均值±標準差)的影響Fig.2 Effects of non-Bt(MH63)and transgenic Bt(HH1)rice varieties on soil microbial biomass carbon and nitrogen(mean±SD)under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
2.3 土壤線蟲群落
溫度、[CO2]和轉Bt水稻對土壤線蟲總數均有顯著影響,且溫度與水稻品種之間存在顯著交互作用(P<0.05,表 2)。在正常溫度和[CO2]下,HH1與MH63處理間土壤線蟲總數差異未達到顯著差異(圖3);但不論[CO2]升高與否,升溫使得MH63下土壤線蟲總數顯著低于HH1(P<0.05,圖3)。
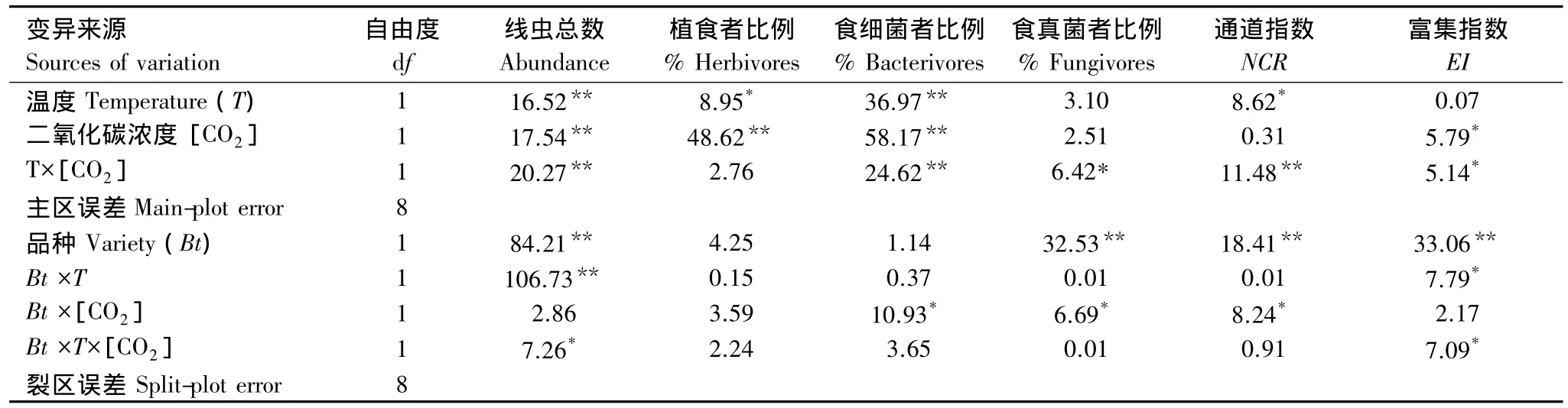
表2 溫度、[CO2]和轉基因水稻品種對土壤線蟲的總數、不同營養類群百分比及生態指數影響的方差分析結果(F值和顯著水平)Table 2 ANOVAs results(F values and Probability level)of the effects of temperature(T),[CO2]and transgenic rice variety(Bt)on the abundance,the proportions of trophic groups and ecological indices of soil nematode community
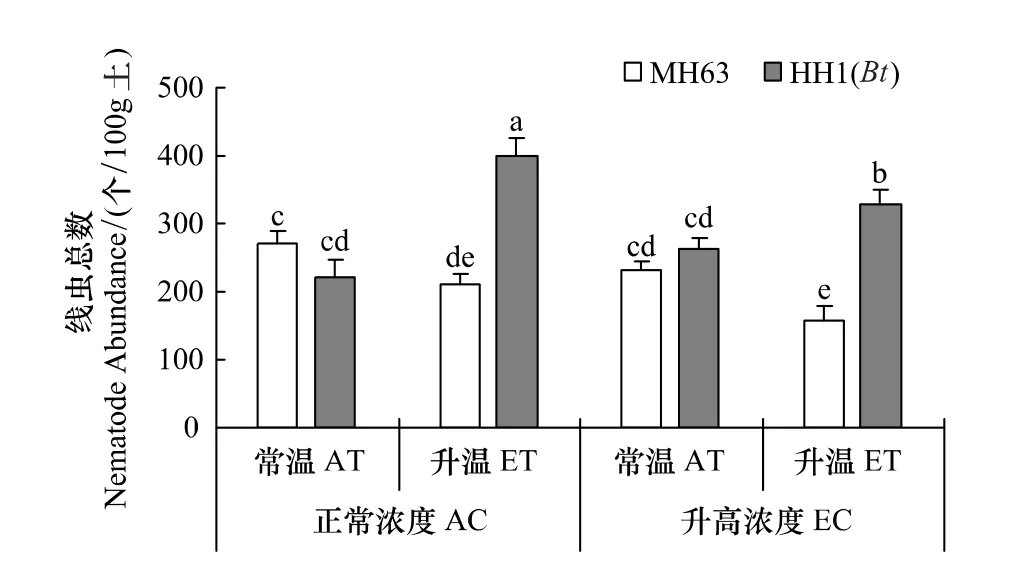
圖3 非轉Bt(MH63)和轉Bt(HH1)水稻在常溫(AT)、升溫(ET)及正常CO2濃度(AC)和升高(EC)條件下對土壤線蟲總數(平均值±標準差)的影響Fig.3 Effects of non-Bt(MH63)and transgenic Bt(HH1)rice varieties on soil nematode abundance(mean±SD)under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
植食線蟲比例沒有受到轉基因水稻的影響,但在溫度和[CO2]升高條件下植食線蟲比例發生顯著變化(P<0.05,表 2)。例如,升高[CO2]后 MH63和HH1的植食者比例分別從12.0%和17.1%提高到34.4%和37.1%,但未達到顯著差異(圖4)。食細菌和食真菌線蟲比例分別受到溫度、[CO2]和轉基因水稻不同程度的影響(P<0.05,表2),不論水稻品種如何,食細菌線蟲在溫度和[CO2]升高后顯著降低(P<0.05,圖4)。在正常溫度和[CO2]下,轉 Bt水稻顯著增加了食細菌線蟲比例,但其差異在溫度和[CO2]升高下未達顯著水平(圖4)。不論溫度和[CO2]升高與否,轉Bt水稻種植降低了土壤食真菌線蟲比例,但未達到顯著差異水平(圖4)。由于均值變異較大,沒有檢測到捕雜食線蟲比例對溫度、[CO2]及水稻品種變化的顯著響應(圖4)。
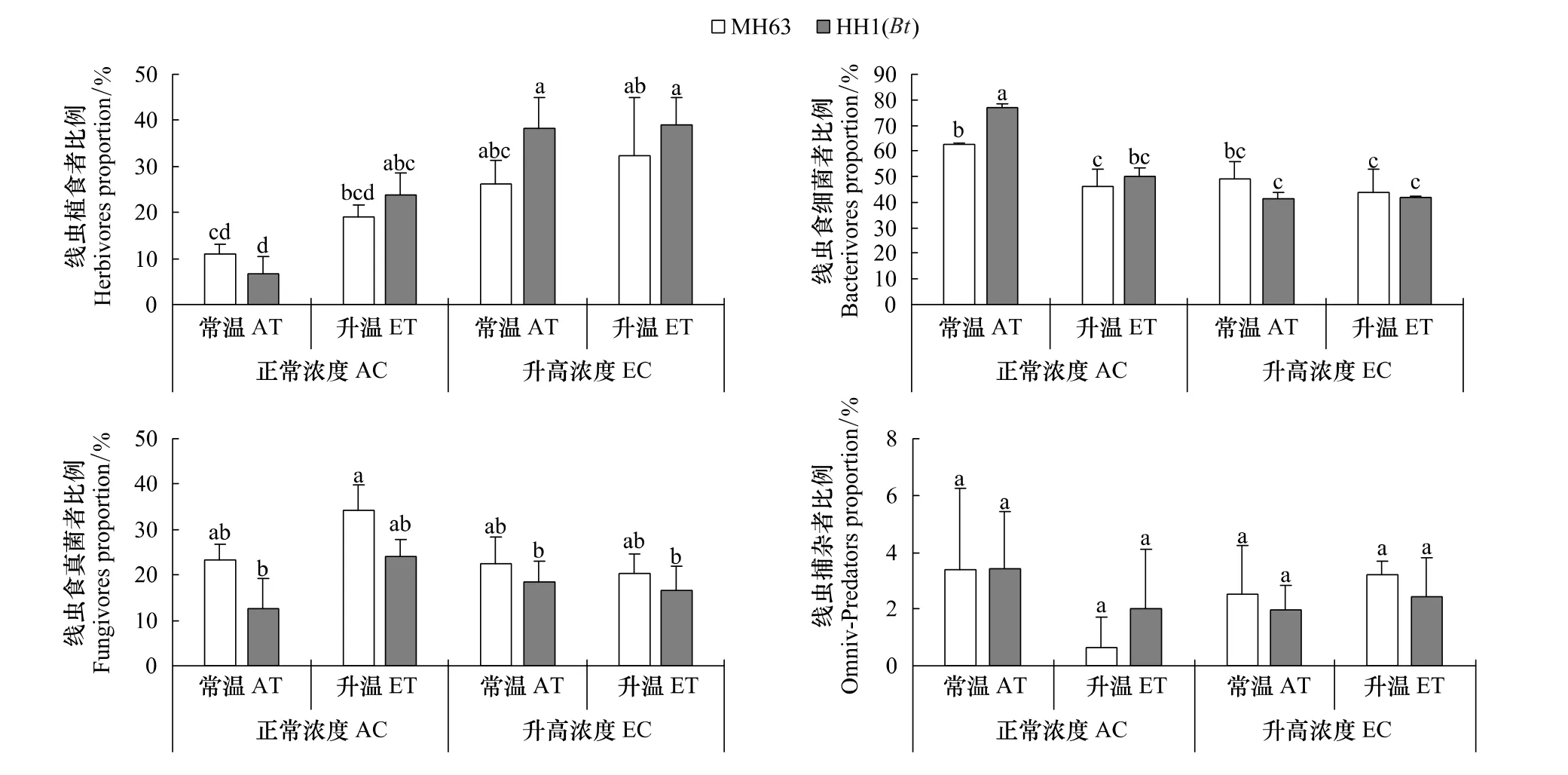
圖4 非轉Bt(MH63)和轉Bt(HH1)水稻在常溫(AT)、升溫(ET)及正常CO2濃度(AC)和升高(EC)條件下對土壤線蟲營養類群百分比(平均值±標準差)的影響Fig.4 Effects of non-Bt(MH63)and transgenic Bt(HH1)rice varieties on the proportion of nematode trophic groups(mean±SD)under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
溫度、[CO2]和轉 Bt水稻分別對通道指數(NCR)及富集指數(EI)產生不同程度的影響(表2)。[CO2]升高對 NCR沒有影響,但在正常[CO2]下升溫顯著降低NCR;不論升溫與否,轉Bt水稻種植呈增加NCR的趨勢,尤其在[CO2]升高下趨勢明顯(表3)。升溫對EI沒有顯著影響,而在常溫下[CO2]升高卻降低EI。轉Bt水稻在常溫下及溫度和[CO2]共同升高下呈增高EI的趨勢(表3)。
3 討論
全球氣候變化能夠通過根系影響進入土壤中的有機碳數量和質量[10],同時轉Bt作物可以通過改變植物生長性狀及Bt毒素釋放而改變作物根系分泌物數量和組成[21],本研究利用野外開頂式氣室(OTC)模擬氣候變化,研究溫度和[CO2]升高條件下轉Bt水稻對土壤活性碳氮水平和線蟲群落的影響。
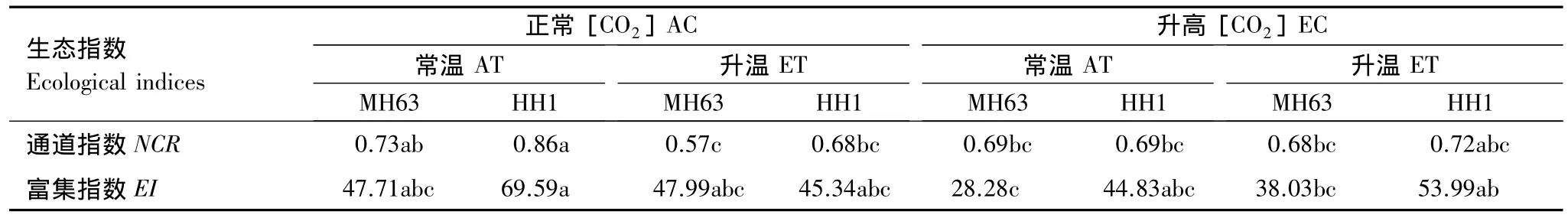
表3 非轉Bt(MH63)和轉Bt(HH1)水稻對常溫(AT)、升溫(ET)及正常(AC)和升高(EC)CO2濃度條件下線蟲群落生態指數的影響Table 3 Ecological indices of soil nematode community as affected by non-Bt(MH63)and transgenic Bt(HH1)rice varieties under the conditions of ambient and elevated temperature(AT vs.ET),ambient and elevated carbon dioxide(AC vs.EC)
研究表明,不論溫度及[CO2]改變與否,轉Bt水稻顯著降低了DOC含量。李修強等[13]基于大田實驗發現轉Bt水稻對DOC和DON影響不明顯。由于土壤可溶性有機物本身組成復雜,并受到根系分泌物及其刺激的微生物生長利用等的雙向影響,因此不同研究間的差異可能與實驗環境條件、土壤肥力、土壤生物群落及植物生長狀況等有關[22]。本研究中溫度和[CO2]升高條件下,親本水稻下 DOC和DON呈降低趨勢,但轉Bt水稻種植下DOC呈升高趨勢;在僅升高溫度或[CO2]條件下,轉Bt水稻顯著降低了DON。一般而言,[CO2]升高可以導致更多的碳通過根系生長及分泌物分配到地下部土壤中[23]。Guo J等[23]利用 FACE 系統對稻田系統土壤可溶性碳氮的變化進行觀測,也發現[CO2]升高顯著增高了土壤DOC的含量,但DON沒有顯著變化。除了上述提到的原因外,由于土壤可溶性有機物組成的復雜性和微生物對溫度的敏感性,土壤微生物群落的不同也會產生明顯的影響[10]。DON的減少可能歸因于[CO2]和溫度升高刺激土壤生物群落驅動的氮素礦化過程。升高溫度和[CO2]使土壤硝態氮含量顯著降低可能源于植物生長量的增加對土壤養分的吸收。
有室內盆栽試驗表明,轉Bt水稻的種植降低土壤微生物量碳氮,這與田間條件下轉Bt水稻對土壤微生物學性質的影響不完全一致[13]。然而,也有研究發現轉Bt水稻在試驗前期對土壤微生物學性質產生的短暫性影響,可能是由于Bt基因的插入導致作物農藝性狀和生理特性(如水稻根系分泌物及根系化學組成)發生改變[24]。與種植其親本的土壤相比,種植轉Bt水稻后土壤微生物量碳氮對溫度和[CO2]升高變化的響應趨勢相反;溫度和[CO2]升高使親本水稻土壤中微生物量碳含量有降低的趨勢,而溫度和[CO2]升高條件下,轉Bt水稻土壤中的微生物量碳氮呈升高趨勢。轉Bt水稻土壤中微生物量碳氮含量升高的可能原因,推測由于轉Bt水稻對非靶標生物的生長可能有促進作用并且溫度和大氣[CO2]升高導致作物對C的吸收和同化增加,刺激植物根系生長和分泌物,從而提高土壤活性有機質的數量[23],并進一步通過土壤食物網影響土壤的微生物學性質。前人研究表明了[CO2]和溫度升高對土壤微生物可以產生積極的、中立的和消極的影響[5,25-26]。此外,轉 Bt克螟稻對土壤微生物學性質沒有產生持續的負面影響,在某些采樣時間甚至會表現出促進作用[13]。在模擬氣候變化條件下,外源抗蟲基因的導入使轉Bt水稻對土壤微生物學性質的影響發生明顯改變,并可朝不同的方向演變。因此,基于田間的模擬全球氣候變化的長期動態監測實驗將會有助于明確轉Bt水稻的潛在生態風險。
溫度和[CO2]升高均導致親本水稻土壤線蟲總數顯著減少,卻使轉Bt水稻土壤線蟲總數增加。親本和轉Bt水稻線蟲總數的差異是由于轉Bt蛋白的作用還是水稻生長的不同,目前還沒有定論。并未發現轉Bt水稻種植導致土壤Bt毒素的顯著增加,因此推測影響線蟲數量的主要因素是作物品種在農藝性狀上的差異,而不是Bt毒素的影響[23]。前期的研究也證明了植物基因型的差異通過改變根系分泌物的質量、數量及釋放進而影響土壤食物網中的植食者和分解者[11,13]。不論溫度是否升高,[CO2]升高顯著增加了土壤線蟲總數,與前人的結果一致[27]。氣候變化通過改變輸入土壤的根系分泌物數量和質量影響土壤線蟲群落結構[10]。與土壤微生物生物量的變化趨勢相對應,溫度和[CO2]升高導致HH1和MH63之間土壤線蟲總數的變化趨勢相反。土壤線蟲的營養類群是反映土壤食物網營養級關系及能流途徑的重要指標。大氣[CO2]升高對土壤線蟲不同營養類群產生的影響還沒有定論[28],但本實驗中植食性線蟲的比例隨[CO2]和溫度升高而體現出升高的趨勢。雖然未達到顯著差異水平,但轉Bt水稻對地下部非靶標植食者的影響及其生態學意義迫切需要進一步確認。
溫度、[CO2]和轉Bt水稻對土壤線蟲能流通道指數和富集指數均有影響。溫度和[CO2]升高使土壤線蟲能流通道轉向由真菌主導[30],這與最近Pritchard在綜述中獲得的結論一致[3]。轉 Bt水稻對能流通道指數和及富集指數的影響在多數情況下表現出促進作用,說明不論氣候變化與否,轉Bt水稻能使土壤生態系統的能流通道偏向于真菌占主導地位,而土壤有效資源相對富集。由于實驗進程相對較短及線蟲生活史分類的不確定性[31],導致結果未達到顯著差異,但是能流通道及土壤資源的改變必將對對土壤生態過程產生深遠的影響[10],今后應加強全球氣候變化條件下轉基因作物對土壤食物網結構影響的研究。
4 結論
溫度和[CO2]升高條件下,對轉Bt水稻種植后土壤活性碳氮和線蟲群落的響應格局表現出復雜的趨勢。在正常溫度和[CO2]條件下,轉Bt水稻種植顯著降低了土壤可溶性碳、微生物生物量碳及土壤線蟲總數含量,但在溫度和[CO2]升高后趨勢相反。在升溫和正常[CO2]下轉Bt水稻降低了土壤可溶性氮含量,但增加了硝態氮含量。此外,溫度和轉Bt水稻顯著影響土壤線蟲能流通道指數,而[CO2]和轉Bt水稻對線蟲富集指數有顯著影響。在正常溫度和[CO2]條件下轉Bt水稻對促進非靶標植食者增加的趨勢值得關注。總之,模擬氣候變化的短期盆栽實驗并未發現轉Bt水稻對土壤生態系統的不利影響。今后應結合水稻生長、水稻地上和地下部的碳氮分配過程及長期尺度的監測,以深入了解土壤生態系統結構和功能的響應機制,為系統評估轉Bt水稻種植在未來氣候變化條件下的潛在土壤生態風險提供依據。
致謝:英國作物與土壤系統研究組(SRUC)Bryan Griffiths教授潤色英文摘要。
[1]Intergovernmental Panel on Climate Change.Report prepared for IPCC by Working Group III Mitigation of Climate Change.Cambridge University Press,2007,USA.
[2]Drigo B,Pijl A S,Duyts H,Kielak A M,Gamper H A,Houtekamer M J,Boschker H T S,Bodelier P L E,Whiteley A S,Van Veen J A,Kowalchuk G A.Shifting carbon flow from roots into associated microbial communities in response to elevated atmospheric CO2.Proceedings of the National Academy of the Sciences ofthe United StatesofAmerica, 2010, 107:10938-10942.
[3]Pritchard S G.Soil organisms and global climate change.Plant Pathology,2011,60:82-99.
[4]Moore J C,McCann K,Set?l? H,DeRuiter P C.Top-down is bottom-up:Does predation in the rhizosphere regulate aboveground dynamics?Ecology,2003,84:846-857.
[5]Eisenhauer N,Cesarz S,Koller R,Worm K,Reich P B.Global change belowground:impacts of elevated CO2,nitrogen,and summer drought on soil food webs and biodiversity.Global Change Biology,2012,18:435-447.
[6]Zhang L,Zhu Z.Effect of transgenic insect-resistant rice on biodiversity.Hereditas,2011,33(5):414-421.
[7]Davidson E A,Janssens I A.Temperature sensitivity of soil carbon decomposition and feedbacks to climate change.Nature,2006,440:165-173.
[8]Inubushi K,Cheng W,Mizuno T,Lou Y,Hasegawa T,Sakai H,Kobayashi K.Microbial biomass carbon and methane oxidation influenced by rice cultivars and elevated CO2in a Japanese paddy soil.European Journal of Soil Science,2011,62:69-73.
[9]Brussaard L,de Ruiter P C,Brown G G.Soil biodiversity for agricultural sustainability. Agriculture, Ecosystems&Environment,2007,121:233-244.
[10]Bardgett R D,Wardle D A.Aboveground-belowground linkages:biotic interactions, ecosystem processes, and global change.Oxford University Press,New York,USA,2010.
[11]Li X Q,Chen F J,Liu M Q,Chen X Y,Hu F.Effects of two years planting transgenic Bt rice(BtSY63)on soil nematode community.Chinese Journal of Applied Ecology,2012,23(11):3065-3071.
[12]Liang W J,Li Q,Chen L J,Huang G H,Zhu J G.Effects of elevated atmospheric CO2on nematode trophic groups in a Chinese paddy-fild ecosystem.Chinese Journal of Applied Ecology,2002,13(10):1269-1272.
[13]Li X Q,Chen F J,Liu M Q,Hu F.Effects of transgenic Bt rice on soil dissolved organic carbon and nitrogen contents and microbiological properties.Chinese Journal of Applied Ecology,2012,23(1):96-102.
[14]Yuan Y Y,Ge F.Effects of transgenic Bt crops on non-target soil animals.Chinese Journal of Applied Ecology,2010,21(5):1339-1345.
[15]Yeates G W,Bongers T,de Goede R G M,Freckman D W,Georgieva S.Feeding habits in soil nematode families and generaan outline for soil ecologists.Journal of Nematology,1993,25:315-331.
[16]Lu R K.SoilandAgro-chemicalAnalyticalMethods(In Chinese).Beijing:China Agricultural Science and Technology Press.2000.
[17]Chen F J,Ge F,Su J W.An improved top-open chamber for research on effects of elevated CO2on agricultural pests in field.Chinese Journal of Ecology,2005,24(5):585-590.
[18]Joergensen R G.Microbial biomass//Alef K,Nannipierri P.Methods in Applied Soil Microbiology and Biochemistry.New York:Academic Press,1995:375-417.
[19]Ferris H,Bongers T,De Goede R G M.A framework for soil food web diagnostics:extension of the nematode faunal analysis concept.Applied Soil Ecology,2001,18:13-29.
[20]Tom B,Marina B.Functional diversity of nematodes.Applied Soil Ecology,1998,239-251.
[21]Saxena D,Neal C S,Illimar A,Shu Q Y,Stotzky G.Larvicidal Cry proteins from Bt are released in root exudates of transgenic Bt corn,potato,and rice but not of Bt canola,cotton and tobacco.Plant Physiology and Biochemistry,2004,42:383-387.
[22]Kalbitz K,Solinger S,Park J H,Michalzik B,Matzner E.Controls on the dynamics of dissolved organic matter in soils:a review.Soil Science,2000,165:277-304.
[23]Guo J,Zhang M Q,Zhang L,Deng A X,Bian X M,Zhu J G,Zhang W J.Responses of dissolved organic carbon and dissolved nitrogen in surface water and soil to CO2enrichment in paddy field.Agriculture, Ecosystems and Environment, 2011, 14:273-279.
[24]Jia Q T,Shi S P,Yang C J,Peng Y F.Changes of several important materials in transgenic Bt rice.Scientia Agricultura Sinica,2005,38(10):2002-2006.
[25]Wang Z H.Potential effects of Bt transgenic crops on soil microecosystem.Chinese Journal of Applied Ecology,2005,16(12):2469-2472.
[26]Stephane C,Angela S.Climate change effects on beneficial plantmicroorganism interactions.FEMS Microbiology Ecology,2010,73:197-214.
[27]Yeates G W,Newton P C D,Ross D J.Response of soil nematode fauna to naturally elevated CO2levels influenced by soil pattern.Nematol,1999,1:285-293.
[28]Li Q,Wang P.Current situation and prospect of elevated atmospheric CO2effects on soil nematodes.Chinese Journal of Applied Ecology,2002,13(10):1349-1351.
[29]Drigo B,Kowalchuk G A,Yergeau E,Bezemer T M,Boschker H T S,Vanveen J A.Impact of elevated carbon dioxide on the rhizosphere communities of Carex arenaria and Festuca rubra.Global Change Biology,2007,13:2396-410.
[30]Blagodatskaya E,Blagodatsky S,Dorodnikov M,Kuzyakov Y.Elevated atmospheric CO2increases microbial growth rates in soil:results of three CO2enrichment experiments.Global Change Biology,2010,16:836-848.
[31]Yeates G W,Newton P C D,Ross D J.Significant changes in soil microfauna in grazed pasture under elevated carbon dioxide.Biology and Fertility of Soils,2003,38:319-26.
[32]Rillig M C,Field C B.Arbuscular mycorrhizae respond to plants exposed to elevated atmospheric CO2as a function of soil depth.Plant Soil,2003,254:383-391.
[33]Treseder K K,Egerton-Warburton L M,Allen M F,Cheng Y F,Oechel W C.Alteration of soil carbon pools and communities of mycorrhizal fungi in chaparral exposed to elevated carbon dioxide.Ecosystems,2003,6:786-796.
[34]Griffiths B S,Heckmann L H,Caul S,Thompson J,Scrimgeour C,Krogh P H.Varietal effects of eight paired lines of transgenic Bt maize and near-isogenic non-Bt maize on soil microbial and nematode communitystructure.PlantBiotechnologyJournal,2007,5:60-68.
[35]Blankinship J C,Niklaus P A,Hungate B A.A meta analysis of responses of soil biota to global change.Oecologia,2011,165:553-565.
參考文獻:
[6]張磊,朱禎.轉基因抗蟲水稻對生物多樣性的影響.遺傳,2011,33(5):414-421.
[11]李修強,陳法軍,劉滿強,陳小云,胡鋒.轉基因水稻Bt汕優63種植兩年對土壤線蟲群落的影響.應用生態學報,2012,23(11):3065-3071.
[12]梁文舉,李琪,陳立杰,黃國宏,朱建國.開放式空氣CO2濃度升高對中國稻田生態系統線蟲營養類群產生的影響.應用生態學報,2002,13(10):1269-1272.
[13]李修強,陳法軍,劉滿強,胡鋒.轉Bt水稻對土壤可溶性有機碳氮及微生物學性質的影響.應用生態學報,2012,23(1):96-102.
[14]袁一楊,戈峰.轉Bt基因作物對非靶標土壤動物的影響.應用生態學報,2010,21(5):1339-1345.
[15]楊保軍,唐健,江云珠,彭于發.轉cry1Ab基因克螟稻對根際可培養細菌類群的影響.生態學報,2009,29(6):3036-3043.
[16]魯如坤.土壤農業化學常規分析方法.北京:中國農業科技出版社,2000.
[17]陳法軍,戈峰,蘇建偉.用于研究大氣二氧化碳濃度升高對農田有害生物影響的田間試驗裝置—改良的開頂式氣室.應用生態學報,2005,24(5):585-590.
[24]賈乾濤,石尚柏,楊長舉,彭于發.轉Bt基因水稻生長期幾種重要成分含量的變化研究.中國農業科學,2005,38(10):2002-2006.
[25]王忠華.轉Bt基因水稻對土壤微生態系統的潛在影響.應用生態學報,2005,16(12):2469-2472.
[28]李琪,王朋.開放式空氣[CO2]增高對土壤線蟲影響的研究現狀與展望.應用生態學報,2002,13(10):1349-1351.

