組織型激肽釋放酶對大鼠急性腦缺血后GLUT-1表達的影響
韓雪梅,李妮妮,李 麗,田弘極,劉松巖*,武利濤
(1.吉林大學中日聯誼醫院神經內一科,吉林長春130033;2.北京中醫藥大學東直門醫院)
組織型激肽釋放酶對大鼠急性腦缺血后GLUT-1表達的影響
韓雪梅1,李妮妮1,李 麗1,田弘極1,劉松巖1*,武利濤2
(1.吉林大學中日聯誼醫院神經內一科,吉林長春130033;2.北京中醫藥大學東直門醫院)
激肽釋放酶-激肽系統(kallikre in-kinin system,KKS)在人體分布廣泛,發揮重要生理的作用,尤其在血管再生方面發揮重要作用[1]。本研究通過觀察組織型激肽釋放酶(TK)對腦缺血后GLUT-1蛋白表達的影響,并進一步探討TK作為腦保護劑對急性腦缺血的治療作用,從而為超過溶栓治療時間窗的腦梗死提供新的治療措施,為臨床腦血管病的防治提供依據。
1 材料與方法
1.1 材料與方法
選擇健康雄性的Wista大鼠30只,體重250-270g,鼠齡3-5個月,由長春市經濟技術開發區實驗動物中心提供。實驗動物隨機分為3組,每組10只。假手術組:只暴露,不插線阻塞大腦中動脈;鹽水組(NS組):大腦中動脈持續永久缺血(PMCAO)后給予生理鹽水,劑量:2ml·kg-1·d-1。治療組(TK組):大腦中動脈永久缺血并注射TK,劑量:17.5×10 3U·kg-1·d-1。給藥方法:在大鼠腦缺血后8h NS、TK腹腔注射給藥,連續3d。大鼠大腦中動脈永久性缺血模型參照Longa等[2]報道的方法。
1.2 免疫組化
CLUT-1為天津生物試劑公司產品。免疫組化染色采用SP法。試劑盒為福州邁新生物技術開發公司產品。
1.3 統計學分析
細胞計數,以單個標本為單位,選取腦內3個區域(缺血周邊區、中心區和對側大腦半球),每個區域選取3個200×鏡下視野,進行計數,取平均值,結果以x—±s表示,各組間比較用方差分析,所有統計學處理應用SPSS統計軟件。
2 結果
免疫組化顯示:正常對照組無GLUT-1蛋白陽性表達。NS對照組(PMCAO)GLUT-1表達增強。陽性細胞表現為細胞漿呈棕黃色。在皮層、底節的神經元及血管內皮細胞都有GLUT-1陽性表達。隨著缺血時間的延長,中心區表達逐漸下降,而周邊區陽性細胞數增多,表達呈逐漸上升趨勢,缺血3d,GLUT-1在缺血周邊區神經細胞的表達達高峰,同時中心區神經細胞接近正常水平,見圖1。TK治療組:GLUT-1在周邊區的神經細胞和血管內皮細胞的表達都顯著增強,與NS對照組相比差異顯著,P<0.05,見表1、圖2。
在血管內皮細胞,隨缺血時間的延長,無論在缺血中心區還是周邊區,GLUT-1的表達均逐漸增強,陽性血管數增多,血管內皮細胞增生,缺血3d達高峰,見表2、圖3。

表1 TK對GLUT-1在缺血周邊區表達的影響(ˉx±s,n=10)

表2 GLUT-1在血管內皮細胞的表達(n=10,ˉx±s)
3 討論
腦缺血后的神經、血管調節機制尚不完全明確。多個研究表明激肽釋放酶(KKS)在腦缺血時促進神經功能的恢復。它能夠擴血管改善循環,促進血管新生,加強神經元及神經纖維的再生[3],研究顯示KKS通過激肽受體降低血壓,神經保護[4,5]。倪耀輝等[6]研究激肽釋放酶在腦缺血后延遲給藥能增加缺血區NSE陽性細胞,從而證明其腦保護作用。血管再生在腦組織發生缺血后誘發。GLUT-1作為低氧誘導因子-1(HIF-1)的靶基因同樣可以通過促進血管生成、改善缺血區周圍的血流供應、改善腦內葡萄糖代謝從而促進腦組織重建。
本研究顯示:正常對照組無GLUT-1蛋白陽性表達,NS對照組(PMCAO)顯示GLUT-1表達增加,證明了缺血可以誘導GLUT-1的表達,至缺血后3d,周邊區的GLUT-1表達達高峰。TK組可見GLUT-1在周邊區表達上調,而且表達GLUT-1的神經細胞多為存活的神經元。表明TK能夠促進GLUT-1的表達。因此GLUT-1在腦缺血及TK治療后表達增加是神經元的代償性反應,有助于恢復腦的葡萄糖和氧代謝和穩定神經元細胞膜。
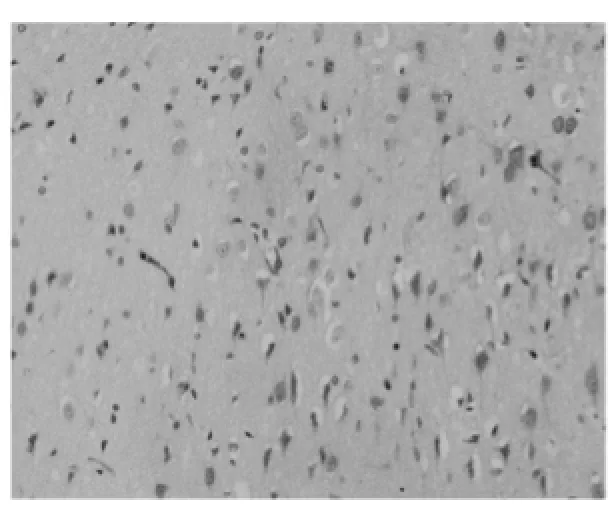
圖1 缺血3 d交界區GLUT-1(組化200×)
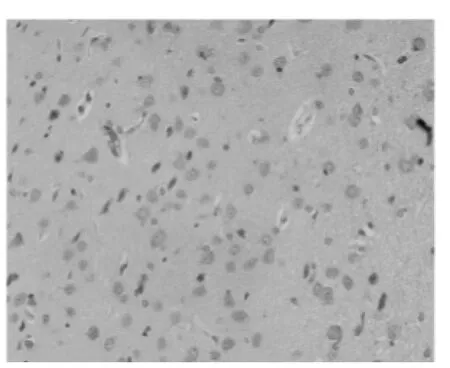
圖2 TK治療組3 d周邊區GLUT-1(組化200×)
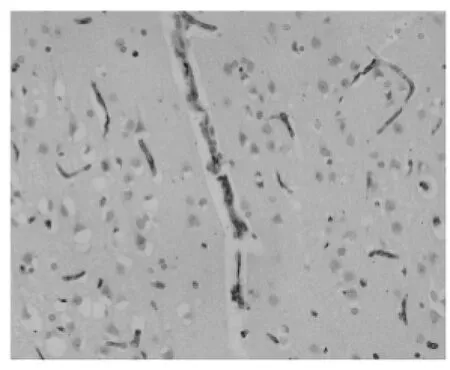
圖3 TK治療后GLUT-1在血管內皮細胞高表達(組化200×)
GLUT-1在血管成分的表達同樣非常明顯。隨缺血時間的延長,無論在中心區還是周邊區,GLUT-1在血管內皮細胞中的表達逐漸增強,陽性血管數增多,伴有微血管增生。TK治療組GLUT-1在血管內皮表達顯著增強,與鹽水對照組相比P<0.05。缺血后,局部血流量急劇減少,腦組織發生代償性反應,葡萄糖載體蛋白的數目增多,腦血流增加,使腦對糖的利用保持在正常水平[7]。同時GLUT-1重新分布在血管內皮細胞,血管腔內面的GLUT-1數量增多,使腦葡萄糖代謝維持,轉運增加[8,9]。GLUT-1在血管成分的高表達是機體對缺血缺氧后一種防御反應,能夠向缺血腦組織提供更多的葡萄糖,以維持腦的能量代謝[10]。
激肽釋放酶能夠促進多種血管生長因子及肝細胞性生長因子(HGF)的生成和釋放[11]。本實驗顯示:TK治療組缺血周邊區新生血管增多,GLUT-1在血管內皮細胞中表達數量及強度均增強,表明TK可以促進血管生成,并與通過上調GLUT-1的表達有關。
[1]Emam iN,Diam and isEP.Human tissue kallik reins:A road un-derconstrat ion[J].Clin Chin Acta,2007,381(1):78.
[2]Longa EZ,Weintein PR,Carson S,et al.Rerersible middle Cerebral aetery occlusion without crainietomy in rats[J].Stroke,1989,20(1):84.
[3]Xia CF,Yin H,Yao YY,et al.Kallikrein protects against ischemic stroke by inhibiting apoptosis and inflammation and promoting angiogenesis and neurogenesis[J].Hum Gene Ther,2006,17:206.
[4]Xia CF,Yin H,Borlongan CV,et al.Kallikrein gene transfer protects afainst ischemic stroke by promoting glial cell migration and inhibiting apoptosis[J].Hypertension,2004,43:452.
[5]Murakami H,Yayama K,Miao RQ,et al.Kallikrein gene delivery inhibits vascular smooth muscle cell growth and neointima formation in the rat artery after balloon angioplasty[J].Hypertension,1999,34:164.
[6]倪耀輝,丁素菊.組織型激肽釋放酶對腦缺血大鼠神經和血管的影響[J].中國神經精神疾病雜志,2009,35(3):173.
[7]Nehlig A.Cerebral energy metabolism,glucose transport and blood flow:changes with maturation and adaptation tohypoglycaemia[J].Diabetes Metab,1997,23(1):18.
[8]Simpson IA,Appel NM,Hokari M,et al.Blood-brain barrier glucose transporter:effects of hypo-and hyperglycemia revisited[J].J Neurochem,1999,72(1):238.
[9]Dobrogowska DH,Vorbrodt AW.Quantitative immunocytochemical study of mouse brain[J].J Histochem Cytochem,1999,47(8):1021.
[10]Regina A,Morechoisne S,Borson ND,et al.Factors released by glucose deprived astrocytes enhance glucose transporter expression and activity in rat brain endothelia cells[J].Biochim Biophys Acta,2001,1540(3):233.
[11]Milkiewicz M,Ispanovic E,Doyle JL,et al.Regulators of angiogenesis and strategies for their therapeutic manipulation[J].Int J Biochem Cell Biol,2006,38:333.
2013-10-16)
1007-4287(2014)07-1052-02
吉林省科技廳社會發展計劃項目(No.20090463)
*通訊作者

